এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘বয়েল ও চার্লসের সূত্রের সমন্বয়, আদর্শ গ্যাস সমীকরণ এবং গ্যাসের গতীয় তত্ত্ব’ নিয়ে আলোচনা করব। এটি ‘গ্যাসের আচরণ’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশ থেকে প্রায় প্রতি বছর প্রশ্ন আসে। এছাড়া, চাকরির পরীক্ষার প্রস্তুতির জন্যও এই আর্টিকেলটি আপনার জন্য গুরুত্বপূর্ণ হবে।

বয়েল ও চার্লরে সূত্রের সমন্বয় রূপ –
মনে করি, নির্দিষ্ট ভরের কোনো গ্যাসের চাপ \(P\), আয়তন \(V\) ও পরম স্কেলে তাপমাত্রা হল \(T\;K\)I
সুতরাং, বয়েলের সূত্রানুযায়ী, \(V\propto\frac1P\) [গ্যাসের ভর \(\left(m\right)\) ও তাপমাত্রা \(\left(T\right)\) স্থির]
চার্লসের সূত্রানুযায়ী, \(V\propto T\) [গ্যাসের ভর \(\left(m\right)\) ও চাপ \(\left(P\right)\) স্থির]
∴ চাপ ও উষ্ণতা উভয়ই পরিবর্তিত হলে যৌগিক ভেদের নিয়মানুসারে,
বা, \(V=\frac{K\cdot T}P\) [\(K\)= সমানুপাতিক ধ্রুবক]
বা, \(\frac{PV}T=K\)
বা, \(PV=KT\)
এই সমীকরণটি হল চার্লস ও বয়েলের সূত্রের সমন্বয় রূপ। এটিকে গ্যাসের অবস্থার সমীকরণ বলা হয়। যদি গ্যাসের ভর স্থির রেখে তার চাপ, আয়তন ও উষ্ণতা যথাক্রমে \(P_1\), \(V_1\) ও \(T_1\) থেকে পরিবর্তিত হয়ে \(P_2\), \(V_2\) ও \(T_2\) হয় তাহলে সমীকরণটি হয় \(\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}\)।
আদর্শ গ্যাস সমীকরণ –
বয়েলের সূত্রানুযায়ী, \(V\propto\frac1P\) [যখন \(T\) ও \(n\) স্থির]
চার্লসের সূত্রানুযায়ী, \(V\propto T\) [যেখানে \(P\) ও \(n\) স্থির]
অ্যাভোগাড্রোর সূত্রানুযায়ী, \(V\propto n\) [যেখানে \(P\) ও \(T\) স্থির]
∴ গ্যাসের \(V,\;P,\;n\) ও \(T\) পরিবর্তিত হলে যৌগিক ভেদের নিয়মানুসারে,
\(V\propto\frac{T\cdot n}P\\\)বা, \(V\propto\frac{nRT}P\) [\(R\) হল ধ্রুবক যাকে মোলার গ্যাস ধ্রুবক বলে]
বা, \(PV=nRT\)
এই সমীকরণটিকে আদর্শ গ্যাস সমীকরণ বলে। যেখানে \(P\) = গ্যাসের চাপ, \(V\) = গ্যাসের আয়তন, \(n\) = মোল সংখ্যা, \(T\) = উষ্ণতা, \(R\) = গ্যাস ধ্রুবক।
আদর্শ গ্যাস –
যেসব গ্যাস \(PV=RT\) সমীকরণ মেনে চলে তাদের আদর্শ গ্যাস বলে।
বাস্তব গ্যাস –
বাস্তবে কোনো গ্যাসই বয়েল ও চার্লসের সূত্র মেনে চলতে পারে না। এইরকম গ্যাসকে বাস্তব গ্যাস বলে। বাস্তব গ্যাসগুলি নিম্ন চাপে ও উচ্চ উষ্ণতায় আদর্শ গ্যাসের মতো আচরণ করে।
অ্যাভোগাড্রোর সূত্র –
একই তাপমাত্রায় ও একই চাপে সম-আয়তন সকল গ্যাসেই সমান সংখ্যক অণু বর্তমান থাকে। অর্থাৎ, চাপ ও উষ্ণতা স্থির থাকলে গ্যাসটির আয়তন তার মোল সংখ্যার সঙ্গে সমানুপাতিক।
∴ \(V\propto n\) [যেখানে \(P\) ও \(T\) স্থির থাকে]
\(1\) মোল অণু হল \(6.022\times10^{23}\) সংখ্যক অণু এবং এই অণুগুলি নির্দিষ্ট উষ্ণতায় ও চাপে যে আয়তন অধিকার করে তাকে মোলার আয়তন বলে। \(STP\) -তে যে-কোনো গ্যাসের মোলার আয়তন হল \(22.4\) লিটার।
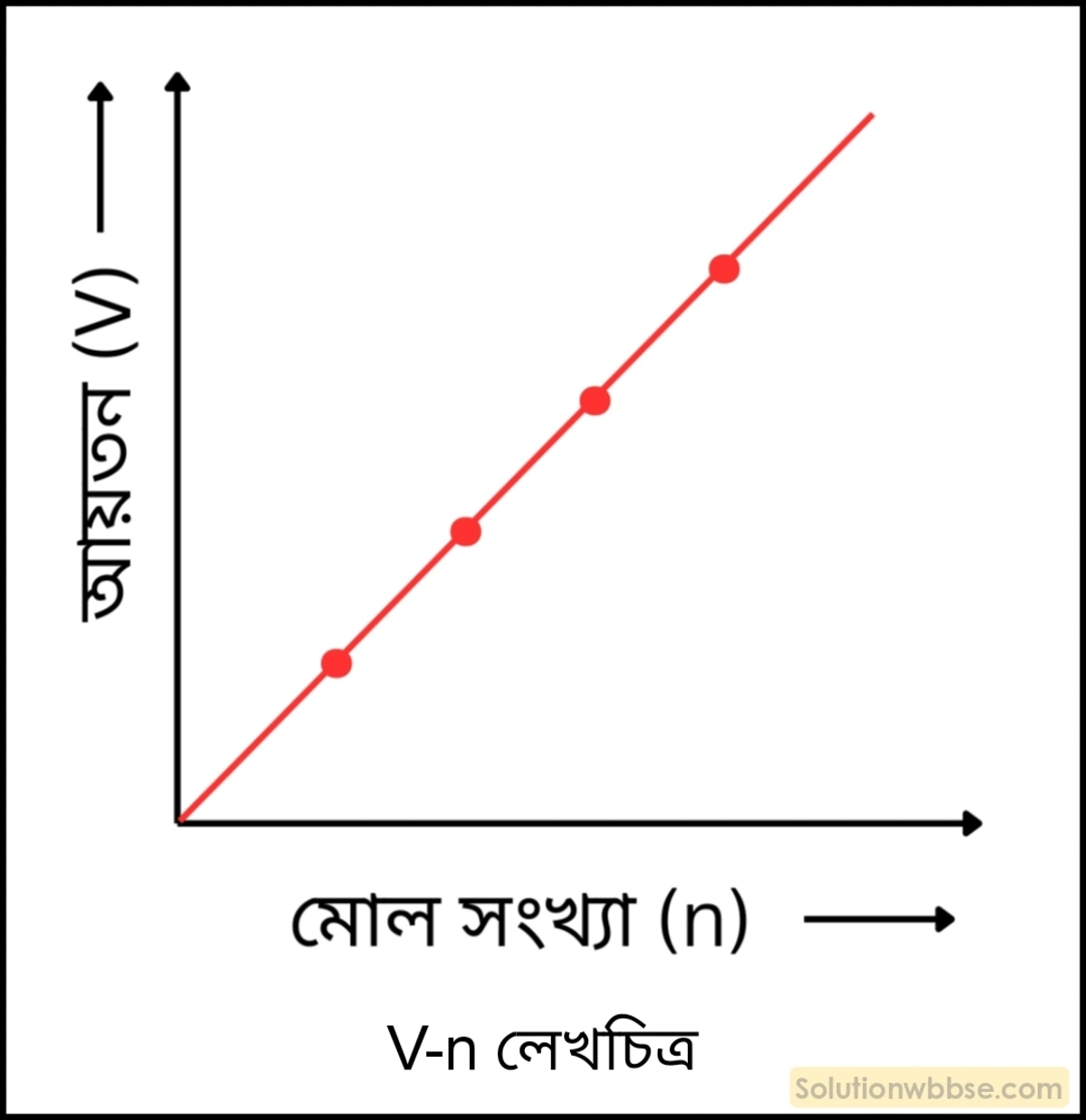
গে-লুসাকের গ্যাস আয়তন সূত্র –
রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী বিক্রিয়ক গ্যাসগুলি সমচাপ ও উষ্ণতায় তাদের আয়তনের সরল অনুপাতে বিক্রিয়া করে এবং বিক্রিয়াজাত পদার্থ গ্যাসীয় হলে সমচাপ ও উষ্ণতায় বিক্রিয়াজাত গ্যাসের আয়তন ও বিক্রিয়কের আয়তনের সঙ্গে সরল অনুপাতে থাকে।
যেমন –
∴ আয়তনের অনুপাত = \(1:1:2\)
সর্বজনীন গ্যাস ধ্রুবক –
এক গ্রাম-অণু যে-কোনো গ্যাসের ক্ষেত্রে \(PV=RT\) এই সমীকরণে \(R\) -কে বলা হয় মোলার গ্যাস ধ্রুবক। \(R\) -এর মান সব গ্যাসের ক্ষেত্রে সমান হওয়ায় এটিকে সর্বজনীন গ্যাস ধ্রুবক বলে।
- \(CGS\) পদ্ধতিতে \(R\) -এর মান \(8.314\times10^7\) আর্গ মোল\({}^{-1}K^{-1}\)।
- \(SI\) পদ্ধতিতে \(R\) -এর মান \(8.314\) জুল মোল\({}^{-1}K^{-1}\)।
- লিটার-অ্যাটমস্ফিয়ার এককে \(R\) -এর মান \(0.082\;L\;atm\;mol^{-1}K^{-1}\)।
- \(R\) -এর মাত্রীয় সংকেত হল \(ML^2T^{-2}K^{-1}\)।
- গাসের মোল সংখ্যা গ্যাসের মোল সংখ্যা, গ্যাসের ভর, অণু সংখ্যা বা \(STP\) -তে আয়তন জানা থাকলে তার থেকে নির্ণয় করা যায়।
- কোনো গ্যাসের ভর \(m\) ও আণবিক ভর \(M\) হলে মোল সংখ্যা \(n=\frac mM\)।
- কোনো গ্যাসের অণু সংখ্যা হলে তার মোল সংখ্যা \(n=\frac x{N_A}\)।
- \(STP\) -তে কোনো গ্যাসের আয়তন \(V\) হলে তার মোল সংখ্যা \(n=\frac V{22.4}\)।
আদর্শ গ্যাস সমীকরণ থেকে গ্যাসের ঘনত্ব নির্ণয় ও মোলার ভর নির্ণয় –
আদর্শ গ্যাস সমীকরণটি হল \(PV=nRT\)। যদি গ্যাসের ভর \(m\) ও আণবিক ভর \(M\) হয় তাহলে \(n=\frac mM\)।
সেক্ষেত্রে \(PV=\frac mMRT\)
বা, \(PM=\frac mVRT\)
∴ \(PM=dRT\) [\(d\) হল ঘনত্ব = \(\frac mV\)]
∴ \(d=\frac{PM}{RT}\) এই সমীকরণ থেকে ঘনত্ব নির্ণয় করা যায়।
আদর্শ গ্যাস সমীকরণ \(PV=nRT\) -তে \(n=\frac mM\) বসালে হয়
\(PV=\frac mMRT\\\)বা, \(M=\frac{mRT}{PV}\) এই সমীকরণ থেকে মোলার ভর পাওয়া যায়।
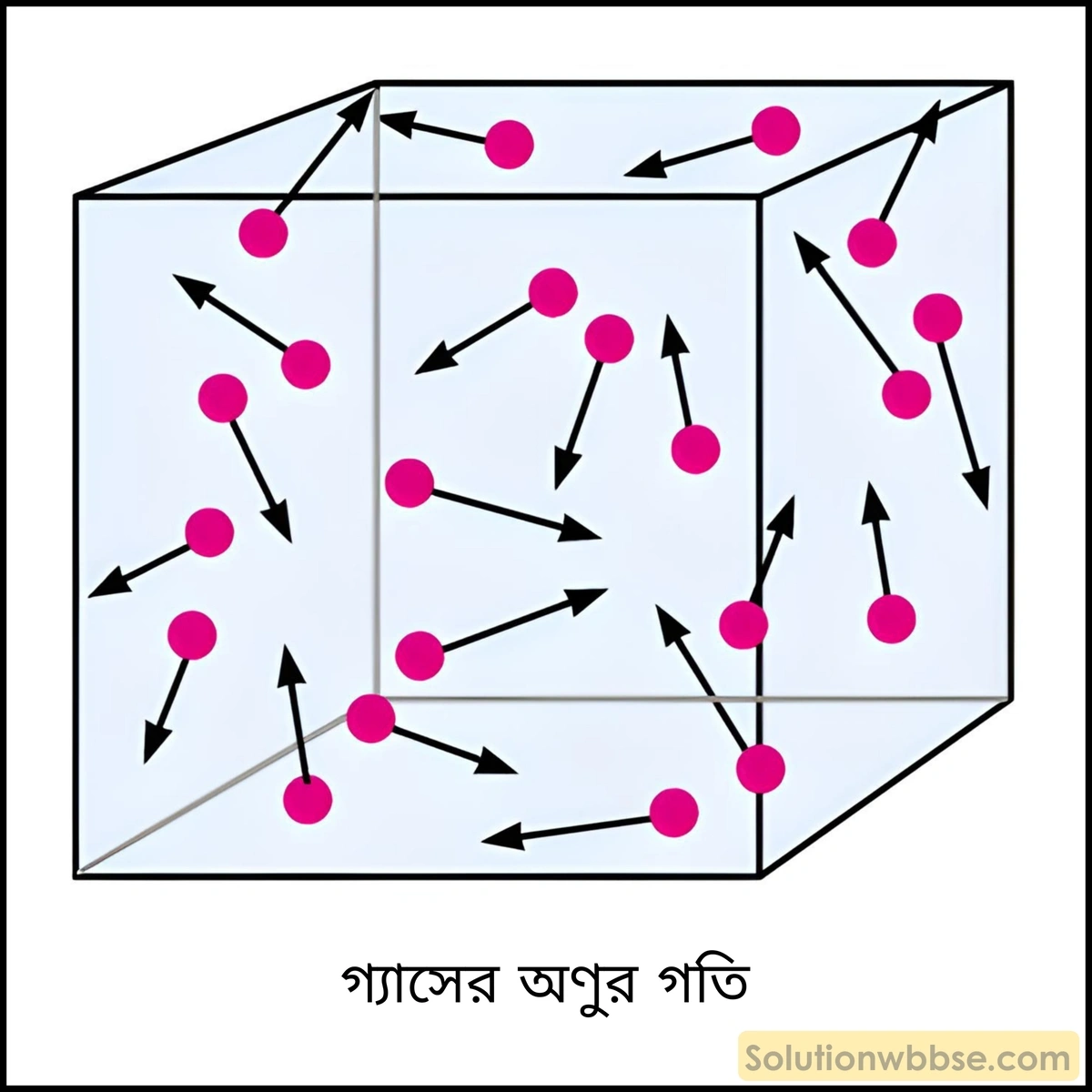
গ্যাসের গতীয় তত্ত্বের স্বীকার্য –
- প্রতিটি গ্যাস অসংখ্য ক্ষুদ্র কণা অর্থাৎ গ্যাসীয় অণু দিয়ে গঠিত। একই গ্যাসের অণুগুলির ভর ও আকার একই হয়।
- গ্যাসীয় অণুগুলি গোলাকার এবং কঠিন। অণুগুলির মধ্যে পারস্পরিক ব্যবধান অনেক বেশি বলে এদের মধ্যে কোনো আকর্ষণ বা বিকর্ষণ থাকে না।
- অণুগুলিকে বিন্দু ভর হিসেবে ধরা যায়। সমগ্র গ্যাসের আয়তনের তুলনায় অণুগুলির মোট আয়তন একেবারে নগণ্য হয়।
- গ্যাসের অণুগুলি সম্ভাব্য সব দিকে অতি দ্রুতগতিতে সরলরেখায় বিচরণ করে এবং ওদের বেগ শূন্য থেকে অসীম পর্যন্ত বিস্তৃত থাকে। বিচরণের সময় গ্যাসের অণুগুলি পরস্পরের সঙ্গে এবং গ্যাস আধারের গাত্রে ধাক্কা খায় বা আঘাত করে। প্রতি দুটি আঘাত বা ধাক্কার মধ্যবর্তী দূরত্বকে মুক্তপথ (free path) বলে। পরপর দুটি আঘাত বা ধাক্কার মধ্যে গ্যাসের অণু যে গড় দূরত্ব অতিক্রম করে তাকে গড় মুক্তপথ (mean free path) বলে। যে সময় ধরে আঘাত ঘটে থাকে, মুক্তপথ অতিক্রম করার সময়ের তুলনায় তা নগণ্য।
- গ্যাস আধারের গাত্রের সঙ্গে গ্যাসীয় অণুগুলির সংঘর্ষে গ্যাসের চাপের সৃষ্টি হয়। সংঘর্ষ যত বেশি হয় চাপও তত বেশি হয়।
- গ্যাসের অণুগুলি সম্পূর্ণরূপে স্থিতিস্থাপক এবং পারস্পরিক আকর্ষণ বর্জিত। নিজেদের মধ্যে এবং আধারের দেয়ালের সঙ্গে অণুগুলির সংঘর্ষও স্থিতিস্থাপক। এই কারণে সংঘর্ষের জন্য গতিশক্তির হ্রাস হয় না। যদি সংঘর্ষ স্থিতিস্থাপক না হত তবে গতিশক্তি হারিয়ে ওরা থেমে যেত।
- পরস্পরের সঙ্গে ধাক্কা খেলেও, স্থিতাবস্থায় একক আয়তনে অণুর সংখ্যা অপরিবর্তিত থাকে।
- বিভিন্ন সময়ে বিভিন্ন গ্যাসের অণুর বেগ বিভিন্ন হয় বলে তাদের গতিশক্তিও বিভিন্ন হয়। এই কারণে কোনো এক বিশেষ মুহূর্তে কোনো একটি গ্যাসের অণুর বেগ বা গতিশক্তি নির্ণয় করা সম্ভব নয়। কিন্তু নির্দিষ্ট উষ্ণতায় গ্যাসের অণুর গড় গতিশক্তি নির্দিষ্ট থাকে। এজন্য নির্দিষ্ট উষ্ণতায় নির্দিষ্ট ভরের গ্যাসের মোট গতিশক্তি স্থির থাকে। গ্যাস অণুর গতিশক্তি তার পরম উষ্ণতায় সমানুপাতী হয়।
ব্যাপন –
পরস্পরের সঙ্গে রাসায়নিক বিক্রিয়া করে না এরূপ দুই বা তার বেশি গ্যাস একটি আবদ্ধ পাত্রে রাখলে গ্যাসগুলি স্বতঃস্ফূর্তভাবে পরস্পরের সঙ্গে মিশে একটি সমসত্ত্ব গ্যাস মিশ্রণ উৎপন্ন করে। গ্যাসগুলির এভাবে পরস্পরের মধ্যে স্বতঃস্ফূর্তভাবে ছড়িয়ে পড়ার প্রবণতাকে ব্যাপন বলে।
গ্যাসের আদর্শ আচরণ থেকে বিচ্যুতি –
গ্যাসের গতীয় তত্ত্বানুযায়ী, গ্যাসীয় অণুগুলিকে বিন্দুবৎ এবং এদের মোট আয়তন গ্যাস আধারের আয়তনের তুলনায় নগণ্য ধরা হয়েছিল-কিন্তু বাস্তবে গ্যাসীয় অণুগুলি অত্যন্ত ক্ষুদ্রাকৃতি হলেও এদের আয়তন বর্তমান-তাই উপরোক্ত কল্পনা খুব উচ্চ উষ্ণতা বা খুব নিম্নচাপের গ্যাসের ক্ষেত্রে প্রযোজ্য হলেও অন্যান্য ক্ষেত্রে সঠিক নয়। অর্থাৎ, বাস্তব গ্যাসের অণুগুলির স্বতঃস্ফূর্ত বিচরণের জন্য কার্যকরী আয়তন ওই গ্যাসের আধারের অভ্যন্তরীণ আয়তনের তুলনায় কিছুটা কম হয়।
এ ছাড়াও গ্যাসের গতীয় তত্ত্বানুযায়ী গ্যাসের অণুগুলির মধ্যে কোনো আকর্ষণ বা বিকর্ষণ বল ক্রিয়াশীল না হলেও অধিক চাপে যখন গ্যাসের আয়তন কম হয় তখন অণুগুলি পরস্পরের খুব নিকটবর্তী হওয়ায় এদের মধ্যে আকর্ষণ বল ক্রিয়া করে-তাই আদর্শ অবস্থায় অণুগুলি পাত্রের দেয়ালে যে বল প্রয়োগ করার কথা, তা বাস্তব গ্যাসের অণু প্রয়োগ করতে পারে না।
অ্যামাগাটের পরীক্ষা (Amagat’s experiment) –
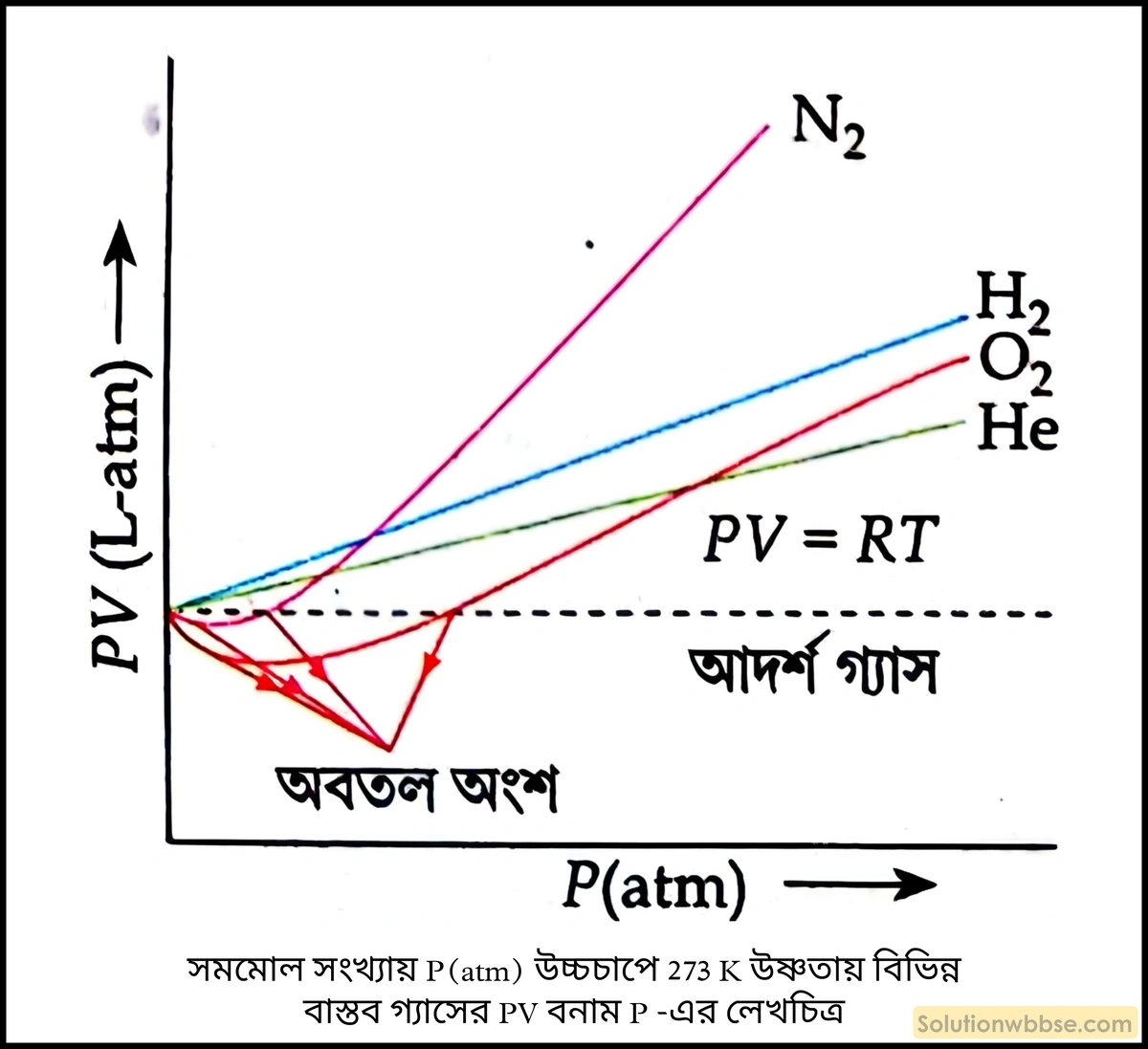
বিজ্ঞানী অ্যামাগাট একটি নির্দিষ্ট উষ্ণতায় \(\left(T\right)\) বিভিন্ন গ্যাসের সমমোল সংখ্যায় নিয়ে তাদের \(PV\) -এর মান পরীক্ষার সাহায্যে নির্ণয় করে \(PV\) -কে কোটি ও \(P\) -কে ভুজ ধরে গ্যাসের অণুগুলির সমোয় রেখা দু-ভাবে অঙ্কন করেন। যথা –
- উচ্চ চাপে \(273\;K\) উষ্ণতায় \(PV\) বনাম \(P\) -এর সমোয় রেখা,
- \(1\;atm\) -এর কম চাপে \(273\;K\) উষ্ণতায় \(PV\) বনাম \(P\) -এর সমোয় রেখা।
সমমোল সংখ্যায় উচ্চচাপে \(273\;K\) উষ্ণতায় বিভিন্ন বাস্তব গ্যাসের লেখচিত্রগুলি পর্যালোচনা করা হল (চিত্র দ্রষ্টব্য)
- আদর্শ গ্যাস সমীকরণের \(PV\) বনাম \(P\) -এর লেখচিত্রটি ভগ্ন রেখা দ্বারা দেখানো হয়েছে।
- বাস্তব গ্যাস, যেমন – \(N_2,\;O_2\) -এর ক্ষেত্রে \(P\) -এর মান বৃদ্ধি হতে থাকলে \(PV\) -এর মান, আদর্শ গ্যাসের \(PV\) -এর মান অপেক্ষা কমতে কমতে একটি সর্বনিম্ন মানে পৌঁছোয়। এরপর \(P\) বৃদ্ধিতে \(PV\) -এর মান বাড়তে থাকে এবং এক সময় আদর্শ গ্যাস সমীকরণের \(PV\) রেখাকে ছেদ করে। এরপর \(P\) বৃদ্ধিতে \(PV\) -এর মান আদর্শ গ্যাসের \(PV\) -এর মান অপেক্ষা ক্রমশ বাড়তে থাকে। \(N_2,\;O_2\) -এর \(PV\) বনাম \(P\) -এর সমোয় রেখাগুলিতে একটি অবতল অংশ থাকে।
- বাস্তব গ্যাস যেমন – \(H_2,\;He\) -এর ক্ষেত্রে \(P\) বৃদ্ধিতে \(PV\) -এর মান প্রথম থেকে আদর্শ গ্যাসের \(PV\) -এর মান অপেক্ষা ক্রমশ বাড়তে থাকে। এদের রেখাগুলির ক্ষেত্রে কোনো অবতল অংশ থাকে না।
- \(H_2,\;He\) বাস্তব গ্যাসের কম উষ্ণতায় \(N_2,\;O_2\) প্রভৃতি গ্যাসের মতো \(PV\) বনাম \(P\) -এর রেখাগুলিতে কোনো অবতল অংশ থাকে না। কিন্তু উষ্ণতা কমালে অতি নিম্ন উষ্ণতায় \(H_2,\;He\) বাস্তব গ্যাসের \(PV\) বনাম \(P\) -এর রেখাগুলিতে অবতল অংশ পাওয়া যায়।
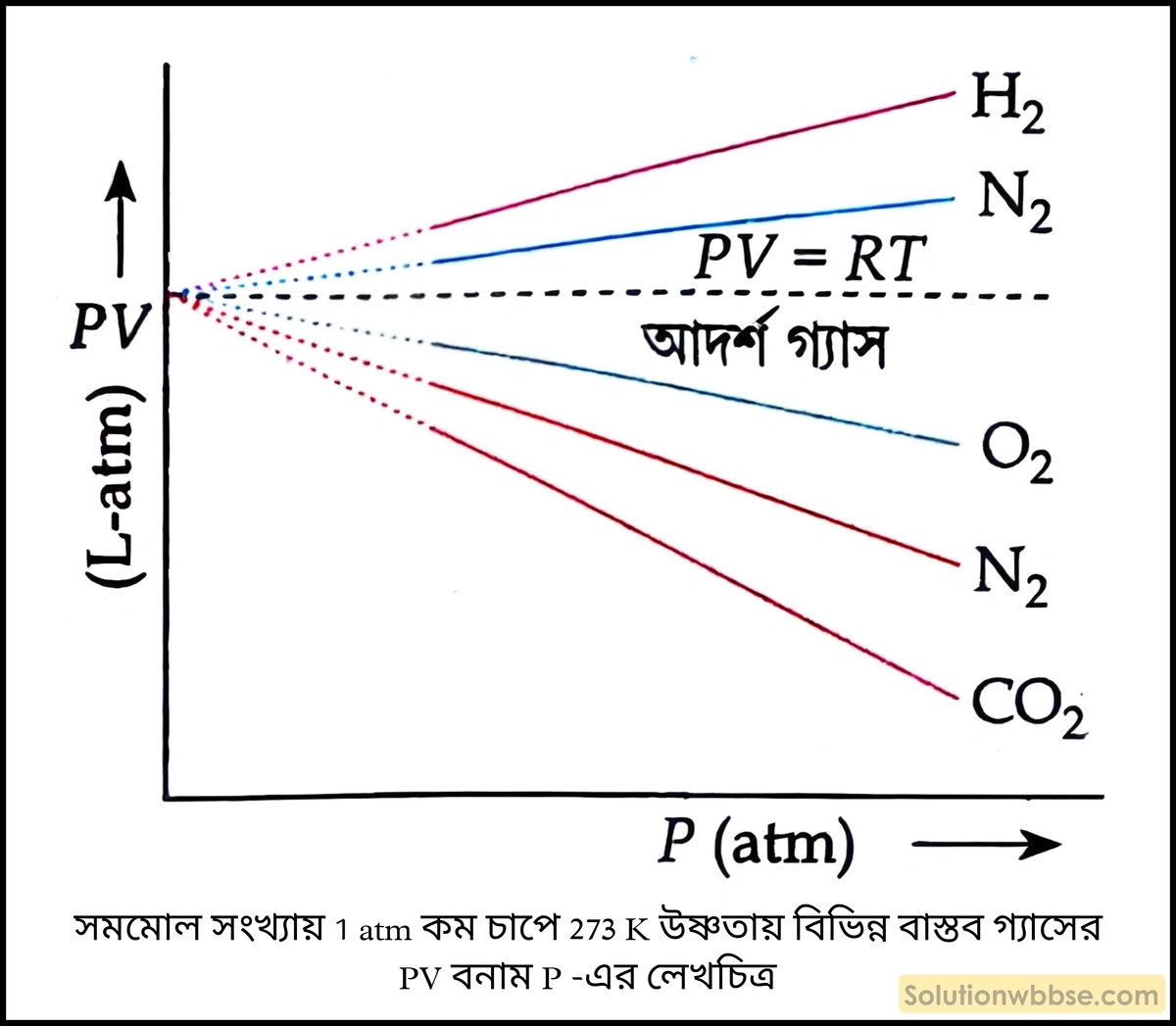
সমমোল সংখ্যায় \(1\;atm\) -এর কম চাপে \(273\;K\) উষ্ণতায় বিভিন্ন বাস্তব গ্যাসের লেখচিত্রগুলি পর্যালোচনা করা হল (চিত্র দ্রষ্টব্য)
- বাস্তব গ্যাস \(O_2,\;N_2,\;CO_2\) ইত্যাদির ক্ষেত্রে \(PV\) বনাম \(P\) -এর লেখচিত্র সরলরৈখিক কিন্তু আদর্শ গ্যাসের PV রেখার নীচে থাকে।
- বাস্তব গ্যাস \(H_2,\;N_2\) ইত্যাদির ক্ষেত্রে \(PV\) বনাম \(P\) -এর লেখচিত্র সরলরৈখিক কিন্তু আদর্শ গ্যাসের \(PV\) রেখার ওপর থাকে।
- বিজ্ঞানী রেনো (Regnault), অ্যানড্রুজ (Andrews), ক্যামারলিং (Kamerlingh) বাস্তব গ্যাসের আদর্শ আচরণ থেকে বিচ্যুতির কারণ সংক্রান্ত পরীক্ষা করেন।
বাস্তব গ্যাসের আদর্শ গ্যাসের মতো আচরণ (Behaviour of a real gas like ideal gas) –
বাস্তব গ্যাস \(CO_2\) -এর বিভিন্ন স্থির উষ্ণতায় \(PV\) বনাম \(P\) -এর লেখচিত্র পর্যালোচনা করা হল- অপেক্ষাকৃত কম উষ্ণতায় \(\left(T_1,\;T_2,\;T_3\right)CO_2\) গ্যাসের লেখচিত্র বাস্তব গ্যাসের অনুরূপ। উষ্ণতা বৃদ্ধির সঙ্গে \(\left(T_3>T_2>T_1\right)\) অবতল অংশের গভীরতা ক্রমশ কমতে থাকে এবং \(PV\) -এর সর্বমিম্ন মান \(PV\) -অক্ষের দিকে অর্থাৎ \(PV\) -এর কম মানের অঞ্চলের দিকে সরে আসতে থাকে। উষ্ণতা বাড়তে বাড়তে একটি নির্দিষ্ট উষ্ণতায় \(\left(T_4\right)PV\) রেখা \(P\) -এর সর্বনিম্ন অঞ্চলে (\(a-b\) অঞ্চল) আদর্শ গ্যাসের \(PV\) রেখার সঙ্গে মিলিত হয় অর্থাৎ, ওই \(\left(a-b\right)\) অঞ্চলে \(PV\) -এর মান ধ্রুবক হয়। এরপর \(PV\) -এর মান বাড়ালে \(PV\) -এর মান আদর্শ গ্যাসের \(PV\) -এর মান অপেক্ষা বেশি হয়। \(T_4\) অপেক্ষা বেশি উষ্ণতায় \(\left(T_5\right)PV\) রেখা \(P\) -এর সর্বনিম্ন অঞ্চলে (\(a-c\) অঞ্চল) আদর্শ গ্যাসের \(PV\) রেখার সঙ্গে মিলিত হয় কিন্তু এক্ষেত্রে \(P\) -অক্ষের সঙ্গে মিলনের বিস্তার (\(a-c\) অঞ্চল) \(T_4\) উষ্ণতার বিস্তার (\(a-b\) অঞ্চল) অপেক্ষা বেশি হয়। \(\left(a-c\right)\) অঞ্চলে \(PV\) -এর মান ধ্রুবক। \(T_5\) উষ্ণতায় \(PV\) ধ্রুবকের অঞ্চল (\(a-c\) অঞ্চল) \(T_4\) উষ্ণতায় \(PV\) ধ্রুবকের অঞ্চল (\(a-b\) অঞ্চল) অপেক্ষা বেশি হয়। এই লেখচিত্র থেকে একটা সিদ্ধান্ত আসা যায় যে –
- কোনো গ্যাস নিম্নচাপ ও উচ্চ উষ্ণতায় আদর্শ গ্যাসের মতো আচরণ করে।
- উচ্চ উষ্ণতায় চাপ উচ্চ হলে সেটির আচরণ আবার আদর্শ গ্যাসের আচরণ থেকে বিচ্যুত হয়।
- উচ্চ উষ্ণতা যত বেশি হতে থাকে ততই বেশি উচ্চ চাপ পর্যন্ত সেটি আদর্শ গ্যাসের মতো আচরণ করে।
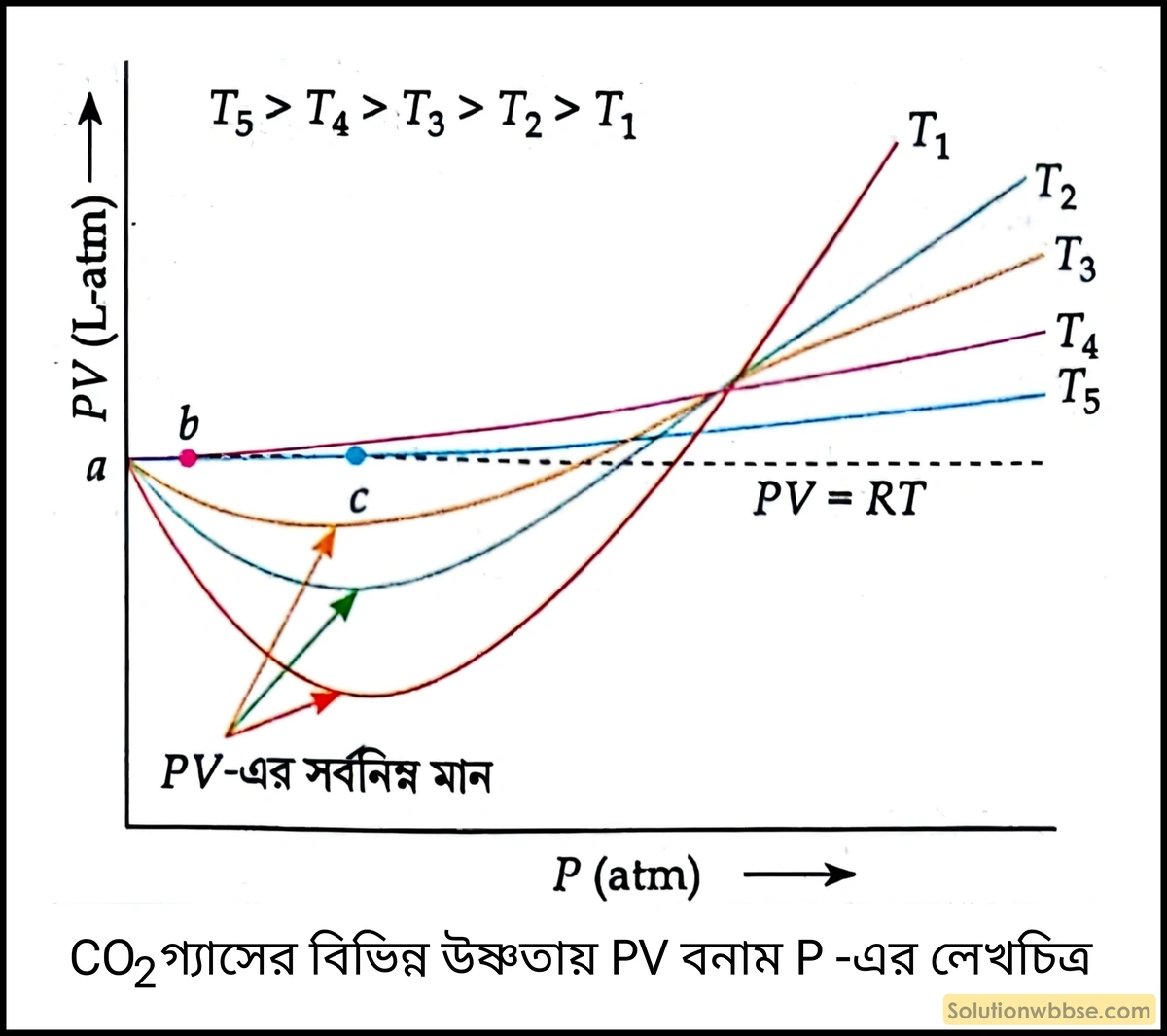
যেমন – ওপরের \(CO_2\) গ্যাসের লেখচিত্রের \(T_5>T_4\)। \(T_5\) উষ্ণতায় \(P\) চাপের \(\left(a-c\right)\) অঞ্চলে \(c\) বিন্দু পর্যন্ত এবং \(T_4\) উষ্ণতায় \(P\) চাপের \(\left(a-b\right)\) অঞ্চলে \(b\) বিন্দু পর্যন্ত \(CO_2\) গ্যাস আদর্শ গ্যাসের মতো আচরণ করে। কিন্তু \(c\) বিন্দুতে গ্যাসের চাপ \(b\) বিন্দুর গ্যাসের চাপ অপেক্ষা বেশি। অর্থাৎ, \(T_5>T_4\) হওয়ায় \(T_4\) উষ্ণতায় \(P\) -এর সর্বোচ্চ যে মান পর্যন্ত \(CO_2\) গ্যাস আদর্শ গ্যাসের মতো আচরণ করে \(T_5\) উষ্ণতায় পূর্বাপেক্ষা \(P\) -এর বেশি মানে \(CO_2\) গ্যাস আদর্শ গ্যাসের মতো আচরণ করে।
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘বয়েল ও চার্লসের সূত্রের সমন্বয়, আদর্শ গ্যাস সমীকরণ এবং গ্যাসের গতীয় তত্ত্ব’ নিয়ে আলোচনা করেছি, যা ‘চার্লসের সূত্র ও চাপের সূত্র’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশটি থেকে প্রায় প্রতি বছর প্রশ্ন আসে এবং চাকরির পরীক্ষার প্রস্তুতির জন্যও এটি অত্যন্ত গুরুত্বপূর্ণ। তাই শিক্ষার্থী ও প্রার্থী সকলের জন্য এই আলোচনা বিশেষভাবে সহায়ক হবে বলে আমরা আশা করি। আশা করি আর্টিকেলটি আপনাদের উপকারে এসেছে। কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের টেলিগ্রামে যোগাযোগ করতে পারেন—আমরা উত্তর দেওয়ার চেষ্টা করব। পাশাপাশি, যাদের এই তথ্যগুলি প্রয়োজন মনে করছেন, তাদের সাথে এই পোস্টটি শেয়ার করুন। ধন্যবাদান্তে, Team SolutionWbbse






মন্তব্য করুন