এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “হাইড্রোজেন ক্লোরাইড তড়িৎযোজী না সমযোজী ব্যাখ্যা করো।” — নিয়ে আলোচনা করব। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ।

হাইড্রোজেন ক্লোরাইড তড়িৎযোজী না সমযোজী ব্যাখ্যা করো।
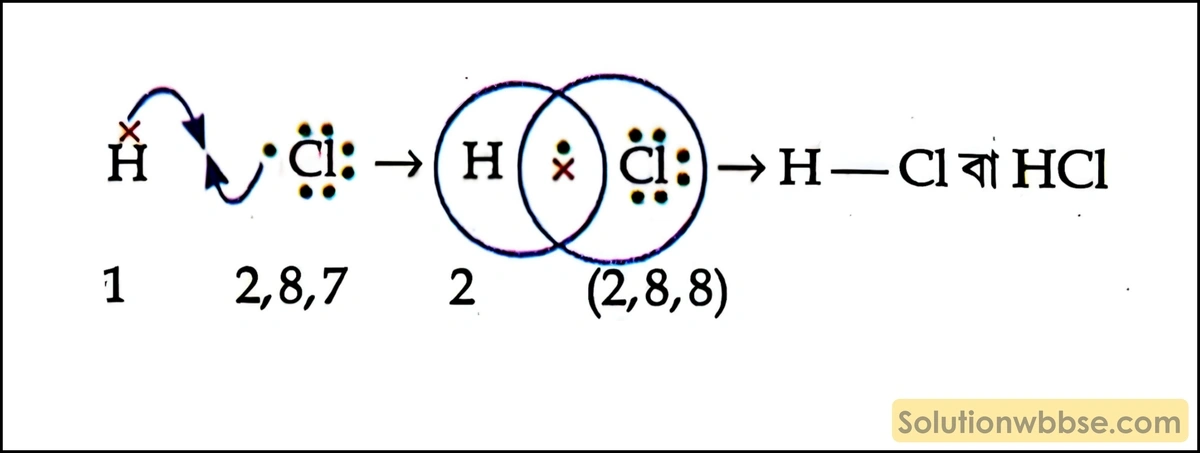
হাইড্রোজেন ক্লোরাইড (HCI) সমযোজী – হাইড্রোজেন পরমাণুর সবচেয়ে বাইরের কক্ষে 1টি এবং ক্লোরিন পরমাণুর সবচেয়ে বাইরের কক্ষে 7টি ইলেকট্রন থাকে। অণু গঠনের সময় একটি H-পরমাণু এবং একটি Cl পরমাণু তাদের সবচেয়ে বাইরের কক্ষ থেকে 1টি করে ইলেকট্রন দিয়ে 1টি ইলেকট্রন জোড় গঠন করে এবং উভয় পরমাণু ওই ইলেকট্রন জোড়কে সমভাবে ব্যবহার করে H-পরমাণু তার সবচেয়ে বাইরের কক্ষে 2টি এবং Cl পরমাণু তার সবচেয়ে বাইরের কক্ষে 8টি ইলেকট্রন পূর্ণ করে ও HCl অণু গঠন করে।
সুতরাং, HCI সমযোজী যৌগ।
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “হাইড্রোজেন ক্লোরাইড তড়িৎযোজী না সমযোজী ব্যাখ্যা করো।” — নিয়ে আলোচনা করেছি। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন।






Leave a Comment