এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “হাইড্রোজেন ক্লোরাইডের অণুর ইলেকট্রন ডট্ গঠন দেখাও।” — নিয়ে আলোচনা করব। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ।

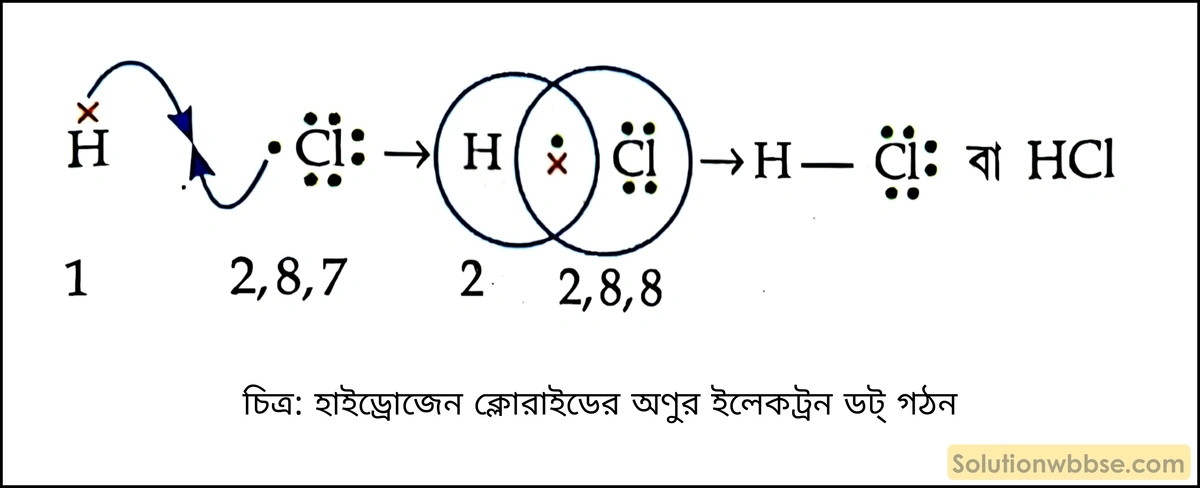
হাইড্রোজেন ক্লোরাইডের অণুর ইলেকট্রন ডট্ গঠন দেখাও।
হাইড্রোজেন ক্লোরাইড (HCl) অণুর গঠন –
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “হাইড্রোজেন ক্লোরাইডের অণুর ইলেকট্রন ডট্ গঠন দেখাও।” — নিয়ে আলোচনা করেছি। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন।






Leave a Comment