এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘রাসায়নিক গণনা’ নিয়ে আলোচনা করব। এটি ‘রাসায়নিক গণনা’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশ থেকে প্রায় প্রতি বছর প্রশ্ন আসে। এছাড়া, চাকরির পরীক্ষার প্রস্তুতির জন্যও এই আর্টিকেলটি আপনার জন্য গুরুত্বপূর্ণ হবে।

মাধ্যমিক ভৌতবিজ্ঞান – রাসায়নিক গণনা
রাসায়নিক গণনা –
কোনো রাসায়নিক সংকেত বা রাসায়নিক সমীকরণ থেকে বিভিন্ন পদার্থের ভর, আয়তন, বাষ্পঘনত্ব ইত্যাদি নির্ণয় করাকে রাসায়নিক গণনা বলে।
রাসায়নিক সমীকরণ –
বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের পরমাণু সংখ্যার সমতা বজায় রেখে চিহ্ন ও সংকেতের সাহায্যে কোনো রাসায়নিক বিক্রিয়ার সংক্ষিপ্ত প্রকাশকে রাসায়নিক সমীকরণ বলে।
রাসায়নিক সমীকরণ থেকে রাসায়নিক বিক্রিয়ার গুণগত এবং পরিমাণগত অনেক তথ্য পাওয়া যায়।
রাসায়নিক বিক্রিয়ায় ভর সংরক্ষণ সূত্র –
পদার্থের ভর অবিনশ্বর। একে সৃষ্টি বা ধ্বংস করা যায় না। কোনো রাসায়নিক বিক্রিয়ার পূর্বে বিক্রিয়ক পদার্থের মোট ভর বা ওজন বিক্রিয়ার পরে বিক্রিয়াজাত পদার্থের মোট ভর বা ওজন সমান থাকে।
অর্থাৎ, রাসায়নিক বিক্রিয়ায়, বিক্রিয়কগুলির মোট ভর = বিক্রিয়াজাত পদার্থগুলির মোট ভর।
আইনস্টাইনের সমীকরণ –
বিজ্ঞানী আইনস্টাইন তাঁর বিখ্যাত সূত্রে ভর ও শক্তির মধ্যে পারস্পরিক সম্পর্কে দেখিয়েছেন যে, কোনো কোনো ক্ষেত্রে পদার্থের ভর ও শক্তি পরস্পর রূপান্তরশীল। শক্তি ও ভরের সম্পর্ক আইনস্টাইন \(E=mc^2\) সমীকরণ দ্বারা প্রকাশ করেন (\(E\) = শক্তি, \(m\) = গ্রামে প্রকাশিত ভর, \(c\) = আলোর গতিবেগ = \(3\times10^{10}\) সেমি/সেকেন্ড)।

ভর ও শক্তির সম্মিলিত নিত্যতা সূত্র –
কোনো রাসায়নিক বিক্রিয়ার আগে ও পরে, পদার্থের ভর ও শক্তির মোট পরিমাণ সর্বদা সমান থাকে। মহাবিশ্বে ভর ও শক্তির মোট পরিমাণ ধ্রুবক ও অপরিবর্তনীয়।
গ্রাম-পারমাণবিক ভর –
কোনো মৌলিক পদার্থের গ্রামে প্রকাশিত আপেক্ষিক গ্রাম-পারমাণবিক ভর কোনো মৌলিক পদার্থের গ্রামে প্রকাশিত আপেক্ষিক পারমাণবিক ভরকে ওই মৌলের গ্রাম-পারমাণবিক ভর বলে। যেমন-কার্বন ও নাইট্রোজেন পরমাণুর আপেক্ষিক পারমাণবিক ভর যথাক্রমে \(12\) ও \(14\), কিন্তু ওই মৌলগুলির গ্রাম-পারমাণবিক ভর যথাক্রমে \(12\;g\) ও \(14\;g\)।
গ্রাম-পরমাণু –
কোনো মৌলিক পদার্থের আপেক্ষিক পারমাণবিক ভরকে গ্রাম এককে প্রকাশ করা হলে যত গ্রাম হয়, তত গ্রাম ভরের মৌলকে ওই মৌলের \(1\) গ্রাম-পরমাণু বলে।
যেমন – \(1\) গ্রাম-পরমাণু কার্বন বলতে বোঝায় \(12\;g\)।
গ্রাম-পরমাণু সংখ্যা –
কোনো মৌলের নির্দিষ্ট পরিমাণ ভরকে (গ্রাম এককে) গ্রাম-পারমাণবিক ভর দ্বারা ভাগ করলে গ্রাম-পরমাণুর সংখ্যা পাওয়া যায়।
যেমন –
গ্রাম-আণবিক ভর –
কোনো মৌলিক বা যৌগিক পদার্থের আপেক্ষিক আণবিক ভরকে গ্রাম এককে প্রকাশ করলে যত গ্রাম হয় তত গ্রাম পরিমাণ ভরকে ওই মৌলিক বা যৌগিক পাদর্থের গ্রাম-আণবিক ভর বলে।
যেমন – অক্সিজেনের গ্রাম-আণবিক ভর \(32\;g\)।
গ্রাম-অণু বা গ্রাম মোল –
কোনো মৌলিক বা যৌগিক পদার্থের আপেক্ষিক আণবিক ভরকে গ্রাম এককে প্রকাশ করলে যত গ্রাম হয় তত গ্রাম ভরের পরিমাণকে ওই মৌলিক বা যৌগিক পদার্থের এক গ্রাম-অণু বা এক গ্রাম মোল বলে।
যেমন – অক্সিজেনের গ্রাম-আণবিক ভর = \(32\;g\)।
∴ \(32\;g\) অক্সিজেন \(=\frac{32}{32}=1\) গ্রাম-অণু বা \(1\) গ্রাম-মোল অক্সিজেন।
অথবা, কোনো মৌলিক বা যৌগিক পদার্থের যত গ্রামের মধ্যে \(6.022\times10^{23}\) সংখ্যক অণু থাকে তত গ্রাম পরিমাণকে ওই মৌলিক বা যৌগিক পদার্থের \(1\) গ্রাম-অণু বলে।
যেমন – \(6.022\times10^{23}\) সংখ্যক নাইট্রোজেন অণুর ভর \(28\;g\)। অতএব \(28\;g\) নাইট্রোজেন = \(1\) গ্রাম-অণু নাইট্রোজেন।
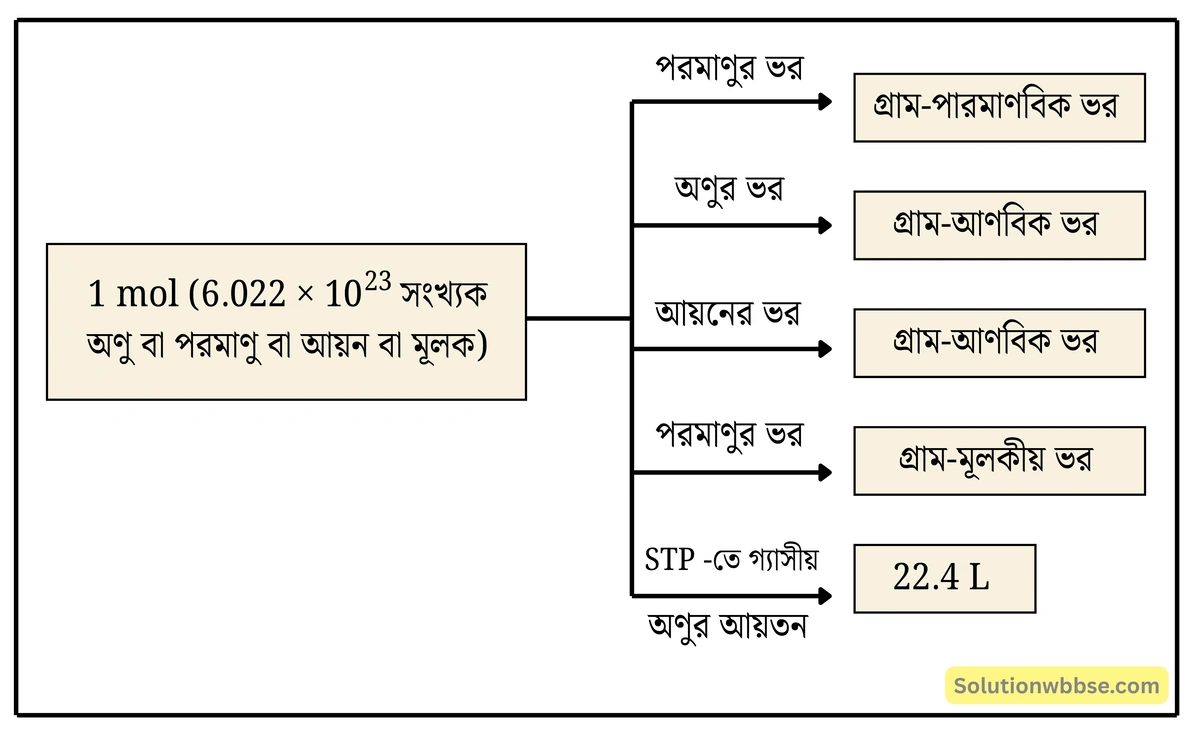
মোল –
কোনো পদার্থের যে পরিমাণে অ্যাভোগাড্রো সংখ্যক \(\left(6.022\times10^{23}\right)\) উপাদান কণিকা থাকে সেই পরিমাণকে ওই পদার্থের এক মোল বলে।
উদাহরণ – \(1\) মোল হাইড্রোজেন পরমাণু, \(1\) মোল হাইড্রোজেন অণু ও \(1\) মোল হাইড্রোজেন আয়ন বলতে বোঝায় যথাক্রমে \(6.022\times10^{23}\) সংখ্যক হাইড্রোজেন পরমাণু, অণু ও আয়ন।
মোল হল পদার্থের পরিমাণের একক।
গ্যাসের বাষ্পঘনত্ব –
একই চাপ ও উষ্ণতায় কোনো গ্যাসের ভর সমআয়তন হাইড্রোজেন গ্যাসের ভরের তুলনায় যতগুণ ভারী, সেই তুলনামূলক সংখ্যাটিকে ওই গ্যাসের বাষ্পঘনত্ব বলে।
- গ্যাসের বাষ্পঘনত্ব, চাপ ও তাপমাত্রার ওপর নির্ভরশীল নয়।
- বাষ্পঘনত্ব একটি সংখ্যা মাত্র, এটি এককবিহীন রাশি। কোনো গ্যাসের বাষ্পঘনত্ব নির্ণয়ের সময় যদি পরীক্ষাকালীন তাপমাত্রায় ওই গ্যাসটি বিয়োজিত হয়ে যায়, তবে সেইসব গ্যাসের বাষ্পঘনত্ব \(M=2D\) সূত্র থেকে প্রাপ্ত তাত্ত্বিক মান অপেক্ষা অনেক কম হয়। উদাহরণ – \(PCl_5,\;NH_4Cl\) ইত্যাদি।
প্রমাণ ঘনত্ব –
\(STP\) -তে এক লিটার গ্যাসের গ্রামে প্রকাশিত ভরকে গ্যাসটির প্রমাণ ঘনত্ব বলে।
যেমন – হাইড্রোজেনের প্রমাণ ঘনত্ব \(\times\) \(0.089\;gL^{-1}\)
বা গ্যাসের প্রমাণ ঘনত্ব গ্যাসের বাষ্পঘনত্ব \(\times\) \(0.089\;gL^{-1}\)।
রাসায়নিক গণনায় প্রয়োজন-বিশেষে নীচের বিষয়গুলি মনে রাখা দরকার –
1. কঠিন পদার্থের শতকরা হিসাব ভর হিসেবে ধরা হয়।
2. গ্যাসীয় পদার্থের ক্ষেত্রে শতকরা হিসাব অধিকাংশ ক্ষেত্রে আয়তন হিসেবে গণ্য করা হয়।
3. তরল পদার্থের ক্ষেত্রে শতকরা হিসাব ভর বা আয়তন উভয় দ্বারা প্রকাশ করা হয়।
4.
5.
6.
বা, ভর (গ্রাম) = মোলসংখ্যা × গ্রাম-আণবিক ভর।
7. \(STP\) -তে এক গ্রাম-অণু যে-কোনো গ্যাসের আয়তন \(22.4\) লিটার। এই আয়তন গ্যাসের প্রকৃতির ওপর নির্ভর করে না।
8. সমীকরণে প্রকাশিত গ্যাসগুলির আয়তন \(STP\) -তে ধরা হয়।
9. গ্যাসের আণবিক গুরুত্ব = \(2\) \(\times\) বাষ্পঘনত্ব অর্থাৎ \(M=2D\) হবে।
10. \(STP\) -তে \(1\) লিটার \(H_2\) গ্যাসের ভর = \(0.089\) গ্রাম।
11. \(STP\) -তে \(1\) লিটার যে-কোনো গ্যাসের ভর গ্যাসটির বাষ্পঘনত্ব \(\times\) \(0.089\) গ্রাম।
12. বিক্রিয়ার সমীকরণ থেকে বিক্রিয়কের ভর নির্ণয় করা হয়।
কিছু গুরুত্বপূর্ণ প্রশ্নোত্তর
রাসায়নিক গণনা কী?
কোনো রাসায়নিক সংকেত বা সমীকরণ থেকে পদার্থের ভর, আয়তন, বাষ্পঘনত্ব ইত্যাদি নির্ণয় করাকে রাসায়নিক গণনা বলে।
রাসায়নিক সমীকরণ কাকে বলে?
বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের পরমাণু সংখ্যার সমতা রেখে চিহ্ন ও সংকেতের সাহায্যে রাসায়নিক বিক্রিয়ার সংক্ষিপ্ত প্রকাশকে রাসায়নিক সমীকরণ বলে।
ভর সংরক্ষণ সূত্র কী?
রাসায়নিক বিক্রিয়ায় বিক্রিয়কগুলির মোট ভর = বিক্রিয়াজাত পদার্থগুলির মোট ভর। অর্থাৎ, পদার্থের ভর সৃষ্টি বা ধ্বংস করা যায় না।
গ্রাম-পরমাণু ও গ্রাম-অণুর মধ্যে পার্থক্য কী?
গ্রাম-পরমাণু ও গ্রাম-অণুর মধ্যে পার্থক্য হল –
1. গ্রাম-পরমাণু – কোনো মৌলের আপেক্ষিক পারমাণবিক ভরকে গ্রামে প্রকাশ করলে যে ভর পাওয়া যায় (যেমন – 1 গ্রাম-পরমাণু কার্বন = 12g)।
2. গ্রাম-অণু (গ্রাম-মোল) – কোনো যৌগের আপেক্ষিক আণবিক ভরকে গ্রামে প্রকাশ করলে যে ভর পাওয়া যায় (যেমন – 1 গ্রাম-অণু O2 = 32g)।
মোল কাকে বলে?
কোনো পদার্থের 6.022 × 1023 (অ্যাভোগাড্রো সংখ্যা) সংখ্যক কণিকা (পরমাণু, অণু বা আয়ন) থাকলে তাকে 1 মোল বলে।
গ্যাসের বাষ্পঘনত্ব কী?
একই চাপ ও তাপমাত্রায় কোনো গ্যাসের ভর সমআয়তন হাইড্রোজেন গ্যাসের ভরের তুলনায় যতগুণ ভারী, তাকে বাষ্পঘনত্ব (D) বলে।
STP -তে গ্যাসের মোলার আয়তন কত?
STP (Standard Temperature and Pressure) -তে 1 মোল গ্যাসের আয়তন = 22.4 লিটার।
প্রমাণ ঘনত্ব কী?
STP -তে 1 লিটার গ্যাসের ভর (গ্রামে) কে প্রমাণ ঘনত্ব বলে।
রাসায়নিক গণনায় কোন বিষয়গুলি মনে রাখা প্রয়োজন?
রাসায়নিক গণনায় যে যে বিষয়গুলি মনে রাখা প্রয়োজন সেগুলি হল –
1. কঠিন পদার্থের হিসাব ভর অনুসারে।
2. গ্যাসীয় পদার্থের হিসাব আয়তন অনুসারে।
3. তরল পদার্থের হিসাব ভর বা আয়তন উভয় ভাবে হতে পারে।
4. STP -তে 1 মোল গ্যাসের আয়তন = 22.4 লিটার।
5. আণবিক ভর = 2 × বাষ্পঘনত্ব।
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘রাসায়নিক গণনা’ নিয়ে আলোচনা করেছি, যা ‘রাসায়নিক গণনা’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশটি থেকে প্রায় প্রতি বছর প্রশ্ন আসে এবং চাকরির পরীক্ষার প্রস্তুতির জন্যও এটি অত্যন্ত গুরুত্বপূর্ণ। তাই শিক্ষার্থী ও প্রার্থী সকলের জন্য এই আলোচনা বিশেষভাবে সহায়ক হবে বলে আমরা আশা করি। আশা করি আর্টিকেলটি আপনাদের উপকারে এসেছে। কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের টেলিগ্রামে যোগাযোগ করতে পারেন—আমরা উত্তর দেওয়ার চেষ্টা করব। পাশাপাশি, যাদের এই তথ্যগুলি প্রয়োজন মনে করছেন, তাদের সাথে এই পোস্টটি শেয়ার করুন। ধন্যবাদান্তে, Team SolutionWbbse






মন্তব্য করুন