আজকের আর্টিকেলে আমরা নবম শ্রেণীর ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “দ্রবণ” থেকে সহজ ও সংক্ষিপ্ত প্রশ্ন-উত্তর শেয়ার করবো। এই প্রশ্নগুলো নবম শ্রেণির ইউনিট টেস্ট থেকে বার্ষিক পরীক্ষা এর জন্য যেমন গুরুত্বপূর্ণ, তেমনি চাকরি বা বিভিন্ন প্রতিযোগিতার পরীক্ষাতেও কাজে লাগবে। এই অধ্যায় থেকে স্কুল পরীক্ষা থেকে শুরু করে চাকরির পরীক্ষায় প্রায়ই প্রশ্ন আসে, তাই এই প্রশ্নোত্তরগুলো সবাইকে সাহায্য করবে। প্রতিটি প্রশ্নের উত্তর সহজ ভাষায় লেখা হয়েছে, যাতে সবাই বুঝতে পারেন। পড়ার শেষে এই অধ্যায়ের মুখ্য বিষয়গুলো আপনার আয়ত্তে চলে আসবে এবং যেকোনো পরীক্ষায় আত্মবিশ্বাসের সঙ্গে লিখতে পারবেন।

জ্ঞানমূলক প্রশ্নোত্তর
সমসত্ত্ব ও অসমসত্ত্ব মিশ্রণ কাকে বলে?
সমসত্ত্ব মিশ্রণ (Homogeneous Mixture) – যে মিশ্রণের বিভিন্ন অংশের গঠন ও ধর্ম একই, তাকে সমসত্ত্ব মিশ্রণ বলে। যেমন – চিনির জলীয় দ্রবণ।
অসমসত্ত্ব মিশ্রণ (Heterogeneous Mixture) – যে মিশ্রণের বিভিন্ন অংশের গঠন ও ধর্ম ভিন্ন, তাকে অসমসত্ত্ব মিশ্রণ বলে। যেমন – বালি ও গন্ধক চূর্ণের মিশ্রণ।
দ্রবণ (Solution) কাকে বলে?
দ্রবণ (Solution) – দুই বা ততোধিক পদার্থের সমসত্ত্ব মিশ্রণের যে-কোনো অংশের গঠন ও ধর্ম যদি একই হয় এবং উপাদানগুলির আপেক্ষিক পরিমাণ যদি একটি নির্দিষ্ট সীমার মধ্যে পরিবর্তন করা যায়, তবে ওই মিশ্রণকে দ্রবণ বলে।
দ্রবণের বিভিন্ন অংশগুলি কী কী? তাদের সংজ্ঞা দাও।
দ্রবণের দুটি অংশ –
- দ্রাব ও
- দ্রাবক।
দ্রাব (Solute) – দ্রবণের মধ্যে যে উপাদানটি কম পরিমাণে থাকে এবং যে উপাদানটি অন্য কোনো তরল, কঠিন বা গ্যাসীয় পদার্থে দ্রবীভূত হয়ে সমসত্ত্ব মিশ্রণ উৎপন্ন করে, তাকে দ্রাব বলে। যেমন – জলে চিনি মেশালে যে দ্রবণ প্রস্তুত হবে, তাতে দ্রাব হল চিনি।
দ্রাবক (Solvent) – দ্রবণের মধ্যে যে উপাদানটির পরিমাণ বেশি থাকে বা যে উপাদানটির ভৌত অবস্থা দ্রবণের ভৌত অবস্থার মতো হয়, তাকে দ্রাবক বলে। যেমন –
- 40 গ্রাম জলে 60 গ্রাম অ্যালকোহল মিশিয়ে দ্রবণ প্রস্তুত করা হলে, অ্যালকোহলের পরিমাণ জল অপেক্ষা বেশি হওয়ায় দ্রাবক হবে অ্যালকোহল।
- 100°C -এ 100 গ্রাম জলে 248 গ্রাম পটাশিয়াম নাইট্রেটের দ্রবণে জলের পরিমাণ কম হলেও, জল ও উৎপন্ন দ্রবণ উভয়েরই ভৌত অবস্থা তরল হওয়ায়, দ্রাবক হবে জল।
দ্রাব ও দ্রাবকের ভৌত অবস্থা অনুযায়ী দ্রবণের বিভিন্ন প্রকারভেদগুলি উল্লেখ করো।
দ্রাব ও দ্রাবকের ভৌত অবস্থা অনুযায়ী দ্রবণের শ্রেণিবিভাগ নিম্নরূপ –
| দ্রাব | দ্রাবক | উদাহরণ |
| গ্যাস | গ্যাস | বায়ু – O2 এবং N2 -এর দ্রবণ। |
| গ্যাস | তরল | জলে HCl গ্যাসের দ্রবণ,জলে NH3 গ্যাসের দ্রবণ ইত্যাদি। |
| গ্যাস | কঠিন | প্যালাডিয়াম, প্ল্যাটিনাম প্রভৃতি ধাতু দ্বারা H2 গ্যাস শোষণের ফলে উৎপন্ন দ্রবণ (একে অন্তর্ধ্বতি বলে)। |
| তরল | গ্যাস | জলীয় বাষ্প দ্বারা সম্পৃক্ত বায়ু। |
| তরল | তরল | জল ও অ্যালকোহলের দ্রবণ। |
| তরল | কঠিন | পারদসংকর বা অ্যামালগাম। যেমন – NaHg, Zn-Hg। |
| কঠিন | তরল | চিনির জলীয় দ্রবণ, সাধারণ লবণের জলীয় দ্রবণ ইত্যাদি। |
| কঠিন | কঠিন | ধাতুসংকর, যেমন – জিংক ও কপারের সমন্বয়ে উৎপন্ন পিতল। |
বাতান্বিত জল কী এবং এটি জলচর প্রাণীদের শ্বাসকার্যে কীভাবে সহায়তা করে?
জলের মধ্যে বায়ু বা অক্সিজেন দ্রবীভূত অবস্থায় থাকলে সেই জলকে বাতান্বিত জল বলে। জলচর প্রাণীরা এই জলে দ্রবীভূত অক্সিজেনের সাহায্যে তাদের শ্বাসকার্য সম্পন্ন করে।
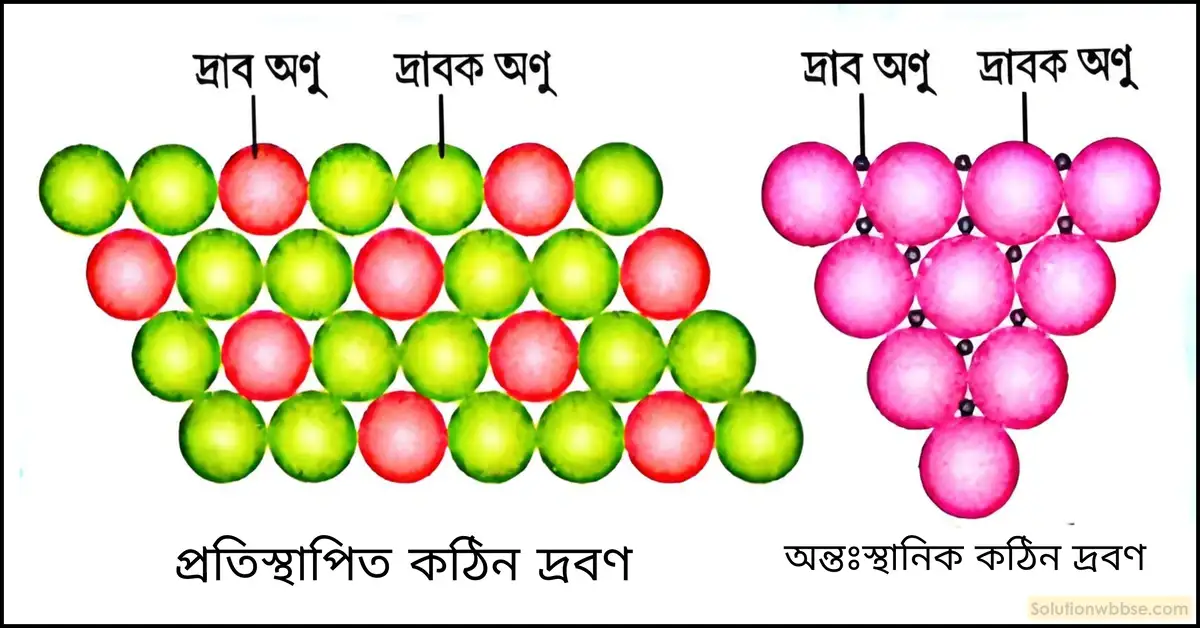
কঠিন দ্রবণ কী? এটি কত প্রকার এবং কীভাবে বিভাজিত করা যায়? উদাহরণসহ ব্যাখ্যা করুন।
কঠিন দ্রবণ (Solid Solution) – দুই বা ততোধিক কঠিন পিতল হল মৌলের সমসত্ত্ব মিশ্রণকে বলা হয় কঠিন দ্রবণ। যেমন – তামা ও জিংক; এই দুই কঠিন মৌলের সমসত্ত্ব মিশ্রণ।
কঠিন দ্রবণকে দ্রাব ও দ্রাবক কণার আকারের ভিত্তিতে দুই ভাগে ভাগ করা যায়। যথা – প্রতিস্থাপিত কঠিন দ্রবণ এবং অন্তঃ স্থানিক কঠিন দ্রবণ।
প্রতিস্থাপিত কঠিন দ্রবণ কী? উদাহরণসহ ব্যাখ্যা করুন।
প্রতিস্থাপিত কঠিন দ্রবণ (Substitutional Solid Solution) – প্রতিস্থাপিত কঠিন দ্রবণে দ্রাব ও দ্রাবক অণুর আকার সমান হয়। তাই সহজেই দ্রাবক অণুগুলি দ্রাব অণু দ্বারা প্রতিস্থাপিত হতে পারে। পিতল, ব্রোঞ্জ ইত্যাদি প্রতিস্থাপিত কঠিন দ্রবণের উদাহরণ।
অন্তঃস্থানিক কঠিন দ্রবণ কী? একটি উদাহরণ উল্লেখ করুন।
অন্তঃস্থানিক কঠিন দ্রবণ (Interstitial Solid Solution) – অন্তঃস্থানিক কঠিন দ্রবণে উপস্থিত দ্রাব কণার আকার দ্রাবক কণার আকার অপেক্ষা ছোটো হয়। তাই দ্রাব কণাগুলি দ্রাবক কণার মাঝে স্থান করে নেয়। স্টিল এক প্রকার অন্তঃস্থানিক কঠিন দ্রবণের উদাহরণ।
নীচের দ্রবণগুলিতে দ্রাবক ও দ্রাব শনাক্ত করো – (1) 40 cc জলে 60 cc ইথানলের দ্রবণ, (2) 200 গ্রাম জলে 210 গ্রাম পটাশিয়াম নাইট্রেটের দ্রবণ, (3) পিতল [80% তামা ও 20% দস্তার সমসত্ত্ব মিশ্রণ], (4) বায়ু, (5) 200 গ্রাম জল ও 200 গ্রাম গ্লিসারিনের দ্রবণ; (6) 80 গ্রাম সোডিয়াম ও 10 গ্রাম পারদ দ্বারা তৈরি সোডিয়াম অ্যামালগাম।
| দ্রবণ | দ্রাব | দ্রাবক | যুক্তি |
| 1. 40 cc জলে 60 ইথানলের দ্রবণ | জল | ইথানল | এক্ষেত্রে দ্রবণের দুটি উপাদান জল ও ইথানল উভয়েরই ভৌত অবস্থা একই অর্থাৎ, তরল। যেহেতু ইথানল বেশি পরিমাণে আছে, তাই দ্রাবক ইথানল এবং জল কম পরিমাণে থাকায় দ্রাব হল জল। |
| 2. 200 গ্রাম জলে 210 গ্রাম পটাশিয়াম নাইট্রেটের দ্রবণ | পটাশিয়াম নাইট্রেট | জল | দ্রবণের উপাদান দুটির ভৌত অবস্থা পৃথক হলে যে উপাদানটির ভৌত অবস্থা দ্রবণের ভৌত অবস্থার মতো হয়, সেটি দ্রাবক এবং অন্য উপাদানটি দ্রাব হয়। এক্ষেত্রে পটাশিয়াম নাইট্রেটের পরিমাণ বেশি হওয়া সত্ত্বেও যেহেতু জল ও দ্রবণের ভৌত অবস্থা তরল এবং পটাশিয়াম নাইট্রেট কঠিন, তাই দ্রাবক জল এবং দ্রাব পটাশিয়াম নাইট্রেট। |
| 3. পিতল (80% তামা ও 20% দস্তার সমসত্ত্ব মিশ্রণ) | দস্তা | তামা | এক্ষেত্রে তামা ও দস্তা উভয়েই কঠিন। যেহেতু তামার পরিমাণ বেশি (80%), তাই তামা দ্রাবক এবং দস্তার পরিমাণ কম (20%), তাই দস্তা দ্রাব। |
| 4. বায়ু | অক্সিজেন | নাইট্রোজেন | বাতাসের প্রধান উপাদান নাইট্রোজেন ও অক্সিজেন উভয়েরই ভৌত অবস্থা গ্যাসীয়, যেহেতু নাইট্রোজেন বেশি পরিমাণে আছে তাই দ্রাবক নাইট্রোজেন এবং তুলনামূলকভাবে অক্সিজেন কম পরিমাণে থাকায়, দ্রাব অক্সিজেন। |
| 5. 200 গ্রাম জল ও 200 গ্রাম গ্লিসারিনের দ্রবণ | জল বা গ্লিসারিন যে-কোনো একটি | জল বা গ্লিসারিন যে-কোনো একটি | দ্রবণে উপস্থিত উপাদান দুটির ভৌত অবস্থা একই এবং উপাদান দুটি দ্রবণে সমপরিমাণে উপস্থিত থাকলে যে-কোনো একটি উপাদানকে দ্রাবক এবং অন্য উপাদানটিকে দ্রাব বলা যেতে পারে। এক্ষেত্রে জল ও গ্লিসারিন উভয়েই তরল এবং দ্রবণটিও তরল। দ্রবণের মধ্যে জল ও গ্লিসারিন সমপরিমাণে উপস্থিত। তাই এদের মধ্যে যে-কোনো একটি উপাদান দ্রাবক এবং অপরটি দ্রাব হবে। |
| 6. 80 গ্রাম সোডিয়াম ও 10 গ্রাম পারদ দ্বারা তৈরি সোডিয়াম অ্যামালগাম | পারদ | সোডিয়াম | এক্ষেত্রে সোডিয়াম কঠিন, পারদ তরল ও উৎপন্ন সোডিয়াম অ্যামালগাম কঠিন। যেহেতু, সোডিয়ামের পরিমাণ বেশি (80 g), তাই সোডিয়াম দ্রাবক এবং পারদের পরিমাণ কম (10 g) থাকায় পারদ দ্রাব। |
প্রকৃত দ্রবণের সংজ্ঞা দাও।
প্রকৃত দ্রবণ (True Solution) – কোনো দ্রাবকে মিশ্রিত দ্রাব কণার ব্যাস 10-8 সেমি বা তার কম হলে সেটি দ্রাবকের সঙ্গে ওতপ্রোতভাবে মিশে গিয়ে যে সমসত্ত্ব মিশ্রণ উৎপন্ন করে, তাকে প্রকৃত দ্রবণ বলে। যেমন – জলের মধ্যে চিনি বা সাধারণ লবণ দ্রবীভূত হয়ে প্রকৃত দ্রবণ গঠন করে।
প্রকৃত দ্রবণের বৈশিষ্ট্যগুলি লেখো।
প্রকৃত দ্রবণের বৈশিষ্ট্যগুলি নিম্নরূপ –
- সমসত্ত্বতা – প্রকৃত দ্রবণ হল দ্রাব ও দ্রাবকের স্বচ্ছ ও সমসত্ত্ব মিশ্রণ। অর্থাৎ, দ্রবণের যে-কোনো অংশের গঠন, উপাদান ও ধর্ম একই রকম হয়।
- দ্রাব কণার আকার – প্রকৃত দ্রবণে দ্রাবের কণাগুলি এতই ক্ষুদ্র হয় (ব্যাস ≤ 10-8 cm) যে, তাদের খালি চোখে তো নয়ই এমনকি উচ্চ শক্তিসম্পন্ন অণুবীক্ষণ যন্ত্রের সাহায্যেও এদের দেখতে পাওয়া যায় না।
- কণাগুলির ভেদ্যতা – দ্রবণে দ্রাবের কণাগুলি ফিলটার পেপার ও পার্চমেন্ট পেপারের মধ্যে দিয়ে সহজেই চলাচল করতে পারে।
- দ্রবণের স্থায়িত্ব – প্রকৃত দ্রবণ স্থায়ী প্রকৃতির হয়। প্রকৃত দ্রবণকে দীর্ঘদিন স্থিরভাবে রেখে দিলেও দ্রাব কণাগুলি থিতিয়ে পড়ে পৃথক হয় না।
- ব্রাউনীয় গতি ও টিন্ডাল প্রভাব – এই দ্রবণের কণাগুলি ব্রাউনীয় গতি ও টিন্ডাল ধর্ম প্রদর্শন করে না।
কোলয়েডীয় দ্রবণ কাকে বলে? উদাহরণ দাও।
কোলয়েডীয় দ্রবণ (Colloidal Solution) – 10-5 সেমি থেকে 10-7 সেমি ব্যাসযুক্ত কোনো অদ্রাব্য কণা যখন কোনো দ্রাবকের মধ্যে ইতস্তত ভেসে বেড়ায়, কিন্তু দ্রবীভূত হয় না, তখন সেই অসমসত্ত্ব এবং দ্বি-দশাবিশিষ্ট মিশ্রণকে কোলয়েডীয় দ্রবণ বলে। উদাহরণ – দুধ, সাবানের ফেনা, রক্ত ইত্যাদি কোলয়েডীয় দ্রবণ।
বিজ্ঞানী টমাস গ্রাহাম কোন গ্রিক শব্দের ভিত্তিতে “Colloid” শব্দটি নামকরণ করেছিলেন?
বিজ্ঞানী টমাস গ্রাহাম Colloid নামকরণ করেছিলেন। গ্রিক শব্দ Kolla = আঠা, iodos = সদৃশ।
উদাহরণসহ কোলয়েডীয় দ্রবণের বিস্তার মাধ্যম ও বিস্তৃত দশা পদগুলির অর্থ ব্যাখ্যা করো।
কোলায়ডীয় দ্রবণের দশা – কোলয়েডীয় দ্রবণের দুটি দশা বর্তমান বিস্তৃত দশা ও বিস্তার মাধ্যম।
বিস্তৃত দশা (Dispersed Phase) – কোলয়েডীয় দ্রবণে 10-5 সেমি থেকে 10-7 সেমি ব্যাসবিশিষ্ট যে পদার্থগুলি প্রলম্বিত অবস্থায় থাকে, তাদের বিস্তৃত দশা বলে।
বিস্তার মাধ্যম (Dispersion medium) – কোলয়েডীয় দ্রবণে যে মাধ্যমে কোলয়েড কণাগুলি প্রলম্বিত অবস্থায় থাকে, তাকে বিস্তার মাধ্যম বলে। যেমন – জলের মধ্যে ফ্যাটজাতীয় কণাগুলি অসমসত্ত্বভাবে মিশে দুধ তৈরি করে। এখানে ফ্যাটজাতীয় কণাগুলি হল বিস্তৃত দশা এবং জল হল বিস্তার মাধ্যম।
বিস্তৃত দশা ও বিস্তার মাধ্যমের ভৌত অবস্থার ভিত্তিতে কোলয়েডের শ্রেণিবিভাগ করো।
বিস্তৃত দশা ও বিস্তারে মাধ্যমের ভৌত অবস্থার ভিত্তিতে কোলয়েডের শ্রেণিবিভাগ –
| বিস্তৃত দশা | বিস্তার মাধ্যম | কোলয়েডের নাম | উদাহরণ |
| কঠিন | তরল | সল (Sol) | সালফার সল, গোল্ড সল, রং |
| তরল | তরল | ইমালসন | দুধ, শ্যাম্পু |
| গ্যাসীয় | তরল | ফোম | সাবানের ফেনা |
| কঠিন | কঠিন | কঠিন সল | রঙিন কাচ, সংকর ধাতু |
| তরল | কঠিন | জেল (Gel) | পনির,দই |
| গ্যাসীয় | কঠিন | কঠিন ফোম | ঝামা পাথর |
| কঠিন | গ্যাসীয় | কঠিন এরোসল | ধোঁয়া |
| তরল | গ্যাসীয় | তরল এরোসল | মেঘ, কুয়াশা |
বিস্তার মাধ্যমের প্রতি বিস্তৃত দশার আসপ্তির ভিত্তিতে কোলয়েডকে কোন দুটি ভাগে বিভক্ত করা হয়? তাদের বৈশিষ্ট্য ও উদাহরণ ব্যাখ্যা করুন।
বিস্তার মাধ্যমের প্রতি বিস্তৃত দশার আসপ্তি অনুযায়ী কোলয়েডকে দুই ভাগে ভাগ করা যায়। যথা – দ্রাবক আকর্ষী কোলয়েড ও দ্রাবক বিকর্মী কোলয়েড।
দ্রাবক আকর্ষী কোলয়েড – যেসব কোলয়েডে বিস্তার মাধ্যমের প্রতি বিস্তৃত দশার তীর আসক্তি আছে অর্থাৎ, দ্রাবক আসক্তি আছে, তাদের দ্রাবক আকর্ষী কোলয়েড বা লায়োফিলিক কোলয়েড বলে। এই ধরনের কোলয়েড স্থায়ী প্রকৃতির হয়। যেমন – গাম, স্টার্চ, জিলেটিন প্রভৃতি হল দ্রাবক আকর্ষী কোলয়েডের উদাহরণ। এই ধরনের কোলয়েডে যখন বিস্তার মাধ্যম হিসেবে জল থাকে, তখন এই কোলয়েডকে জলাকর্মী বা হাইড্রোফিলিক কোলয়েড (Hydrophilic Colloid) বলে।
দ্রাবক বিকর্ষী কোলয়েড – যেসব কোলয়েডের বিস্তার মাধ্যমের প্রতি বিস্তৃত দশার কোনো আসপ্তি নেই, তাদের দ্রাবক বিকর্ষী বা লায়োফোবিক কোলয়েড বলে। এই ধরনের কোলয়েড অস্থায়ী প্রকৃতির হয়। যেমন গোল্ড সল, সিলভার সল, ফেরিক হাইড্রক্সাইড সল ইত্যাদি দ্রাবক বিকর্ত্রী কোলয়েডের উদাহরণ। এই ধরনের কোলয়েডে যখন বিস্তার মাধ্যম হিসেবে জল থাকে, তখন এই কোলয়েডকে জলবিকর্ষী বা হাইড্রোফোবিক কোলয়েড (Hydrophobic Colloid) বলে।
কোলয়েডীয় দ্রবণের বৈশিষ্ট্যগুলি উল্লেখ করো।
কোলয়েডীয় দ্রবণের বৈশিষ্ট্যগুলি নিম্নরূপ –
- দ্রবণের প্রকৃতি – কোলয়েড দ্রবণে বিস্তার মাধ্যম ও বিস্তৃত দশা পরস্পরের সঙ্গে দ্বি-দশাবিশিষ্ট অসমসত্ত্ব মিশ্রণ উৎপন্ন করে।
- দ্রাব কণার আকার – কোলয়েডীয় দ্রবণে দ্রাব কণাগুলির ব্যাস 10-5 সেমি থেকে 10-7 সেমি -এর মধ্যে হয়। দ্রাবের কণাগুলি খালি চোখে এবং সাধারণ অণুবীক্ষণ যন্ত্রে দেখা না গেলেও পরাঅণুবীক্ষণ যন্ত্রে দৃশ্যমান। দ্রবণে দ্রাবের কণাগুলি সাধারণ ফিলটার কাগজের মধ্যে দিয়ে যেতে পারে কিন্তু পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না।
- দ্রবণের স্থায়িত্ব – কোলয়েডীয় দ্রবণ স্থায়ী প্রকৃতির হয়। তবে বিশেষ কিছু শর্তের উপস্থিতিতে (তাপ দিলে, তড়িদবিশ্লেষ্য পদার্থ যোগ করলে) কোলয়েডীয় দ্রবণে প্রাবের কণাগুলি থিতিয়ে পড়ে।
- ব্রাউনীয় গতি – কোলয়েড কণাগুলি বিস্তার মাধ্যমে ইতস্তত বিক্ষিপ্তভাবে অবিরাম ছুটে বেড়ায়। ফলে, কোলয়েড কণাগুলি ব্রাউনীয় গতি প্রদর্শন করে।
- টিন্ডাল প্রভাব – কোলয়েডীয় দ্রবণের মধ্যে দিয়ে আলোকরশ্মি পাঠালে কোলয়েড কণাগুলি আলোকরশ্মির বিচ্ছুরণ ঘটায়। ফলে, আলোর গতিপথ দৃশ্যমান হয়। তাই কোলয়েড কণাগুলির টিন্ডাল প্রভাব দেখা যায়।
- অধিশোষণ ক্ষমতা – কোলয়েড কণাগুলির অধিশোষণ ক্ষমতা আছে। কোনো কোনো কোলয়েড কণা পরা-তড়িদধর্মী আয়ন অধিশোষণ করে পরা-তড়িদাহিত হয়। অপরপক্ষে কোনো কোনো কোলয়েড কণা অপরা-তড়িদধর্মী আয়ন অধিশোষণ করে অপরা-তড়িদাহিত হয়।
- তড়িৎচলন – কোলয়েড দ্রবণের মধ্যে দিয়ে তড়িৎপ্রবাহ চালনা করলে আধানগ্রস্ত কোলয়েড কণাগুলি বিপরীত আধানযুক্ত তড়িদ্বারের দিকে ছুটে যায়। কোলয়েড কণার এরূপ চলনকে তড়িৎচলন বলে।
- ব্যাপন ধর্ম – কোলয়েডীয় দ্রবণের কণাগুলির ব্যাপন খুব ধীর গতিতে ঘটে।
প্রলম্বনের বৈশিষ্ট্যগুলি লেখো।
প্রলম্বনের বৈশিষ্ট্যগুলি নিম্নরূপ –
- দ্রবণের প্রকৃতি – প্রলম্বন অস্বচ্ছ ও অসমসত্ত্ব প্রকৃতির হয়।
- দ্রাব কণার আকার – প্রলম্বনের কণাগুলির ব্যাস > 10-5 হয়। কণাগুলি অণুবীক্ষণ যন্ত্রের সাহায্যে, আবার কখনো খালি চোখেও দৃশ্যমান হয়।
- কণাগুলির ভেদ্যতা – প্রলম্বনের কণাগুলির আকার বড়ো হওয়ায় কণাগুলি সাধারণ ফিলটার কাগজ কিংবা পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না।
- দ্রবণের স্থায়িত্ব – প্রলম্বন অস্থায়ী প্রকৃতির হয়, প্রলম্বনের কণাগুলি সাধারণত অভিকর্ষ বলের প্রভাবে থিতিয়ে পড়ে।
সারণি আকারে প্রকৃত দ্রবণ, কোলয়েডীয় দ্রবণ ও প্রলম্বনের কণার ব্যাসের তুলনা করো।
| দ্রবণের প্রকৃতি | কণার ব্যাস | উদাহরণ |
| প্রকৃত দ্রবণ | ≤ 10-8 cm বা ≤ 0.1 nm | চিনির জলীয় দ্রবণ |
| কোলয়েডীয় দ্রবণ | 10-7 – 10-5 cm বা 1 – 100 nm | ভাতের ফ্যান, দুধ, রক্ত |
| প্রলম্বন | 10-5 cm বা 100 nm | জলের মধ্যে চকের গুঁড়ো,বালি ও জলের মিশ্রণ |

সুতরাং, কণার ব্যাসের ঊর্ধ্বক্রমটি হল – প্রকৃত দ্রবণ < কোলয়েডীয় দ্রবণ < প্রলম্বন।
ঝিল্লি বিশ্লেষণ (Dialysis) কী? মানবদেহে এটি কীভাবে কার্যকর হয়?
কোলয়েড কণার আকার প্রকৃত দ্রবণের কণার আকারের থেকে বড়ো হয়। তাই এরা পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না। কোলয়েডের এই ধর্মকে কাজে লাগিয়ে প্রকৃত দ্রবণ থেকে কোলয়েডকে পৃথক করে বিশুদ্ধ কোলয়েড প্রস্তুত করা হয়। এই পদ্ধতিকে ঝিল্লি বিশ্লেষণ (Dialysis) বলা হয়। মানবদেহে কিডনিতে এইরূপ ঝিল্লি বিশ্লেষণ ঘটে। মানবদেহে শারীরবৃত্তীয় কাজের ফলে যে দূষিত পদার্থ উৎপন্ন হয়ে রক্তে মিশে যায়, কিডনি সেগুলিকে ঝিল্লি বিশ্লেষণের মাধ্যমে রক্ত থেকে দূর করে রক্ত বিশুদ্ধ করে।
একটি প্রকৃত দ্রবণ ও একটি কোলয়েডীয় দ্রবণের বর্ণ কী কী বিষয়ের ওপর নির্ভরশীল?
একটি প্রকৃত দ্রবণের বর্ণ নির্ভর করে দ্রাবকের বর্ণের ওপর। যদি দ্রাবক বর্ণহীন হয় তবে দ্রবণের বর্ণ দ্রাবের বর্ণের ওপর নির্ভর করে। যেমন – কপার সালফেটের (CuSO4) জলীয় দ্রবণ নীল বর্ণের হয়। আবার, কোলয়েডীয় দ্রবণের বর্ণ নির্ভর করে বিস্তৃত দশার কণার আকারের ওপর। যেমন গোল্ড সলের বর্ণ লাল, কণাগুলির আকার বৃদ্ধির সঙ্গে সঙ্গে এর বর্ণ লাল থেকে নীল হয়ে যায়।
ইমালসন কী?
ইনালসল (Emulsion) – কোনো তরল বিস্তার মাধ্যমে অপর একটি অমিশ্রণীয় তরল পদার্থ ক্ষুদ্র ক্ষুদ্র বিন্দুর আকারে (ব্যাস 10-5 – 10-4 cm) বিস্তৃত থেকে যে কোলয়েডীয় দ্রবণ গঠন করে, তাকে ইমালসন বা অবদ্রব বলে। কোলয়েড দ্রবণ (ইমালসন) = বিস্তার মাধ্যম (তরল) + বিস্তৃত দশা (তরল)।

উদাহরণ – দুধ, কোল্ড ক্রিম, ভ্যানিশিং ক্রিম, মাখন ইত্যাদি।
ইমালসনের প্রকারভেদগুলি কী কী?
ইমালসনের প্রকারভেদ – ইমালসন (Emulsion) দু-ধরনের। যথা –
- জলে-তেলজাতীয় (Oil in water) ইমালসন
- তেলে-জলজাতীয় (Water in oil) ইমালসন
জলে-তেলজাতীয় (Oil in water) ইমালসন – অতিরিক্ত পরিমাণ জলের (বিস্তার মাধ্যম) মধ্যে অল্প পরিমাণ তেল (বিস্তৃত দশা) মিশিয়ে ঝাঁকালে জলে-তেলজাতীয় ইমালসন উৎপন্ন হয়। যেমন – দুধ (জলের মধ্যে তরল সূক্ষ্ম চর্বিকণা বিস্তৃত)।
তেলে-জলজাতীয় (Water in oil) ইমালসন – অতিরিক্ত পরিমাণ তেলের (বিস্তার মাধ্যম) মধ্যে অল্প পরিমাণ জল (বিস্তৃত দশা) মিশিয়ে ঝাঁকালে তেলে-জলজাতীয় ইমালসন উৎপন্ন হয়। যেমন – মাখন (চর্বির মধ্যে জলের সূক্ষ্ম কণা বিস্তৃত)।
অবদ্রবকারক বা ইমালসিফায়িং এজেন্ট বলতে কী বোঝায়? উদাহরণ দাও।
অবদ্রবকারক বা ইমালসিফায়িং এজেন্ট (Emulsifier) – ইমালসন প্রস্তুতকারী তরল দুটি অমিশ্রণীয় হওয়ায় ইমালসন খুব অস্থায়ী হয়। বেশ কিছু সময় ধরে ইমালসন রেখে দিলে উপাদান তরল দুটি পৃথক স্তর গঠন করে। ইমালসনের স্থায়িত্ব বৃদ্ধির জন্য ইমালসন তৈরির সময় উপাদান তরল দুটি ছাড়াও তৃতীয় একটি পদার্থ (রাসায়নিক/প্রাকৃতিক) যোগ করা হয়। ইমালসনের স্থায়িত্ববর্ধক এই তৃতীয় পদার্থটিকেই অবদ্রবকারক বা ইমালসিফায়িং এজেন্ট বা বলে। উদাহরণ – সাবান ও ডিটারজেন্ট জাতীয় পদার্থ, জিলেটিন, অ্যালবুমিন।
দৈনন্দিন জীবনে অবদ্রবকারকের উদাহরণ দাও ও ব্যবহার লেখো।
দৈনন্দিন জীবনে যে বিভিন্ন অবদ্রবকারকগুলি ব্যবহৃত হয় সেগুলি সংক্ষেপে আলোচনা করা হল –
- খাদ্যদ্রব্যের ক্ষেত্রে –
- কেসিন – দুধে বর্তমান, দুধের মধ্যে ভাসমান ক্ষুদ্র ফ্যাট কণিকাগুলি জলের মধ্যে কেসিনের মাধ্যমে স্থায়ী ইমালসন গঠন করে।
- লেসিথিন – ডিমের কুসুমের ইমালসনকারক, এছাড়া চকোলেট শিল্পে ব্যবহৃত হয়।
- DATEM (ডাই অ্যাসিটাইল টারটারিক [অ্যাসিড] এস্টার অফ মনোগ্লিসারাইড) – এই অবদ্রবকারক বিভিন্ন কেক ও পেস্ট্রির ক্ষেত্রে ব্যবহৃত হয়।
- জিলেটিন – আইসক্রিমের অবদ্রবকারক হিসেবে ব্যবহৃত হয়।
- প্রসাধনী শিল্পে – বেসওয়াক্স (Basewax), কার্বোমার (Carbomer) ইত্যাদি অবদ্রবকারকগুলি বিভিন্ন ক্রিম, লোশন, প্রসাধনী জেল প্রভৃতিতে ব্যবহৃত হয়।
- সাবান ও ডিটারজেন্ট – সিলিকোন যৌগ (Silicone) সোডিয়াম ওলিয়েট, সোডিয়াম স্টিয়ারেট প্রভৃতি সাবান ও ডিটারজেন্টে উপস্থিত থেকে সাবান ও ডিটারজেন্টের পরিষ্কারক ক্রিয়ার ক্ষেত্রে অবদ্রবকারক রূপে কাজ করে।
- ঔষধশিল্পে – বিভিন্ন স্টেরয়েড, উচ্চ আণবিক গুরুত্বযুক্ত প্রোটিন, গাম অ্যারাবিক প্রভৃতি বিভিন্ন ঔষধ প্রস্তুতিকালে অবদ্রবকারকরূপে ব্যবহৃত হয়।
সাবানের সাহায্যে জামাকাপড়ের ময়লা কীভাবে অপসারিত হয়?
অথবা, সাবানের কার্যনীতি লেখো।
সাবানের কার্যনীতি – সাবান হল দীর্ঘ কার্বন শৃঙ্খলযুক্ত জৈব অ্যাসিডের (স্টিয়ারিক বা পামিটিক অ্যাসিড) সোডিয়াম বা পটাশিয়াম লবণ। এগুলি জল ও তেলের মধ্যে ইমালসনকারকরূপে কাজ করতে পারে। সাবান বা সোডিয়াম স্টিয়ারেটকে (C17H35COONa) জলে দ্রবীভূত করলে স্টিয়ারেট আয়ন (C17H35COO-) উৎপন্ন হয়, যার হাইড্রোকার্বন অংশটি। (-C17H35) জল বিকর্ষী, কিন্তু আয়নীয় অংশটি (-COO–) জল আকর্ষী।
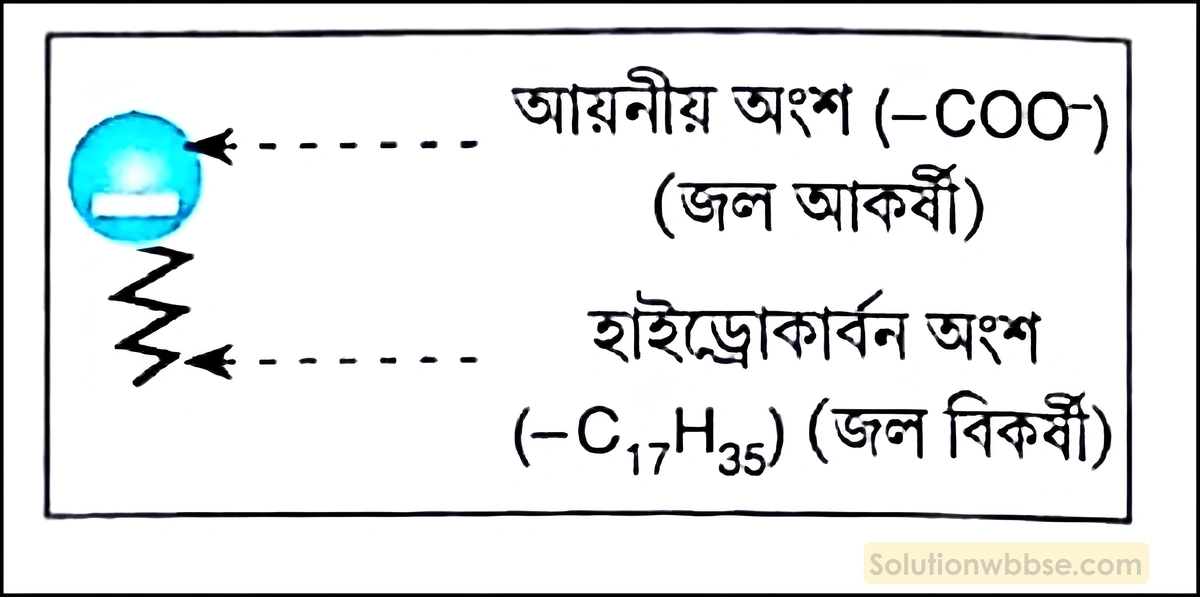
সাবানের হাইড্রোকার্বন অংশটি কাপড় বা দেহে লেগে থাকা ময়লা বা তেল জাতীয় পদার্থের মধ্যে অবস্থান করে ও আয়নীয় অংশটি তেল জাতীয় পদার্থের বাইরে অর্থাৎ, জলে বিস্তৃত থাকে। ফলে, ঋণাত্মক তড়িদাহিত কার্বক্সিলেট আয়নগুলি (-COO–) কাপড় বা দেহে লেগে থাকা তেল জাতীয় পদার্থকে বেষ্টন করে। থাকে। আবার -COO– আয়নগুলি জল আকর্ষী হওয়ায় নিজের সঙ্গে তেল বা ময়লাকে জলের দিকে টানে। ফলে, জামাকাপড় থেকে ময়লা বিচ্ছিন্ন হয়। সাবান দেহে বা জামাকাপড়ে আটকে থাকা তৈলাক্ত ময়লাগুলিকে জলের সঙ্গে ইমালসন গঠনে সাহায্য করে। ফলে, জামাকাপড়ে লেগে থাকা ময়লা সহজে ধুয়ে দূর করা যায়।

সংযোজিত কোলয়েড কাকে বলে?
সংযোজিত কোলয়েড – দীর্ঘ কার্বন শৃঙ্খলযুক্ত কয়েকটি হাইড্রোকার্বন যৌগ পরস্পর সংযোজিত হয়ে যে কোলয়েড উৎপন্ন করে, তাকে সংযোজিত কোলয়েড বলে। যেমন – বিভিন্ন স্টিয়ারিক অ্যাসিড, পামিটিক অ্যাসিডের জলীয় দ্রবণ হল সংযোজিত কোলয়েডের উদাহরণ।
মিসেল কাকে বলে?
মিসেল – সংযোজিত কোলয়েডের ক্ষেত্রে দেখা যায় যে, একটি বিশেষ গাঢ়ত্বের উপরে কোলয়েড কণাগুলি জোটবদ্ধ হয়ে গোল আকার ধারণ করে, একে মিসেল বলা হয়।
দৈনন্দিন জীবনে ইমালসনের ব্যাবহারিক প্রয়োগ আলোচনা করো।
দৈনন্দিন জীবনে ইমালসলের ব্যাবহারিক প্রয়োগ –
- দুধ, মাখন, কোল্ডক্রিম প্রভৃতি দৈনন্দিন জীবনে ব্যবহৃত ইমালসনের উদাহরণ।
- অনেক ঔষধ, যেমন – কড্ লিভার তেল, ভিটামিন B কমপ্লেক্স ইত্যাদি তেলে-জলজাতীয় ইমালসন।
- ডেটল, লাইসল প্রভৃতি তরল জীবাণুনাশক জলে মেশালে জলে-তেলজাতীয় ইমালসন গঠন করে।
- অস্ত্রে ফ্যাটজাতীয় খাদ্য হজমের সময় খাবারটি প্রথমে ইমালসনে পরিণত হয়।
সল -এর উদাহরণসহ সংজ্ঞা দাও।
সল (Sol) – যে-সমস্ত কোলয়েডের বিস্তার মাধ্যম তরল এবং বিস্তৃত দশা কঠিন, তাদের সল বলে। উদাহরণ – নদীর ঘোলা জল, গরম ভাতের ফ্যান, গোল্ড সল, রং প্রভৃতি।

জেল -এর উদাহরণসহ সংজ্ঞা দাও।
জেল (Gel) – যে-সমস্ত কোলয়েডের বিস্তার মাধ্যম কঠিন এবং বিস্তৃত দশা তরল, তাদের জেল বলে। উদাহরণ – ঠান্ডায় জমে যাওয়া ভাতের ফ্যান, পনির, জিলেটিন, জ্যাম-জেলি, ইত্যাদি।

এরোসল -এর উদাহরণসহ সংজ্ঞা দাও।
এরোসল (Aerosol) – এরোসল হল এক ধরনের কোলয়েড। অতি ক্ষুদ্র কঠিন বা তরল আণুবীক্ষণিক কিছু কণা কোনো গ্যাসীয় মাধ্যমে বিস্তৃত হয়ে এরোসল গঠন করে। উদাহরণ – ধোঁয়া (কঠিন এরোসল), কুয়াশা (তরল এরোসল)। এরোসল দু-প্রকার। যথা –

- কঠিন এরোসল,
- তরল এরোসল।
কঠিন এরোসল – যেসব কোলয়েডের বিস্তার মাধ্যম গ্যাসীয় এবং বিস্তৃত দশা কঠিন, তাদের কঠিন এরোসল বলে। যেমন – ধোঁয়া।
তরল এরোসল – যেসব কোলয়েডের বিস্তার মাধ্যম গ্যাসীয় এবং বিস্তৃত দশা তরল, তাদের তরল এরোসল বলে। যেমন – কুয়াশা।
সোডিয়াম থায়োসালফেট থেকে কোলয়েডীয় সালফার উৎপন্ন হয় কীভাবে?
সোডিয়াম থায়োসালফেটের (Na2S2O3) লঘু জলীয় দ্রবণে ফোঁটা ফোঁটা করে লঘু সালফিউরিক অ্যাসিড (H2SO4) যোগ করলে যে সালফারের অধঃক্ষেপ পাওয়া যায়, তাকে বারবার জলে ধৌত করলে সালফারের সল উৎপন্ন হয়।
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S + (সালফার সল)
ক্লক বিক্রিয়া কাকে বলে?
সোডিয়াম থায়োসালফেটের লঘু জলীয় দ্রবণে ফোঁটা ফোঁটা করে লঘু হাইড্রোক্লোরিক অ্যাসিড যোগ করলেও কোলয়েডীয় সালফার অধঃক্ষিপ্ত হয়।
Na2S2O3 + 2HCl → 2NaCl + S↓ + SO2 + H2O (সালফার সল)
এই বিক্রিয়াটিকে ক্লক বিক্রিয়া বলে।
দৈনন্দিন জীবনে কোলয়েডের ব্যাবহারিক প্রয়োগ আলোচনা করো।
দৈনন্দিন জীবনে কোলয়েডের ব্যাবহারিক প্রয়োগ –
- খাদ্যদ্রব্যরূপে ব্যবহার – দৈনন্দিন জীবনে ব্যবহৃত দুধ, মাখন, জেলি প্রভৃতি কোলয়েড দ্রবণের উদাহরণ।
- ঔষধরূপে ব্যবহার – অধিকাংশ ঔষধ কোলয়েডরূপে ব্যবহৃত হয়, কারণ – এতে ঔষধ সহজে দেহে শোষিত হয়।
- জামাকাপড় পরিষ্কারে ব্যবহার – সাবান, ডিটারজেন্ট প্রভৃতির জলীয় দ্রবণ কোলয়েডীয় প্রকৃতির।
- রক্ততঞ্চন – রক্ত কোলয়েডীয় দ্রবণ। দেহের কোনো অংশ কেটে গেলে ফটকিরি ঘষে রক্ত বন্ধ করা হয়।
- ফোটোগ্রাফিক প্লেট – ফোটোগ্রাফিক প্লেট তৈরি করার কাজে কোলয়েড (জিলেটিন মিশ্রিত সিলভার ব্রোমাইড দ্রবণ) ব্যবহৃত হয়।
- পানীয় জল বিশুদ্ধিকরণ – অবিশুদ্ধ জলে কাদামাটি কণাগুলি কোলয়েড গঠন করে। এই জলে ফটকিরি যোগ করে কোলয়েড কণাগুলিকে তঞ্চিত করা হয়।
- বদ্বীপ গঠন – নদীর কাদা এবং পলিমিশ্রিত জল কোলয়েডীয় দ্রবণ, যা লবণাক্ত সমুদ্র জলের সংস্পর্শে এসে তঞ্চিত হয়ে বদ্বীপ গঠন করে।
- কটরেল অধঃক্ষেপক – বিভিন্ন কলকারখানার চিমনি থেকে নির্গত ধোঁয়ায় থাকা আধানযুক্ত কার্বন কণা ও অন্যান্য কণা বাতাসে মেশার আগে, একটি প্রকোষ্ঠের মধ্যে দিয়ে পাঠানো হয়, যাকে কটরেল অধঃক্ষেপক বলে। এই কটরেল অধঃক্ষেপক যন্ত্রের সাহায্যে আধানযুক্ত কার্বন কণা ও অন্যান্য কণাকে নিস্তড়িৎ করে তঞ্চিত করা হয়। ফলে, বায়ুদূষণ কম হয়।
- কৃত্রিম বৃষ্টিপাত – জলীয় বাষ্প দ্বারা সম্পৃক্ত মেঘ কোলয়েডের উদাহরণ এবং এর কণাগুলি আধানযুক্ত হয়। এরোপ্লেনের সাহায্যে বিপরীত আধানযুক্ত সল যেমন – সিলভার ব্রোমাইড (AgBr) ছড়িয়ে জলকণাগুলি প্রশমিত করে কৃত্রিম বৃষ্টিপাত ঘটানো হয়।
বিভিন্ন কোলয়েড কণার উপস্থিতিতে কীভাবে বায়ুদূষণ হয় তা সংক্ষেপে আলোচনা করো।
আমাদের পারিপার্শ্বিক বায়ুমণ্ডলে ভাসমান বিভিন্ন প্রকার কোলয়েড কণার উপস্থিতিতেও বায়ু দুষিত হয়।
- বিভিন্ন প্রাকৃতিক ঘটনাবলি, যেমন – আগ্নেয়গিরির অগ্ন্যুৎপাত, বায়ুপ্রবাহ, ঘূর্ণিঝড় প্রভৃতির কারণে কিংবা মনুষ্যসৃষ্ট বিভিন্ন নির্মাণের ফলে উৎপন্ন ধূলিকণাসমূহ বাতাসে প্রলম্বিত অবস্থায় উপস্থিত থেকে বায়ুদূষণ ঘটায়।
- বাতাসে প্রলম্বিত সুক্ষ্ম কার্বন কণা বা অন্য যে-কোনো দাহ্য বস্তুর অসম্পূর্ণ দহনে উৎপন্ন ধোঁয়া হল অতি সূক্ষ্ম কণার মিশ্রণ। কলকারখানা, যানবাহন, গৃহস্থালির জ্বালানি প্রভৃতি থেকে উৎপন্ন ধোঁয়ায় কার্বন ডাইঅক্সাইড, কার্বন মনোক্সাইড, নাইট্রোজেনের অক্সাইডসমূহ, সিলিকন, সিসা, বেঞ্জোপাইরিন, হাইড্রোকার্বন প্রভৃতি বিষাক্ত পদার্থ বায়ুতে মিশে বায়ুদূষণ ঘটায়।
- বায়ুতে প্রলম্বিত তরল জলকণায় দ্রবীভূত SO2, NO2 ও অন্যান্য কঠিন কণা মিশে ধোঁয়াশা সৃষ্টি করে। শিল্পাঞ্চল ও বড়ো বড়ো শহরাঞ্চলে শীতকালে সন্ধ্যাবেলায় ধোঁয়া ও কুয়াশা মিশে ধোঁয়াশার সৃষ্টি করে এবং সুক্ষ্ম সুক্ষ্ম কণার আকারে বায়ুমণ্ডলে বিস্তৃত হয়ে বায়ুদূষণ ঘটায়।
- সিমেন্ট ও অ্যাসবেসটস শিল্প থেকে নির্গত বিভিন্ন সিলিকেটের সুক্ষ্ম কণিকা, অ্যাসবেসটসের সূক্ষ্ম কণিকা বায়ুতে কোলয়েডরূপে মিশে বায়ুদূষণ ঘটায়।
- খনিজ তেল, কয়লা প্রভৃতি নানা প্রকার জীবাশ্ম জ্বালানির দহনের ফলে ধোঁয়া, সূক্ষ্ম সূক্ষ্ম কার্বন কণা ও ছাইয়ের ধূলিকণা সৃষ্টি হয়ে কোলয়েড রূপে বাতাসে ভেসে বেরিয়ে বায়ুদূষণ ঘটায়।
- গাড়ির ঝাঁকুনি রোধক হিসেবে ব্যবহৃত টেট্রাইথাইল লেড, ডাইক্লোরোইথেন, ডাইব্রোমোইথেন প্রভৃতির দহনে উৎপন্ন PbCl2 ও PbBr2 বায়ুতে মিশে দূষণ সৃষ্টি করে।
- কিছু কিছু এককোশী জীবাণু, ব্যাকটেরিয়া প্রভৃতির উপস্থিতিও (কোলয়েড কণারূপে) বায়ুদূষণের জন্য বিশেষভাবে দায়ী। বাতাসে ভাসমান এই সুক্ষ্ম কোলয়েড কণাগুলি শ্বাসপ্রশ্বাসের মাধ্যমে ফুসফুসে প্রবেশ করে, যার ফলে শ্বাসপ্রশ্বাসে সমস্যার সৃষ্টি হয়। ফুসফুসের রোগ, অ্যাসবেস্টসিস, সিলিকোসিস প্রভৃতি রোগ হতে পারে।
টিন্ডাল প্রভাব কী?
টিন্ডাল প্রভাব (Tyndal effect) – কোলয়েড কণার দ্রবণে আলোকরশ্মি চালনা করলে সেই আলোকরশ্মি কোলয়েড কণা দ্বারা বিচ্ছুরিত হয়। ফলে, কোলয়েড কণাগুলির মধ্যে দিয়ে আলোকরশ্মির গতিপথ পাশ থেকে দৃশ্যমান হয়। বিজ্ঞানী টিন্ডালের নাম অনুযায়ী কোলয়েড কণার এই ধর্মকে টিন্ডাল এফেক্ট বলে।

টিন্ডাল প্রভাবের ব্যাবহারিক প্রয়োগ উল্লেখ করো।
টিন্ডাল প্রভাবের ব্যাবহারিক প্রয়োগগুলি হল –
- টিন্ডাল প্রভাবের সাহায্যে কোলয়েডীয় দ্রবণ ও প্রকৃত দ্রবণের মধ্যে পার্থক্য নির্দেশ করা যায়।
- টিন্ডাল প্রভাবকে কাজে লাগিয়ে পরা অণুবীক্ষণ যন্ত্র (ultra microscope) আবিষ্কার করা হয়েছে।
- স্পর্শ পদ্ধতিতে সালফিউরিক অ্যাসিড প্রস্তুতির সময় ব্যবহৃত সালফার ডাইঅক্সাইড (SO2) ও বায়ুর মিশ্রণে ধূলিকণা থাকলে মূল্যবান অনুঘটক Pt -এর কার্যকারিতা নষ্ট হয়। এই ধূলিকণার উপস্থিতি পরীক্ষা করার জন্য টিন্ডাল প্রভাবকে কাজে লাগানো হয়।
তোমাকে দুটি বিকারের একটিতে চিনির দ্রবণ এবং অপরটিতে সাবানের জলীয় দ্রবণ দেওয়া হল। কোনটি কী দ্রবণ কীভাবে নির্ণয় করবে তা একটি পরীক্ষা সহযোগে লেখো।
পরীক্ষা – একটি কাচের বিকারে চিনির দ্রবণ নিয়ে তার মধ্যে দিয়ে আলোকরশ্মি পাঠানো হল। অপর একটি কাচের বিকারে সাবানের জলীয় দ্রবণ নিয়ে তার মধ্যে দিয়ে ওই একইভাবে আলোকরশ্মি পাঠানো হল।
পর্যবেক্ষণ – চিনির দ্রবণের ক্ষেত্রে আলোকরশ্মির গতিপথে চোখ রাখলে তবেই আলোক দৃশ্যমান হয়। পাশ থেকে আলোকের উজ্জ্বল গতিপথ দেখা যায় না। অর্থাৎ, আলোর বিচ্ছুরণ হয় না। সাবানের জলীয় দ্রবণের ক্ষেত্রে পাশ থেকে আলোকের স্পষ্ট ও উজ্জ্বল গতিপথ দেখা যায় অর্থাৎ, আলোর বিচ্ছুরণ ঘটে।
সিদ্ধান্ত – কাচের বিকারে রাখা চিনির দ্রবণ হল প্রকৃত দ্রবণ। আর এই প্রকৃত দ্রবণে আলোর বিচ্ছুরণ হয় না কারণ প্রকৃত দ্রবণে দ্রাবের কণাগুলির আকার অতি ক্ষুদ্র। অপরপক্ষে অন্য কাচের বিকারে রাখা সাবানের জলীয় দ্রবণ হল কোলয়েডীয় দ্রবণ। এই দ্রবণের মধ্যে দিয়ে আলোকরশ্মি যাওয়ার ফলে কোলয়েডীয় দ্রবণের কণাগুলির দ্বারা আলোকরশ্মির বিচ্ছুরণ ঘটে আলোকরশ্মির গতিপথ পাশ থেকে স্পষ্ট ও উজ্জ্বলভাবে দৃশ্যমান হয়েছে।
দ্রাব্যতার সংজ্ঞা দাও। এর একক লেখো।
দ্রাব্যতা (Solubility) – কোনো নির্দিষ্ট উষ্ণতায় 100 গ্রাম দ্রাবকে সর্বাধিক যত গ্রাম দ্রাব দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ উৎপন্ন করে, দ্রাবের সেই গ্রাম সংখ্যাকে ওই উষ্ণতায় ওই দ্রাবের দ্রাব্যতা বলে।
দ্রাব্যতার একক – দ্রাব্যতা একটি এককহীন রাশি। প্রকৃতপক্ষে দ্রাব্যতা হল সম্পৃক্ত দ্রবণে দ্রাবের ভর ও ওই দ্রবণে দ্রাবকের ভরের অনুপাত। দুটি ভরের অনুপাত বলে এটি একটি সংখ্যা মাত্র।
50°C উষ্ণতায় পটাশিয়াম নাইট্রেটের দ্রাব্যতা 85 বলতে কী বোঝায়?
50°C উষ্ণতায় পটাশিয়াম নাইট্রেটের (KNO3) দ্রাব্যতা 85 বলতে বোঝায় 50°C উষ্ণতায় 100 গ্রাম জলে সর্বাধিক 85 গ্রাম পটাশিয়াম নাইট্রেট (KNO3) দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ উৎপন্ন করে।
পদার্থের দ্রাব্যতা কোন্ কোন্ বিষয়ের ওপর নির্ভর করে?
পদ্যার্থর দ্রাব্যতা নিম্নলিখিত বিষয়গুলির ওপর নির্ভরশীল –
দ্রাব ও দ্রাবকের প্রকৃতি – স্থির উষ্ণতায় নির্দিষ্ট দ্রাবকে বিভিন্ন দ্রাবের দ্রাব্যতা বিভিন্ন হয়। যেমন – নির্দিষ্ট উষ্ণতায় জলে KNO3 -এর দ্রাব্যতা NaCl -এর দ্রাব্যতার চেয়ে বেশি। আবার, স্থির উষ্ণতায় বিভিন্ন দ্রাবকে নির্দিষ্ট কোনো দ্রাবের দ্রাব্যতা বিভিন্ন হয়। যেমন – জলে I2 -এর দ্রাব্যতা, কার্বন ডাইসালফাইডে I2 -এর দ্রাব্যতার চেয়ে কম।
উষ্ণতা – কঠিনের দ্রাব্যতার ওপর উষ্ণতার প্রভাব – কঠিন পদার্থের দ্রাব্যতা উন্নতার ওপর নির্ভরশীল। বেশিরভাগ ক্ষেত্রে উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে কঠিন দ্রাবের দ্রাব্যতা বৃদ্ধি পায় বা উষ্ণতা হ্রাসে দ্রাব্যতা হ্রাস পায়। যে-সমস্ত পদার্থ জলে দ্রবীভূত হওয়ার সময় তাপের শোষণ ঘটে, উষ্ণতা বৃদ্ধিতে ওই পদার্থের দ্রাব্যতা বাড়ে, যেমন – KNO3, NH4Cl। আবার, যে-সমস্ত পদার্থ জলে দ্রবীভূত হওয়ার সময় তাপ উৎপন্ন হয়, উষ্ণতা বৃদ্ধিতে ওই পদার্থের দ্রাব্যতা কমে, যেমন – Ca(OH)2।
গ্যাসীয় পদার্থের দ্রাব্যতার ওপর উষ্ণতার প্রভাব –
গ্যাসীয় পদার্থের ক্ষেত্রে উষ্ণতা বাড়ালে গ্যাসের দ্রাব্যতা হ্রাস পায়। কারণ – তাপ দিলে তরলে দ্রবীভূত গ্যাস বুদবুদ আকারে নির্গত হয়। ফলে, গ্যাসের দ্রাব্যতা হ্রাস পায়। আবার গ্যাসীয় পদার্থের দ্রাব্যতা উষ্ণতা হ্রাসে বৃদ্ধি পায়।
চাপ – তরলে গ্যাসের দ্রাব্যতার ওপর চাপের প্রভাব – তরলে গ্যাসের দ্রাব্যতার ক্ষেত্রে চাপ বাড়ালে দ্রাব্যতা বাড়ে এবং চাপ কমালে দ্রাব্যতা কমে।
তরলে কঠিনের দ্রাব্যতার ওপর চাপের প্রভাব –
নির্দিষ্ট উষ্ণতায় কোনো তরলে কোনো কঠিন দ্রাবের দ্রাব্যতা প্রকৃতপক্ষে চাপের সঙ্গে অপরিবর্তিত থাকে।
দ্রাবকের পরিমাণ – দ্রাবকের পরিমাণ বৃদ্ধি করলে দ্রাবের দ্রাব্যতা বৃদ্ধি পায়।
ওজনমাত্রিক শতকরা এককে কঠিনের দ্রাব্যতা কীভাবে প্রকাশ করা হয়?
ওজনমাত্রিক শতকরা হিসাব ওজনমাত্রিক শতকরা এককে কঠিনের দ্রাব্যতা প্রকাশের ক্ষেত্রে দ্রাব ও দ্রাবক উভয়কে কঠিন হিসেবে গণ্য করা হয়। অর্থাৎ,
যেমন – \(85\%\;\frac WW\;H_2SO_4\) দ্রবণ বলতে বোঝায় ওই দ্রবণের প্রতি \(100\;g\) -এ \(85\;g\;H_2SO_4\) দ্রবীভূত আছে।
বেরিয়াম সালফেটের দ্রাব্যতা শূন্য – এর অর্থ কী?
বেরিয়াম সালফেটের (BaSO4) মিহি চূর্ণকে জলে যোগ করে ভালোভাবে ঝাঁকানো হলে কণাগুলি জলের সর্বত্র সমানভাবে ছড়িয়ে পড়ে। এইভাবে মিশ্রণটিকে স্থির অবস্থায় কিছুক্ষণ রেখে দিলে দেখা যায় যে বেরিয়াম সালফেটের কণাগুলি ধীরে ধীরে পাত্রের তলায় অধঃক্ষিপ্ত হচ্ছে অর্থাৎ, বেরিয়াম সালফেট জলের মধ্যে সম্পূর্ণরূপে দ্রবীভূত হয়ে প্রকৃত দ্রবণ উৎপন্ন করতে পারে না। প্রকৃতপক্ষে, জলে বেরিয়াম সালফেট অদ্রাব্য (খুবই স্বল্প দ্রাব্য), এর কারণ হল বেরিয়াম সালফেটের গুঁড়োকে জলে মেশালে এর কণার ব্যাস 10 cm বা এর সামান্য কিছু বেশি হওয়ায় এটি জলে দ্রবীভূত না হয়ে প্রলম্বিতভাবে জলের মধ্যে ভেসে বেড়ায়। তাই বলা যায় যে, জলে বেরিয়াম সালফেটের দ্রাব্যতা শূন্য।
20°C তাপমাত্রায় জলে BaSO4-এর দ্রাব্যতা কত mL?
20°C উষ্ণতায় জলে BaSO4 -এর দ্রাব্যতা 0.0002448 g/100 mL, যা খুবই নগণ্য। তাই BaSO4 -এর দ্রাব্যতা প্রায় শূন্য ধরা যায়।
জলে কার্বন ডাইঅক্সাইডের দ্রাব্যতা উষ্ণতা ও চাপের দ্বারা কীভাবে প্রভাবিত হয় লেখো।
উষ্ণতায় প্রভাব – সাধারণ উষ্ণতায় জলে গ্যাস দ্রবীভূত হয়। চাপ স্থির রেখে উষ্ণতা বৃদ্ধি করলে জলে কার্বন ডাইঅক্সাইডের দ্রাব্যতা হ্রাস পায় এবং উষ্ণতা হ্রাস করলে জলে -এর দ্রাব্যতা বৃদ্ধি পায়। যেমন – মিশ্রিত জলকে উত্তপ্ত করলে গ্যাস বুদ্বুদ আকারে বেরিয়ে আসে। অর্থাৎ, দ্রাব্যতা হ্রাস পায়। সুতরাং, 1 জলে -এর দ্রাব্যতা ∝ ।
চাপের প্রভাব – উষ্ণতা স্থির রেখে চাপ বাড়ালে জলে কার্বন ডাইঅক্সাইডের দ্রাব্যতা বৃদ্ধি পায় ও চাপ কমালে দ্রাব্যতা হ্রাস পায়। যেমন – বেশি চাপে জলে অতিরিক্ত CO2 গ্যাস দ্রবীভূত করে সোডা-ওয়াটার প্রস্তুত করা হয়। সুতরাং, জলে CO2 -এর দ্রাব্যতা ∝ চাপ।
দ্রাব্যতা লেখ কী?
দ্রাব্যতা লেখ (Solubility curve) – উষ্ণতা পরিবর্তনের সঙ্গে সঙ্গে দ্রাবের দ্রাব্যতার পরিবর্তন যে লেখচিত্র দ্বারা প্রকাশ করা হয়, তাকে দ্রাব্যতা লেখ বলে। লেখচিত্রের X -অক্ষ বরাবর উষ্ণতা ও Y -অক্ষ বরাবর দ্রাব্যতাকে স্থাপন করা হয়। বিভিন্ন উষ্ণতায় প্রাপ্ত দ্রাব্যতার মানগুলিকে লেখচিত্রে স্থাপন করে বিন্দুগুলিকে পরস্পর যোগ করে দ্রাব্যতা লেখ পাওয়া যায়।
দ্রাব্যতা লেখর কয়েকটি উপযোগিতা আলোচনা লেখো।
দ্রাব্যতা লেখর উপযোগিতাগুলি হল –
- দ্রাব্যতা লেখ দ্বারা কোনো পদার্থের দ্রাব্যতা কোন্ উষ্ণতায় কত তা জানা যায়।
- উষ্ণতার হ্রাস-বৃদ্ধিতে পদার্থের দ্রাব্যতার পরিবর্তন জানা যায়।
- দুটি পদার্থের মিশ্র দ্রবণের উষ্ণতা কমালে কোন পদার্থটি আগে দ্রবণ থেকে পৃথক হবে তা জানা যায়।
- উচ্চ উষ্ণতায় থাকা কোনো সম্পৃক্ত দ্রবণকে নিম্নতর কোনো উষ্ণতায় আনলে কতটা দ্রাব কেলাসিত হবে তা জানা যায়।
- নির্দিষ্ট উষ্ণতায় নির্দিষ্ট দ্রাবকে একাধিক পদার্থের দ্রাব্যতার তুলনা করা সম্ভব।
- পরীক্ষা না করেই যে-কোনো উষ্ণতায় পদার্থের দ্রাব্যতা কত তা বলা সম্ভব হয়।
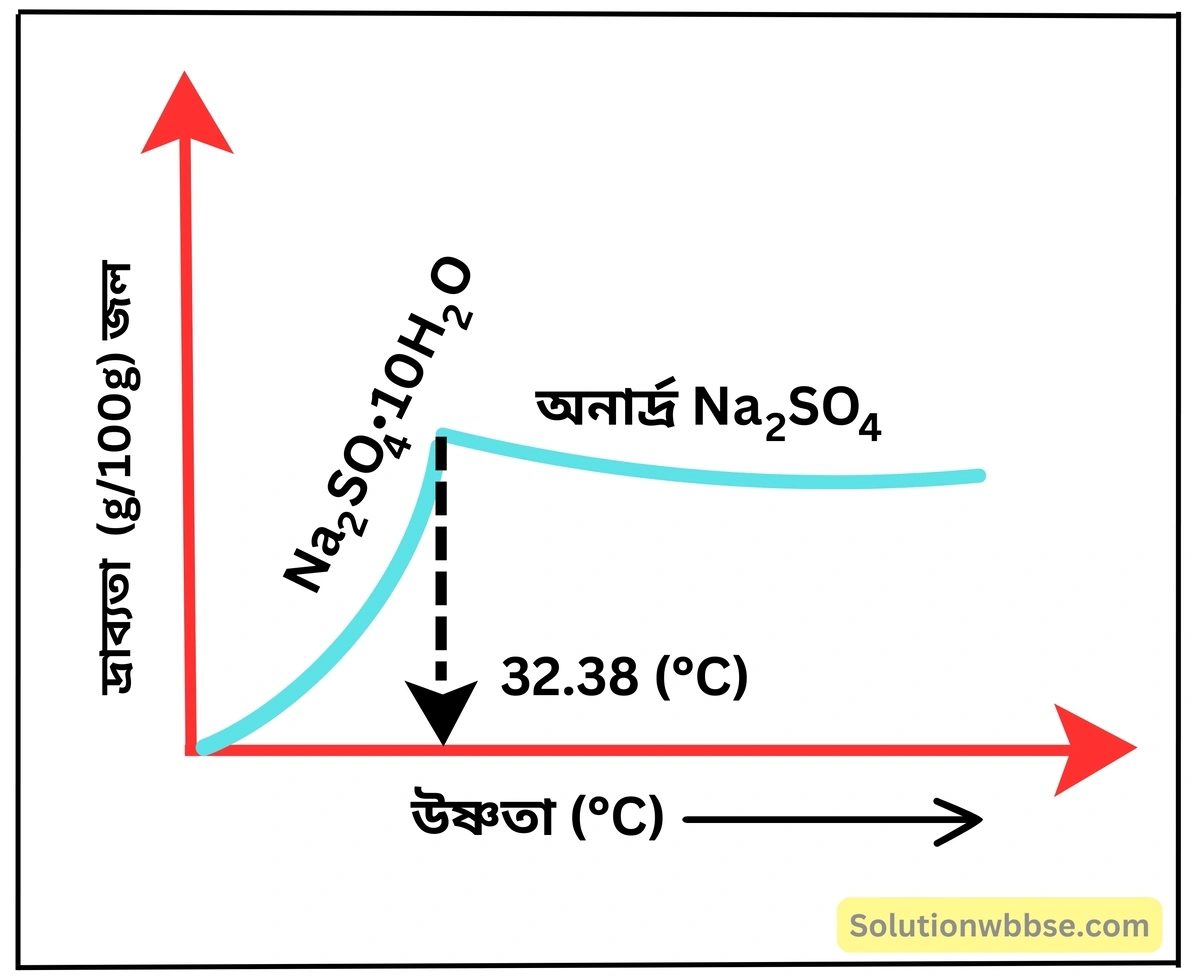
লেখচিত্রের সাহায্যে নিম্নলিখিত পদার্থগুলির দ্রাব্যতার ওপর উষ্ণতার প্রভাব দেখাও – (1) NaCl, (2) KNO3 (3) গ্লবার (Na2SO4⋅10H2O) (4) Ca(OH)2
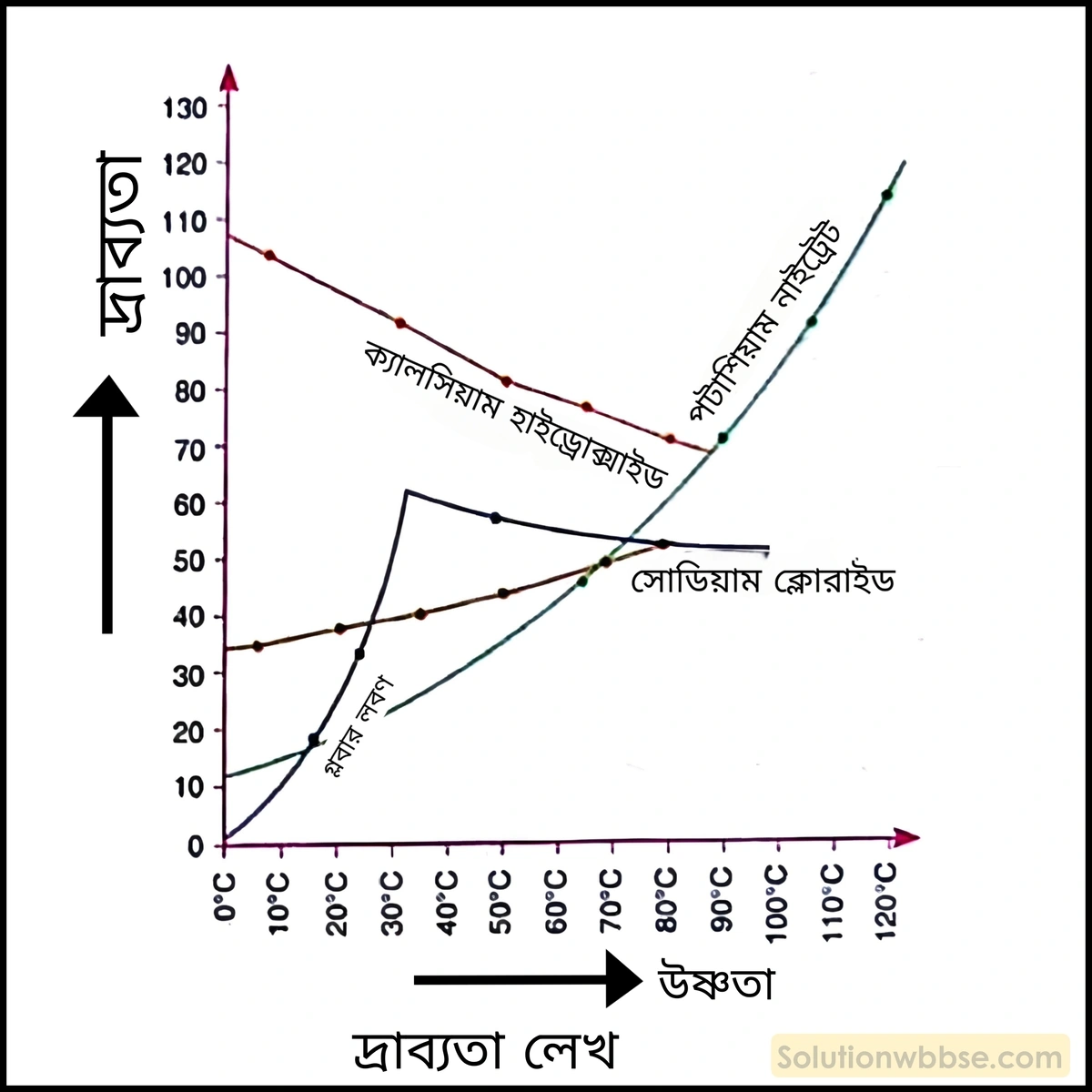
- খাদ্য লবণ বা সোডিয়াম ক্লোরাইডের (NaCl) দ্রাব্যতা উষ্ণতা বৃদ্ধির সঙ্গে খুব কম বাড়ে বা প্রায় অপরিবর্তিত থাকে।
- পটাশিয়াম নাইট্রেটের (KNO3) দ্রাব্যতা উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে দ্রুত বাড়তে থাকে।
- গ্লবার লবণ বা সোডিয়াম সালফেট ডেকাহাইড্রেটের দ্রাব্যতা একটি নির্দিষ্ট উষ্ণতা পর্যন্ত প্রথমে বৃদ্ধি পায়, কিন্তু তারপর হ্রাস পেতে থাকে। সাধারণত 32.38°C উষ্ণতা পর্যন্ত এর দ্রাব্যতা বৃদ্ধি পায়, কিন্তু এর পরে উষ্ণতা বাড়ালেও এর দ্রাব্যতা বৃদ্ধি না পেয়ে হ্রাস পেতে থাকে।
- ক্যালশিয়াম হাইড্রক্সাইড বা কলিচুনের [Ca(OH)2] দ্রাব্যতা, উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে হ্রাস পেতে থাকে।
সম্পৃক্ত দ্রবণ কাকে বলে?
সম্পৃক্ত দ্রবণ (Saturated Solution) – নির্দিষ্ট উষ্ণতায় নির্দিষ্ট পরিমাণ দ্রাবকের মধ্যে কোনো দ্রাব সর্বাধিক যত পরিমাণে দ্রবীভূত হতে পারে, সেই পরিমাণ দ্রাব দ্রবীভূত হয়ে যে দ্রবণ উৎপন্ন হয়, তাকে ওই উষ্ণতায় ওই দ্রাবের সম্পৃক্ত দ্রবণ বলে।
নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণে অতিরিক্ত দ্রাব যোগ করলে তা দ্রবীভূত না হয়ে পাত্রের নীচে থিতিয়ে পড়ে এবং দ্রবণের ঘনত্ব অপরিবর্তিত থাকে। উদাহরণ – সাধারণ উষ্ণতায় একটি বিকারে জল নিয়ে তাতে ধীরে ধীরে কিছু চিনি যোগ করে নাড়াতে থাকলে এমন একটা অবস্থায় পৌঁছোবে, যখন আর চিনির দানা দ্রবীভূত না হয়ে নীচে থিতিয়ে পড়বে, তখন ওই দ্রবণ ওই উষ্ণতায় চিনির সম্পৃক্ত দ্রবণ।
অসম্পৃক্ত দ্রবণ কাকে বলে?
অসম্পৃক্ত দ্রবণ (Unsaturated Solution) – নির্দিষ্ট উষ্ণতায় নির্দিষ্ট পরিমাণ দ্রাবকের মধ্যে সর্বাধিক যত পরিমাণ দ্রাব দ্রবীভূত থাকতে পারে, তার চেয়ে কম পরিমাণ দ্রাব দ্রবীভূত হয়ে যে দ্রবণ উৎপন্ন হয়, তাকে ওই উষ্ণতায় ওই দ্রাবের অসম্পৃক্ত দ্রবণ বলে।
নির্দিষ্ট উষ্ণতায় কোনো অসম্পৃক্ত দ্রবণে দ্রাব যোগ করলে তা দ্রবীভূত হয় এবং সম্পৃক্ত না হওয়া পর্যন্ত দ্রবণটির ঘনত্ব ক্রমশ বাড়তে থাকে।
দ্রাবকের পরিমাণ অনুযায়ী অসম্পৃক্ত দ্রবণকে কত ভাগে ভাগ করা হয় ও তার সঙ্গে দাও।
দ্রাবকের পরিমাণ অনুযায়ী অসম্পৃক্ত দ্রবণকে দুটি ভাগে ভাগ করা যায় –
- লঘু দ্রবণ (Dilute solution)
- গাঢ় দ্রবণ (Concentrated Solution)
লঘু দ্রবণ (Dilute solution) – অসম্পৃক্ত দ্রবণে দ্রাবের পরিমাণ অপেক্ষাকৃত কম হলে, তাকে লঘু দ্রবণ বলে।
গাঢ় দ্রবণ (Concentrated Solution) – অসম্পৃক্ত দ্রবণে দ্রাবের পরিমাণ অপেক্ষাকৃত বেশি হলে, তাকে গাঢ় দ্রবণ বলে।
সাধারণ উষ্ণতায় সোডিয়াম ক্লোরাইডের একটি সম্পৃক্ত দ্রবণ কীভাবে তৈরি করবে?
সাধারণ উষ্ণতায় সোডিয়াম ক্লোরাইডের সম্পৃক্ত দ্রবণ প্রস্তুতি –
প্রয়োজনীয় উপকরণ –
- একটি কাচের বিকার,
- কিছুটা সাধারণ লবণ বা সোডিয়াম ক্লোরাইড (NaCl),
- জল,
- একটি কাচদণ্ড,
- ফানেল,
- ফিলটার কাগজ।
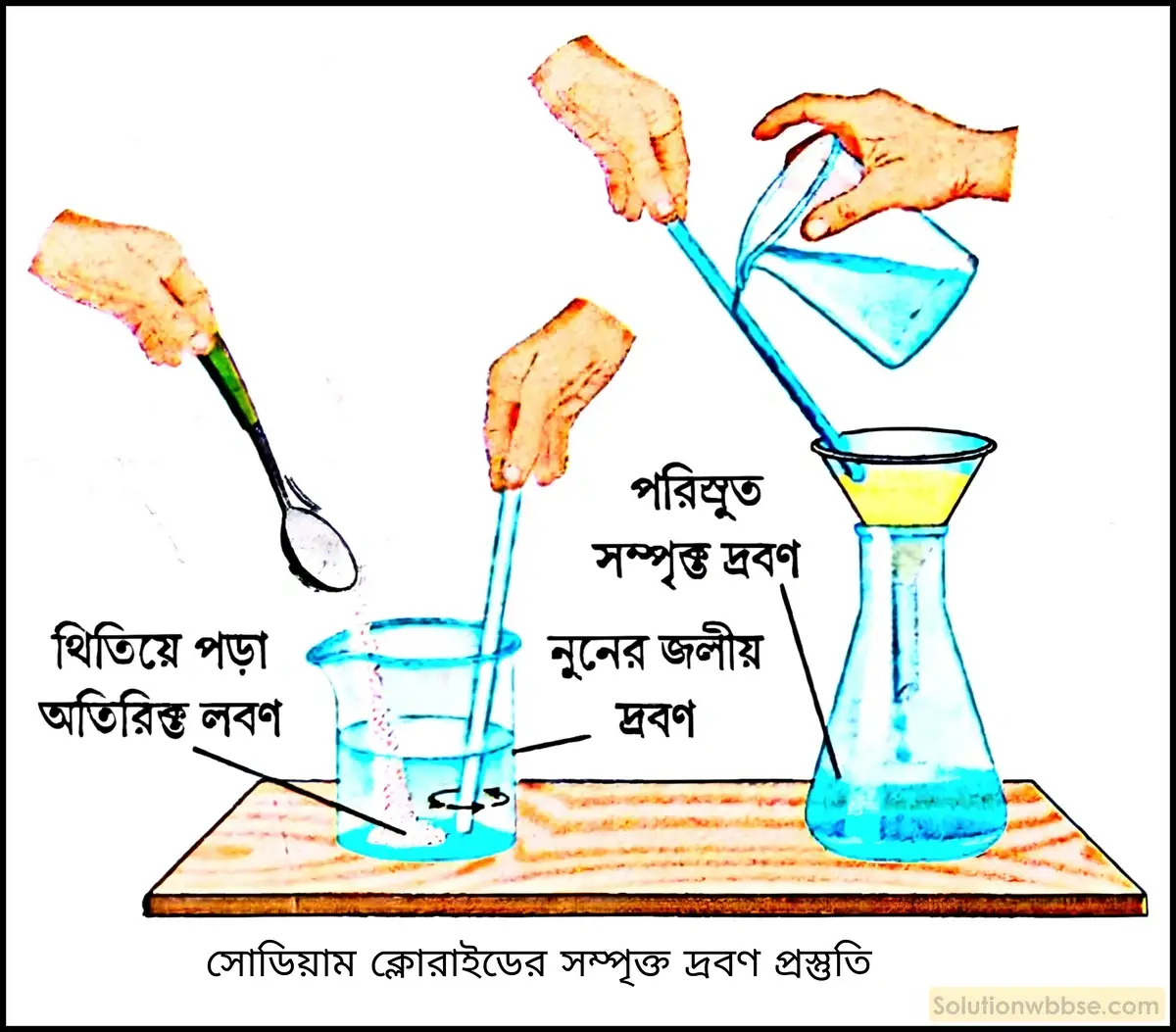
দ্রবণ প্রস্তুতির পদ্ধতি –
- ঘরের উষ্ণতায় একটি বিকারে কিছুটা জল নিয়ে তাতে অল্প অল্প করে সাধারণ লবণ বা সোডিয়াম ক্লোরাইড (NaCl) যোগ করা হল এবং ধীরে ধীরে কাচদণ্ড দিয়ে নাড়া হল।
- শুরুতে সাধারণ লবণ বেশ দ্রুত দ্রবীভূত হল। ধীরে ধীরে সাধারণ লবণের দ্রবীভূত হওয়ার হার কমে যেতে দেখা গেল।
- এরপর আরও সাধারণ লবণ যোগ করে ক্রমাগত কাচদণ্ড দিয়ে নাড়া হল। একসময় দেখা গেল, সাধারণ লবণ আর দ্রবীভূত হল না এবং অতিরিক্ত লবণ বিকারের তলদেশে অদ্রবীভূত অবস্থায় জমা হয়ে থাকল। সমগ্র পদ্ধতিটি স্থির উষ্ণতায় ঘটানো হল।
- ফানেল ও ফিলটার কাগজের সাহায্যে পরিস্রাবণ পদ্ধতিতে অদ্রবণীয় সাধারণ লবণকে দ্রবণ থেকে পৃথক করে পরিস্রুতটিকে একটি পাত্রে সংগ্রহ করা হল। এই পরিস্রুত তরলটিই হল পরীক্ষা চলাকালীন ঘরের উষ্ণতায় সোডিয়াম ক্লোরাইডের সম্পৃক্ত দ্রবণ।
একটি সম্পৃক্ত দ্রবণকে কী কী উপায়ে অসম্পৃক্ত করা যায়?
সম্পৃক্ত দ্রবণকে অসম্পৃক্ত করার উপায় –
- স্থির উষ্ণতায় সম্পৃক্ত দ্রবণে অতিরিক্ত দ্রাবক যোগ করলে দ্রবণটি ওই উষ্ণতায় অসম্পৃক্ত দ্রবণে পরিণত হয়।
- উষ্ণতা বৃদ্ধিতে যেসব দ্রাবের দ্রাব্যতা বাড়ে, তাদের সম্পৃক্ত দ্রবণকে উত্তপ্ত করলে উচ্চতর উষ্ণতায় দ্রবণটি অসম্পৃক্ত দ্রবণে পরিণত হয়।
- উষ্ণতা হ্রাসে যেসব দ্রাবের দ্রাব্যতা বাড়ে, তাদের সম্পৃক্ত দ্রবণকে ঠান্ডা করলে নিম্নতর উষ্ণতায় দ্রবণটি অসম্পৃক্ত হয়ে যায়।
একটি অসম্পৃক্ত দ্রবণকে কী কী উপায়ে সম্পৃক্ত করা যায়?
অসম্পৃক্ত দ্রবণকে সম্পৃক্ত করার উপায় –
- স্থির উষ্ণতায় অসম্পৃক্ত দ্রবণে অতিরিক্ত দ্রাব যোগ করলে একসময় দ্রবণটি সম্পৃক্ত দ্রবণে পরিণত হয়।
- অসম্পৃক্ত দ্রবণটিকে উত্তপ্ত করলে কিছু পরিমাণ দ্রাবক বাষ্পীভূত হয়ে যায়। ফলে, দ্রাবকের পরিমাণ কমে যায়, কিন্তু দ্রাবের পরিমাণ একই থাকে। ফলে, দ্রবণটি সম্পৃক্ত দ্রবণে পরিণত হয়।
- উষ্ণতা বৃদ্ধিতে যেসব দ্রাবের দ্রাব্যতা বাড়ে, তাদের অসম্পৃক্ত দ্রবণের উষ্ণতা হ্রাস করলে একটি বিশেষ নিম্নতর উষ্ণতায় দ্রবণটি সম্পৃক্ত দ্রবণে পরিণত হয়।
- উষ্ণতা হ্রাসে যেসব দ্রাবের দ্রাব্যতা বাড়ে, তাদের অসম্পৃক্ত দ্রবণকে উত্তপ্ত করলে উচ্চতর উষ্ণতায় দ্রবণটি সম্পৃক্ত হয়ে যায়।
অতিপৃক্ত দ্রবণ কাকে বলে?
অতিপৃক্ত দ্রবণ (Supersaturated Solution) – নির্দিষ্ট উষ্ণতায় নির্দিষ্ট পরিমাণ দ্রাবকে সর্বাধিক যত পরিমাণ দ্রাব দ্রবীভূত থাকতে পারে, কোনো বিশেষ অবস্থায় তার চেয়ে বেশি পরিমাণ দ্রাব দ্রবীভূত থাকলে, ওই উষ্ণতায় দ্রবণটিকে অতিপৃক্ত দ্রবণ বলে।
অতিপৃক্ত দ্রবণ খুবই অস্থায়ী। এই দ্রবণকে একটু নাড়লে বা দ্রবণে ছোটো একটি দ্রাব কণা যোগ করলে দ্রবণ থেকে অতিরিক্ত দ্রাব পৃথক হয়ে যায় এবং দ্রবণটি সম্পৃক্ত দ্রবণে পরিণত হয়।
সোডিয়াম থায়োসালফেটের অতিপৃক্ত দ্রবণ কীভাবে প্রস্তুত করা যায়? ওই দ্রবণে একটি থায়োসালফেটের দানা যোগ করলে কী ঘটবে?
সোডিয়াম থায়োসালফেট (Na2S2O3⋅5H2O) বা হাইপোর অতিপৃক্ত দ্রবণ প্রস্তুতি –
প্রয়োজনীয় উপকরণ –
- একটি শক্ত টেস্টটিউব,
- কিছুটা সোডিয়াম থায়োসালফেট বা হাইপো কেলাস,
- তুলো,
- বুনসেন বার্নার,
- ক্ল্যাম্প ও স্ট্যান্ড।
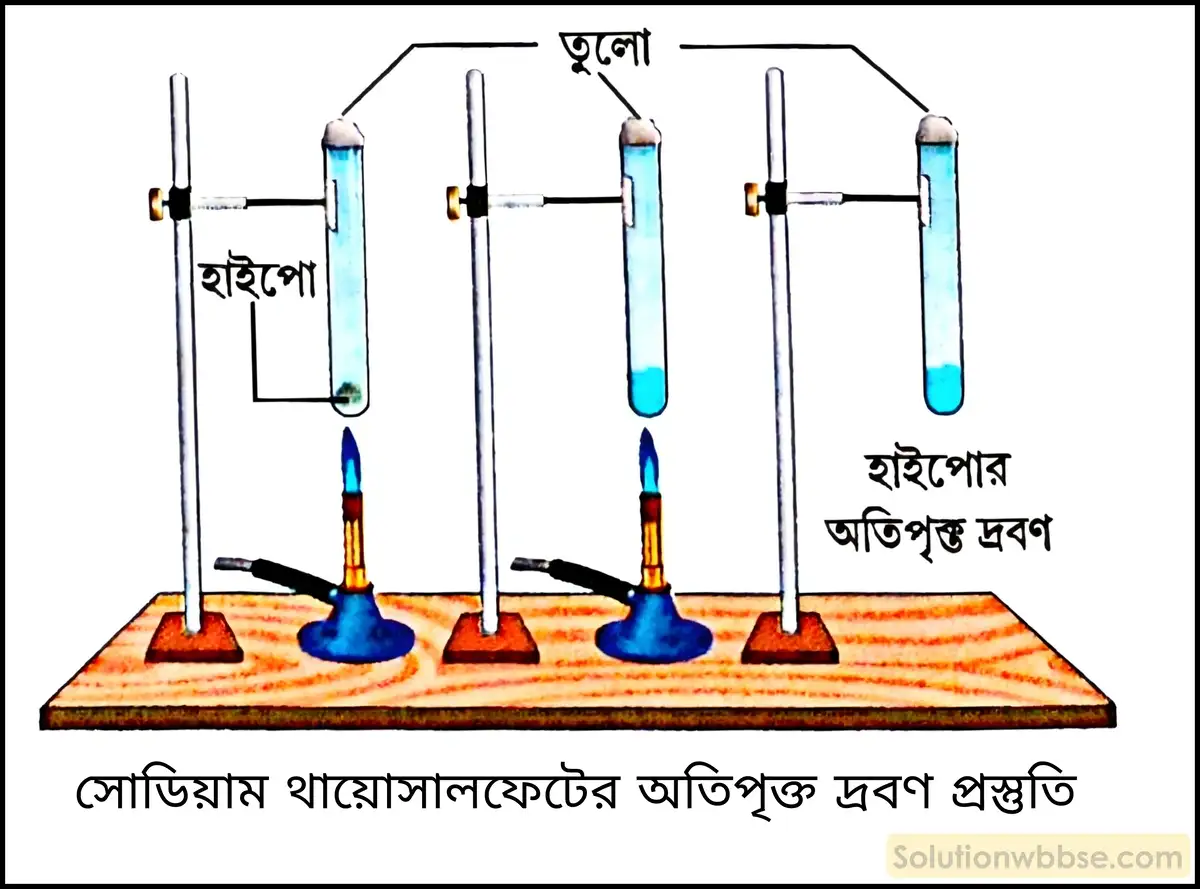
অতিপৃক্ত দ্রবণ প্রস্তুতির পদ্ধতি –
- একটি শক্ত কাচের টেস্টটিউবে কিছু পরিমাণ সোডিয়াম থায়োসালফেটের কেলাস (Na2S2O3⋅5H2O) নেওয়া হল। এরপর টেস্টটিউবের খোলা মুখটি তুলো দিয়ে বন্ধ করে দেওয়া হল, যাতে ভিতরে কোনো ধূলিকণা প্রবেশ করতে না পারে।
- টেস্টটিউবটিকে অত্যন্ত সতর্কতার সঙ্গে বার্নারের মৃদু শিখায় ধীরে ধীরে উত্তপ্ত করা হল।
- কিছুক্ষণের মধ্যেই সোডিয়াম থায়োসালফেটের কেলাস গলতে থাকল এবং শেষে স্বচ্ছ বর্ণহীন তরলে পরিণত হল। এক্ষেত্রে তাপের প্রভাবে কেলাস মধ্যস্থ কেলাস জলেই ওই কেলাস দ্রবীভূত হয়েছে।
- টেস্টটিউবটিকে না নাড়িয়ে ঠান্ডা করে ঘরের উষ্ণতায় নিয়ে এলে দেখা যাবে কোনো কেলাস পৃথক হচ্ছে না। এইভাবে যে স্বচ্ছ দ্রবণটি পাওয়া গেল, সেটিই হল সোডিয়াম থায়োসালফেটের অতিপৃক্ত দ্রবণ। ওই সোডিয়াম থায়োসালফেটের স্বচ্ছ অতিপৃক্ত দ্রবণে একটি থায়োসালফেট দানা যোগ করলে বা দ্রবণটিকে নাড়লে দেখা যাবে, দ্রবণ থেকে সোডিয়াম থায়োসালফেটের কেলাস পৃথক হয়ে যাবে অর্থাৎ, দ্রবণটি আবার জমাট বেঁধে আগের মতো কঠিন অবস্থায় ফিরে আসবে।
তোমাকে গ্লুকোজের একটি দ্রবণ দেওয়া হল। দ্রবণটি সম্পৃক্ত, অসম্পৃক্ত বা অতিপৃক্ত হতে পারে। সহজ পরীক্ষার সাহায্যে কীভাবে বুঝবে দ্রবণটি কী প্রকৃতির?
প্রয়োজনীয় উপকরণ –
- কাচের বিকার,
- পরীক্ষণীয় গ্লুকোজ দ্রবণ,
- গ্লুকোজ,
- কাচদণ্ড।
পরীক্ষা – একটি কাচের বিকারে গ্লুকোজের নমুনা দ্রবণের কিছুটা অংশ নিয়ে তার মধ্যে অল্প পরিমাণ গ্লুকোজ অতিরিক্ত হিসেবে যোগ করা হল। এবার দ্রবণটিকে কাচদণ্ডের সাহায্যে ভালোভাবে নাড়া হল।
পর্যবেক্ষণ ও সিদ্ধান্ত –
- যদি অতিরিক্ত গ্লুকোজ দ্রবণে আংশিক বা সম্পূর্ণভাবে দ্রবীভূত হয় এবং দ্রবণের ঘনত্ব বৃদ্ধি পায়, তাহলে বুঝতে হবে দ্রবণটি ওই উষ্ণতায় অসম্পৃক্ত দ্রবণ।
- যদি অতিরিক্ত গ্লুকোজ দ্রবণে দ্রবীভূত না হয়ে অদ্রাব্য অবস্থায় পাত্রের তলায় থিতিয়ে পড়ে এবং দ্রবণের ঘনত্ব অপরিবর্তিত থাকে, তাহলে বুঝতে হবে দ্রবণটি ওই উষ্ণতায় সম্পৃক্ত দ্রবণ।
- যদি অতিরিক্ত গ্লুকোজ দ্রবণে যোগ করে নাড়ার সময় আরও বেশি পরিমাণে গ্লুকোজ দ্রবণ থেকে পৃথক হয়ে বেরিয়ে এসে পাত্রের তলায় অধঃক্ষিপ্ত হয়, তাহলে বুঝতে হবে দ্রবণটি ওই উষ্ণতায় অতিপৃক্ত দ্রবণ।
কোনো দ্রবণের দ্রাব গ্রহণ ক্ষমতা কোন্ কোন্ বিষয়ের ওপর নির্ভর করে?
কোনো দ্রবণের দ্রাব গ্রহণ করার ক্ষমতা নিম্নলিখিত বিষয়গুলির ওপর নির্ভর করে –
- দ্রাব ও দ্রাবকের প্রকৃতি – দ্রবণে দ্রাব গ্রহণ করার ক্ষমতা দ্রাব ও দ্রাবকের প্রকৃতির ওপর নির্ভর করে। বেশিরভাগ তড়িৎযোজী পদার্থ জল বা অন্যান্য অজৈব দ্রাবকে দ্রাব্য, বেশিরভাগ সমযোজী যৌগ জৈব দ্রাবকে দ্রবীভূত হয়।
- দ্রাবকের পরিমাণ – দ্রবণে দ্রাবকের পরিমাণ বাড়ালে ওই দ্রবণের দ্রাব গ্রহণ করার ক্ষমতা বৃদ্ধি পায়।
- দ্রবণের উষ্ণতা – দ্রবণের উষ্ণতা বৃদ্ধি করলে সাধারণত দ্রাবকের দ্রাব গ্রহণ করার ক্ষমতা বাড়ে, উষ্ণতা হ্রাস করলে দ্রাবকের দ্রাব গ্রহণ করার ক্ষমতা হ্রাস পায়।
- দ্রাবের সূক্ষ্মতা – দ্রাব যত সূক্ষ্ম কণার আকারে থাকবে, তত দ্রুত দ্রবীভূত হবে।
- দ্রাব ও দ্রাবক মিশ্রণকে ঝাঁকানো – দ্রাব ও দ্রাবকের মিশ্রণকে ভালোভাবে ঝাঁকালে দ্রাবকে দ্রাবের ব্যাপন ত্বরান্বিত হয় এবং দ্রুত গতিতে দ্রবীভূত হয়।
কেলাস বা কেলাসিত পদার্থ কাকে বলে? কেলাসের আকার কীরূপ?
কেলাস (Crystal) – নির্দিষ্ট ত্রিমাত্রিক জ্যামিতিক আকারবিশিষ্ট এবং নির্দিষ্ট সংখ্যক সমতল পৃষ্ঠ দ্বারা সীমাবদ্ধ সমসত্ত্ব কঠিন পদার্থের দানাকে কেলাস বা কেলাসিত পদার্থ বলে। যেমন – চিনি, সাধারণ লবণ, ফটকিরি প্রভৃতির কেলাস।
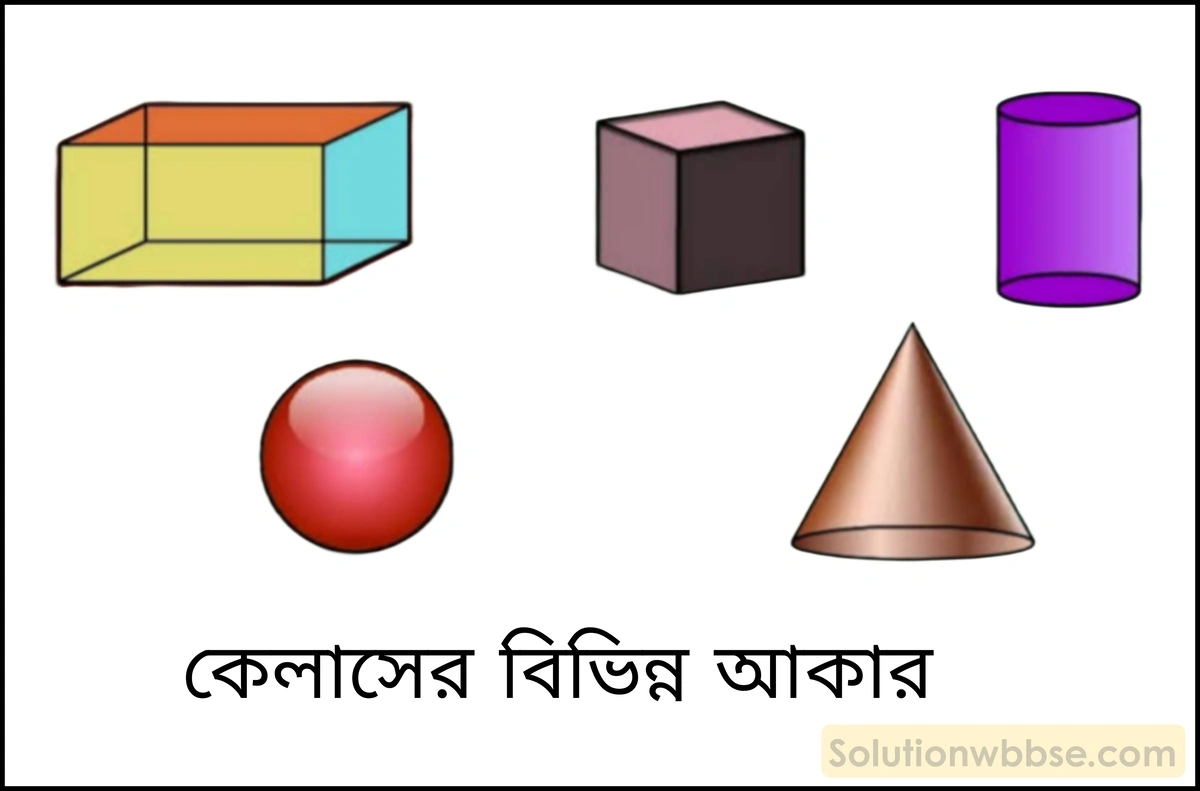
কেলাসের আকার বিভিন্ন রকম হতে পারে। যেমন – ঘনকাকার, চতুস্তলাকার, প্রিজম অথবা পিরামিডের মতো আকার।
অনিয়তাকার পদার্থ কাকে বলে?
অনিয়তাকার পদার্থ (Amorphous Solid) – যে-সমস্ত কঠিন পদার্থের নির্দিষ্ট কোনো জ্যামিতিক আকার নেই, তাদের অনিয়তাকার পদার্থ বলে। যেমন – চুন, ময়দা, পিচ ইত্যাদি।
সমাকৃতি কেলাস বলতে কী বোঝায়?
সমাকৃতি কেলাস – যে-সমস্ত কঠিন পদার্থের কেলাসের জ্যামিতিক গঠন একই রকম, তাদের সমাকৃতি কেলাস বলে। যে ধর্মের জন্য সমাকৃতি কেলাস গঠিত হয়, তাদের সমাকৃতিত্ব বলে। যেমন – জিংক সালফেট (ZnSO4⋅7H2O), ম্যাগনেশিয়াম সালফেট (MgSO4⋅7H2O), ফেরাস সালফেট (FeSO4⋅7H2O) পরস্পরের সমাকৃতি কেলাস।
কেলাসজল কাকে বলে? উদাহরণসহ সোদক কেলাসের সংজ্ঞা দাও।
কেলাসজল (Crystal Water) – কোনো কঠিন পদার্থের সম্পৃক্ত জলীয় দ্রবণ থেকে কেলাস গঠনের সময় ওই কঠিন পদার্থের প্রতিটি অণুতে যে নির্দিষ্ট সংখ্যক জলের অণু কেলাসের মধ্যে রাসায়নিক বন্ধনে আবদ্ধ হয়ে থাকে, সেই নির্দিষ্ট সংখ্যক জলের অণুকেই কেলাসজল বলে। যেমন – কাপড় কাচার সোডাতে (Na2CO3⋅10H2O) 10 অণু কেলাসজল থাকে।
সোদক বেলাস (Hydrated Crystal) – যে কেলাসগুলিতে কেলাসজল থাকে, তাদের সোদক কেলাস বলে। উদাহরণ – তুঁতের কেলাস বা ব্লু-ভিট্রিয়ল (CuSO4⋅5H2O) -এ 5 অণু কেলাসজল থাকে। হোয়াইট ভিট্রিয়ল (ZnSO4⋅7H2O) -এ 7 অণু কেলাসজল থাকে।
গ্রাফাইট, ফটকিরি, সোডিয়াম ক্লোরাইড, হীরক, তুঁতে – কোনগুলি সোদক কেলাস?
প্রদত্ত পদার্থগুলির মধ্যে ফটকিরি [K2SO4⋅Al2(SO4)3⋅24H2O] এবং ছুঁতে [CuSO4⋅5H2O] হল সোদক কেলাস, কারণ – ফটকিরিতে 24 অণু ও তুঁতেতে 5 অণু কেলাসজল আছে।
যৌগের বর্ণের ক্ষেত্রে কেলাসজলের ভূমিকা একটি উদাহরণসহ আলোচনা করো।
যৌগের বর্ণের ক্ষেত্রে কেলাসজলের ভূমিকা লক্ষণীয়। যেমন – ছুঁতে বা সোদক কপার সালফেট (CuSO4⋅5H2O) -এর বর্ণ নীল। 5 অণু কেলাসজল নির্গত হলে কেলাসটি অনার্দ্র CuSO4 -এ পরিণত হয়। তখন এটির বর্ণ হয় সাদা। এই সাদা অনার্স কপার সালফেট জলের সংস্পর্শে আসলেই আবার নীল বর্ণে পরিণত হয়।
কেলাসজল যুক্ত কেলাস এবং কেলাসজল বিহীন কেলাস বা অনার্দ্র কেলাস পার্থক্য লেখো।
| কেলাসজল যুক্ত কেলাস | কেলাসজল বিহীন কেলাস বা অনার্দ্র কেলাস |
| কাপড় কাচার সোডা (Na2CO3⋅10H2О) | সোডিয়াম ক্লোরাইড (NaCl) |
| ফটকিরি [K2SO4⋅Al2(SO4)3⋅24H2O] | পটাশিয়াম নাইট্রেট (KNO3) |
| গ্রিনভিট্রিয়ল (FeSO4⋅7H2O) | অ্যামোনিয়াম সালফেট [(NH4)2SO4)] |
| গ্লবার লবণ (Na2SO4⋅10H2О) | পটাশিয়াম ক্লোরাইড (KCl) |
| বোরাক্স (Na2B4O7⋅10H2O) | পটাশিয়াম ডাইক্রোমেট (K2Cr2O7) |
কেলাসন কী? শেষদ্রব কাকে বলে?
কেলাসন (Crystallisation) – যে পদ্ধতিতে কোনো পদার্থের কেলাস প্রস্তুত করা হয়, তাকেই কেলাসন বলে।
শেষদ্রব (Mother liquor) – কেলাসন পদ্ধতিতে কেলাস প্রস্তুত করার সময় অপেক্ষাকৃত শীতল দ্রবণ থেকে কেলাস পৃথক হওয়ার পর পাত্রে যে অবশেষ দ্রবণটি পড়ে থাকে, তাকে শেষদ্রব বলে।
কীভাবে কেলাস প্রস্তুত করা হয়?
কেলাস প্রস্তুতিকরণ –
- কোনো পদার্থের উত্তপ্ত সম্পৃক্ত দ্রবণকে ধীরে ধীরে ঠান্ডা করলে ওই পদার্থের কেলাস পাওয়া যায়।
- যেসব পদার্থ ঊর্ধ্বপাতিত হয়, যেমন – আয়োডিন, কপূর প্রভৃতিকে উত্তপ্ত করলে ঊর্ধ্বপাতিত হয় এবং ঠান্ডা করলে কেলাস আকারে আবার পাত্রের দেয়ালে জমা হয়।
- কোনো পদার্থের অসম্পৃক্ত দ্রবণ থেকে কেলাস তৈরি করার জন্য দ্রবণটিকে ধীরে ধীরে উত্তপ্ত করে বাষ্পীভূত করা হয়। এই সময় কাচদণ্ডের সাহায্যে দ্রবণটিকে ক্রমাগত নাড়তে হয়। একসময়, পাত্রের তলদেশে বা পাত্রের দেয়ালে দু-একটি দানা উৎপন্ন হতে দেখা যায়। তৎক্ষণাৎ উত্তাপ দেওয়া বন্ধ করে দ্রবণটিকে ঘরের উষ্ণতায় ধীরে ধীরে শীতল করলে ওই দ্রাবের কেলাস পাওয়া যায়।
- ঘরের উষ্ণতা থেকে উচ্চতর উষ্ণতায় প্রস্তুত কোনো সম্পৃক্ত দ্রবণের মধ্যে, ওই দ্রাবের একটি ছোটো কেলাস সুতোর সাহায্যে ঝুলিয়ে দিয়ে দ্রবণটিকে ধীরে ধীরে ঠান্ডা করলে দেখা যায়, ওই দ্রবণ থেকে কঠিন দ্রাব ওই ঝোলানো কেলাসটির গায়ে জমা হচ্ছে। এই ঘটনাকে অধিবৃদ্ধি বলে।
কেলাসন শুরুর ঠিক পূর্বে দ্রবণটি কোন অবস্থায় থাকে এবং কেলাসনের পরে শেষ দ্রবণের অবস্থা কী হয়?
কেলাসন শুরুর ঠিক পূর্বে দ্রবণটি অতিপুক্ত হয়। কেলাসনের পরে শেষদ্রবটি সম্পৃক্ত থাকে।
জলীয় দ্রবণ থেকে ফটকিরির কেলাস প্রস্তুতি বর্ণনা করো।
ফটকিরির ফেলাস প্রস্তুতি –
প্রয়োজনীয় রাসায়নিক উপকরণ –
- ফটকিরি,
- পাতিত জল।
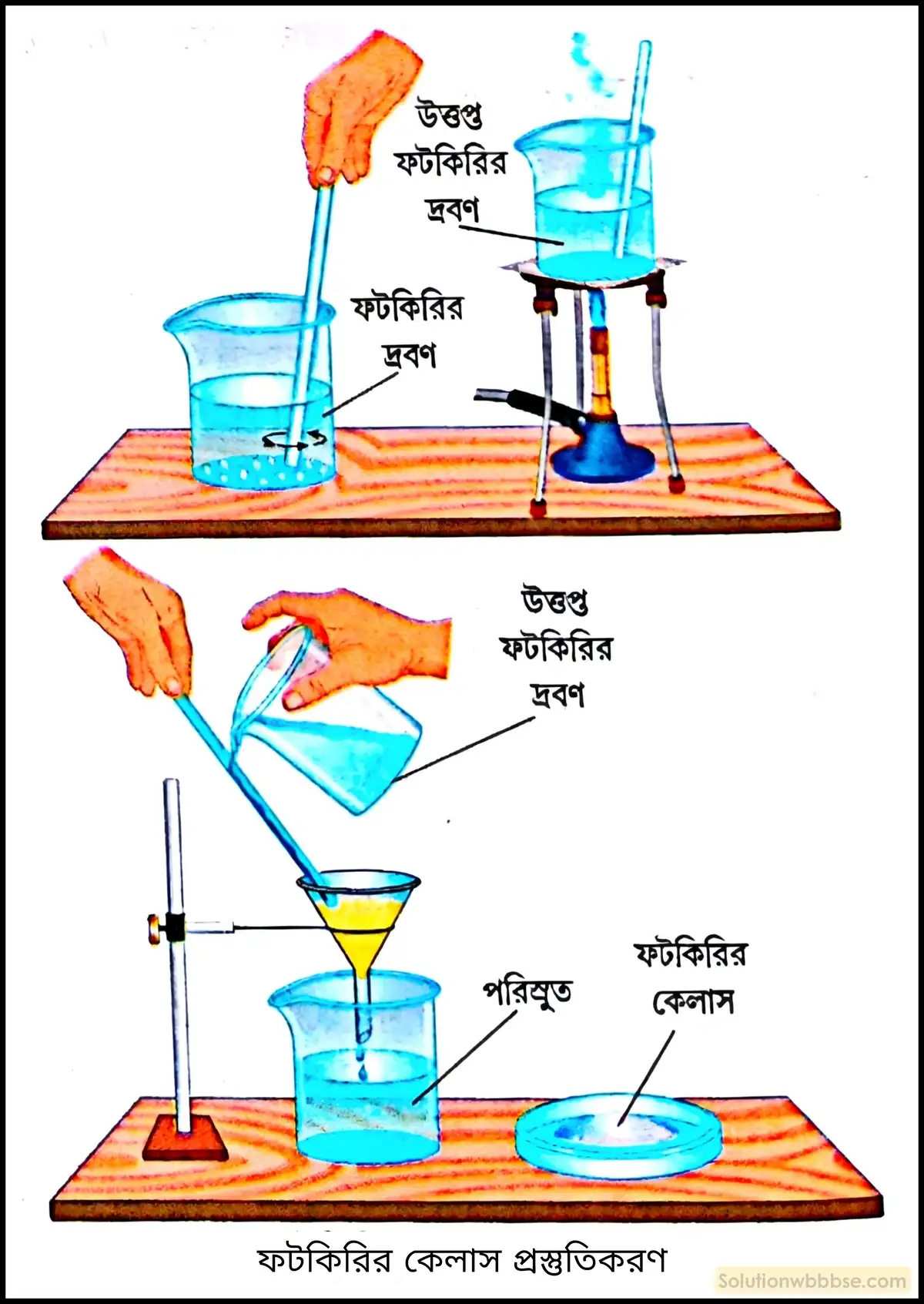
পদ্ধতি – ফটকিরিকে পাতিত জলে দ্রবীভূত করে পরিস্রাবণ পদ্ধতিতে জলে অদ্রাব্য অশুদ্ধি পৃথক করা হয়। এরপর পরিস্রুতকে উত্তপ্ত করে গাঢ় দ্রবণে পরিণত করার পর ফিলটার করে অশুদ্ধি দূর করা হয়। এবার পরিস্রুতকে ধীরে ধীরে শীতল করা হয়। 30 – 45 মিনিট পর ফটকিরির কেলাস উৎপন্ন হতে দেখা যায়। অনেকসময় দেখা যায় যে, উত্তপ্ত গাঢ়ীকৃত দ্রবণটিকে ধীরে ধীরে শীতল করা সত্ত্বেও কেলাস প্রস্তুত হচ্ছে না। সেক্ষেত্রে ওই দ্রবণের মধ্যে দ্রাবের দু-একটি ছোটো দানা বা কেলাস যোগ করলেই ওই দ্রাবের সুন্দর কেলাস পাওয়া যায়।
আংশিক কেলাসন কাকে বলে?
আংশিক কেলাসন – একই দ্রাবকে দ্রাব্য কিন্তু বিভিন্ন দ্রাব্যতাবিশিষ্ট দুই বা ততোধিক কঠিন পদার্থের মিশ্র দ্রবণ থেকে পদার্থগুলিকে বিভিন্ন তাপমাত্রায় শীতল করার পর কেলাসিত করে পৃথক করার পদ্ধতিকে আংশিক কেলাসন বলে।
পুনঃকেলাসন কাকে বলে?
পুনঃকেলাসন – কেলাসের মধ্যে অপদ্রব্য মিশে থাকলে তাকে ন্যূনতম দ্রাবকে দ্রবীভূত করার পর উত্তপ্ত করে ঘন করা হয়। এই গাঢ়ীকৃত দ্রবণকে ধীরে ধীরে শীতল করলে মূল পদার্থটির বিশুদ্ধ কেলাস পাওয়া যায়, এই প্রক্রিয়াকেই পুনঃকেলাসন বলা হয়।
কেলাসন প্রক্রিয়ায় কোনো কঠিন পদার্থের বিশুদ্ধিকরণের শর্ত কী?
কেলাসন প্রক্রিয়ায় কোনো কঠিন পদ্যার্থর বিশুদ্ধিকরণের শর্ত –
- একই দ্রাবকে বিভিন্ন কঠিন পদার্থের দ্রাব্যতা বিভিন্ন হয়। কেলাসন পদ্ধতিতে কোনো কঠিন পদার্থকে বিশুদ্ধকরণের শর্ত হল সংশ্লিষ্ট ওই কঠিন পদার্থকে দ্রবীভূত করার জন্য এমন দ্রাবক নির্বাচন করতে হবে যাতে ওই কঠিন পদার্থের মধ্যে উপস্থিত অশুদ্ধিগুলি ওই দ্রাবকে অদ্রবীভূত অবস্থায় থাকে এবং অপদ্রব্যগুলি কঠিনটির সঙ্গে যেন সমাকৃতি কেলাস গঠন না করে। ফলস্বরূপ পরিস্রাবণ পদ্ধতিতে ওই অদ্রাব্য অশুদ্ধিগুলিকে দ্রবণ থেকে পৃথক করা সম্ভব হয়।
- দ্রাবক যেন অশুদ্ধ যৌগের সঙ্গে বিক্রিয়া না করে।
- যে যৌগটিকে কেলাসিত করতে হবে সেটি যেন ঘরের উষ্ণতার চেয়ে বেশি উষ্ণতায় ওই দ্রাবকে অপেক্ষাকৃত বেশি দ্রাব্য হয়।
অতিপৃক্ত দ্রবণের সঙ্গে কেলাসনের সম্পর্ক কী?
নির্দিষ্ট উষ্ণতায় কোনো সম্পৃক্ত দ্রবণে যে পরিমাণ দ্রাব থাকা সম্ভব তার থেকে বেশি পরিমাণ দ্রাব যদি কোনো বিশেষ উপায়ে দ্রবীভূত থাকে, তবে সেই দ্রবণকে অতিপৃক্ত দ্রবণ বলা হয়। এই অতিপৃক্ত দ্রবণকে নাড়িয়ে দিলে তা থেকে কঠিন দ্রাব কেলাসিত হয়ে দ্রবণ থেকে পৃথক হয়ে যায়। এইভাবে অতিপৃক্ত দ্রবণ কেলাসনের সঙ্গে সম্পর্কিত। আবার কোনো সম্পৃক্ত দ্রবণকে শীতল করে অথবা, অসম্পৃক্ত দ্রবণকে বাষ্পীভূত করে দ্রাবের কেলাসন শুরু করার পূর্বে দ্রবণটি অতিপৃক্ত হয়ে পড়ে।
কেলাসের স্ফীতকরণ বা অধিবৃদ্ধি বলতে কী বোঝায়?
কেলাসের স্ফীতকরণ বা অধিবৃদ্ধি (Seeding) – কোনো পদার্থের ঘন দ্রবণে যদি সেই পদার্থের একটি কেলাস ডোবানো অবস্থায় ঝুলিয়ে দেওয়া হয়, তবে সেই কেলাসের গায়ে ওই দ্রবণ থেকে দ্রাব ক্রমাগত জমতে থাকে। ফলে, কেলাসের আয়তন বৃদ্ধি পায়। একে কেলাসের স্ফীতকরণ বা অধিবৃদ্ধি বলে।
বীজ কেলাসন বলতে কী বোঝায়? এর ব্যবহার লেখো।
বীজ কেলাসন (Seed Crystallisation) – অনেকক্ষেত্রে সম্পৃক্ত দ্রবণকে শীতল করলেও কেলাস গঠন হয় না। এই অবস্থায় ওই কঠিন পদার্থের সম্পৃক্ত দ্রবণে দ্রাবের ছোটো কেলাস যুক্ত করলে যে কেলাস গঠিত হয়, তাকে বীজ কেলাস (Seed Crystal) বলে এবং এই প্রক্রিয়াকে বীজ কেলাসন বলা হয়।

বীজ কেলাসন -এর ব্যবহার – যেসব ক্ষেত্রে কেলাসন ধীরে ধীরে হয়, সেক্ষেত্রে বীজ কেলাসন পদ্ধতি প্রয়োগ করে কেলাসন প্রক্রিয়াকে দ্রুত করা হয়।
শিল্পক্ষেত্রে বীজ কেলাসনের প্রয়োগ আলোচনা করো।
শিল্পক্ষেত্রে বীজ কেলাসনের প্রয়োগ –
- শিল্পক্ষেত্রে বীজ কেলাসনের প্রায়াগ অর্ধপরিবাহী (Semiconductors) উৎপাদনে বীজ কেলাসন পদ্ধতির ব্যাপক ব্যবহার রয়েছে। সিলিকন, জার্মেনিয়াম, গ্যালিয়াম আর্সেনাইড প্রভৃতি অর্ধপরিবাহীর কেলাস গঠন করার সময় শিল্পক্ষেত্রে বীজ কেলাসন পদ্ধতির ব্যবহার করা হয়। এই পদ্ধতিতে অশুদ্ধিমুক্ত অর্ধপরিবাহী পাওয়া যায়।
- বিভিন্ন সংশ্লেষিত রত্ন (Synthetic Gemstones) তৈরির সময় বীজ কেলাসন পদ্ধতি ব্যবহার করা হয়। যেমন – রুবি, স্যাফায়ার, জার্কন ইত্যাদি।
- প্যালাডিয়াম, প্ল্যাটিনাম, রুপো, সোনা প্রভৃতি ধাতুর কেলাস তৈরি করার জন্যও বীজ কেলাসন পদ্ধতির ব্যবহার হয়।
- আখের রস থেকে চিনি প্রস্তুতির সময় বীজ কেলাসরূপে বিশুদ্ধ চিনির দানা ব্যবহার করা হয়।
- বায়ার পদ্ধতিতে অ্যালুমিনা প্রস্তুতির সময় বীজ কেলাসরূপে সোদক Al2O3 -এর কেলাস ব্যবহার করা হয়।

উদ্ত্যাগ ও উদ্ত্যাগী পদার্থ কাকে বলে?
উদ্ত্যাগ (Efflorescence) ও উদ্ত্যাগী পদার্থ (Efflorescent substance) – সাধারণ উষ্ণতায় কতগুলি সোদক কেলাসকে বায়ুর মধ্যে খোলা অবস্থায় রেখে দিলে কেলাসগুলির কেলাসজল আংশিক বা সম্পূর্ণভাবে বাষ্পাকারে নির্গত হয় এবং কেলাসগুলি অনিয়তাকার পদার্থে পরিণত হয়। সোদক কেলাসের এই ধর্মকে উদ্ত্যাগ বলে। যেসব সোদক কেলাস এই ধর্ম প্রদর্শন করে, তাদের উদ্ত্যাগী কেলাস বলে। উদাহরণ – সাদা বর্ণের কাপড় কাচার সোডা (Na2CO3⋅10H2O) একটি উদ্ত্যাগী পদার্থ।
উদ্গ্রহণ ও উদ্গ্রাহী পদার্থ কাকে বলে?
উদ্গ্রহণ (Deliquescence) এবং উদ্গ্রাহী পদার্থ (Deliquescent substance) – সাধারণ উষ্ণতায় কয়েকটি কঠিন পদার্থকে খোলা বাতাসে রেখে দিলে, ওই পদার্থগুলি বায়ু থেকে জলীয় বাষ্প শোষণ করে সেই শোষিত জলে দ্রবীভূত হয়ে যায়। এই ঘটনাকে উদ্গ্রহণ বলে। যেসব পদার্থ এই ধর্ম প্রদর্শন করে, তাদের উদ্গ্রাহী পদার্থ বলে। উদাহরণ – কস্টিক সোডা (NaOH), ম্যাগনেশিয়াম ক্লোরাইড (MgCl2), ক্যালশিয়াম ক্লোরাইড (CaCl2) প্রভৃতি যৌগগুলি হল উদ্গ্রাহী পদার্থ।
কোনো পদার্থের উদ্ত্যাগী এবং উদ্গ্রাহী হওয়ার শর্ত কী?
অথবা, উদ্ত্যাগ ও উদ্গ্রহণের কারণ উল্লেখ করো।
পদার্থের উদ্ত্যাগী হওয়ার শর্ত – সংশ্লিষ্ট পদার্থের সোদক কেলাস মধ্যস্থ কেলাসজলের নিজস্ব বাষ্পচাপ বায়ুতে উপস্থিত জলীয় বাষ্পচাপের চেয়ে বেশি হলে কেলাসজল বাষ্পাকারে বাতাসে চলে যায়। ফলে, কেলাস গঠন ভেঙে কেলাসগুলি গুঁড়োয় পরিণত হয়।
পদার্থের উদ্গ্রাহী হওয়ার শর্ত – সংশ্লিষ্ট পদার্থের কেলাস মধ্যস্থ কেলাসজলের বাষ্পচাপ সাধারণ উষ্ণতায় বায়ুতে উপস্থিত জলীয় বাষ্পচাপের চেয়ে কম হলে বাতাস থেকে কেলাসগুলি জলীয় বাষ্প শোষণ করে। এই সমস্ত পদার্থ জলে বেশি মাত্রায় দ্রাব্য হয়।
জলাকর্ষী পদার্থ কাকে বলে? উদাহরণ দাও।
জলাকর্ষী পদার্থ (Hygroscopic substance) – কতকগুলি পদার্থ খোলা বাতাসে কিংবা কোনো আর্দ্র বস্তুর সংস্পর্শে রেখে দিলে পদার্থগুলি বাতাস অথবা ওই আর্দ্র বস্তু থেকে জলীয় বাষ্প শোষণ করে, কিন্তু ওই শোষিত জলে নিজে দ্রবীভূত হয় না। এই পদার্থগুলিকে জলাকর্ষী পদার্থ বলে। এরা কেলাসাকার, অনিয়তাকার বা তরলও হতে পারে। উদাহরণ – পোড়াচুন (CaO), সিলিকা জেল (SiO2), ফসফরাস পেন্টক্সাইড (P2O3), অনার্স ক্যালশিয়াম ক্লোরাইড (CaCl2) হল জলাকর্ষী পদার্থ।
দ্রবণের গাঢ়ত্ব বলতে কী বোঝায়? দ্রবণের গাঢ়ত্ব প্রকাশের এককগুলি কী কী?
দ্রবণের গাঢ়ত্ব – দ্রবণের গাঢ়ত্ব বলতে প্রকৃতপক্ষে দ্রবণের একটি নির্দিষ্ট পরিমাণে কত পরিমাণ দ্রাব দ্রবীভূত আছে তা বোঝায়। প্রকৃতপক্ষে দ্রবণের গাঢ়ত্বই এর শক্তি বা মাত্রা।
দ্রবণের গাঢ়ত্ব প্রকাশের একক – শতকরা মাত্রা, নর্মালিটি, মোলালিটি, মোলারিটি, ফর্মালিটি, গ্রাম প্রতি লিটার, মোল প্রতি লিটার, মোল-ভগ্নাংশ ইত্যাদি।
শতকরা মাত্রায় শক্তি বলতে কী বোঝায়? ওজন-আয়তন ভিত্তিক শতাংশ \(\left(\%\frac WV\right)\) কী?
শতকরা মাত্রায় শক্তি – কোনো দ্রবণের 100 ভাগে যত ভাগ দ্রাব দ্রবীভূত থাকে সেই সংখ্যাকে ওই দ্রবণের শতকরা মাত্রায় শক্তি বলে। যেমন – 100 mL জলে 40 g NaOH দ্রবীভূত থাকলে তার শক্তি মাত্রা 40%।
শতকরা মাত্রায় শক্তি তিন প্রকার। যথা – ওজন-ওজন \(\left(\%\frac WW\right)\) ভিত্তিতে শতকরা মাত্রা, ওজন-আয়তন \(\left(\%\frac WV\right)\) ভিত্তিতে শতকরা মাত্রা, আয়তন-আয়তন \(\left(\%\frac VV\right)\) ভিত্তিতে শতকরা মাত্রা শক্তি।
ওজন-আয়তন ভিত্তিক শতাংশ \(\left(\%\frac WV\right)\) – ওজন-আয়তন ভিত্তিক শতাংশ বলতে দ্রবণের প্রতি 100 mL আয়তনে যত গ্রাম দ্রাব দ্রবীভূত আছে তা বোঝায়।
যেমন – \(20\%\frac WV\) NaOH বলতে বোঝায় ওই দ্রবণের প্রতি 100 mL আয়তনে 20 g বিশুদ্ধ NaOH দ্রবীভূত আছে।
কখন কোনো দ্রবণের ওজনমাত্রিক শতাংশ \(\left(\%\frac WW\right)\) এবং আয়তনমাত্রিক শতাংশ \(\left(\%\frac WV\right)\) সমান হবে?
ওজন-ওজন ভিত্তিতে শতকরা মাত্রা \(\left(\%\frac WW\right)\) ও ওজন-আয়তন ভিত্তিতে শতকরা মাত্রা \(\left(\%\frac WV\right)\) পরস্পর দ্রবণের ঘনত্বের মাধ্যমে সম্পর্কিত। যদি দ্রবণের ঘনত্ব 1 গ্রাম/মিলি হয় তাহলে এই দুই মাত্রার গাণিতিক মান পরস্পর সমান হয়।
10% গ্লুকোজ দ্রবণ বলতে কী বোঝায়?
10% গ্লুকোজ দ্রবণ বলাত বোঝায় –
- 10% গ্লুকোজ দ্রবণ \(\left(\%\frac WW\right)\) – 100 g ভরের উক্ত গ্লুকোজ দ্রবণে 10 g গ্লুকোজ দ্রাব রূপে দ্রবীভূত আছে।
- 10% গ্লুকোজ দ্রবণ \(\left(\%\frac WV\right)\) 100 mL আয়তনের উক্ত গ্লুকোজ দ্রবণে 10 g গ্লুকোজ দ্রাব রূপে দ্রবীভূত আছে।
গ্রাম/লিটার (gL-1) কাকে বলে?
গ্রাম/লিটার শক্তিমাত্রা – কোনো দ্রবণের প্রতি লিটারে কোনো দ্রাবের যত গ্রাম দ্রবীভূত থাকে, সেই গ্রাম সংখ্যাকে ওই দ্রবণের গ্রাম/লিটার শক্তিমাত্রা বলে। যেমন – কপার সালফেটের 1 লিটার জলীয় দ্রবণে যদি 20 g কপার সালফেট দ্রবীভূত থাকে, তবে ওই দ্রবণের মাত্রা হবে 20 g/L।
মোল/লিটার কাকে বলে? উদাহরণ দাও।
অথবা, দ্রবণের মোলারিটির সংজ্ঞা দাও। মোলারিটির ওপর উষ্ণতার প্রভাব আলোচনা করো।
মোল/লিটার শক্তিমাত্রা বা মোলারিটি – কোনো দ্রবণের 1 লিটারে কোনো দ্রাবের যত গ্রাম মোল দ্রবীভূত থাকে, সেই সংখ্যাকে ওই দ্রবণের মোল/লিটার শক্তিমাত্রা বা মোলারিটি বলে।
যেমন – NaOH -এর 1 লিটার জলীয় দ্রবণে যদি 80 গ্রাম NaOH দ্রবীভূত থাকে, তবে ওই দ্রবণের শক্তিমাত্রা হবে 2 মোল/লিটার।
কারণ –
1 মোল NaOH = 40 g
∴ 2 মোল NaOH = 80 g
মোলারিটি উষ্ণতার ওপর নির্ভর করে কারণ – উষ্ণতার পরিবর্তনে দ্রাবের মোলসংখ্যা অপরিবর্তিত থাকলেও দ্রাবকের আয়তন উষ্ণতার পরিবর্তনে পরিবর্তিত হয়। সাধারণত উষ্ণতা বাড়ালে দ্রবণের আয়তন সামান্য বাড়ে ও উষ্ণতা কমালে দ্রবণের আয়তন সামান্য কমে (জলের ক্ষেত্রে ব্যতিক্রম 0°C থেকে 4°C পর্যন্ত আয়তন কমে)। সর্বোপরি উষ্ণতার পরিবর্তনে মোলারিটির পরিবর্তন হয়। তাই দ্রবণের মোলারিটি নির্ণয়ের ক্ষেত্রে উষ্ণতার উল্লেখ অবশ্যই প্রয়োজন।
মোলালিটি কাকে বলে?
মোলাল গাঢ়ত্ব বা মোলালিটি – 1000 g দ্রাবকে কোনো দ্রাবের যত গ্রাম-অণু দ্রবীভূত হয়ে দ্রবণ উৎপন্ন করে, সেই গ্রাম-অণু সংখ্যাকে ওই দ্রবণের মোলালিটি বলে।
দ্রবণের শক্তিমাত্রা কীভাবে উষ্ণতার ওপর নির্ভর করে?
দ্রবণের শতকরা মাত্রায় শক্তি \(\left(\%\frac WV\right)\) ও \(\left(\%\frac VV\right)\), গ্রাম প্রতি লিটারে শক্তি ও মোল প্রতি লিটারে শক্তি উষ্ণতা নির্ভরশীল রাশি। এই শক্তিমাত্রাগুলি দ্রাব বা দ্রাবকের আয়তনের সঙ্গে সম্পর্কিত। দ্রবণের আয়তন উষ্ণতার সঙ্গে পরিবর্তিত হয়। তাই আয়তনের ওপর নির্ভরশীল এই শক্তিমাত্রাগুলিও উষ্ণতার ওপর নির্ভর করে।
পদার্থের ভর উষ্ণতা নিরপেক্ষ তাই স্রাব ও দ্রাবকের ভরের ওপর নির্ভরশীল শক্তিমাত্রাগুলি (যেমন – মোলালিটি, \(\left(\%\frac WW\right)\), মোল ভগ্নাংশ) উষ্ণতা নিরপেক্ষ রাশি।
ব্রাউনীয় গতি বলতে কী বোঝায়?
ব্রাউনীয় গতি (Brownian Motion) – দ্রবণে দ্রাব ও দ্রাবক কণার বিরামহীন, ইতস্তত বিচরণকে ব্রাউনীয় গতি বলা হয়।
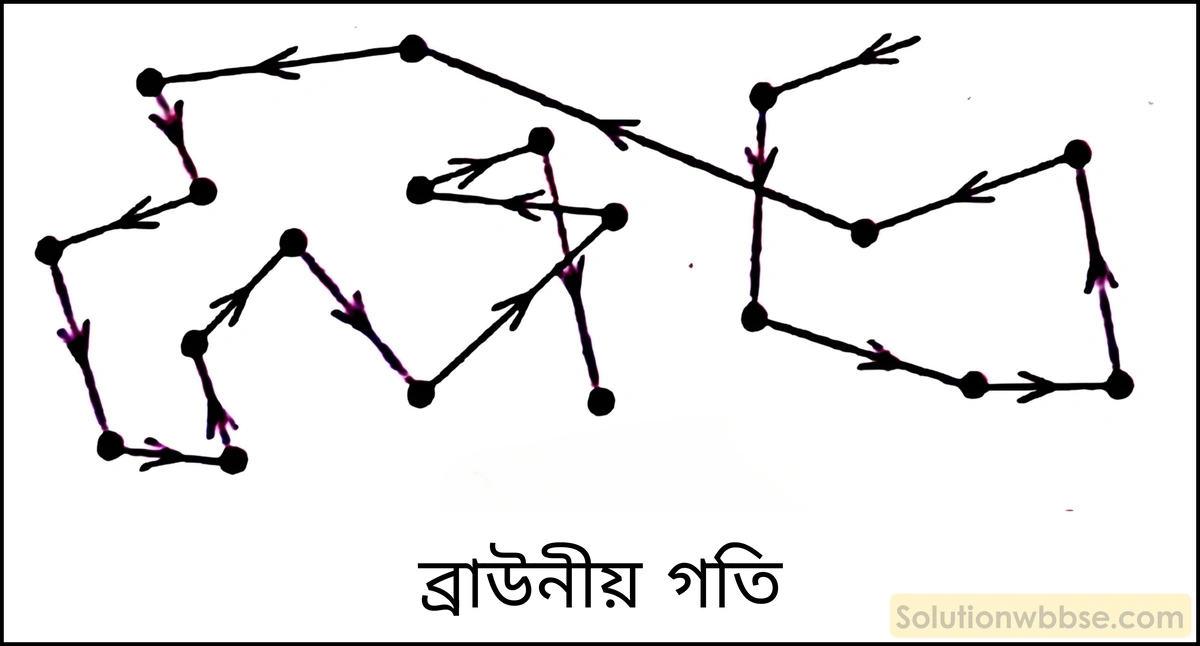
ব্রাউনীয় গতির কারণ ও তাৎপর্য আলোচনা করো।
ব্রাউনীয় গতির কারণ – কোনো দ্রবণে দ্রাব ও দ্রাবক কণার মধ্যে অনবরত সংঘাতের ফলে এই ব্রাউনীয় গতির সৃষ্টি হয়। এই গতি বিশেষ করে কোলয়েডীয় দ্রবণে দেখা যায়। সাধারণত বিস্তার মাধ্যমের অণুগুলি বা দ্রাবক অণুগুলি কোলয়েড কণাগুলিকে বা দ্রাব অণুর কণাগুলিকে বিভিন্ন দিকে ধাক্কা দেয়। কিন্তু দ্রাব কণার আকার অপেক্ষা দ্রাবক কণার আকার বড়ো হবার কারণে, দ্রাব কণাগুলি ধাক্কা খেয়ে একটি নির্দিষ্ট দিকে অগ্রসর হয়। অন্যান্য কণার সঙ্গে ধাক্কা লাগার কারণে দ্রাব কণার এই গতিপথ অনবরত পরিবর্তিত হয়।
ব্রাউনীয় গতির তাৎপর্য –
- এই গতির সাহায্যে অ্যাভোগাড্রো সংখ্যা নির্ণয় করা যায়।
- ব্রাউনীয় গতির দ্বারা তরল বা গ্যাস অণুর যে বিরামহীন গতি আছে তা প্রমাণিত হয়।
- কোলয়েড দ্রবণের (বিশেষ করে দ্রাবক-বিকর্ষী কোলয়েড) স্থায়িত্বের জন্য ব্রাউনীয় গতিই দায়ী।
ব্রাউনীয় গতি কী?
1827 খ্রিস্টাব্দে বিজ্ঞানী রবার্ট ব্রাউন মাইক্রোস্কোপের সাহায্যে জলে প্রলম্বিত রেণু কণার গতি পর্যবেক্ষণ করতে গিয়ে দেখেন, কণাগুলি দ্রবণের মধ্যে ইতস্তত ও বিরামহীনভাবে সঞ্চরণশীল। দ্রবণে কণার এই গতির নামই হল ব্রাউনীয় গতি।
ব্যাপন কাকে বলে? এটি সৃষ্টির কারণ উল্লেখ করো।
ব্যাপন (Diffusion) – যে ধর্মের জন্য দুই বা ততোবিক গ্যাসীয় বা তরল পদার্থ তাদের বেশি ঘনত্ব থেকে কম ঘনত্বের মধ্যে স্বতঃস্ফূর্তভাবে মিশে সমসত্ত্ব মিশ্রণ উৎপন্ন করে, তাকে ব্যাপন বলে।
ব্যাপন প্রধানত দুটি কারণে হয়। যথা –
- তরল বা গ্যাস অণুর দ্রুত অবিন্যস্ত ও ইতস্তত গতির ফলে, যখন একটি তরল অন্য তরলের বা একটি গ্যাস যখন অন্য একটি গ্যাসের সংস্পর্শে আসে তখন ব্যাপন হয়।
- গ্যাসের ব্যাপনের ক্ষেত্রে গ্যাসকে যে পাত্রে রাখা হয় সেই পাত্রের দেয়ালে ছিদ্র থাকলে, সেই ছিদ্র দিয়ে গ্যাস অণুগুলি ধীরে ধীরে বেরিয়ে যেতে পারে।
ব্যাপনের হার কী কী বিষয়ের ওপর নির্ভরশীল?
কোনো পদার্থের (তরল/গ্যাসীয়) ব্যাপনের হার নিম্নলিখিত বিষয়গুলির ওপর নির্ভরশীল। যথা – তরল বা গ্যাসের চাপ, উষ্ণতা, ঘনত্ব, অণুর আকার ইত্যাদি।
একটি পরীক্ষা দ্বারা ব্যাপন পদ্ধতিটি আলোচনা করো।
ব্যাপন সংক্রান্ত পরীক্ষা –
উপকরণ –
- একটি জলপূর্ণ বিকার,
- একটি ড্রপার,
- লাল কালি।
পরীক্ষা – একটি জলপূর্ণ বিকার নিয়ে তাতে ড্রপারের সাহায্যে একফোঁটা লাল কালি ফেলা হল। বিকারটিকে এমনভাবে রাখা হল যাতে বিকারের জলতল কোনোভাবে আন্দোলিত না হয়।

পর্যবেক্ষণ – প্রথমে দেখা যাবে, বিকারের মাঝখানে কালির ফোঁটাটি ফেলায় সেখানে লাল বর্ণের গাঢ়ত্ব সর্বাধিক। কিছু সময় পরে সমগ্র বিকারে কালির লাল বর্ণ সমানভাবে ছড়িয়ে পড়ে।
সিদ্ধান্ত – এই পরীক্ষা থেকে দেখা যায়, বেশি ঘনত্বের কালি ধীরে ধীরে কম ঘনত্বের জলে সমানভাবে ছড়িয়ে পড়ে। অর্থাৎ, এখানে ব্যাপন ঘটেছে।
ব্রাউনীয় গতির নিরিখে ব্যাপন প্রক্রিয়া আলোচনা করো।
কোলয়েড কণাগুলি বিস্তার মাধ্যমে ইতস্তত বিরামহীনভাবে ছুটে বেড়ায়। কোলয়েড কণাগুলির এরূপ গতিকে ব্রাউনীয় গতি বলে। কোলয়েড কণার সঙ্গে বিস্তার মাধ্যমের অণুর সংঘাতের ফলেই ব্রাউনীয় গতির সৃষ্টি হয়। যখন একটি গ্যাস অপর একটি গ্যাসের সংস্পর্শে আসে, তখন ওই গ্যাসের অণুগুলি অপর গ্যাসের আন্তরাণবিক ফাঁকের মধ্যে প্রবেশ করে ছড়িয়ে পড়ে। গ্যাস অণুর নিরন্তর বিশৃঙ্খল গতির জন্য একটি গ্যাস অপর আর একটি গ্যাসের মধ্যে সহজে মিশে যায়, এই প্রক্রিয়াকে ব্যাপন বলে। তরল অণুর গতি অনেক ধীর হওয়ায় তরল দ্রবণে ব্যাপন খুব ধীরে ধীরে হয়।
উদ্বায়ী ও অনুদ্বায়ী তরলের সংজ্ঞা দাও।
উদ্বায়ী তরল (Volatile liquid) – সাধারণ অবস্থায় যেসব তরল স্বতঃস্ফূর্তভাবে বাষ্পীভূত হয়ে বায়ুতে মিশে যায়, তাদের উদ্বায়ী তরল বলে। যেমন – ইথার, ক্লোরোফর্ম, স্পিরিট ইত্যাদি।
অনুদ্বায়ী তরল (Non-volatile liquid) – সাধারণ অবস্থায় যেসব তরল স্বতঃস্ফূর্তভাবে বাষ্পীভূত হয়ে বায়ুতে মেশে না, তাদের অনুদ্বায়ী তরল বলে। যেমন – জল, তেল ইত্যাদি।
ইথাইল অ্যালকোহল, মিথাইল অ্যালকোহল, অ্যাসিটোন, ক্লোরোফর্ম, কেরোসিন তরলগুলির প্রকৃতি ও ব্যবহার উল্লেখ করো।
জল ভিন্ন অন্য দ্রাবকগুলি সাধারণত জৈব পদার্থ হয় যারা মূলত জৈব যৌগগুলিকে দ্রবীভূত করতে সক্ষম।
| দ্রাবকের নাম | প্রকৃতি | ব্যবহার |
| ইথাইল অ্যালকোহল | (1) মিষ্টি গন্ধযুক্ত বর্ণহীন উদ্বায়ী পদার্থ। (2) দাহ্য তরল। (3) প্রশম, জৈব দ্রাবক। | রজন, সাবান, বার্নিশ, রং, রেয়ন, সুগন্ধি, রঞ্জক দ্রব্য, ঔষধের দ্রাবক। |
| মিথাইল অ্যালকোহল | (1) মিষ্টি গন্ধযুক্ত উদ্বায়ী তরল পদার্থ। (2) দাহ্য তরল। (3) প্রশম তরল। | রং, বার্নিশ, সেলুলয়েড, সিমেন্ট, চর্বি প্রভৃতির দ্রাবক। |
| অ্যাসিটোন | (1) মিষ্টি গন্ধযুক্ত উদ্বায়ী তরল পদার্থ। (2) বর্ণহীন ও দাহ্য তরল। (3) স্ফুটনাঙ্ক 56°C। এটি জল, অ্যালকোহল ও ইথারে দ্রাব্য। | নেলপলিশ, ক্লোরোফিল ও গ্রিজ-এর দ্রাবক। |
| ক্লোরোফর্ম | (1) বর্ণহীন, সুমিষ্ট গন্ধযুক্ত উদ্বায়ী তরল। (2) চেতনানাশক ধর্ম আছে। স্ফুটনাঙ্ক 61°C। (3) জলে অদ্রাব্য কিন্তু অ্যালকোহল ও ইথারে দ্রাব্য। | আয়োডিন, চর্বির দ্রাবক। |
| কেরোসিন | (1) বিশেষ গন্ধযুক্ত তরল পদার্থ। (2) দাহ্য তরল। (3) প্রশম জৈব তরল। | গ্রিজ, রং-এর দ্রাবক। |
উদবায়ী দ্রাবকের ক্ষতিকর প্রভাবগুলি লেখো।
উদ্বায়ী দ্রাবকের ক্ষতিকর প্রভাব – উদ্বায়ী তরলগুলি হল – ইথার, ক্লোরোফর্ম, অ্যালকোহল, অ্যাসিটোন প্রভৃতি। এই তরলগুলি বিভিন্ন শিল্পক্ষেত্রে জ্বালানি হিসেবে ব্যবহৃত হয়। বর্তমানে এগুলি ব্যবহারের ফলে মানুষের বিভিন্ন ক্ষতি হচ্ছে।
- অ্যালকোহলের থেকে মানুষের বিভিন্ন রোগ, যেমন – অপুষ্টি, লিভারের রোগ, কেন্দ্রীয় স্নায়ুতন্ত্রের সমস্যা হয়।
- অ্যাসিটোনের প্রভাবে চামড়ায় ক্ষত হয়, লিভারের কার্যক্ষমতা ব্যাহত হয়।
- ক্লোরোফর্ম বায়ুর অক্সিজেনের সঙ্গে যুক্ত হয়ে ফসজিন নামক এক প্রকার বিষাক্ত গ্যাস গঠন করে, যা অত্যন্ত ক্ষতিকর।
ফসজিন (COCl2) কী ধরনের গ্যাস, এবং এটি কীভাবে তৈরি হয়?
ফসজিন (COCl2) এমনই একটি বর্ণহীন বিষাক্ত গ্যাস, যার ক্ষতিকর প্রভাবে প্রথম বিশ্বযুদ্ধের সময় প্রচুর লোক মারা যায়। এই গ্যাস প্রাকৃতিকভাবে পাওয়া যায় না। শিল্প পদ্ধতিতে এই গ্যাস তৈরি হয়।
জলকে সর্বজনীন দ্রাবক বলা হয় কেন?
সর্বজনীন দ্রাবক – জলকে সর্বজনীন দ্রাবক বলা হয় কারণ –
- জলে কঠিন, তরল বা গ্যাসীয় সব ধরনের পদার্থই দ্রবীভূত হয়,
- জলের পোলার ধর্ম থাকার জন্য বেশিরভাগ সমযোজী যৌগ, যেমন – চিনি, ইউরিয়া, অ্যালকোহল জলের সঙ্গে হাইড্রোজেন বন্ধন গঠনের মাধ্যমে দ্রবীভূত হয়,
- জলের পরা-বৈদ্যুতিক ধ্রুবকের মান বেশি (80.4) হওয়ায় বিভিন্ন আয়নীয় বা তড়িৎযোজী যৌগগুলি বিপরীত মেরুর আকর্ষণ বলজনিত কারণে জলে দ্রবীভূত হয়,
- জল অনেক পদার্থের সঙ্গে রাসায়নিক বিক্রিয়া করে সেই সমস্ত পদার্থকে দ্রবীভূত করে, NO2 + H2O = HNO3, SO2 + H2O = H2SO3, CO2 + H2O = H2CO3।
- জলকে 0°C থেকে 100°C পর্যন্ত এই বিস্তীর্ণ পাল্লার মধ্যে তরলরূপে পাওয়া যায়, জলের মাধ্যমে অধিকাংশ রাসায়নিক বিক্রিয়া সংঘটিত হয়। অধিকাংশ রাসায়নিক বিকারকেরই জলীয় দ্রবণ প্রস্তুত করা হয়,
- প্রকৃতির জলের ভাণ্ডার বৃহৎ, এটি সহজলভ্য দ্রাবক। তাই একে সহজে ও নিরাপদে ব্যবহার করা যায়,
- বেশিরভাগ লবণের দ্রাব্যতা জলের পরিপ্রেক্ষিতে গণনা করা হয়।
জলের মতো ভৌত ও রাসায়নিক ধর্মের বিস্তৃতি আর অন্য কোনো দ্রাবকের না থাকায় জলকে সর্বজনীন দ্রাবক অ্যাখ্যা দেওয়া হয়।
জলের মধ্যে ক্ষুদ্র অণু বা আয়নের দ্রবীভবন কীভাবে ঘটে?
জলে ক্ষুদ্র অণু বা আয়নের দ্রবীভবন – জল একটি সমযোজী ধ্রুবীয় দ্রাবক। জলের পরা-বৈদ্যুতিক ধ্রুবকের মান উচ্চ (80.4) হওয়ায় জলে কোনো আয়নীয় যৌগ যোগ করলে সেটি ক্যাটায়ন ও অ্যানায়নে বিয়োজিত হয়। এই ক্ষুদ্র আয়নগুলি জলের আন্তরাণবিক স্থানে প্রবেশ করে দ্রবণ উৎপন্ন করে। আবার, জলের অণুর সঙ্গে অ্যালকোহল, চিনি, গ্লুকোজ ইত্যাদি ধ্রুবীয় সমযোজী অণুর আন্তরাণবিক আকর্ষণ বল কাজ করে। তাই এইসব পদার্থকে জলের সঙ্গে মেশালে ওদের ক্ষুদ্র অণুগুলি পরস্পর থেকে পৃথক হয়ে পড়ে। অণুগুলি (যাদের ব্যাস < 10-8 cm) জলের আন্তরাণবিক স্থানে প্রবেশ করে দ্রবণ উৎপন্ন করে।
বৃহৎ অণুরা কীভাবে জলে দ্রবীভূত হয়?
জলের বৃহৎ অণুর দ্রবীভবন – অপেক্ষাকৃত বড়ো আকারের অণুগুলি (প্রোটিন, DNA, স্টার্চ ইত্যাদি) জলের আন্তরাণবিক ক্ষুদ্র স্থানে প্রবেশ করতে না পারায়, বহু সংখ্যক জলের অণুকে অপসারিত করে সেই স্থান দখল করে এবং জলে দ্রবীভূত হয়ে কোলয়েডীয় দ্রবণ উৎপন্ন করে।
বোধমূলক প্রশ্নোত্তর
সব দ্রবণই মিশ্রণ, কিন্তু সব মিশ্রণই দ্রবণ নয় – উক্তিটি ব্যাখ্যা করো।
দুই বা ততোধিক পদার্থের সমসত্ত্ব মিশ্রণের প্রতিটি অংশের উপাদান, গঠন ও ধর্ম যদি একই থাকে, তবে ওই মিশ্রণকে দ্রবণ বলে। আবার মিশ্রণ সমসত্ত্ব ও অসমসত্ত্ব এই দুই প্রকারের হতে পারে। সুতরাং, সমসত্ত্ব মিশ্রণই দ্রবণ, কিন্তু অসমসত্ত্ব মিশ্রণ দ্রবণ নয়। তাই সব দ্রবণই মিশ্রণ, কিন্তু সব মিশ্রণই দ্রবণ নয়।
দ্রবণ যে সর্বদা তরল হবে এমন কোনো কথা নেই – উক্তিটির তাৎপর্য ব্যাখ্যা করো।
দ্রবণ মাত্রই সর্বদা তরল নাও হতে পারে। দ্রাবক এবং দ্রাবের ভৌত অবস্থা অনুযায়ী দ্রবণ কঠিন অথবা গ্যাসীয়ও হতে পারে। যেমন –
- কঠিনে-কঠিনের দ্রবণ – দুটি কঠিন ধাতু সমসত্ত্বভাবে মিশে কঠিনে-কঠিনের দ্রবণ উৎপন্ন হয়। যেমন- পিতল, ব্রোঞ্জ।
- কঠিনে-গ্যাসের দ্রবণ – প্যালাডিয়াম, নিকেল প্রভৃতি ধাতু H2 গ্যাস শোষণ করে কঠিনে-গ্যাসের দ্রবণ উৎপন্ন হয়। এখানে দ্রাবক হল কঠিন ধাতু এবং দ্রাব হল H2 গ্যাস।
- গ্যাসে-গ্যাসের দ্রবণ –পরস্পর রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না এমন দুটি গ্যাসের মিশ্রণ। যেমন বাতাস (প্রধানত N2 ও O2 -এর মিশ্রণ)। এক্ষেত্রে, N2 গ্যাস হল দ্রাবক এবং O2 গ্যাস হল দ্রাব।
চিনির জলীয় দ্রবণকে প্রকৃত দ্রবণ বলা হয় কেন?
চিনির কণাগুলির ব্যাস 10-8 cm বা তার চেয়ে কম হয়। জলের মধ্যে চিনি যোগ করে নাড়াতে থাকলে চিনির কণাগুলি জলের আন্তরাণবিক ফাঁকা স্থানে (Interstitial Gap) প্রবেশ করে দ্রবীভূত হয়। ফলে, চিনির কণাগুলি দ্রবণ থেকে পৃথক হয়ে সহজে থিতিয়ে পড়ে না। দ্রবণের কণাগুলি ফিলটার পেপারের মধ্যে দিয়ে সহজেই চলাচল করতে পারে। দ্রবণে দ্রাবের কণাগুলি খালি চোখে তো নয়ই এমনকি আল্ট্রামাইক্রোস্কোপ যন্ত্রেও দৃশ্যমান হয় না। জলের সঙ্গে ওতপ্রোতভাবে মিশে যাওয়ায় দ্রবণটি স্বচ্ছ ও সমসত্ত্ব প্রকৃতির হয় অর্থাৎ, দ্রবণের প্রতিটি অংশের উপাদান ও ধর্ম অপরিবর্তিত থাকে। তাই একে প্রকৃত দ্রবণ বলা হয়।
কোলয়েড পদার্থের একটি বিশেষ অবস্থা মাত্র – ব্যাখ্যা করো।
যেসব পদার্থ জলে দ্রবীভূত অবস্থায় পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে, তাদের ক্রিস্টালয়েড পদার্থ বলে। আর যেসব পদার্থের জলীয় দ্রবণ পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না, তাদের কোলয়েড বলে। কিন্তু কিছু কিছু পদার্থ কোনো মাধ্যমে ক্রিস্টালয়েডের মতো আচরণ করলেও কোনো কোনো মাধ্যমে কোলয়েডের মতো আচরণ করে। তাই বলা যায় যে, কোলয়েড কোনো বিশেষ ধরনের পদার্থ নয়, এটি পদার্থের একটি বিশেষ অবস্থা মাত্র।
বিস্তার মাধ্যম ও বিস্তৃত দশা উভয়ই গ্যাসীয় অবস্থায় আছে, এরূপ কোলয়েড পাওয়া যায় না কেন?
অথবা, গ্যাস মিশ্রণের ক্ষেত্রে কোলয়েড সিস্টেম সম্ভব নয় কেন?
কোলয়েডীয় দ্রবণে বিস্তৃত দশার কণাগুলি বিস্তার মাধ্যমে ইতস্তত বিক্ষিপ্ত গতিশীল অবস্থায় থেকে দ্বি-দশাবিশিষ্ট অসমসত্ত্ব মিশ্রণ উৎপন্ন করে। পদার্থ কঠিন, তরল ও গ্যাসীয় এই তিন অবস্থাতেই বিস্তার মাধ্যম ও বিস্তৃত দশা হিসেবে কাজ করতে পারে।
কিন্তু বিস্তৃত দশা ও বিস্তার মাধ্যম দুটিই গ্যাসীয় এমন কোলয়েড সিস্টেম পাওয়া সম্ভব নয়। কারণ দুটি গ্যাসকে পরস্পরের সঙ্গে মিশ্রিত করলে, মিশ্রণে গ্যাসের কণাগুলি স্বতন্ত্রভাবে ও সমান দ্রুততায় বিচরণ করে। এক্ষেত্রে কোনো গ্যাসের কণাগুলি পরস্পরের সঙ্গে অণুপুঞ্জ (Cluster) গঠন করে না। ফলে, দুটি গ্যাস যে-কোনো অনুপাতে মিশ্রিত হয়ে সর্বদা সমসত্ত্ব মিশ্রণ উৎপন্ন করে, কোলয়েডীয় দ্বি-দশাবিশিষ্ট অসমসত্ত্ব মিশ্রণ উৎপন্ন করে না।
দুধ একটি ইমালসন – ব্যাখ্যা করো।
ইমালসন হল তরল বিস্তার মাধ্যমে অপর একটি তরল বিস্তৃত দশার কোলয়েডীয় দ্রবণ। এক্ষেত্রে যে তরলটি বেশি পরিমাণে থাকে সেটি বিস্তার মাধ্যম এবং যে তরলটি ক্ষুদ্র ক্ষুদ্র কণার আকারে বিস্তার মাধ্যমে ছড়িয়ে থাকে, সেটি হল বিস্তৃত দশা। দুধ একটি ইমালসন কারণ – দুধে বিস্তার মাধ্যম হল জল। এর মধ্যে তরল স্নেহজাতীয় পদার্থ বিস্তৃত দশারূপে ক্ষুদ্র ক্ষুদ্র বিন্দুর আকারে ছড়িয়ে পড়ে কোলয়েডীয় দ্রবণ উৎপন্ন করে। এই তরল স্নেহজাতীয় কণাগুলির ব্যাস 10-5 থেকে 10-4 সেমি বা 1 – 10 µm হয়।
এছাড়াও দুধের তড়িৎ পরিবাহিতা পরিমাপ করে দুধ যে একটি ইমালসন তা বোঝা যায়। প্রথমে দুধের তড়িৎ পরিবাহিতা পরিমাপ করা হয়। তারপর তাতে সামান্য NaCl যোগ করে, আবার তড়িৎ পরিবাহিতা পরিমাপ করলে যদি পরিবাহিতার মান অনেক বেড়ে যায় তবে বুঝতে হবে যে এটি একটি ইমালসন এবং এটি জলে তেল জাতীয় প্রকৃতির ইমালসন।
খাদ্যলবণ জলে দ্রবীভূত হয় অথচ চকের সূক্ষ্ম গুঁড়ো জলে দ্রবীভূত হয় না কেন?
কোনো দ্রাবকে দ্রাব দ্রবীভূত হবে কি না তা দ্রাব কণার আকারের ওপর নির্ভর করে। দ্রাব কণার ব্যাস 10-8 সেমি থেকে 10-7 সেমির মধ্যে হলে তা দ্রাবকে দ্রবীভূত হয়। খাদ্যলবণের কণাগুলির ব্যাস 10-8 সেমি বা তারও কম হবার কারণে দ্রাবক অণুর মাঝে ফাঁকা স্থানে জায়গা করে নেয়। ফলে, লবণ দ্রবীভূত হয়ে যায়। কিন্তু চকের মিহি কণার ব্যাস 10-4 সেমি বা তার থেকে বেশি হবার কারণে চকের গুঁড়ো জলের অণুর মাঝের ফাঁকা স্থানে প্রবেশ করতে পারে না। তাই চকের গুঁড়ো জলে দ্রবীভূত হয় না।
প্রোটিন, DNA, স্টার্চ ইত্যাদি জলে দ্রবীভূত করলে কোলয়েডীয় দ্রবণ সৃষ্টি হয় কেন?
প্রোটিন, DNA, স্টার্চ ইত্যাদি জৈব পলিমারগুলির অণু বৃহদাকার হয় (Macro molecule)। এই অণুগুলির আকার প্রকৃত দ্রবণের দ্রাব কণাগুলির আকার (ব্যাস ≥ 10-8 cm) অপেক্ষা বেশ বড়ো হয়। এই অণু কণাগুলিকে জলে যুক্ত করলে এরা জলে দ্রাবকায়িত হতে পারে না, কারণ – জলের অণুর আন্তরাণবিক ফাঁক এদের আকারের চেয়ে ছোটো হয়। ফলে, অণুগুলি জলে দ্রবীভূত হয়ে প্রকৃত দ্রবণও গঠন করে না। আবার অণুগুলির সঙ্গে জলের আকর্ষণ বল (হাইড্রোফিলিক) উপস্থিত থাকায় অণুগুলি দ্রবণ থেকে পৃথক হয়ে থিতিয়ে পড়ে না। এই অণুগুলির কণার ব্যাস প্রকৃত দ্রবণের দ্রাব কণা ও প্রলম্বন কণার ব্যাসের মাঝামাঝি হওয়ায় (10-5 – 10-7 cm) এরা বহুসংখ্যক জলের অণুকে অপসারিত করে জলে দ্রবীভূত দ্বি-দশাবিশিষ্ট অসমসত্ত্ব মিশ্রণ অর্থাৎ, কোলয়েডীয় দ্রবণ সৃষ্টি করে।
নদীর ঘোলা জল বালতিতে অনেকক্ষণ রেখে দিলেও তা কখনও স্বচ্ছ হয় না কেন?
নদীর ঘোলা জল বালতিতে অনেকক্ষণ রেখে দিলে তা কখনও স্বচ্ছ হয় না, কারণ – জলে দ্রবীভূত বা প্রলম্বিত অবস্থায় কাদা-পলিমাটি ও অন্যান্য অপদ্রব্য মিশে থাকে। কাদামাটি, পলিমাটি প্রভৃতি কোলয়েডীয় কণার আকারে জলে সমসত্ত্বভাবে মিশে থাকে এবং কখনও থিতিয়ে পড়ে না। ফলে, নদীর জল অনেকক্ষণ রেখে দিলেও তা স্বচ্ছ হয় না।
কেটে গেলে রক্তপাত বন্ধ করতে ফটকিরি ব্যবহার করা হয় কেন?
মানুষের রক্ত হল একটি কোলয়েডীয় দ্রবণ, যাতে জলীয় বিস্তার মাধ্যমে ঋণাত্মক আধানযুক্ত কঠিন হিমোগ্লোবিন কণা বিস্তৃত থাকে। ফটকিরিতে [K2SO4⋅Al2(SO2)3⋅24H2O] উপস্থিত Al3+ আয়ন ও K+ আয়ন দ্বারা রক্তের বিপরীত আধান প্রশমিত হয়, অর্থাৎ, আধানহীন হয়। ফলে, রক্ত তঞ্চিত হয়ে জমাটবন্ধ হয় এবং রক্তপাত বন্ধ হয়ে যায়।
কোলয়েডীয় দ্রবণ ও প্রলম্বনের মধ্যে কোনটি অপেক্ষাকৃত অস্থায়ী এবং কেন?
অথবা, কোলয়েডের কণাগুলি থিতিয়ে পড়ে না, কিন্তু প্রলম্বনের কণাগুলি থিতিয়ে পড়ে কেন?
কোলয়েডীয় দ্রবণ অপেক্ষা প্রলম্বন অস্থায়ী কারণ – প্রলম্বনের কণাগুলির ক্ষেত্রে ব্রাউনীয় গতি না থাকায় স্থির অবস্থায় পাত্রটিকে রেখে দিলে আকারে বড়ো প্রলম্বন কণাগুলি পরস্পরের কাছে আসে এবং জোটবদ্ধ হয়। আবার প্রলম্বনের কণাগুলি আধানযুক্ত নয় বলে তাদের নিজেদের মধ্যে কোনো বিকর্ষণ বলও কাজ করে না। ফলে, জোটবদ্ধ ভারী প্রলম্বন কণাগুলি অভিকর্ষ বলের প্রভাবে দ্রবণ থেকে পৃথক হয়ে পাত্রের তলায় থিতিয়ে পড়ে। অপরদিকে, ব্রাউনীয় গতির জন্য কোলয়েডীয় দ্রবণের কণাগুলি সর্বদা ইতস্তত বিচরণশীল হওয়ায় পরস্পরের কাছে আসার সম্ভাবনা খুবই কম থাকে। আবার কোলয়েড কণাগুলি নির্দিষ্ট আধানযুক্ত হওয়ায়, কণাগুলির মধ্যে সর্বদাই একটি বিকর্ষণ বল কাজ করে। ফলে, কণাগুলি জোটবন্ধ হয়ে থিতিয়ে পড়তে পারে না। তাই কোলয়েড দ্রবণ অপেক্ষাকৃত বেশি স্থায়ী।
সাধারণ প্রলম্বনের ক্ষেত্রে ব্রাউনীয় গতি দেখা যায় না কেন?
সাধারণ প্রলম্বনের কণাগুলির আকার বড়ো (> 10-5 cm) হওয়ায় বিস্তার মাধ্যমের অণুর সঙ্গে এদের সংঘর্ষ সুষম হয়। অর্থাৎ, বিস্তার মাধ্যমের কণাগুলি প্রলম্বনের কণার ওপর কোনো একটি দিকে যে ঘাত প্রয়োগ করে তার অপর দিকের কণাগুলির দ্বারা প্রযুক্ত ঘাতের প্রায় সমান ও বিপরীত হয়। ফলে, প্রলম্বনের কণাগুলি দ্রুত ধাবিত হয় না এবং ব্রাউনীয় গতি দেখা যায় না।
জ্বলন্ত সিগারেটের ধোঁয়া অনেক সময় হালকা নীল রঙের দেখায় কেন?
সিগারেটের ধোঁয়া প্রকৃতপক্ষে কঠিন এরোসল। যেখানে কার্বনের সূক্ষ্ম কণা (বিস্তৃত দশা) বায়ুতে (বিস্তার মাধ্যম) ভাসমান অবস্থায় থাকে। সিগারেটের ধোঁয়াকে আলোর গতিপথের সাপেক্ষে সোজাসুজি দেখলে নীল বর্ণের দেখায়। প্রকৃতপক্ষে, এক্ষেত্রে বিস্তৃত দশার কণার দ্বারা আলোকরশ্মির বিচ্ছুরণের জন্য (টিন্ডাল এফেক্ট) এইরূপ ঘটনা ঘটে।
দ্রাব্যতার সংজ্ঞায় দ্রাবকের পরিমাণ নির্দিষ্ট রাখা হয় কেন?
দ্রাব্যতার সংজ্ঞায় দ্রাবকের পরিমাণ সর্বদা স্থির বা নির্দিষ্ট রাখা হয়। কারণ – নির্দিষ্ট উষ্ণতায় কোনো সম্পৃক্ত দ্রবণ প্রস্তুত করতে কত গ্রাম দ্রাবের প্রয়োজন হয় তা নির্ভর করে দ্রাবকের পরিমাণের ওপর। দ্রাবকের পরিমাণ যদি বেশি হয় তবে নির্দিষ্ট উয়তায় সম্পৃক্ত দ্রবণ তৈরি করতে বেশি দ্রাব প্রয়োজন। আবার দ্রাবকের পরিমাণ যদি কম হয়, তবে নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণ তৈরি করতে কম দ্রাব প্রয়োজন হবে। সুতরাং, দ্রাবকের পরিমাণ নির্দিষ্ট করে বলা না থাকলে কোনো নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণ প্রস্তুত করতে কত পরিমাণ দ্রাব লাগবে, তা নির্ধারণ করা যায় না। তাই দ্রাব্যতার সংজ্ঞায় দ্রাবকের পরিমাণ (100 g দ্রাবক) নির্দিষ্ট রাখা হয়।
দ্রাব্যতার সংগ্রায় নির্দিষ্ট উষ্ণতার উল্লেখ থাকে কেন?
কোনো পদার্থের দ্রাব্যতা একটি নির্দিষ্ট উষ্ণতায় নির্দিষ্ট। কোনো নির্দিষ্ট দ্রাবকে কোনো নির্দিষ্ট দ্রাবের দ্রাব্যতা উষ্ণতার সঙ্গে সঙ্গে পরিবর্তিত হয়। উষ্ণতা বাড়ালে কিছু কিছু দ্রাবের দ্রাব্যতা বাড়ে, আবার কারোর দ্রাব্যতা কমে। দেখা গেছে, 100 গ্রাম দ্রাবককে বিভিন্ন উষ্ণতায় সম্পৃক্ত করতে একই দ্রাবের ভিন্ন ভিন্ন পরিমাণ প্রয়োজন হয়। তাই দ্রাব্যতার সংজ্ঞায় নির্দিষ্ট উষ্ণতার উল্লেখ প্রয়োজন। যেমন – 30°C উষ্ণতায় জলে KNO3 -এর দ্রাব্যতা 44, আবার 40°C উষ্ণতায় জলে KNO3 -এর দ্রাব্যতা 65। অর্থাৎ, উষ্ণতার পরিবর্তনে KNO3 -এর দ্রাব্যতারও পরিবর্তন হয়।
এক কাপ জলে চিনির একটি সম্পৃক্ত দ্রবণ কলকাতায় তৈরি করা হল। এটিকে দার্জিলিং -এ নিয়ে গেলে দ্রবণের দ্রাব্যতার কীরূপ পরিবর্তন হতে পারে?
কোনো পদার্থের দ্রাব্যতা উষ্ণতার ওপর নির্ভরশীল। কলকাতা এবং দার্জিলিং -এর তাপমাত্রা একই সময়ে দুটি জায়গায় ভিন্ন হয়। ফলে, জলে চিনির দ্রাব্যতা কলকাতা ও দার্জিলিং -এ ভিন্ন হবে, কখনোই এক হবে না। সাধারণত দার্জিলিং -এর স্বাভাবিক তাপমাত্রা কলকাতা অপেক্ষা কম। তাই এক কাপ জলে চিনির একটি সম্পৃক্ত দ্রবণকে কলকাতা থেকে দার্জিলিং -এ নিয়ে গেলে উষ্ণতা হ্রাসের কারণে চিনির দ্রাব্যতা হ্রাস পাওয়ায় দ্রবণ থেকে অতিরিক্ত চিনি অধঃক্ষিপ্ত হয়।
জলকে গরম করলে বুদ্বুদ সৃষ্টি হয় কেন?
সাধারণ উষ্ণতায় জলের মধ্যে কিছু পরিমাণ বায়ু দ্রবীভূত অবস্থায় থাকে। তরল পদার্থে গ্যাসের দ্রাব্যতা উষ্ণতা বৃদ্ধির সঙ্গে হ্রাস পায়। তাই জলকে গরম করলে গ্যাসীয় পদার্থের দ্রাব্যতা কমে যায়। ফলে, জলের মধ্যে থাকা বায়ু বুদ্বুদ আকারে বাইরে বেরিয়ে আসে।
উষ্ণতা বাড়ালে গ্লবার লবণের দ্রাব্যতা প্রথমে বেড়ে পরে কমে কেন?
উষ্ণতা বাড়ালে 0°C থেকে 32.38°C পর্যন্ত গ্লবার লবণের দ্রাব্যতা প্রথমে বৃদ্ধি পায়। কিন্তু 32.38°C উষ্ণতার উপরে এর দ্রাব্যতা ক্রমশ হ্রাস পেতে থাকে। কারণ – ওই উষ্ণতার উপরে গ্লবার লবণের অণুতে উপস্থিত দশ অণু কেলাসজলের মধ্যে নয় অণু কেলাসজল কেলাস গঠন ভেঙে বেরিয়ে যায়। ফলে, গ্লবার লবণ Na2SO4⋅H2O -তে পরিণত হয়। এই কেলাসের দ্রাব্যতা অপেক্ষাকৃত কম হবার কারণে এর কিছু অংশ দ্রবণ থেকে পৃথক হয়ে যায়।
কলিচুন গরম জলের চেয়ে ঠান্ডা জলে বেশি দ্রবীভূত হয় কেন?
কলিচুনের দ্রাব্যতা উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে হ্রাস পায়। গরম জলের উষ্ণতা ঠান্ডা জলের উষ্ণতার চেয়ে বেশি হওয়ায়, গরম জলে কলিচুনের দ্রাব্যতা কম। কিন্তু ঠান্ডা জলে দ্রাব্যতা বেশি। তাই কলিচুন গরম জলের চেয়ে ঠান্ডা জলে বেশি দ্রবীভূত হয়।
একটি সোডা ওয়াটারের বোতলের ছিপি খোলা হলে দ্রাব্যতার কী পরিবর্তন লক্ষ করা যায় এবং কেন?
সোডা ওয়াটার প্রকৃতপক্ষে জলে কার্বন ডাইঅক্সাইডের দ্রবণ। গ্যাসের ক্ষেত্রে তরলে দ্রাব্যতা চাপ বাড়ালে বৃদ্ধি পায়। তাই উচ্চচাপে কার্বন ডাইঅক্সাইড গ্যাসকে জলে দ্রবীভূত করা হয় এই কারণে সোডা ওয়াটারের বোতলের মুখ খুললে উচ্চচাপে থাকা অতিরিক্ত CO2 গ্যাস বাইরে বেরিয়ে আসতে চায়। তাই বোতলের মুখ খুললে ফেনা বের হয়।
একটি চিনির দ্রবণ সম্পৃক্ত কি না তা চোখে দেখে বুঝবে কীভাবে?
চিনির একটি দ্রবণ সম্পৃক্ত কি না তা সহজে বোঝার জন্য সুতো দিয়ে একটি বৃহৎ, ঘনকাকার চিনির কেলাসকে বেঁধে নমুনা দ্রবণের মধ্যে ঝুলিয়ে দেওয়া হল এবং কিছু সময় ধরে ভালো করে পর্যবেক্ষণ করা হল।
চিনির কেলাসটি যদি ক্রমশ জলের মধ্যে দ্রবীভূত হয়ে গিয়ে আকারে ছোটো হতে থাকে তবে বুঝতে হবে দ্রবণটি অসম্পৃক্ত। কিন্তু কিছু সময় পরেও যদি চিনির কেলাসটির আকারের কোনোরূপ পরিবর্তন না হয় তবে বুঝতে হবে চিনির দ্রবণটি সম্পৃক্ত।
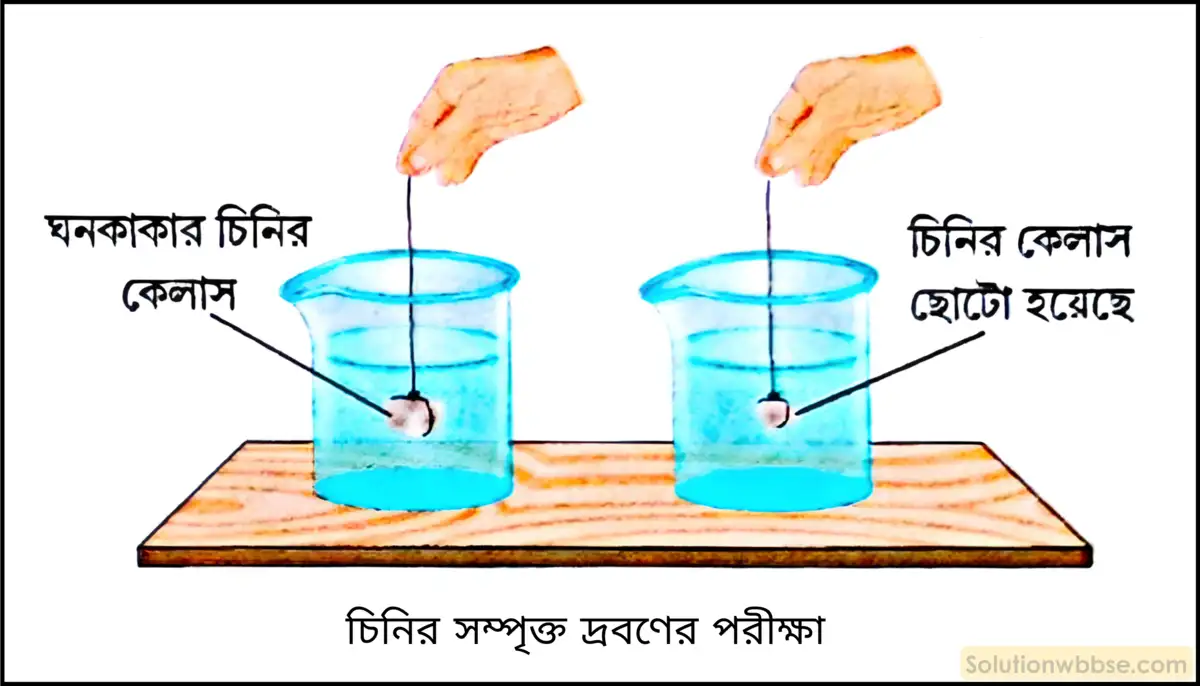
ঘরের উষ্ণতায় চিনির সম্পৃক্ত দ্রবণে আরও চিনি যোগ করে নাড়তে থাকলে কী হবে? এখন ওই দ্রবণের তাপমাত্রা বাড়ালে কী হবে?
ঘরের উষ্ণতায় চিনির সম্পৃক্ত দ্রবণে আরও চিনি যোগ করে নাড়তে থাকলে, চিনি দ্রবীভূত না হয়ে পাত্রের তলায় থিতিয়ে পড়বে এবং দ্রবণের ঘনত্বের কোনো পরিবর্তন হবে না।
চিনির সম্পৃক্ত দ্রবণের তাপমাত্রা বাড়ালে দ্রবণে দ্রাবকের (অর্থাৎ, জলের) দ্রাব (অর্থাৎ, চিনি) গ্রহণ করার ক্ষমতা বেড়ে যায় এবং উচ্চ তাপমাত্রায় এই সম্পৃক্ত দ্রবণ অসম্পৃক্ত হয়ে পড়ে। ফলে, দ্রবণের তাপমাত্রা বাড়ালে বাড়তি চিনি ক্রমশ দ্রবীভূত হতে থাকবে এবং দ্রবণের ঘনত্ব ততক্ষণ বৃদ্ধি পাবে, যতক্ষণ না পর্যন্ত ওই উচ্চ উষ্ণতায় দ্রবণটি সম্পৃক্ত হয়ে যায়।
60°C তাপমাত্রায় পটাশিয়াম নাইট্রেটের একটি সম্পৃক্ত দ্রবণকে 25°C তাপমাত্রায় আনলে দ্রবণটি কি সম্পৃক্ত থাকবে? সম্ভাব্য পর্যবেক্ষণ কী হবে? ব্যাখ্যা করো।
60°C তাপমাত্রায় পটাশিয়াম নাইট্রেটের (KNO3) একটি সম্পৃক্ত জলীয় দ্রবণকে 25°C তাপমাত্রায় অর্থাৎ, ঘরের উষ্ণতায় আনলে দ্রবণটি তার মধ্যে অতিরিক্ত দ্রাবকে কিছু সময়ের জন্য দ্রবীভূত করে রাখে, অর্থাৎ, দ্রবণটি অতিপৃক্ত দ্রবণে পরিণত হয়। কিন্তু এটি দ্রবণটির একটি অস্থায়ী অবস্থা। অবশেষে অতিরিক্ত KNO3 (দ্রাব) কেলাসরূপে অধঃক্ষিপ্ত হয় এবং দ্রবণটি 25°C উষ্ণতায় সম্পৃক্ততা লাভ করে। কারণ উষ্ণতা হ্রাস করলে KNO3 -এর দ্রাব্যতা হ্রাস পায়। ফলে, দ্রবণের উষ্ণতা 60°C থেকে নামিয়ে 25°C -এ নিয়ে আসলে KNO3 -এর দ্রাব্যতা হ্রাস পাওয়ায় দ্রবণটি ওই উষ্ণতায় (25°C) অপেক্ষাকৃত কম পরিমাণ KNO3 দ্বারা সম্পৃক্ততা লাভ করে। ফলে, অতিরিক্ত পটাশিয়াম নাইট্রেট দ্রবণ থেকে পৃথক হয়ে পাত্রের তলায় অধঃক্ষিপ্ত হয়।
গ্লবার লবণের সম্পৃক্ত দ্রবণকে উত্তপ্ত করে অসম্পৃক্ত দ্রবণ প্রস্তুত করা যায় না কেন?
গ্লবার লবণের (Na2SO4⋅10H2O) দ্রাব্যতা উষ্ণতা বৃদ্ধিতে প্রথমে দ্রুত হারে বৃদ্ধি পায় এবং পরে হ্রাস পায় (32.38°C -এর পর)। লবণের এইরূপ ধর্মকে ব্যতিক্রান্ত দ্রাব্যতা (Anomalous Solubility) বলে। প্রকৃতপক্ষে, 32.38°C উষ্ণতার উপরে গ্লবার লবণের রাসায়নিক পরিবর্তন ঘটে, অর্থাৎ, সোদক সোডিয়াম থায়োসালফেটের কেলাস গঠন ভেঙে যায় এবং অনার্দ্র Na2SO4 -এ পরিণত হয়। গ্লবার লবণের এই ব্যতিক্রমী ধর্মের জন্য এর সম্পৃক্ত দ্রবণকে উত্তপ্ত করা হলেও 32.38°C -এর ঊর্ধ্বে এর দ্রাব্যতা হ্রাস পায়। ফলে, উচ্চ উষ্ণতায় দ্রবণটিকে অসম্পৃক্ত করা যায় না।
বর্ষাকালে বাণিজ্যিক খাদ্যলবণ ভিজে থাকার কারণ কী?
বাণিজ্যিক খাদ্যলবণের (NaCl) মধ্যে অশুদ্ধি হিসেবে ম্যাগনেশিয়াম ক্লোরাইড (MgCl2), ক্যালশিয়াম ক্লোরাইড (CaCl2) প্রভৃতি উদ্গ্রাহী পদার্থ মিশে থাকে। আবার, বর্ষাকালে বাতাসে জলীয় বাষ্পের পরিমাণও বেশি থাকে। MgCl2, CaCl2 প্রভৃতি এই ধরনের পদার্থের কেলাসের অভ্যন্তরীণ বাষ্পচাপ সাধারণ উষ্ণতায় বাতাসের জলীয় বাষ্পের চাপের চেয়ে কম হওয়ায় এরা বাতাস থেকে জলীয় বাষ্প শোষণ করে এবং ওই শোষিত জলে দ্রবীভূত হয়ে দ্রবণে পরিণত হয়। ফলে, বর্ষাকালে খাদ্যলবণকে ভিজে দেখায়।
কাপড় কাচার সোডা (Na2CO3⋅10H2O) বায়ুতে রাখলে স্বচ্ছতা হারিয়ে ফেলে কিন্তু দ্রবণ উৎপন্ন করে না, ক্যালশিয়াম ক্লোরাইড (CaCl2) বায়ুতে রাখলে গলে যায় এবং শেষ পর্যন্ত দ্রবীভূত হয়ে যায় কেন?
কাপড় কাচার সোডা বা সোদক সোডিয়াম কার্বনেট (Na2CO3⋅10H2O) একটি উদ্ত্যাগী পদার্থ। সোদক সোডিয়াম কার্বনেটের স্বচ্ছ কেলাসকে বায়ুতে রেখে দিলে, সোদক কেলাসের অভ্যন্তরীণ বাষ্পচাপ সাধারণ উষ্ণতায় বাতাসের জলীয় বাষ্পের চাপের চেয়ে বেশি হওয়ার কারণে এর 9 অণু কেলাসজল বাষ্পাকারে বেরিয়ে যায়। ফলে, এর কেলাস গঠন ভেঙে যায় এবং কেলাসগুলি স্বচ্ছতা হারিয়ে অস্বচ্ছ অনিয়তাকার সাদা গুঁড়োয় পরিণত হয়।
অপরপক্ষে অনার্স ক্যালশিয়াম ক্লোরাইড (CaCl2) একটি উদ্গ্রাহী পদার্থ। এর অণু মধ্যস্থ বাষ্পচাপ (সম্পৃক্ত) সাধারণ বায়ুমণ্ডলীয় বাষ্পচাপ অপেক্ষা অনেক কম। তাই খোলা বাতাসে রাখলে বায়ুমণ্ডল থেকে জলীয় বাষ্প শোষণ করে, এবং যতক্ষণ না পর্যন্ত এর সম্পৃক্ত বাষ্পচাপ, বায়ুমণ্ডলীয় বাষ্পচাপের সমান হয় ততক্ষণ জলীয় বাষ্প শোষণ করতে থাকে। ফলে, এক সময় ওই শোষিত জলের মধ্যে দ্রবীভূত হয়ে যায়।
দুটি দ্রবণ মেশালে ব্যাপন ঘটে কেন?
ভিন্ন গাঢ়ত্ব বিশিষ্ট দুটি দ্রবণ মেশালে বেশি গাঢ়ত্বের দ্রবণ থেকে কম গাঢ়ত্বের দ্রবণে দ্রাবের কণাগুলির সমান ভাবে ছড়িয়ে পড়ার ঘটনাকে ব্যাপন বলে। দ্রাবের কণাগুলির অবিরাম গতিই হল ব্যাপনের কারণ। দ্রবণে দ্রাব ও দ্রাবক উভয় কণাগুলি সর্বদাই গতিশীল। দ্রাবের অণুগুলি নিজেদের মধ্যে ও দ্রাবক অণুগুলির সঙ্গে সংঘর্ষে লিপ্ত হয়। ফলে, তাদের গতির অভিমুখ পরিবর্তিত হয়। দ্রবণে দ্রাব ও দ্রাবক কণাদের এরকম অবিশ্রান্ত ও বিশৃঙ্খল গতির জন্য যখন দুটি দ্রবণ মেশানো হয় তখন দ্রাবের অণুগুলি উচ্চ গাঢ়ত্বের দিক থেকে নিম্ন গাঢ়ত্বের দিকে চলে গিয়ে একটি সমসত্ত্ব মিশ্রণ তৈরির চেষ্টা করে। তাই দুটি দ্রবণ মেশালে দ্রাবক ও দ্রাব অণুদের গতির জন্যই ব্যাপন সংঘটিত হয়, যতক্ষণ না পর্যন্ত দুটি দ্রবণের মধ্যে ঘনত্বের সমতা প্রতিষ্ঠিত হয়।
রং ও বার্নিশের দ্রাবক হিসেবে উদ্বায়ী তরল ব্যবহার করা হয় কেন?
ঘরের দেয়াল, আসবাবপত্র, অন্যান্য বিভিন্ন গৃহস্থালির দ্রব্যের সৌন্দর্যায়নে আমরা বিভিন্ন রং ও বার্নিশ ব্যবহার করি। এই রং ও বার্নিশের দ্রাবক হিসেবে উদ্বায়ী তরল (যেমন – অ্যাসিটোন, ইথাইল অ্যালকোহল ইত্যাদি) ব্যবহার করা হয়, কারণ –
- ইথাইল অ্যালকোহল, অ্যাসিটোন, কেরোসিন, ইথার ইত্যাদি জৈব দ্রাবকের ঘনত্ব কম হয়। ফলে, রঙে উপস্থিত বিভিন্ন রঞ্জক পদার্থ, পলিমার সহজেই এতে দ্রবীভূত হয়ে যায় এবং রঙের সান্দ্রতা বজায় থাকে।
- কোনো বস্তুর ওপর রং বা বার্নিশ করার সময় উদ্বায়ী দ্রাবক ব্যবহার করলে দ্রাবক দ্রুত বাষ্পীভূত হয়। ফলে, রং বা বার্নিশ দ্রুত শুকিয়ে গিয়ে বস্তুর ওপর মসৃণ আস্তরণ সৃষ্টি করে।
- উদ্বায়ী দ্রাবকে দ্রবীভূত রং স্প্রে করে ব্যবহার করলে নির্দিষ্ট পরমাণু তল ঢাকতে কম পরিমাণ রং -এর প্রয়োজন হয়। ফলে, রং করার খরচ অনেক কমে যায়।
পার্থক্যধর্মী প্রশ্নোত্তর
প্রকৃত দ্রবণ, কোলয়েডীয় দ্রবণ ও প্রলম্বনের মধ্যে পার্থক্যগুলি লেখো।
প্রকৃত দ্রবণ, কোলয়েডীয় দ্রবণ ও প্রলম্বনের মধ্যে পার্থক্যগুলি হল –
| বিষয় | প্রকৃত দ্রবণ (True Solution) | কোলয়েডীয় দ্রবণ (Colloidal Solution) | প্রলম্বন (Suspension) |
| দ্রবণের প্রকৃতি | প্রকৃত দ্রবণ সমসত্ত্ব ও স্বচ্ছ। | এই দ্রবণ অসমসত্ত্ব ও অস্বচ্ছ। | প্রলম্বন অসমসত্ত্ব ও অস্বচ্ছ। |
| দ্রাব কণার ব্যাস | দ্রাব কণার ব্যাস ≤ 10-8 সেমি। | দ্রাব কণার ব্যাস 10-5 – 10-7 সেমি। | দ্রাব কণার ব্যাস 10-5 সেমি -এর বেশি। |
| দ্রবণের স্থায়িত্ব | কণাগুলি কখনোই থিতিয়ে পড়ে না। অর্থাৎ, দ্রবণটি স্থায়ী প্রকৃতির হয়। | উত্তপ্ত করলে বা উপযুক্ত তড়িদবিশ্লেষ্য পদার্থ যোগ করলে কণাগুলি থিতিয়ে পড়ে। | অভিকর্ষ বলের প্রভাবে কণাগুলি থিতিয়ে পড়ে। অর্থাৎ, দ্রবণটি অস্থায়ী প্রকৃতির হয়। |
| কণাগুলির ভেদ্যতা | ফিলটার করা যায় না, কারণ – সাধারণ ফিলটার কাগজ ও পার্চমেন্ট কাগজের মধ্যে দিয়ে সহজেই অতিক্রম করে। | সাধারণ ফিলটার কাগজের মধ্যে দিয়ে যেতে পারে, কিন্তু পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না। | সাধারণ ফিলটার কাগজ বা পার্চমেন্ট কাগজের মধ্যে দিয়ে যেতে পারে না। |
| কণার আধান | আণবিক বা আয়নিত অবস্থায় থাকে। | কণাগুলি আধানগ্রস্ত। | কণাগুলি প্রশম। |
| ব্রাউনীয় গতি | ব্রাউনীয় গতি প্রদর্শন করে না। | ব্রাউনীয় গতি প্রদর্শন করে। | কোনো কোনো ক্ষেত্রে দেখা যায়। |
| টিন্ডাল প্রভাব | টিন্ডাল প্রভাব দেখা যায় না। | টিন্ডাল প্রভাব দেখা যায়। | টিন্ডাল প্রভাব দেখা যায়। |
তেলে-জল জাতীয় ইমালসন ও জলে-তেল জাতীয় ইমালসনের পার্থক্যগুলি লেখো।
তেলে-জল জাতীয় ইমালসন ও জলে-তেল জাতীয় ইমালসনের পার্থক্যগুলি হল –
| বিষয় | তেলে-জল জাতীয় ইমালসন | জলে-তেল জাতীয় ইমালসন |
| বিস্তার মাধ্যম ও বিস্তৃত দশা | বিস্তার মাধ্যম তেল, বিস্তৃত দশা জল। এক্ষেত্রে তেল বেশি পরিমাণে থাকে ও জল কম থাকে। | বিস্তার মাধ্যম জল, বিস্তৃত দশা তেল। এক্ষেত্রে জল বেশি পরিমাণে থাকে ও তেল কম থাকে। |
| জল যোগ করার প্রভাব | জল যোগ করে ঝাঁকালে একটি পৃথক স্তর গঠিত হয়। | জল যোগ করে ঝাঁকালে কোনো পৃথক স্তর গঠিত হয় না। |
| তেলে দ্রাব্য রঞ্জক পদার্থ যোগ করার প্রভাব | পুরো দ্রবণটি রঙিন হয়ে যায়। | মাইক্রোস্কোপে দেখলে দ্রবণটিতে রঙিন বিন্দুর উপস্থিতি দেখা যায়। |
| জলে দ্রাব্য রঞ্জক পদার্থ যোগ করার প্রভাব | মাইক্রোস্কোপে দেখলে বর্ণহীন দ্রবণে রঙিন বিন্দু দেখা যায়। | পুরো ইমালসনটি রঙিন হয়ে যায়। |
| সান্দ্রতা ও তড়িৎ পরিবাহিতা | এই প্রকার ইমালসনের সান্দ্রতা বেশি এবং তড়িৎ পরিবাহিতা কম হয়। | এই প্রকার ইমালসনের সান্দ্রতা কম এবং তড়িৎ পরিবাহিতা বেশি হয়। |
সম্পৃক্ত দ্রবণ (Saturated Solution) ও অসম্পৃক্ত দ্রবণের (Unsaturated Solution) মধ্যে পার্থক্য লেখো।
সম্পৃক্ত দ্রবণ (Saturated Solution) ও অসম্পৃক্ত দ্রবণের (Unsaturated Solution) মধ্যে পার্থক্যগুলি হল –
| বিষয় | সম্পৃক্ত দ্রবণ (Saturated Solution) | অসম্পৃক্ত দ্রবণ (Unsaturated Solution) |
| দ্রবণে দ্রাবের পরিমাণ | নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণের নির্দিষ্ট পরিমাণ দ্রাবকে সর্বোচ্চ যত পরিমাণ দ্রাব দ্রবীভূত হতে পারে তা দ্রবীভূত থাকে। | নির্দিষ্ট উষ্ণতায় অসম্পৃক্ত দ্রবণের নির্দিষ্ট পরিমাণ দ্রাবকে সম্পৃক্ত দ্রবণের তুলনায় কম পরিমাণ দ্রাব দ্রবীভূত থাকে। |
| অতিরিক্ত দ্রাবের দ্রবীভবন | নির্দিষ্ট উষ্ণতায় কোনো সম্পৃক্ত দ্রবণে আরও দ্রাব যোগ করলে তা দ্রবীভূত না হয়ে থিতিয়ে পড়ে। | নির্দিষ্ট উষ্ণতায় অসম্পৃক্ত দ্রবণে আরও দ্রাব যোগ করলে তা আংশিক বা সম্পূর্ণভাবে দ্রবীভূত হয়। |
| ঘনত্বের পরিবর্তন | দ্রাব যোগ করলেও সম্পৃক্ত দ্রবণের ঘনত্বের পরিবর্তন হয় না। | দ্রাব যোগ করলে অসম্পৃক্ত দ্রবণের ঘনত্বের বৃদ্ধি ঘটে। |
সম্পৃক্ত দ্রবণ (Saturated Solution) ও অতিপৃক্ত দ্রবণের (Supersaturated Solution) মধ্যে পার্থক্য লেখো।
সম্পৃক্ত দ্রবণ (Saturated Solution) ও অতিপৃক্ত দ্রবণের (Supersaturated Solution) মধ্যে পার্থক্যগুলি হল –
| বিষয় | সম্পৃক্ত দ্রবণ (Saturated Solution) | অতিপৃক্ত দ্রবণ (Supersaturated Solution) |
| দ্রবণে দ্রাবের পরিমাণ | সম্পৃক্ত দ্রবণে নির্দিষ্ট উষ্ণতায় নির্দিষ্ট পরিমাণ দ্রাবকে সর্বোচ্চ যত পরিমাণ দ্রাব দ্রবীভূত হতে পারে তা দ্রবীভূত থাকে। | অতিপৃক্ত দ্রবণে নির্দিষ্ট উষ্ণতায় নির্দিষ্ট পরিমাণ দ্রাবকে সর্বোচ্চ যত পরিমাণ দ্রাব দ্রবীভূত থাকতে পারে তার চেয়ে বেশি পরিমাণ দ্রাব দ্রবীভূত থাকে। |
| স্থায়িত্ব | সম্পৃক্ত দ্রবণ স্থায়ী। | অতিপৃক্ত দ্রবণ অস্থায়ী। |
| অতিরিক্ত দ্রাবের দ্রবীভবন | সম্পৃক্ত দ্রবণে আরও দ্রাব যোগ করলে দ্রাব দ্রবীভূত না হয়ে থিতিয়ে পড়ে। | অতিপৃক্ত দ্রবণে আরও দ্রাব যোগ করলে দ্রাব দ্রবীভূত না হয়ে দ্রবণ থেকে আরও কিছু পরিমাণ দ্রাব পৃথক হয়। |
| ঘনত্বের পরিবর্তন | দ্রাব যোগ করলেও দ্রবণের ঘনত্বের কোনো পরিবর্তন হয় না। | দ্রাব যোগ করলে দ্রবণের ঘনত্ব হ্রাস পায়। |
| প্রস্তুতি | সহজ উপায়ে প্রস্তুত করা সম্ভব। | সহজ উপায়ে প্রস্তুত করা যায় না। |
অসম্পৃক্ত দ্রবণ (Unsaturated Solution) ও অতিপৃক্ত দ্রবণের (Supersaturated Solution) মধ্যে পার্থক্য লেখো।
অসম্পৃক্ত দ্রবণ (Unsaturated Solution) ও অতিপৃক্ত দ্রবণের (Supersaturated Solution) মধ্যে পার্থক্যগুলি হল –
| বিষয় | অসম্পৃক্ত দ্রবণ (Unsaturated Solution) | অতিপৃক্ত দ্রবণ (Supersaturated Solution) |
| সংজ্ঞা | নির্দিষ্ট উষ্ণতায় কোনো দ্রাবকে সর্বাধিক যত গ্রাম দ্রাব দ্রবীভূত হতে পারে তার থেকে কম পরিমাণ দ্রাব দ্রবীভূত থাকলে যে দ্রবণ উৎপন্ন হয় তাকে অসম্পৃক্ত দ্রবণ বলে। | নির্দিষ্ট উষ্ণতায় কোনো দ্রাবকে সর্বাধিক যত গ্রাম দ্রাব দ্রবীভূত থাকতে পারে তার চেয়ে বেশি পরিমাণ দ্রাব দ্রবীভূত থাকলে যে দ্রবণ উৎপন্ন হয় তাকে অতিপৃক্ত দ্রবণ বলে। |
| স্থায়িত্ব | এই দ্রবণ স্থায়ী হয়। | এই দ্রবণ অস্থায়ী হয়। |
| দ্রাব যোগ করার প্রভাব | এই দ্রবণে অতিরিক্ত দ্রাব যোগ করলে তা দ্রবীভূত হয়ে যায়। | এই দ্রবণে অতিরিক্ত দ্রাব যোগ করলে সেটি দ্রবীভূত না হয়ে দ্রবণ থেকে আরও বেশ কিছু পরিমাণ দ্রাব পৃথক হয়। |
| দ্রাব যোগে ঘনত্বের পরিবর্তন | এই দ্রবণে অতিরিক্ত দ্রাব যোগ করলে দ্রবণের ঘনত্ব বৃদ্ধি পায়। | এই দ্রবণে অতিরিক্ত দ্রাব যোগ করলে দ্রবণের ঘনত্ব হ্রাস পায়। |
উদ্গ্রাহী পদার্থ (Deliquescent substance) ও উদ্ত্যাগী পদার্থের (Efflorescent substance) মধ্যে পার্থক্য লেখো।
উদ্গ্রাহী পদার্থ (Deliquescent substance) ও উদ্ত্যাগী পদার্থের (Efflorescent substance) মধ্যে পার্থক্যগুলি হল –
| বিষয় | উদ্গ্রাহী পদার্থ (Deliquescent Substance) | উদ্ত্যাগী পদার্থ (Efflorescent substance) |
| সংজ্ঞা | যেসব কেলাসকে সাধারণ উষ্ণতায় খোলা বাতাসে রাখলে বাতাস থেকে জলীয় বাষ্প শোষণ করে ও শোষিত জলে দ্রবীভূত হয়ে দ্রবণ উৎপন্ন করে, তাদের উদ্গ্রাহী পদার্থ বলে। | যেসব সোদক কেলাসকে সাধারণ উষ্ণতায় খোলা বাতাসে রাখলে তাদের অণু মধ্যস্থ কেলাস জল বেরিয়ে যায় এবং কেলাসগুলি অনিয়তাকার পদার্থে পরিণত হয়, তাদের উদ্ত্যাগী পদার্থ বলে। |
| ওজনের পরিবর্তন | উদ্গ্রহণের ফলে পদার্থের ওজন বৃদ্ধি পায়। | উদ্ত্যাগের ফলে পদার্থের ওজন হ্রাস পায়। |
| উদাহরণ | ক্যালশিয়াম ক্লোরাইড, ম্যাগনেশিয়াম ক্লোরাইড ইত্যাদি উদ্গ্রাহী পদার্থ। | কাপড় কাচার সোডা হল উদ্ত্যাগী পদার্থ। |
উদ্গ্রাহী পদার্থ (Deliquescent substance) ও জলাকর্ষী পদার্থের (Hygroscopic substance) মধ্যে পার্থক্য লেখো।
উদ্গ্রাহী পদার্থ (Deliquescent substance) ও জলাকর্ষী পদার্থের (Hygroscopic substance) মধ্যে পার্থক্যগুলি হল –
| বিষয় | উদ্গ্রাহী পদার্থ (Deliquescent Substance) | জলাকর্ষী পদার্থ (Hygroscopic Substance) |
| ভৌত অবস্থা | উদ্গ্রাহী পদার্থ কেলাসাকার কঠিন। | জলাকর্ষী পদার্থগুলি কেলাসাকার, অনিয়তাকার কঠিন অথবা তরল হতে পারে। |
| শোষিত জলে দ্রবীভবন | সাধারণত উদ্গ্রাহী পদার্থ শোষিত জলে দ্রবীভূত হয়ে ওই পদার্থের জলীয় দ্রবণ তৈরি করে। | জলাকর্ষী পদার্থ শোষিত জলে দ্রবীভূত হয় না। |
| কেলাসজলের বাষ্পচাপ | উদ্গ্রাহী পদার্থের কেলাস মধ্যস্থ কেলাসজলের বাষ্পচাপ বাতাসের জলীয় বাষ্পচাপের চেয়ে কম। | এক্ষেত্রে অনুরুপ ঘটনা ক্রিয়াশীল নয়। |
| উদাহরণ | ক্যালশিয়াম ক্লোরাইড (CaCl2), ম্যাগনেশিয়াম ক্লোরাইড (MgCl2),ফেরিক ক্লোরাইড (FeCl3) প্রভৃতি উদ্গ্রাহী পদার্থের উদাহরণ। | পোড়াচুন (CaO),গাঢ় সালফিউরিক অ্যাসিড (H2SO4), অনার্দ্র সোডিয়াম সালফেট (Na2SO4) প্রভৃতি জলাকর্ষী পদার্থের উদাহরণ। |
উদ্বায়ী তরল (Volatile liquid) ও অনুদ্বায়ী তরলের (Non-volatile liquid) মধ্যে পার্থক্য লেখো।
উদ্বায়ী তরল (Volatile liquid) ও অনুদ্বায়ী তরলের (Non-volatile liquid) মধ্যে পার্থক্যগুলি হল –
| বিষয় | উদ্বায়ী তরল (Volatile liquid) | অনুদ্বায়ী তরলের (Non-volatile liquid) |
| সংজ্ঞা | যেসব তরল সাধারণ অবস্থায় বায়ুতে উবে যায়, তাদের উদ্বায়ী তরল বলে। | যেসব তরল সাধারণ অবস্থায় বায়ুতে উবে যায় না, তাদের অনুদ্বায়ী তরল বলে। |
| উদাহরণ | ইথার, স্পিরিট, অ্যালকোহল। | জল। |
| দ্রবীভূত করার ক্ষমতা | এই তরলে সাধারণ জৈব পদার্থগুলি দ্রবীভূত হয়। | এই তরলে প্রায় সকল প্রকার অজৈব যৌগ ও কিছু কিছু জৈব যৌগ (চিনি) দ্রবীভূত হয়। |
| সংরক্ষণ ক্ষমতা | উদ্ভিদ ও প্রাণীর বিভিন্ন জৈব নমুনা সংরক্ষণে ব্যবহৃত হয়। | জৈব নমুনা সংরক্ষণে এর কোনো ভূমিকা নেই। |
জলে NaCl -এর আয়নগুলি দ্রবীভূত হওয়া ও একটি প্রোটিন অণুর দ্রবীভূত হওয়ার মধ্যে প্রধান পার্থক্য লেখো।
জলে NaCl -এর আয়নগুলি দ্রবীভূত হওয়া ও একটি প্রোটিন অণুর দ্রবীভূত হওয়ার মধ্যে প্রধান পার্থক্য হল –
| বিষয় | জলে NaCl -এর আয়নগুলির দ্রবীভূত হওয়া | জলে প্রোটিন অণুর দ্রবীভূত হওয়া |
| আয়নীয় বিয়োজন | জলে Nacl -এর আয়নীয় বিয়োজন ঘটে। | জলে প্রোটিন অণুর আয়নীয় বিয়োজন ঘটে না। |
| তড়িৎ পরিবাহিতা | জলে দ্রবীভূত NaCl -এর আয়নগুলি তড়িৎ পরিবহণ করতে পারে। | প্রোটিন অণুর দ্রবণ তড়িৎ পরিবহণ করতে পারে না। |
গাণিতিক প্রশ্নাবলি
প্রয়োজনীয় সূত্রাবলি
30°C উষ্ণতায় 75 g জলে 33 g সোডিয়াম নাইট্রেট দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ উৎপন্ন করে। 30°C উষ্ণতায় সোডিয়াম নাইট্রেটের দ্রাব্যতা কত?
= \(\frac{33}{75}\times100\)
= 44
সুতরাং, 30°C উষ্ণতায় সোডিয়াম নাইট্রেটের দ্রাব্যতা 44।
30°C উষ্ণতায় 45 g KNO3, 10 g জলে দ্রবীভূত করলে সম্পৃক্ত দ্রবণ উৎপন্ন হয়। ওই তাপমাত্রায় KNO3 -এর দ্রাব্যতা কত?
30°C উষ্ণতায় 10 g জলে KNO3 আছে = 45 g
30°C উষ্ণতায় 1 g জলে KNO3 আছে = \(\frac{45}{10}\) g
∴ 30°C উষ্ণতায় 100 g জলে KNO3 আছে = \(\frac{45\times100}{10}\) g = 450 g
সুতরাং, 30°C উষ্ণতায় KNO3 -এর দ্রাব্যতা 450।
40°C উষ্ণতায় প্রস্তুত একটি লবণের সম্পৃক্ত দ্রবণের 75 g -কে বাষ্পীভূত করলে 20 g অবশেষ পাওয়া গেল। 40°C উষ্ণতায় লবণটির দ্রাব্যতা কত?
40°C উষ্ণতায় লবণের সম্পৃক্ত দ্রবণের ভর = 75 g ভর
40°C উষ্ণতায় লবণের ভর = 20 g ভর
∴ ওই সম্পৃক্ত দ্রবণে দ্রাবকের ভর = (75 – 20) g = 55 g
= \(\frac{20}{55}\times100\)
= 36.36
সুতরাং, 40°C উষ্ণতায় লবণের দ্রাব্যতা 36.36।
25°C উষ্ণতায় 150 গ্রাম সম্পৃক্ত দ্রবণে 15 গ্রাম দ্রাব দ্রবীভূত থাকলে ওই উষ্ণতায় ওই দ্রাবের দ্রাব্যতা নির্ণয় করো।
25°C উষ্ণতায় সম্পৃক্ত দ্রবণের ভর = 150 g
25°C উষ্ণতায় সম্পৃক্ত দ্রাবের ভর = 15 g
____________________________________________
ওই সম্পৃক্ত দ্রবণে দ্রাবকের ভর (150 – 15) g = 135 g
∴
= \(\frac{15}{135}\times100\)
= 11.11
সুতরাং, 25°C উষ্ণতায় দ্রাবের দ্রাব্যতা 11.11।
40°C উষ্ণতায় একটি লবণের দ্রাব্যতা 25। ওই উষ্ণতায় 400 g জলকে সম্পৃক্ত করতে কী পরিমাণ লবণ প্রয়োজন হবে?
∴ 40°C উষ্ণতায় সম্পৃক্ত দ্রবণে লবণের ভর = 25 × 4 = 100 g
অর্থাৎ, 40°C উষ্ণতায় 400 g জলকে সম্পৃক্ত করতে 100 g লবণ প্রয়োজন হবে।
75 g ফুটন্ত জলে 50 g লেড নাইট্রেট দ্রবীভূত হয়। দ্রবণটিকে 20°C উষ্ণতায় শীতল করলে কী পরিমাণ দ্রাব দ্রবণ থেকে কেলাসাকারে পৃথক হবে? 20°C উষ্ণতায় লেড নাইট্রেটের দ্রাব্যতা 54.4।
20°C উষ্ণতায়,
100 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় লেড নাইট্রেটের পরিমাণ = 54.4 g
1 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় লেড নাইট্রেটের পরিমাণ = \(\frac{54.4}{100}\) g
∴ 75 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় লেড নাইট্রেটের পরিমাণ = \(\frac{54.4}{100}\times75\) g = \(40.8\) g
75 g ফুটন্ত জলে 50 g লেড নাইট্রেট দ্রবীভূত ছিল। 20°C উষ্ণতায় দ্রবণটিকে শীতল করলে (50 – 40.8) = 9.2 g লেড নাইট্রেট দ্রবণ থেকে কেলাসাকারে পৃথক হবে।
40°C উষ্ণতার চিনির 32 g সম্পৃক্ত দ্রবণে 12 g চিনি দ্রবীভূত আছে। দ্রবণের উষ্ণতা 30°C করলে কী পরিমাণ চিনি থিতিয়ে পড়বে? (30°C উষ্ণতায় চিনির দ্রাব্যতা 40)
40°C উষ্ণতায় চিনির সম্পৃক্ত দ্রবণের ভর = 32 g এবং দ্রবীভূত চিনির ভর = 12 g
∴ সম্পৃক্ত দ্রবণে দ্রাবকের ভর = (32 – 12) g = 20 g
30°C উষ্ণতায় চিনির দ্রাব্যতা 40।
30°C উষ্ণতায় 100 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় চিনির পরিমাণ = 40 g
1 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় চিনির পরিমাণ = \(\frac{40}{100}\) g
∴ 20 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় চিনির পরিমাণ = \(\frac{40\times20}{100}\) g = 8 g
∴ 40°C উষ্ণতায় 20 g জলে 12 g চিনি দ্রবীভূত ছিল।
∴ 30°C উষ্ণতায় দ্রবণটিকে শীতল করলে (12 – 8) = 4 g চিনি থিতিয়ে পড়বে।
70°C ও 20°C উষ্ণতায় জলে KNO3 -এর দ্রাব্যতা যথাক্রমে 134 ও 30। 70°C উষ্ণতায় KNO3 দ্বারা সম্পৃক্ত 200 গ্রাম জলকে 20°C উষ্ণতায় ঠান্ডা করলে কী পরিমাণ KNO3 কেলাসিত হবে?
70°C উষ্ণতায় KNO3 -এর দ্রাব্যতা = 134
70°C উষ্ণতায় 100 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = 134 g
1 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = \(\frac{134}{100}\) g
200 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = \(\frac{134\times200}{100}\) g = 268 g
20°C উষ্ণতায় KNO3 -এর দ্রাব্যতা = 30
20°C উষ্ণতায় 100 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = 30 g
1 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = \(\frac{30}{100}\) g
200 g জলকে সম্পৃক্ত করতে প্রয়োজনীয় KNO3 -এর পরিমাণ = \(\frac{30\times200}{100}\) g = 60 g
∴ 70°C উষ্ণতায় KNO3 দ্বারা সম্পৃক্ত 200 গ্রাম জলকে 20°C উষ্ণতায় ঠান্ডা করলে (268 – 60) g = 208 g KNO3 কেলাসিত হবে।
100°C উষ্ণতায় 200 g Pb(NO3)2 -এর সম্পৃক্ত দ্রবণের উষ্ণতা 10°C -এ নিয়ে গেলে কী পরিমাণ Pb(NO3)2 দ্রবণ থেকে পৃথক হবে? [10°C এবং 100°C উষ্ণতায় Pb(NO3)2 -এর দ্রাব্যতা যথাক্রমে 25 এবং 275]
100°C উষ্ণতায় লেড নাইট্রেটের দ্রাব্যতা 275।
∴ 100°C উষ্ণতায় 100 g দ্রাবকে 275 g Pb(NO3)2 মিশে সম্পৃক্ত দ্রবণ তৈরি করে।
∴ সম্পৃক্ত দ্রবণের ওজন = (100 + 275) = 375 g
100°C উষ্ণতায়,
375 g দ্রবণে দ্রাবক আছে = 100 g
1 g দ্রবণে দ্রাবক আছে = \(\frac{100}{375}\) g
∴ 200 g দ্রবণে দ্রাবক আছে = \(\frac{100\times200}{375}\) g = 53.33 g
∴ 200 g Pb(NO3)2 -এর দ্রবণে দ্রাব আছে = (200 – 53.33) g = 146.67 g
10°C উষ্ণতায়,
100 g জলে Pb(NO3)2 আছে = 25 g
1 g জলে Pb(NO3)2 আছে = \(\frac{25}{100}\) g
∴ 53.33 g জলে Pb(NO3)2 আছে = \(\frac{25\times53.33}{100}\) g = 13.33 g
∴ 100°C উষ্ণতায় 200 g Pb(NO3)2 -এর সম্পৃক্ত দ্রবণকে 10°C উষ্ণতায় নিয়ে গেলে (146.67 – 13.33) g = 133.34 g Pb(NO3)2, দ্রবণ থেকে পৃথক হবে।
50°C উষ্ণতায় KNO3 -এর সম্পৃক্ত দ্রবণের 64 g 30°C উষ্ণতায় শীতল করলে কত গ্রাম কঠিন KNO3 কেলাসিত হবে? [30°C উষ্ণতা ও 50°C উষ্ণতায় KNO3 -এর দ্রাব্যতা যথাক্রমে ৪6 এবং 114]
50°C উষ্ণতায় KNO3 -এর দ্রাব্যতা = 114। ওই উষ্ণতায় সম্পূর্ণ দ্রবণের ভর = (114 + 100) g = 214 g
50°C উষ্ণতায়,
214 g সম্পৃক্ত দ্রবণে দ্রবীভূত KNO3 -এর পরিমাণ = 114 g
1 g সম্পৃক্ত দ্রবণে দ্রবীভূত KNO3 -এর পরিমাণ = \(\frac{114}{214}\) g
∴ 64 g সম্পৃক্ত দ্রবণে দ্রবীভূত KNO3 -এর পরিমাণ = \(\frac{114\times64}{214}\) g = 34.09 g
সুতরাং, 64 g সম্পৃক্ত দ্রবণে দ্রাবকের পরিমাণ = (64 – 34.09) g = 29.91 g
30°C উষ্ণতায় KNO3 -এর দ্রাব্যতা = 86
30°C উষ্ণতায় সম্পৃক্ত দ্রবণের,
100 g দ্রাবকে দ্রবীভূত KNO3 -এর পরিমাণ = 86 g
1 g দ্রাবকে দ্রবীভূত KNO3 -এর পরিমাণ = \(\frac{86}{100}\) g
29.91 g দ্রাবকে দ্রবীভূত KNO3 -এর পরিমাণ = \(\frac{86\times29.91}{100}\) g = 25.72 g
50°C থেকে 30°C -এ শীতল করলে কঠিন KNO3 কেলাসের পরিমাণ = (34.09 – 25.72) g = 8.37 g
40 g/L NaOH দ্রবণটিকে শতকরা মাত্রায় প্রকাশ করো।
NaOH দ্রবণের মাত্রা = 40 g/L
1 লিটার = 1000 mL
1000 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ = 40 g
1 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ = \(\frac{40}{1000}\) g
100 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ = \(\frac{40}{1000}\times100\) g = 4 g
∴ দ্রবণের মাত্রা \(4\%\;\left(\frac WV\right)\)
40 g সাধারণ লবণ জলে দ্রবীভূত করে 360 mL দ্রবণ তৈরি করা হল। দ্রবণের শতকরা গাঢ়ত্ব কত?
360 mL দ্রবণে দ্রবীভূত সাধারণ লবণের পরিমাণ = 40 g
1 mL দ্রবণের দ্রবীভূত সাধারণ লবণের পরিমাণ = \(\frac{40}{360}\) g
100 mL দ্রবণে দ্রবীভূত সাধারণ লবণের পরিমাণ = \(\frac{40\times100}{360}\) g = 11.11 g
∴ দ্রবণের শতকরা গাঢ়ত্ব \(11.11\%\;\left(\frac WV\right)\)
12.5 গ্রাম সোডিয়াম ক্লোরাইডকে জলে দ্রবীভূত করে দ্রবণের আয়তন সঠিকভাবে 250 cm3 করা হল। ওই দ্রবণের শতকরা মাত্রা নির্ণয় করো।
250 cm3 দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = 12.5 g
1 cm3 দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = \(\frac{12.5}{250}\) g
100 cm3 দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = \(\frac{12.5\times100}{250}\) g = 5 g
∴ ওই দ্রবণের মাত্রা \(5\%\;\left(\frac WV\right)\)
1 লিটার NaCl -এর জলীয় দ্রবণে 25 g NaCl দ্রবীভূত আছে। দ্রবণটির গাঢ়ত্বের শতকরা মাত্রা নির্ণয় করো।
1 লিটার = 1000 mL
1000 mL দ্রবণে NaCl আছে = 25 g
1 mL দ্রবণে NaCl আছে = \(\frac{25}{1000}\) g
∴ 100 mL দ্রবণে NaCl আছে = \(\frac{25\times100}{1000}\) g
∴ গাঢ়ত্বের মাত্রা \(2.5\%\;\left(\frac WV\right)\)
সোডিয়াম হাইড্রক্সাইডের 5L জলীয় দ্রবণে 40 গ্রাম সোডিয়াম হাইড্রক্সাইড দ্রবীভূত আছে। দ্রবণটির gL-1 এককে গাঢ়ত্ব নির্ণয় করো।
5 লিটার সোডিয়াম হাইড্রক্সাইড দ্রবণে NaOH -এর পরিমাণ = 40 g
1 লিটার সোডিয়াম হাইড্রক্সাইড দ্রবণে NaOH -এর পরিমাণ = \(\frac{40}5\) g = 8 g
∴ দ্রবণের গাঢ়ত্ব 8 gL-1
12.5% NaCl দ্রবণকে গ্রাম/লিটার এককে প্রকাশ করো।
1 লিটার = 1000 mL
দ্রবণের গাঢ়ত্ব (শতকরা মাত্রা) = 12.5%
100 mL দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = 12.5 g
1 mL দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = \(\frac{12.5}{100}\) g
1000 mL দ্রবণে দ্রবীভূত NaCl -এর পরিমাণ = \(\frac{12.5}{100}\times1000\) g = 125 g
∴ দ্রবণের মাত্রা = 125 g/L
সোডিয়াম সালফেটের একটি জলীয় দ্রবণের গাঢ়ত্ব 1.2 gL-1। ওই দ্রবণের 2.5 L আয়তনে দ্রাবের পরিমাণ গণনা করো।
Na2SO4 -এর জলীয় দ্রবণের গাঢ়ত্ব 1.2 g/L
অর্থাৎ, 1 L দ্রবণে দ্রাব আছে = 1.2 g
2.5 L দ্রবণে দ্রাব আছে = 1.2 × 2.5 = 3 g
∴ ওই দ্রবণের 2.5 L আয়তনে দ্রাবের পরিমাণ 3 g
500 mL দ্রবণে কত গ্রাম গ্লুকোজ দ্রবীভূত করলে দ্রবণের মাত্রা 10 gL-1 হবে?
1 লিটার = 1000 mL
1000 mL দ্রবণে দ্রবীভূত গ্লুকোজের পরিমাণ = 10 g
1 mL দ্রবণে দ্রবীভূত গ্লুকোজের পরিমাণ = \(\frac{10}{1000}\) g
∴ 500 mL দ্রবণে দ্রবীভূত গ্লুকোজের পরিমাণ = \(\frac{10\times500}{1000}\) g = 5 g
∴ 500 mL দ্রবণে 5 g গ্লুকোজ দ্রবীভূত করতে হবে।
সুক্রোজের (আণবিক ভর = 342) একটি জলীয় দ্রবণের গড়ত্ব 1.2 mol⋅L-1। ওই দ্রবণের 2.5 L আয়তনে দ্রবীভূত সুক্রোজের ভর নির্ণয় করো।
1 মোল সুক্রোজ = 342 g সুক্রোজ
∴ 1.2 মোল সুক্রোজ = 342 × 1.2 g = 410.4 g সুক্রোজ
প্রশ্নানুসারে,
1 L দ্রবণে সুক্রোজ আছে = 410.4 g
∴ 2.5 দ্রবণে সুক্রোজ আছে = 410.4 × 2.5 g = 1026 g
∴ সুক্রোজের ভর 1026 g
75 mL দ্রবণে 15 গ্রাম সোডিয়াম কার্বনেট দ্রবীভূত থাকলে ওই দ্রবণের গ্রাম/লিটার মাত্রা এবং শতকরা মাত্রা কত হবে?
আমরা জানি, 1 লিটার = 1000 mL
75 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = 15 g
1 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = \(\frac{15}{75}\) g
1000 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = \(\frac{15\times1000}{75}\) g = 200 g
∴ দ্রবণের মাত্রা 200 g/L
আবার, 75 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = 15 g
1 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = \(\frac{15}{75}\) g
100 mL দ্রবণে দ্রবীভূত Na2CO3 -এর পরিমাণ = \(\frac{15\times100}{75}\) g = 20 g
∴ দ্রবণের মাত্রা \(20\%\;\left(\frac WV\right)\)
1.575 g অক্সালিক অ্যাসিডকে 250 mL জলীয় দ্রবণে দ্রবীভূত করা হল। দ্রবণটির গাঢ়ত্ব g/L ও শতকরা মাত্রায় \(\left(\%\frac WV\right)\) প্রকাশ করো।
250 mL জলীয় দ্রবণে দ্রবীভূত অক্সালিক অ্যাসিডের পরিমাণ = 1.575 g
1 mL জলীয় দ্রবণে দ্রবীভূত অক্সালিক অ্যাসিডের পরিমাণ = \(\frac{1.575}{250}\) g
1000 mL জলীয় দ্রবণে দ্রবীভূত অক্সালিক অ্যাসিডের পরিমাণ = \(\frac{1.575\times1000}{250}\) g = 6.3 g
∴ দ্রবণটির গাঢ়ত্ব = 6.3 g/L
আমরা জানি,
1 L = 1000 mL
1000 mL দ্রবণে অক্সালিক অ্যাসিড থাকে = 6.3 g
1 mL দ্রবণে অক্সালিক অ্যাসিড থাকে = \(\frac{6.3}{1000}\) g
100 mL দ্রবণে অক্সালিক অ্যাসিড থাকে = \(\frac{6.3}{1000}\times100\) g = 0.63 g
∴ দ্রবণটির মাত্রা \(0.63\%\;\left(\frac WV\right)\)
1 L আয়তনের একটি জলীয় দ্রবণে 90 গ্রাম গ্লুকোজ দ্রবীভূত আছে। mol⋅L-1 এককে দ্রবণটির শক্তিমাত্রা কত? (গ্লুকোজের আণবিক ভর = 180)
গ্লুকোজের আণবিক ওজন = (12 × 6) + 12 + (16 × 6) = 180
180 গ্রাম গ্লুকোজ = 1 মোল গ্লুকোজ
∴ 90 গ্রাম গ্লুকোজ = \(\frac{90}{180}\) মোল গ্লুকোজ = 0.5 মোল গ্লুকোজ
∴ দ্রবণটির শক্তিমাত্রা 0.5 mol⋅L-1
500 mL দ্রবণে 6 g Na2CO3 দ্রবীভূত আছে। দ্রবণের গাঢ়ত্ব mol⋅L-1 এককে প্রকাশ করো। [Na = 23, C = 12, O = 16]
Na2CO3 -এর আণবিক ওজন = (2 × 23) + 12 + (16 × 3) = 106
106 g Na2CO3 = 1 মোল Na2CO3
1 g Na2CO3 = \(\frac1{106}\) মোল Na2CO3
∴ 6 g Na2CO3 = \(\frac6{106}\) মোল Na2CO3 = 0.0566
500 mL দ্রবণে দ্রবীভূত Na2CO3 -এর মোল সংখ্যা = 0.0566 মোল/লিটার
1 mL দ্রবণে দ্রবীভূত Na2CO3 -এর মোল সংখ্যা = \(\frac{0.0566}{500}\) মোল/লিটার
∴ 1000 mL দ্রবণে দ্রবীভূত Na2CO3 -এর মোল সংখ্যা = \(\frac{0.0566}{500}\times1000\) মোল/লিটার = 0.1132 মোল/লিটার
∴ দ্রবণের গাঢ়ত্ব = 0.1132 মোল/লিটার।
1.5 L আয়তনের একটি সালফিউরিক অ্যাসিড দ্রবণে 29.4 g H2SO4 দ্রবীভূত আছে। দ্রবণটির মোলারিটি নির্ণয় করো।
সালফিউরিক অ্যাসিডের (H2SO4) আণবিক ওজন
= (1 × 2) + 32 + (16 × 4)
= 98
98 g H2SO4 = 1 মোল H2SO4
1 g H2SO4 = \(\frac1{98}\) মোল H2SO4
∴ 29.4 g H2SO4 = \(\frac{29.4}{98}\) মোল H2SO4 = 0.3 মোল H2SO4
1.5 L দ্রবণে দ্রবীভূত H2SO4 -এর মোল সংখ্যা = 0.3
1 L দ্রবণে দ্রবীভূত H2SO4 -এর মোল সংখ্যা = \(\frac{0.3}{1.5}=0.2\)
∴ দ্রবণের মোলারিটি = 0.2 মোল/লিটার।
2% NaOH দ্রবণকে মোল/লিটার এককে প্রকাশ করো।
NaOH -এর আণবিক ভর (23 + 16 + 1) = 40
2% NaOH দ্রবণের 100 mL আয়তনে দ্রবীভূত NaOH -এর পরিমাণ = 2 g
40 g NaOH = 1 মোল NaOH
2 g NaOH = \(\frac2{40}\) মোল NaOH = \(\frac1{20}\) মোল NaOH
100 mL দ্রবণে দ্রবীভূত NaOH -এর মোল সংখ্যা = \(\frac1{20}\)
1000 mL দ্রবণে দ্রবীভূত NaOH -এর মোল সংখ্যা = \(\frac{1000} {100\times20}=\frac12=0.5\)
সুতরাং, দ্রবণের মাত্রা 0.5 মোল/লিটার।
400 mL 0.25 mol⋅L-1 CaCO3 -এর পরিমাণ কত?
CaCO3 দ্রবণের গাঢ়ত্ব = 0.25 mol⋅L-1
আমরা জানি, 1 L = 1000 mL
1000 mL দ্রবণে দ্রবীভূত CaCO3 -এর মোলসংখ্যা = 0.25
1 mL দ্রবণে দ্রবীভূত CaCO3 -এর মোলসংখ্যা = \(\frac{0.25}{1000}\)
400 mL দ্রবণে দ্রবীভূত CaCO3 -এর মোলসংখ্যা = \(\frac{0.25\times400}{1000}\)
CaCO3 -এর আণবিক ওজন = [40 + 12 + (16 × 3)] = 100
1 মোল CaCO3 = 100 g CaCO3
∴ 0.1 মোল CaCO3 = 100 × 0.1 g = 10 g CaCO3
∴ 400 mL 0.25 molL-1 CaCO3 দ্রবণে CaCO3 -এর পরিমাণ 10 g
4 g NaOH (NaOH -এর মোলার ভর 40 g mol-1) 500 mL আয়তনের জলে দ্রবীভূত অবস্থায় আছে। দ্রবণটির শক্তিমাত্রা %\(\frac WV\) এককে এবং molL-1 এককে নির্ণয় করো।
500 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ= 4 g
1 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ = \(\frac4{500}\) g
100 mL দ্রবণে দ্রবীভূত NaOH -এর পরিমাণ = \(\frac{4\times100}{500}=0.8\) g
∴ দ্রবণের শক্তিমাত্রা (%\(\frac WV\) এককে) = 0.8%
NaOH -এর মোলার ভর = 40 g⋅mol-1
40 g NaOH = 1 মোল NaOH
1 g NaOH = \(\frac1{40}\) মোল NaOH
∴ 4 g NaOH = \(\frac4{40}\) মোল NaOH = 0.1 মোল NaOH
500 mL জলীয় দ্রবণে দ্রবীভূত NaOH -এর মোল সংখ্যা = 0.1
1 mL জলীয় দ্রবণে দ্রবীভূত NaOH -এর মোল সংখ্যা = \(\frac{0.1}{500}\)
1000 mL জলীয় দ্রবণে দ্রবীভূত NaOH -এর মোল সংখ্যা \(\frac{0.1\times1000}{500}=0.2\)
∴ দ্রবণটির শক্তিমাত্রা (mol⋅L-1 এককে) = 0.2 mol⋅L-1
500 mL দ্রবণে 3.65 g HCl দ্রবীভূত আছে। দ্রবণটির শক্তিমাত্রা g/L এবং mol/L এককে নির্ণয় করো।
আমরা জনি, 1 L = 1000 mL
500 mL দ্রবণে দ্রবীভূত HCl -এর পরিমাণ = 3.65 g
1 mL দ্রবণে দ্রবীভূত HCl -এর পরিমাণ = \(\frac{3.65}{500}\) g
1000 mL দ্রবণে দ্রবীভূত HCl -এর পরিমাণ = \(\frac{3.65\times100}{500}=7.3\) g
∴ দ্রবণটির শক্তিমাত্রা (g/L এককে) = 7.3 g/L
HCl -এর মোলার ভর = 36.5 g⋅mol-1
∴ 36.5 g HCl = 1 মোল HCl
1 g HCl = \(\frac1{36.5}\) মোল HCl
3.65 g HCl = \(\frac{3.65}{36.5}\) মোল HCl = 0.1 মোল HCl
∴ 500 mL জলীয় দ্রবণে দ্রবীভূত HCl -এর মোলসংখ্যা = 0.1
1 mL জলীয় দ্রবণে দ্রবীভূত HCl -এর মোলসংখ্যা = \(\frac{0.1}{500}\)
1000 mL জলীয় দ্রবণে দ্রবীভূত HCl -এর মোলসংখ্যা = \(\frac{0.1\times1000}{500}=0.2\)
∴ দ্রবণটির শক্তিমাত্রা (mol/L, এককে) 0.2 mol⋅L-1
নৈর্ব্যক্তিক প্রশ্নোত্তর
সঠিক উত্তরটি নির্বাচন করো
দ্রবণ হল –
- মিশ্র পদার্থ
- যৌগিক পদার্থ
- মৌলিক পদার্থ
- কেলাসাকার পদার্থ
উত্তর – 1. মিশ্র পদার্থ
প্রদত্ত দ্রবণগুলির মধ্যে কোন্টি সমসত্ত্ব? –
- জল ও তেল
- জল ও অ্যালকোহল
- জল ও বালি
- জল ও বেঞ্জিন
উত্তর – 2. জল ও অ্যালকোহল
কঠিনে কঠিনের দ্রবণ হল –
- বোরন
- ব্রোঞ্জ
- বেরিলিয়াম
- বেরিয়াম
উত্তর – 2. ব্রোঞ্জ
কঠিনে তরলের দ্রবণের একটি উদাহরণ হল –
- কুয়াশা
- বায়ুতে মিশ্রিত কপূর
- জিংক অ্যামালগাম
- পিতল
উত্তর – 3. জিংক অ্যামালগাম
সোডিয়াম অ্যামালগামে দ্রাবক হল –
- পারদ
- সোডিয়াম
- জল
- কোনোটিই নয়
উত্তর – 1. পারদ
100 গ্রাম সমুদ্র জলের উত্তাপনে 25 গ্রাম সোডিয়াম ক্লোরাইড পাওয়া গেল। এক্ষেত্রে দ্রাবক হচ্ছে –
- সমুদ্র জল
- বালি
- সোডিয়াম ক্লোরাইড
- কোনোটিই নয়
উত্তর – 1. সমুদ্র জল
প্রকৃত দ্রবণে দ্রাবের কণার ব্যাস –
- 10-8 সেমি বা তার কম
- 10-4 সেমি
- 10-5 সেমি থেকে 10-7 সেমি
- 10-4 সেমির বেশি
উত্তর – 1. 10-8 সেমি বা তার কম
তুঁতের জলীয় দ্রবণ –
- কোলয়েড
- প্রকৃত দ্রবণ
- প্রলম্বন
- মিসেল
উত্তর – 2. প্রকৃত দ্রবণ
কোনো দ্রাবকে দ্রাব কণার ব্যাস 10-5 সেমি ও 10-7 সেমির মধ্যে হলে –
- সম্পৃক্ত দ্রবণ উৎপন্ন হয়
- প্রকৃত দ্রবণ উৎপন্ন হয়
- প্রলম্বন উৎপন্ন হয়
- কোলয়েডীয় দ্রবণ উৎপন্ন হয়
উত্তর – 4. কোলয়েডীয় দ্রবণ উৎপন্ন হয়
কোলয়েড একটি –
- অস্বচ্ছ ও অসমসত্ত্ব মিশ্রণ
- স্বচ্ছ ও সমসত্ত্ব মিশ্রণ
- অসমসত্ত্ব কিন্তু স্বচ্ছ মিশ্রণ
- অস্বচ্ছ কিন্তু সমসত্ত্ব মিশ্রণ
উত্তর – 1. অস্বচ্ছ ও অসমসত্ত্ব মিশ্রণ
অ্যারারুট ও উষ্ণ জলের মিশ্রণে উৎপন্ন হয় –
- প্রকৃত দ্রবণ
- কোলয়েডীয় দ্রবণ
- সাসপেনশন
- কোনোটিই নয়
উত্তর – 2. কোলয়েডীয় দ্রবণ
গঙ্গার জল যে প্রকার দ্রবণের উদাহরণ তা হল –
- কোলয়েড
- প্রকৃত দ্রবণ
- প্রলম্বন
- কোনোটিই নয়
উত্তর – 1. কোলয়েড
ইমালসন একটি কোলয়েডীয় দ্রবণ যা তৈরি হয় –
- দুটো তরল দিয়ে যারা মিশে যায়
- দুটো তরল দিয়ে যারা মেশে না
- দুটো গ্যাস দিয়ে
- কোনোটিই ঠিক নয়
উত্তর – 2. দুটো তরল দিয়ে যারা মেশে না
প্রদত্ত কোনটি অবদ্রব বা ইমালসনের উদাহরণ? –
- কোলয়েডাল সালফার
- ধোঁয়াশা
- কুয়াশা
- দুধ
উত্তর – 4. দুধ
একটি ইমালসন কারক হল –
- অ্যারারুট
- জিলেটিন
- ডেটল
- কড লিভার অয়েল
উত্তর – 2. জিলেটিন
কোনটির বিস্তৃত দশা তরল ও বিস্তার মাধ্যম গ্যাসীয়? –
- মেঘ
- ধোঁয়া
- জেল
- সাবানের বুদ্বুদ
উত্তর – 1. মেঘ
প্রদত্ত কোনটির বিস্তার মাধ্যম তরল নয়? –
- ক্রিম
- ফেনা
- কুয়াশা
- সালফার সল
উত্তর – 3. কুয়াশা
যাকে প্রলম্বন বলা যায় –
- দুধ
- মিল্ক অব ম্যাগনেশিয়া
- নুনজল
- ভিনিগার
উত্তর – 2. মিল্ক অব ম্যাগনেশিয়া
প্রকৃত দ্রবণ, কোলয়েডীয় দ্রবণ এবং প্রলম্বনে কণাগুলির ব্যাসকে নিম্নক্রমে সাজালে হয় –
- প্রকৃত দ্রবণ > কোলয়েড দ্রবণ > প্রলম্বন
- প্রলম্বন > প্রকৃত দ্রবণ > কোলয়েড দ্রবণ
- প্রলম্বন > কোলয়েড দ্রবণ > প্রকৃত দ্রবণ
- কোলয়েড দ্রবণ > প্রকৃত দ্রবণ > প্রলম্বন
উত্তর – 3. প্রলম্বন > কোলয়েড দ্রবণ > প্রকৃত দ্রবণ
যে মিশ্রণটি কোলয়েডীয় নয় তা হল –
- কুয়াশা
- গোল্ড সল
- চিনির দ্রবণ
- দুধ
উত্তর – 3. চিনির দ্রবণ
কোনটিতে টিন্ডাল এফেক্ট দেখা যায় না? –
- সাবানের দ্রবণ
- কালি
- চিনির দ্রবণ
- স্টার্চের দ্রবণ
উত্তর – 3. চিনির দ্রবণ
যদি X g দ্রাব t°C তাপমাত্রায় Y g দ্রবণ তৈরি করে, তবে °C তাপমাত্রায় দ্রাব্যতা হয় –
- \(\frac XY\times100\\\)
- \(\frac YX\times100\\\)
- \(\frac X{Y-X}\times100\\\)
- \(\frac Y{X-Y}\times100\\\)
উত্তর – 3. \(\frac X{Y-X}\times100\)
40°C উষ্ণতায় 100 গ্রাম জলে সর্বাধিক 36 গ্রাম NaCl দ্রবীভূত হতে পারে। 40°C উষ্ণতায় NaCl -এর দ্রাব্যতা –
- 36 গ্রাম
- 36
- 0.36 গ্রাম
- 0.36
উত্তর – 2. 36
দ্রাব্যতার একক –
- g⋅cm-3
- Kg⋅m2
- g
- নেই
উত্তর – 4. নেই
দ্রাব্যতার সংজ্ঞায় দ্রাবকের পরিমাণ হল –
- 100 mL
- 1000 g
- 1000 mL
- 100 g
উত্তর – 4. 100 g
চাপ বৃদ্ধিতে তরলে কঠিনের দ্রাব্যতা –
- বৃদ্ধি পায়
- হ্রাস পায়
- একই থাকে
- প্রথমে বাড়ে, পরে কমে
উত্তর – 3. একই থাকে
উষ্ণতা বৃদ্ধিতে তরলে গ্যাসের দ্রাব্যতা –
- বাড়ে
- একই থাকে
- কমে
- বৃদ্ধি বা হ্রাস পাওয়া গ্যাসটির প্রকৃতির ওপর নির্ভর করে
উত্তর – 2. কমে
উষ্ণতা বৃদ্ধিতে পটাশিয়াম নাইট্রেট (KNO3) -এর দ্রাব্যতা –
- কমে
- বাড়ে
- প্রায় অপরিবর্তিত থাকে
- প্রথমে বাড়ে ও পরে কমে
উত্তর – 2. বাড়ে
তাপমাত্রা বাড়লে কোন্ পদার্থের দ্রাব্যতা কমে? –
- NaCl
- Ca(OH)2
- Mg(OH)2
- Na2CO3
উত্তর – 2. Ca(OH)2
উষ্ণতা বৃদ্ধিতে কার দ্রাব্যতা অপরিবর্তিত থাকে? –
- CaSO4
- KNO3
- ZnCl2
- NaCl
উত্তর – 4. NaCl
সম্পৃক্ত দ্রবণে আরও দ্রাব যোগ করলে দ্রবণের ঘনত্ব –
- বাড়ে
- কমে
- অপরিবর্তিত থাকে
- কোনোটিই নয়
উত্তর – 3. অপরিবর্তিত থাকে
সম্পৃক্ত দ্রবণে দ্রাবের কণা সুতো দিয়ে বেঁধে ঝুলিয়ে দিলে তার ওপর কেলাস গঠিত হওয়ার ঘটনাকে বলে –
- বৃদ্ধি
- অবৃদ্ধি
- অধিবৃদ্ধি
- অপবৃদ্ধি
উত্তর – 3. অধিবৃদ্ধি
কোন্ দ্রবণটির অসম্পৃক্ত দ্রবণকে উষ্ণতা বাড়িয়ে সম্পৃক্ত করা যাবে? –
- Ca(OH)2
- KNO3
- NaCl
- Na2SO4⋅10H2O
উত্তর – 1. Ca(OH)2
কোন্ ধরনের দ্রবণ অস্থায়ী প্রকৃতির? –
- সম্পৃক্ত
- অতিপৃক্ত
- অসম্পৃক্ত
- সবকটি
উত্তর – 2. অতিপৃক্ত
অতিপৃক্ত দ্রবণ তৈরি করা যায় প্রদত্ত কোনটি ব্যবহার করে? –
- FeSO4⋅7H2O
- ZnSO4⋅7H2O
- CuSO4⋅5H2O
- Na2S2O3⋅5H2O
উত্তর – 4. Na2S2O3⋅5H2O
কোনো নির্দিষ্ট উষ্ণতায় অতিপৃক্ত দ্রবণে আরও কিছু দ্রাব যোগ করলে দ্রবণটির ঘনত্ব –
- কমে যায়
- বৃদ্ধি পায়
- একই থাকে
- ঘনত্ব একই থাকলেও গাঢ়ত্ব বাড়ে
উত্তর – 1. কমে যায়
দ্রবণ থেকে কেলাসকে পৃথক করার পর পরিস্রুত যে সম্পৃক্ত দ্রবণ পড়ে থাকে –
- দ্রব
- কেলাস
- শেষ দ্রব
- কোনোটিই নয়
উত্তর – 3. শেষ দ্রব
একটি কেলাসাকার কঠিন পদার্থের উদাহরণ হল –
- কাচ
- মোম
- পিচ
- সাধারণ লবণ
উত্তর – 4. সাধারণ লবণ
কেলাসনের একটি পদ্ধতি হল –
- ঊর্ধ্বপাতন
- পরিস্রবণ
- আংশিক পাতন
- আস্রাবণ
উত্তর – 1. ঊর্ধ্বপাতন
প্রদত্ত কোনটির কেলাস জল থাকে না? –
- ব্লু ভিট্রিয়ল
- বোরাক্স
- কাপড় কাচার সোডা
- চিনি
উত্তর – 4. চিনি
অনার্দ্র কপার সালফেট কী ধরনের পদার্থ? –
- উদ্গ্রাহী
- উদ্ত্যাগী
- জলাকর্ষী
- অতিপৃক্ত
উত্তর – 3. জলাকর্ষী
ফটকিরির সংকেত হল –
- [K2SO4⋅Al2(SO4)3⋅24H2O]
- [K2SO4⋅Cr2(SO4)⋅24H2O]
- [Na2SO4⋅Al2(SO4)3⋅24H2O]
- [K2SO4⋅Al2(SO4)3⋅6H2O]
উত্তর – 1. [K2SO4⋅Al2(SO4)3⋅24H2O]
উষ্ণতার ওপর দ্রবণের কোন্ শক্তিমাত্রা নির্ভর করে না? –
- ওজনমাত্রিক শতাংশ
- আয়তনমাত্রিক শতাংশ
- gL-1 শক্তিমাত্রা
- molL-1 শক্তিমাত্রা
উত্তর – 1. ওজনমাত্রিক শতাংশ
10% Na2CO3 দ্রবণ বলতে বোঝায় –
- 100 mL দ্রবণে 10 g Na2CO3 দ্রবীভূত আছে
- 10 mL দ্রবণে 100 g Na2CO3 দ্রবীভূত আছে
- 10 mL দ্রবণে 10 g Na2CO3 দ্রবীভূত আছে
- 10 g দ্রবণে 10 g Na2CO3 দ্রবীভূত আছে
উত্তর – 1. 100 mL দ্রবণে 10 g Na2CO3 দ্রবীভূত আছে
মোলারিটি হল –
- দ্রাব্যতার একক
- দ্রবণের শক্তিমাত্রার একক
- দ্রবণের অম্লত্ব মাপার একক
- দ্রবণের ক্ষারকত্ব মাপার একক
উত্তর – 2. দ্রবণের শক্তিমাত্রার একক
15 g KNO3 জলে দ্রবীভূত করে দ্রবণের আয়তন 250 mL করা হল। দ্রবণটির শতকরা মাত্রা হল –
- 5%
- 6%
- 10%
- 15%
উত্তর – 2. 6%
জলের আন্তরাণবিক ব্যবধানে প্রবেশ করে –
- 10-9 সেমি ব্যাসের কণা
- 10-6 সেমি ব্যাসের কণা
- 10-4 সেমি ব্যাসের কণা
- 10-3 সেমি ব্যাসের কণা
উত্তর – 1. 10-9 সেমি ব্যাসের কণা
প্রদত্ত যে মিশ্রণটি একটি অবদ্রব বা ইমালসনের উদাহরণ সেটি হল –
- কুয়াশা
- ধোঁয়াশা
- দুধ
- জল ও চিনির সম্পৃক্ত দ্রবণ
উত্তর – 3. দুধ
প্রদত্ত কোনটি প্রাকৃতিক কোলয়েডের উদাহরণ –
- নুনজল
- চিনির দ্রবণ
- রক্ত
- তুঁতের দ্রবণ
উত্তর – 3. রক্ত
কোলয়েডীয় দ্রবণে প্রলম্বিত কণার ব্যাস হল –
- 10-5 – 10-7 m
- 10-8 – 10-9 cm
- 10-5 – 10-7 mm
- 10-5 – 10-7 cm
উত্তর – 4. 10-5 – 10-7 cm
অসমসত্ত্ব মিশ্রণের উদাহরণ হল –
- গঁদ
- দুধ
- চিনির দ্রবণ
- দ্রবণ
উত্তর – 1. গঁদ
শূন্যস্থান পূরণ করো
দ্রবণ = ___ + ___।
উত্তর – দ্রবণ = দ্রাবক + দ্রাব।
সোডা ওয়াটারে দ্রাবক হল ___।
উত্তর – সোডা ওয়াটারে দ্রাবক হল জল।
স্টিল একটি ___ দ্রবণের উদাহরণ।
উত্তর – স্টিল একটি কঠিনে-কঠিনে দ্রবণের উদাহরণ।
কোলয়েড দ্রবণের আকার প্রকৃত দ্রবণের কণা অপেক্ষা ___।
উত্তর – কোলয়েড দ্রবণের আকার প্রকৃত দ্রবণের কণা অপেক্ষা বড়ো।
দুধ একটি ___ দ্রবণ।
উত্তর – দুধ একটি কোলয়েডীয় দ্রবণ।
কড লিভার তেল একটি ___।
উত্তর – কড লিভার তেল একটি ইমালসন।
বিস্তৃত দশা কঠিন ও বিস্তার মাধ্যম তরল এমন একটি কোলয়েডীয় মিশ্রণের উদাহরণ হল ___।
উত্তর – বিস্তৃত দশা কঠিন ও বিস্তার মাধ্যম তরল এমন একটি কোলয়েডীয় মিশ্রণের উদাহরণ হল গোল্ড সল।
জলে গ্যাসের দ্রাব্যতা বাড়াতে হলে চাপ ___ হবে।
উত্তর – জলে গ্যাসের দ্রাব্যতা বাড়াতে হলে চাপ বাড়াতে হবে।
সম্পৃক্ত দ্রবণ + দ্রাবক = ___ -দ্রবণ।
উত্তর – সম্পৃক্ত দ্রবণ + দ্রাবক = অসম্পৃক্ত দ্রবণ।
সম্পৃক্ত দ্রবণে তাপ প্রয়োগ করলে দ্রবণটি ___ হয়ে যায়।
উত্তর – সম্পৃক্ত দ্রবণে তাপ প্রয়োগ করলে দ্রবণটি অসম্পৃক্ত হয়ে যায়।
নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণে উপস্থিত দ্রাবের তুলনায় বেশি পরিমাণ দ্রাব দ্রবীভূত থাকলে দ্রবণটিকে ___ দ্রবণ বলে।
উত্তর – নির্দিষ্ট উষ্ণতায় সম্পৃক্ত দ্রবণে উপস্থিত দ্রাবের তুলনায় বেশি পরিমাণ দ্রাব দ্রবীভূত থাকলে দ্রবণটিকে অতিপৃক্ত দ্রবণ বলে।
সোডিয়াম থায়োসালফেট কেলাসকে উত্তপ্ত করলে ___ দ্রবণ উৎপন্ন হয়।
উত্তর – সোডিয়াম থায়োসালফেট কেলাসকে উত্তপ্ত করলে অতিপৃক্ত দ্রবণ উৎপন্ন হয়।
একটি উদ্গ্রাহী পদার্থের উদাহরণ হল ___।
উত্তর – একটি উদ্গ্রাহী পদার্থের উদাহরণ হল ক্যালশিয়াম ক্লোরাইড।
___ কে সর্বজনীন দ্রাবক বলে।
উত্তর – জল -কে সর্বজনীন দ্রাবক বলে।
জল হল ___ দ্রাবক কিন্তু ইথার হল ___ দ্রাবক।
উত্তর – জল হল অজৈব দ্রাবক কিন্তু ইথার হল জৈব দ্রাবক।
আইসক্রিম হল একপ্রকার বিশেষ ___। একে ‘Sol-id foam’ বা ‘Solid sus-pension’ দুটিই বলা যায়।
উত্তর – আইসক্রিম হল একপ্রকার বিশেষ কোলয়েড। একে ‘Sol-id foam’ বা ‘Solid sus-pension’ দুটিই বলা যায়।
রসায়নবিদ ___ ‘কোলয়েড’ নিয়ে প্রচুর গবেষণা করেন যা পরবর্তীকালে ‘dialysis’ বিদ্যার সূচনা করে। তাঁকে ‘___’ -এর প্রতিষ্ঠাতাও বলা হয়।
উত্তর – রসায়নবিদ থমাস গ্রাহাম ‘কোলয়েড’ নিয়ে প্রচুর গবেষণা করেন যা পরবর্তীকালে ‘dialysis’ বিদ্যার সূচনা করে। তাঁকে ‘colloid chemistry‘-এর প্রতিষ্ঠাতাও বলা হয়।
আমাদের দেহের রক্ত হল এক প্রকার ‘___’ -এর উদাহরণ।
উত্তর – আমাদের দেহের রক্ত হল এক প্রকার ‘সল‘ -এর উদাহরণ।
ঠিক বা ভুল নির্বাচন করো
সব মিশ্রণই দ্রবণ কিন্তু সব দ্রবণই মিশ্রণ নয়।
উত্তর – ভুল।
সঠিক উত্তর – সব মিশ্রণ দ্রবণ নয়, কিন্তু সব দ্রবণই মিশ্রণ।
যে-কোনো প্রকৃত দ্রবণই হল সমসত্ত্ব মিশ্রণ।
উত্তর – ঠিক।
প্রকৃত দ্রবণের কণা ফিলটার কাগজ ভেদ করতে পারে না।
উত্তর – ভুল।
সঠিক উত্তর – পারে।
কোলয়েড দ্রবণ একটি সমসত্ত্ব দ্রবণ।
উত্তর – ভুল।
সঠিক উত্তর – অসমসত্ত্ব দ্রবণ।
তরলের মধ্যে গ্যাসের দ্রাব্যতা উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে বৃদ্ধি পায়।
উত্তর – ভুল।
সঠিক উত্তর – হ্রাস পায়।
ক্যালশিয়াম সালফেট গরম জলের চেয়ে ঠান্ডা জলে বেশি দ্রাব্য।
উত্তর – ঠিক।
নির্দিষ্ট উষ্ণতায় অসম্পৃক্ত দ্রবণে অতিরিক্ত দ্রাব যোগ করলে ঘনত্ব অপরিবর্তিত থাকে।
উত্তর – ভুল।
সঠিক উত্তর – ঘনত্ব বৃদ্ধি পায়।
কেলাস মধ্যস্থ কেলাসজলের অণুর ওপর কেলাসের জ্যামিতিক আকার ও বর্ণ নির্ভর করে।
উত্তর – ঠিক।
জলাকর্ষী পদার্থ জলীয় বাষ্প শোষণ করে ওই জলে দ্রবীভূত হয়ে জলীয় দ্রবণ উৎপন্ন করে।
উত্তর – ভুল।
সঠিক উত্তর – ওই জলে দ্রবীভূত হয় না।
দু-একটি শব্দে উত্তর দাও
50 cc অ্যালকোহলে 10 cc জল মেশানো হল। দ্রাব ও দ্রাবক উল্লেখ করো।
দ্রাব জল, দ্রাবক অ্যালকোহল।
সোডা ওয়াটারে কোনটি দ্রাব এবং কোনটি দ্রাবক?
সোডা ওয়াটারে দ্রাব – কার্বন ডাইঅক্সাইড এবং দ্রাবক – জল।
প্যালাডিয়াম সাধারণ উষ্ণতায় হাইড্রোজেন গ্যাস শোষণ করে। এখানে দ্রাব ও দ্রাবক কোনটি?
প্যালাডিয়াম সাধারণ উষ্ণতায় হাইড্রোজেন গ্যাস শোষণ করে। এখানে দ্রাব – হাইড্রোজেন ও দ্রাবক – প্যালাডিয়াম।
চা -এর দ্রাব ও দ্রাবক কী কী লেখো।
চা -এর দ্রাব – চা পাতার নির্যাস, ও দ্রাবক – জল।
জুতোর কালি কীসের মিশ্রণ?
জুতোর কালি কঠিনে তরলের মিশ্রণ।
প্রকৃত দ্রবণে দ্রাব যে ভূমিকা পালন করে, কোলয়েডীয় দ্রবণের কোন্ অংশ সেই ভূমিকা পালন করে?
প্রকৃত দ্রবণে দ্রাব যে ভূমিকা পালন করে, কোলয়েডীয় দ্রবণের কোলয়েডের বিস্তৃত দশা অংশ সেই ভূমিকা পালন করে।
কোন্ ধরনের কণা তড়িৎধর্ম প্রদর্শন করে?
কোলয়েড কণা ধরনের কণা তড়িৎধর্ম প্রদর্শন করে।
বায়ুতে উপস্থিত একটি কোলয়েডের উদাহরণ দাও যা বায়ুদূষণ ঘটায়।
বায়ুতে উপস্থিত একটি কোলয়েডের উদাহরণ হল – ধোঁয়াশা, যা বায়ুদূষণ ঘটায়।
একটি বৃহদানবিক কোলয়েড কী?
একটি বৃহদানবিক কোলয়েড স্টার্চ।
দৈনন্দিন জীবনে ব্যবহৃত হয় এমন দুটি কোলয়েডের নাম লেখো।
দৈনন্দিন জীবনে ব্যবহৃত হয় এমন দুটি কোলয়েডের হল দুধ, দই।
মিল্ক অব ম্যাগনেশিয়া কোলয়েডের বিস্তার মাধ্যম ও বিস্তৃত দশার নাম লেখো।
বিস্তার মাধ্যম জল (তরল) এবং বিস্তৃত দশা ম্যাগনেশিয়াম হাইড্রক্সাইড (কঠিন)।
একটি কোলয়েড সিস্টেমের উদাহরণ দাও যেখানে জলের সুক্ষ্মকণাগুলি চর্বির মধ্যে বিস্তৃত থাকে।
একটি কোলয়েড সিস্টেমের উদাহরণ হল মাখন, যেখানে জলের সুক্ষ্মকণাগুলি চর্বির মধ্যেবিস্তৃত থাকে।
বিস্তৃত দশা তরল, বিস্তার মাধ্যম কঠিন হলে সেই কোলয়েড দ্রবণের নাম কী? একটি উদাহরণ দাও।
বিস্তৃত দশা তরল, বিস্তার মাধ্যম কঠিন হলে সেই কোলয়েড দ্রবণের নাম জেল। একটি উদাহরণ হল – দই।
বিস্তার মাধ্যম তরল ও বিস্তৃত দশা কঠিন – এরূপ একটি কোলয়েডের উদাহরণ দাও।
বিস্তার মাধ্যম তরল ও বিস্তৃত দশা কঠিন – এরূপ একটি কোলয়েডের উদাহরণ হল গোল্ড সল।
তরল এরোসলের উদাহরণ দাও।
তরল এরোসলের উদাহরণ হল – কুয়াশা, মেঘ।
জেলির ক্ষেত্রে বিস্তার মাধ্যম ও বিস্তৃত দশা কী কী?
বিস্তার মাধ্যম কঠিন,বিস্তৃত দশা তরল।
জলে-তেল জাতীয় ইমালসনের উদাহরণ দাও।
জলে-তেল জাতীয় ইমালসনের উদাহরণ হল দুধ।
দুধে ইমালসনকারক হিসেবে কাজ করে কোন্ পদার্থ?
দুধে ইমালসনকারক হিসেবে কাজ করে কেসিন নামক প্রোটিন পদার্থ।
জীবাণুনাশক হিসেবে ব্যবহৃত হয় এমন একটি ইমালসনের নাম লেখো।
জীবাণুনাশক হিসেবে ব্যবহৃত হয় এমন একটি ইমালসনের নাম হল ডেটল (জলে-তেল জাতীয় ইমালসন)।
আইসক্রিমে কোন্ সংরক্ষক কোলয়েড ব্যবহৃত হয়?
আইসক্রিমে জিলেটিন সংরক্ষক কোলয়েড ব্যবহৃত হয়।
বায়ুতে ভাসমান ধূলিকণা কোন্ প্রকারের কোলয়েড?
বায়ুতে ভাসমান ধূলিকণা কঠিন এরোসল (বিস্তার মাধ্যম গ্যাসীয় এবং বিস্তৃত দশা কঠিন) প্রকারের কোলয়েড।
ঠান্ডায় জমে যাওয়া ভাতের ফ্যান কীসের উদাহরণ?
ঠান্ডায় জমে যাওয়া ভাতের ফ্যান জেল জাতীয় কোলয়েডের উদাহরণ।
কোলয়েড দ্রবণের অধঃক্ষেপণের নাম কী?
কোলয়েড দ্রবণের অধঃক্ষেপণের নাম হল তঞ্চন বা কোয়াগুলেশন।
সাবানের দ্রবণ ও চিনির দ্রবণের মধ্যে কোনটিতে আলোকরশ্মি বিচ্ছুরিত হয়?
সাবানের দ্রবণ ও চিনির দ্রবণের মধ্যে সাবানের দ্রবণে আলোকরশ্মি বিচ্ছুরিত হয়।
কোলয়েড ও ক্রিস্টালয়েডের পৃথকীকরণে কোন্ পদ্ধতি ব্যবহৃত হয়?
কোলয়েড ও ক্রিস্টালয়েডের পৃথকীকরণে ঝিল্লি বিশ্লেষণ বা ডায়ালিসিস পদ্ধতি ব্যবহৃত হয়।
কোলয়েডীয় সালফার তৈরিতে H2SO4 -এর সঙ্গে কোন্ যৌগের লঘু জলীয় দ্রবণ ব্যবহার করা হয়?
কোলয়েডীয় সালফার তৈরিতে H2SO4 -এর সঙ্গে সোডিয়াম থায়োসালফেটের (Na2S2O3) জলীয় দ্রবণ যৌগের লঘু জলীয় দ্রবণ ব্যবহার করা হয়।
কোলয়েড কণার ব্যাসের সীমা কত?
কোলয়েড কণার ব্যাসের সীমা 10-5 – 10-7 সেমি।
প্রলম্বনের একটি উদাহরণ দাও।
প্রলম্বনের একটি উদাহরণ হল বেরিয়াম সালফেটের (BaSO4) জলীয় দ্রবণ।
জলে উপস্থিত একটি পদার্থ Q এবং এর কণার আকার 80 nm। দ্রবণটির প্রকৃতি কীরূপ?
জলে উপস্থিত একটি পদার্থ Q এবং এর কণার আকার 80 nm। দ্রবণটির প্রকৃতি কোলয়েডীয় দ্রবণ।
দ্রাব্যতা লেখ -এর ক্ষেত্রে X ও Y -অক্ষ কী কী নির্দেশ করে?
দ্রাব্যতা লেখ -এর ক্ষেত্রে X ও Y -অক্ষ X -অক্ষ তাপমাত্রা এবং Y -অক্ষ দ্রাব্যতা নির্দেশ করে।
কোনোকঠিন জলে দ্রবীভূত হওয়ার সময় তাপগ্রাহী দ্রবীভবন হলে, উষ্ণতা বৃদ্ধিতে ওই কঠিনের দ্রাব্যতার কীরূপ পরিবর্তন ঘটে?
কোনোকঠিন জলে দ্রবীভূত হওয়ার সময় তাপগ্রাহী দ্রবীভবন হলে, উষ্ণতা বৃদ্ধিতে ওই কঠিনের দ্রাব্যতা দ্রুত বৃদ্ধি পায়।
পটাশিয়াম নাইট্রেটের জলে দ্রবীভূত হওয়া তাপগ্রাহী পরিবর্তন। উষ্ণতা বৃদ্ধিতে জলে পটাশিয়াম নাইট্রেটের দ্রাব্যতা কীভাবে পরিবর্তিত হবে?
পটাশিয়াম নাইট্রেটের জলে দ্রবীভূত হওয়া তাপগ্রাহী পরিবর্তন। উষ্ণতা বৃদ্ধিতে জলে পটাশিয়াম নাইট্রেটের দ্রাব্যতা দ্রুত বৃদ্ধি পায়।
একটি যৌগের নাম লেখো উষ্ণতা বৃদ্ধিতে যার দ্রাব্যতা প্রথমে বাড়ে ও পরে কমে।
একটি যৌগের নাম হল গ্লবার লবণ উষ্ণতা বৃদ্ধিতে যার দ্রাব্যতা প্রথমে বাড়ে ও পরে কমে।
40°C তাপমাত্রায় 20 গ্রাম জলে সর্বোচ্চ M গ্রাম কোনো লবণ দ্রবীভূত থাকলে, ওই তাপমাত্রায় লবণের দ্রাব্যতা কত হবে?
40°C তাপমাত্রায় 20 গ্রাম জলে সর্বোচ্চ M গ্রাম কোনো লবণ দ্রবীভূত থাকলে, ওই তাপমাত্রায় লবণের দ্রাব্যতা 5M হবে।
সম্পৃক্ত দ্রবণে তাপ দিলে উচ্চ উষ্ণতায় কী ঘটবে?
সম্পৃক্ত দ্রবণে তাপ দিলে উচ্চ উষ্ণতায় অসম্পৃক্ত দ্রবণে পরিণত হবে।
নির্দিষ্ট উষ্ণতায় যে দ্রবণ আরও দ্রাব গ্রহণ করতে পারে তাকে কী দ্রবণ বলে?
নির্দিষ্ট উষ্ণতায় যে দ্রবণ আরও দ্রাব গ্রহণ করতে পারে তাকে অসম্পৃক্ত দ্রবণ বলে।
উষ্ণতার পরিবর্তন না করে একটি সম্পৃক্ত দ্রবণকে কীভাবে অসম্পৃক্ত দ্রবণে পরিণত করবে?
উষ্ণতার পরিবর্তন না করে একটি সম্পৃক্ত দ্রবণকে অতিরিক্ত দ্রাবক যোগ করে অসম্পৃক্ত দ্রবণে পরিণত করবে।
উষ্ণতার পরিবর্তন না করে অসম্পৃক্ত দ্রবণকে কীভাবে সম্পৃক্ত দ্রবণে পরিণত করা যায়?
উষ্ণতার পরিবর্তন না করে অসম্পৃক্ত দ্রবণকে অতিরিক্ত দ্রাব দ্রবীভূত করে সম্পৃক্ত দ্রবণে পরিণত করা যায়।
সম্পৃক্ত, অসম্পৃক্ত এবং অতিপৃস্ত দ্রবণকে গাঢ়ত্বের ঊর্ধ্বক্রমে সাজাও।
অসম্পৃক্ত দ্রবণ < সম্পৃক্ত দ্রবণ < অতিপূক্ত দ্রবণ।
এমন একটি দ্রবণের উদাহরণ দাও,যাকে কখনোই সম্পৃক্ত করা যায় না।
এমন একটি দ্রবণের উদাহরণ হল জল এবং ইথাইল অ্যালকোহলের দ্রবণ,যাকে কখনোই সম্পৃক্ত করা যায় না।
একটি সোদক কেলাসের নাম লেখো।
একটি সোদক কেলাসের নাম হল তুঁতে (CuSO4⋅5H2O)।
বীজ কেলাস ব্যবহার করে একটি কেলাসনের উদাহরণ দাও।
বীজ কেলাস ব্যবহার করে একটি কেলাসনের উদাহরণ হল ফটকিরির কেলাসন।
কাপড় কাচার সোডা ও ক্যালশিয়াম ক্লোরাইডের মধ্যে কোনটি উদ্ত্যাগী কেলাস?
কাপড় কাচার সোডা ও ক্যালশিয়াম ক্লোরাইডের মধ্যে কাপড় কাচার সোডা উদ্ত্যাগী কেলাস।
জলের সংস্পর্শে নীল হয়ে যায় এমন একটি পদার্থের নাম ও সংকেত লেখো।
জলের সংস্পর্শে নীল হয়ে যায় এমন একটি পদার্থের নাম ও সংকেত হল অনার্দ্র সাদা বর্ণের কপার সালফেট।
ডেসিকেটরে নিরুদক হিসেবে কী ব্যবহার করা হয়?
ডেসিকেটরে নিরুদক হিসেবে অনার্দ্র ক্যালশিয়াম ক্লোরাইড ব্যবহার করা হয়।
সোডাভস্ম কী?
সোডাভস্ম হল অনার্দ্র সোডিয়াম কার্বনেট।
মোলারিটি এবং মোলালিটির মধ্যে কোনটি উষ্ণতা নিরপেক্ষ?
মোলারিটি এবং মোলালিটির মধ্যে মোলালিটি উষ্ণতা নিরপেক্ষ।
দ্রবণে ব্যাপন প্রক্রিয়া সংঘটিত হওয়ার কারণ কী?
দ্রবণে ব্যাপন প্রক্রিয়া সংঘটিত হওয়ার কারণ দ্রাব ও দ্রাবক কণার নিরন্তর বিশৃঙ্খল গতি।
জলে দ্রবীভূত হয় এমন দুটি কঠিন জৈব পদার্থের নাম লেখো।
জলে দ্রবীভূত হয় এমন দুটি কঠিন জৈব পদার্থের নাম হল গ্লুকোজ (C6H12O6), ইউরিয়া [CO(NH2)2]।
জলে দ্রবীভূত হয় এমন দুটি তরল জৈব পদার্থের নাম লেখো।
জলে দ্রবীভূত হয় এমন দুটি তরল জৈব পদার্থের নাম হল অ্যাসিটোন, অ্যাসিটিক অ্যাসিড।
জলে দ্রবীভূত হয় এমন দুটি অজৈব কঠিন পদার্থের নাম লেখো।
জলে দ্রবীভূত হয় এমন দুটি অজৈব কঠিন পদার্থের নাম হল তুঁতে (CusO4⋅5H2O), সোডিয়াম নাইট্রেট (NaNO3)।
একটি অজৈব এবং একটি জৈব দ্রাবকের নাম লেখো।
একটি অজৈব এবং একটি জৈব দ্রাবকের নাম হল অজৈব দ্রাবক – জল, জৈব দ্রাবক – কার্বন টেট্রাক্লোরাইড।
বিষক্রিয়া আছে, এমন একটি জৈব দ্রাবকের উদাহরণ দাও।
বিষক্রিয়া আছে, এমন একটি জৈব দ্রাবকের উদাহরণ হল মিথানল (CH3OH)।
চারটি অজলীয় দ্রাবকের নাম লেখো।
চারটি অজলীয় দ্রাবকের নাম হল অ্যালকোহল, ইথার, ক্লোরোফর্ম ও বেঞ্জিন।
চর্বির দ্রাবক কী?
চর্বির দ্রাবক হল ক্লোরোফর্ম।
গালা দ্রবীভূত হয় কোন্ দ্রাবকে?
গালা দ্রবীভূত হয় অ্যালকোহল দ্রাবকে।
জলকে কেন সর্বজনীন দ্রাবক বলা হয় এবং মানবদেহে এটি প্রধান পরিবহণের মাধ্যম হিসেবে কীভাবে কাজ করে?
জল হল সর্বজনীন দ্রাবক, তাই জীবদেহের প্রধান পরিবহণের মাধ্যম হল জল। মানবদেহের সমস্ত জলের 1% কমে গেলেই আমরা তৃষ্ণার্ত অনুভব করি।
একটি গ্লাস ভরতি জলে একমুঠো লবণ গুলে দিলে জলতল বাড়ার পরিবর্তে কমে যায় কেন?
একটি গ্লাস ভরতি জলে যদি তুমি একমুঠো লবণ ফেলে গুলে দাও তবে জলতল বাড়ার পরিবর্তে কমে যাবে।
বামদিকের সঙ্গে ডানদিক মিল করো
নীচের বামদিকের সঙ্গে ডানদিক মিলিয়ে লেখো।
| বামদিক | ডানদিক | উত্তর |
| 1. গ্লবার লবণ | a. K2SO4⋅Al2(SO4)3⋅24H2O | 1. → b. |
| 2. কাপড় কাচার সোডা | b. Na2SO4⋅10H2O | 2. → c. |
| 3. তুঁতে | c. Na2CO3⋅10H2O | 3. → g |
| 4. হোয়াইট ভিট্রিয়ল | d. Na2B4O7⋅10H2O | 4. → i. |
| 5. ফটকিরি | e. FeCl3 | 5. → a. |
| 6. উদ্গ্রাহী পদার্থ | f. Na2S2O3⋅5H2O | 6. → e. |
| 7. জলাকর্ষী পদার্থ | g. CuSO4⋅5H2O | 7. → h. |
| 8. হাইপো | h. P2O5 | 8. → f. |
| 9. বোরাক্স | i. ZnSO4⋅7H2O | 9. → d. |
বিভিন্ন পদ্ধতিতে উৎপন্ন কোলয়েড সলের বর্ণ বিভিন্ন হয় কেন?
কোলয়েড দ্রবণের বর্ণ মূলত নির্ভর করে কোলয়েড কণার আকার বা আকৃতির ওপর। কোলয়েড কণার ব্যাস 10-7 – 10-5 সেমির মধ্যে পরিবর্তিত হওয়ায় বিভিন্ন আকার ও আকৃতির কোলয়েড কণার দ্বারা বিচ্ছুরিত দৃশ্যমান আলোর তরঙ্গদৈর্ঘ্য বিভিন্ন হয়। যেমন – বড়ো কণা দীর্ঘ তরঙ্গদৈর্ঘ্যের আলো শোষণ করায় বিচ্ছুরিত আলোর তরঙ্গদৈর্ঘ্য ছোটো হয়। ছোটো কণা ক্ষুদ্র তরঙ্গদৈর্ঘ্যের আলো শোষণ করায় বিচ্ছুরিত আলোর তরঙ্গদৈর্ঘ্য দীর্ঘ হয়। ফলে, বিভিন্ন পদ্ধতিতে উৎপন্ন কোলয়েড সলের কণাগুলির আকার আলাদা হওয়ায় কোলয়েডগুলির বর্ণও আলাদা হয়। যেমন – গোল্ড সলের বর্ণ লাল। কিন্তু গোল্ড সলের আকার ক্রমশ বৃদ্ধি পেলে সল লাল বর্ণ থেকে নীল বর্ণে পরিণত হয়।
নদীর মোহানায় বদ্বীপ গঠিত হয় কেন?
নদীর জলে প্রলম্বিত কাদা ও অন্যান্য অপদ্রব্য কোলয়েড দ্রবণ হিসেবে কাজ করে। এই কোলয়েড ঋণাত্মক তড়িদ্গ্রস্ত। নদীর পলিমাটি মিশ্রিত জল যখন সমুদ্রে মেশে তখন সমুদ্রে লবণাক্ত জলে মিশ্রিত তড়িদবিশ্লেষ্য পদার্থের (যেমন – NaCl, MgSO4) ক্যাটায়নগুলি যুক্ত হওয়ায় কোলয়েড কণাগুলি ওই স্থানে তঞ্চিত হয়ে অবঃক্ষিপ্ত হয় এবং দীর্ঘদিন এই প্রক্রিয়ার ফলে বদ্বীপের সৃষ্টি হয়।
অ্যাকোয়া ড্যাগ ও অয়েল ড্যাগ কী?
জলে গ্রাফাইটের কোলয়েড হল অ্যাকোয়া ড্যাগ যেখানে বিস্তার মাধ্যম জল এবং বিস্তৃত দশা গ্রাফাইট। ক্যাথোড রে টিউবে গ্রাফাইটের আস্তরণ দিতে এই কোলয়েড ব্যবহৃত হয়।
তেলে গ্রাফাইটের কোলয়েড হল অয়েল ড্যাগ যেখানে বিস্তার মাধ্যম তেল এবং বিস্তৃত দশা গ্রাফাইট। পিচ্ছিলকারক পদার্থরূপে বিভিন্ন যন্ত্রাংশে এই কোলয়েড ব্যবহৃত হয়।
অ্যালকাসল ও হাইড্রোসল বলতে কী বোঝায়?
অ্যালকাসল এক প্রকার সল। এই সলের বিস্তার মাধ্যম অ্যালকোহল ও বিস্তৃত দশা কঠিন।
হাইড্রোসল এক প্রকার সল। এই সলের বিস্তার মাধ্যম জল ও বিস্তৃত দশা কঠিন।
SPM কি?
বায়ু মাধ্যমে তরল বা কঠিন পদার্থের সূক্ষ্ম কণা মিশে যে এরোসল তৈরি করে, তাকে SPM (Suspended Particulate Matter) বলে। শহরাঞ্চলে SPM -এর মান সর্বাধিক হয়, কারণ – শহরাঞ্চলে শিল্পকারখানা ও অতিরিক্ত যানবাহনের কারণে বায়ুদূষণ বেশি হয়।
ডুবুরিদের জলের তলা থেকে হঠাৎ করে উপরে উঠে আসা উচিত নয় – উক্তিটি ব্যাখ্যা করো।
জলের নীচে শ্বাসক্রিয়া সম্পন্ন করার জন্য ডুবুরিরা যে স্বয়ং সম্পূর্ণ শ্বাসযন্ত্র ব্যবহার করে তার মধ্যে উচ্চচাপে বায়ু রাখা থাকে। উচ্চচাপের জন্য বায়ুর উপাদানগুলি শ্বাসক্রিয়ার সময় ডুবুরিদের দেহের রক্তে ও অন্যান্য দেহরসে অনেক বেশি মাত্রায় দ্রবীভূত হয়। এই অবস্থায় ডুবুরিরা যদি জলের উপরে হঠাৎ উঠে আসে, তবে চাপ হঠাৎ যথেষ্ট পরিমাণে হ্রাস পাওয়ায় রক্তে N2 গ্যাসের দ্রাব্যতাও হ্রাস পায় এবং বুদ্বুদ আকারে দ্রুত নির্গত হওয়ার চেষ্টা করে। এর ফলে রক্তবাহী কৈশিক নালির অভ্যন্তরে অত্যধিক চাপের সৃষ্টি করে এবং দেহের রক্তপ্রবাহ বিঘ্নিত হয়। ফলে, ডুবুরিদের দেহে অসহ্য যন্ত্রণার সৃষ্টি হয় এবং অনেক সময় তারা মৃত্যুমুখে পতিত হয়।
লাইকার অ্যামোনিয়া বোতলের ছিপি খোলার আগে বোতলটি ঠান্ডা করা উচিত কেন?
লাইকার অ্যামোনিয়া হল অ্যামোনিয়ার গাঢ় সম্পৃক্ত জলীয় দ্রবণ (আপেক্ষিক গুরুত্ব 0.88)। লাইকার অ্যামোনিয়ার বোতলে অ্যামোনিয়া উচ্চচাপে দ্রবীভূত করে রাখা হয়। এই অবস্থায় বোতল খুললে বোতলের ভেতরের চাপ হঠাৎ কমে যাওয়ায় জলে অ্যামোনিয়ার দ্রাব্যতা কমে যায় এবং গ্যাসীয় অ্যামোনিয়ার সঙ্গে জলীয় দ্রবণও তীব্র বেগে ছিটকে বেরিয়ে আসে। ফলে মারাত্মক দুর্ঘটনা ঘটতে পারে। তাই বোতল খোলার আগে বোতলটি ঠান্ডা করে নিলে অ্যামোনিয়ার দ্রাব্যতা বৃদ্ধি পায় এবং বোতল খোলার সময় ছিটকে বেরিয়ে এসে দুর্ঘটনা ঘটার সম্ভাবনা থাকে না।
হেরির সূত্রটি বিবৃত করো।
স্থির উষ্ণতায় কোনো তরল দ্রাবকে কোনো গ্যাসের দ্রাব্যতা দ্রবণের সঙ্গে সাম্যাবস্থায় থাকা উক্ত গ্যাসের চাপের সমানুপাতিক। অর্থাৎ, উষ্ণতা স্থির থাকলে কোনো তরল দ্রাবকে গ্যাসীয় পদার্থের দ্রাব্যতা চাপ বাড়ালে বাড়ে এবং চাপ কমালে হ্রাসপ্রাপ্ত হয়।
কোনো নির্দিষ্ট গাঢ়ত্বের \(\left(\frac WV\right)\) দ্রবণের উষ্ণতা বৃদ্ধি করা হলে দ্রবণটির গাঢ়ত্বের কী কী পরিবর্তন ঘটতে পারে তা উল্লেখ করো।
- উষ্ণতা বাড়ালে দ্রবণের আয়তন বাড়ে। কিন্তু দ্রবণের মধ্যে দ্রাবের পরিমাণ নির্দিষ্ট বা স্থির থাকায় বেশি আয়তনের দ্রবণে একই পরিমাণ দ্রাব দ্রবীভূত থাকে। ফলে, দ্রবণের গাঢ়ত্ব হ্রাস পেতে পারে।
- উষ্ণতা বাড়ালে তরল দ্রাবক বাষ্পীভূত হয়ে দ্রবণ থেকে দূরীভূত হয়। কিন্তু দ্রবণের মধ্যে দ্রাবের (অনুদ্বায়ী) পরিমাণ নির্দিষ্ট বা স্থির থাকায় কম আয়তনের দ্রাবকে একই পরিমাণ দ্রাব দ্রবীভূত থাকে। ফলে, দ্রবণের গাঢ়ত্ব বৃদ্ধি পেতে পারে।
সমপ্রকৃতির দ্রাবক সমপ্রকৃতির দ্রাব-কে দ্রবীভূত করে (like dissolves like) – ব্যাখ্যা করো।
কোনো দ্রাবকে দ্রাব যোগ করলে তা দ্রবীভূত হবে কি না তা দ্রবণে উপস্থিত আন্তরাণবিক বলের দ্বারা নির্ণীত হয়। এক্ষেত্রে –
- দ্রাব অণু – দ্রাব অণু,
- দ্রাব অণু – দ্রাবক অণু এবং
- দ্রাবক অণু – দ্রাবক অণুর মধ্যে আন্তঃক্রিয়ার ফলে বল উদ্ভূত হয়।
এদের প্রকৃতি ও মাত্রা প্রায় সমান হলে তবেই দ্রাব পদার্থ, দ্রাবকে দ্রবীভূত হয়। তাই পোলার যৌগগুলি পোলার দ্রাবকে এবং নন্-পোলার যৌগগুলি নন্-পোলার দ্রাবকে দ্রবীভূত হয়।
Class 9 Physical Science – Notes for All Chapters
| Chapter Name | Tropics |
|---|---|
| পরিমাপ | পরিমাপ ও একক বিভিন্ন মাপের একক মাত্রা পরিমাপ |
| বল ও গতি | স্থিতি ও গতি গতির সমীকরণ নিউটনের প্রথম গতিসূত্র নিউটনের দ্বিতীয় গতি সূত্র নিউটনের তৃতীয় গতিসূত্র বিভিন্ন ধরনের বল রৈখিক ভরবেগ রৈখিক ভরবেগ সংরক্ষণ |
| পদার্থ : গঠন ও ধর্ম | তরল ও বায়ুর চাপ আর্কিমিডিসের নীতি পৃষ্ঠটান সান্দ্রতা বার্নোলির নীতি স্থিতিস্থাপকতা |
| পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ | পরমাণুর গঠন মোলের ধারণা দ্রবণ অ্যাসিড, ক্ষার, লবণ মিশ্রণের উপাদানের পৃথকীকরণ জল |
| শক্তির ক্রিয়া , কার্য, ক্ষমতা | শক্তির ক্রিয়া , কার্য, ক্ষমতা |
| তাপ | ক্যালোরিমিতি কার্য ও তাপের তুল্যতা লীনতাপ সম্পৃক্ত ও অসম্পৃক্ত বাষ্প জলের ব্যতিক্রান্ত প্রসারণ |
| শব্দ | শব্দের উৎস : কম্পন শব্দের বিস্তার : তরঙ্গ শব্দের কয়েকটি ধর্ম শব্দের বৈশিষ্ট্য মানুষের কান ও শব্দ শোনার কৌশল শব্দদূষণ |
আজকের আর্টিকেলে আমরা নবম শ্রেণির ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “দ্রবণ” থেকে পরীক্ষায় আসা গুরুত্বপূর্ণ প্রশ্ন ও উত্তরগুলো আলোচনা করেছি। এই প্রশ্নোত্তরগুলো নবম শ্রেণির বার্ষিক পরীক্ষা, এমনকি চাকরি বা যেকোনো প্রতিযোগিতামূলক পরীক্ষার জন্যও উপযোগী। কারণ, এই অধ্যায়ের প্রশ্ন প্রায়ই বিভিন্ন পরীক্ষায় কমন আসে।
আশা করি, এই আর্টিকেলটি আপনাদের পরীক্ষার প্রস্তুতিতে কিছুটা হলেও সাহায্য করবে। যদি কোনো প্রশ্ন, মতামত বা সাহায্যের প্রয়োজন হয়, নিচে কমেন্ট করে জানাতে পারেন কিংবা টেলিগ্রামে যোগাযোগ করুন—আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত।
ধন্যবাদ সবাইকে।






Leave a Comment