এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “অসমযোজী বন্ধন বলতে কী বোঝো? অসমযোজী যৌগ কী? উদাহরণ দাও।” — নিয়ে আলোচনা করব। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ।

অসমযোজী বন্ধন বলতে কী বোঝো? অসমযোজী যৌগ কী? উদাহরণ দাও।
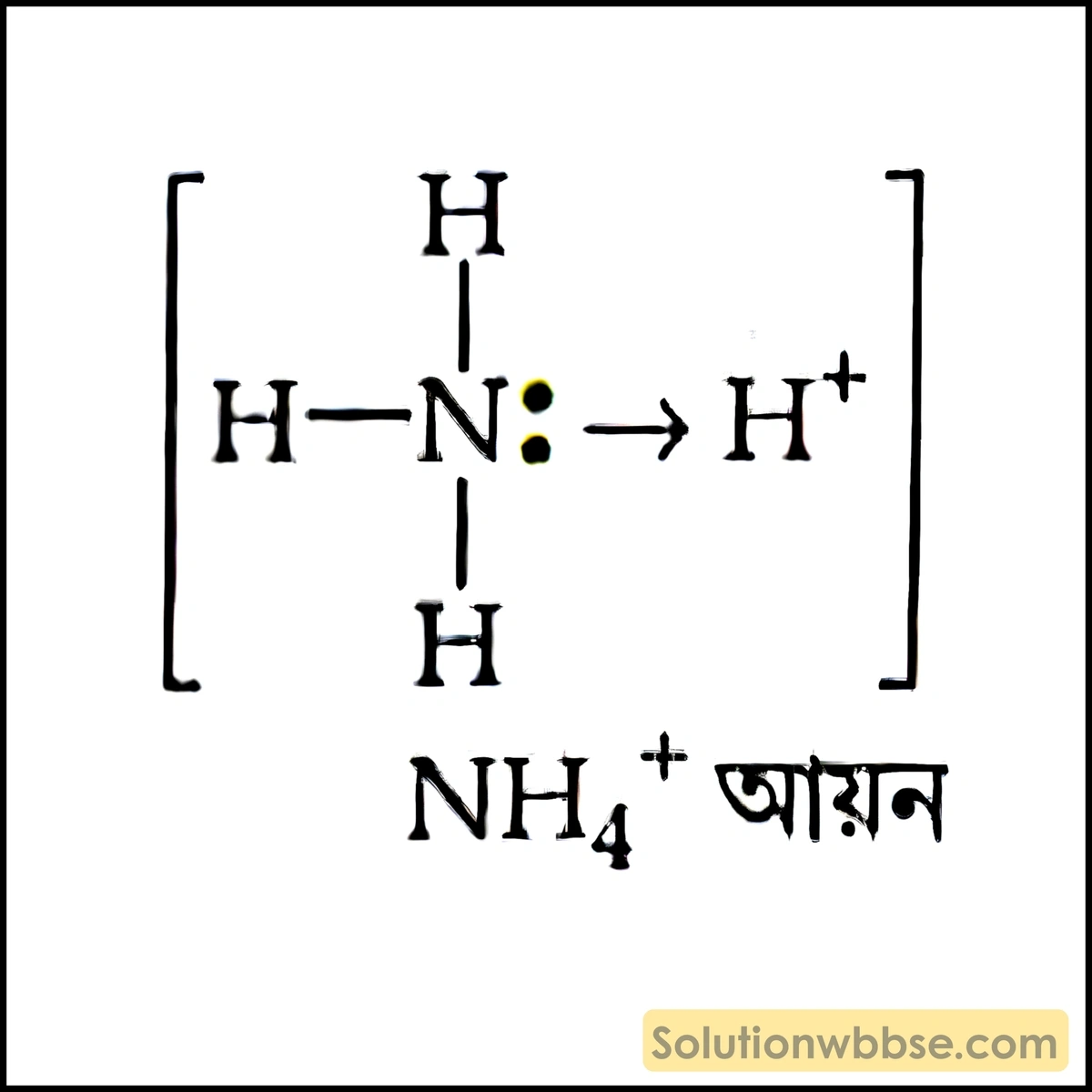
রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী দুটি পরমাণুর মধ্যে একটি পরমাণু দুটি ইলেকট্রন (ইলেকট্রন জোড়) দান করে উভয় পরমাণু ওই ইলেকট্রন জোড়টি সমভাবে ব্যবহার করে তাদের সর্ববহিস্থ কক্ষে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস ঘটিয়ে যে বন্ধন সৃষ্টি করে তাকে অসমযোজী বন্ধন বলে এবং এই বন্ধন গঠনের মাধ্যমে যে যৌগ গঠিত হয় তাকে অসমযোজী যৌগ বলে।
উদাহরণ – অ্যামোনিয়াম আয়ন (NH₄⁺), অ্যালুমিনিয়াম ক্লোরাইডের ডাইমার (Al₂Cl₆), সালফিউরিক অ্যাসিড (H₂SO₄), নাইট্রিক অ্যাসিড (HNO₃) ইত্যাদি।
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “অসমযোজী বন্ধন বলতে কী বোঝো? অসমযোজী যৌগ কী? উদাহরণ দাও।” — নিয়ে আলোচনা করেছি। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “আয়নীয় ও সমযোজী বন্ধন” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন।






Leave a Comment