আজকের আর্টিকেলে আমরা নবম শ্রেণীর ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “পরমাণুর গঠন” থেকে সহজ ও সংক্ষিপ্ত প্রশ্ন-উত্তর শেয়ার করবো। এই প্রশ্নগুলো নবম শ্রেণির ইউনিট টেস্ট থেকে বার্ষিক পরীক্ষা এর জন্য যেমন গুরুত্বপূর্ণ, তেমনি চাকরি বা বিভিন্ন প্রতিযোগিতার পরীক্ষাতেও কাজে লাগবে। এই অধ্যায় থেকে স্কুল পরীক্ষা থেকে শুরু করে চাকরির পরীক্ষায় প্রায়ই প্রশ্ন আসে, তাই এই প্রশ্নোত্তরগুলো সবাইকে সাহায্য করবে। প্রতিটি প্রশ্নের উত্তর সহজ ভাষায় লেখা হয়েছে, যাতে সবাই বুঝতে পারেন। পড়ার শেষে এই অধ্যায়ের মুখ্য বিষয়গুলো আপনার আয়ত্তে চলে আসবে এবং যেকোনো পরীক্ষায় আত্মবিশ্বাসের সঙ্গে লিখতে পারবেন।
জ্ঞানমূলক প্রশ্নোত্তর
পরমাণু কাকে বলে?
পরমাণু (Atom) – মৌলিক পদার্থের ক্ষুদ্রতম কণা যার মধ্যে মৌলের সমস্ত ধর্ম বজায় থাকে এবং যা রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তাকে পরমাণু বলে।
পরমাণুর মূল উপাদান কণাগুলি কী কী?
পরমাণুর মূল উপাদান কণাগুলি হল ধনাত্মক তড়িদ্গ্রস্ত কণা প্রোটন, ঋণাত্মক তড়িদ্গ্রস্ত কণা ইলেকট্রন এবং নিস্তড়িৎ কণা নিউট্রন।
কণাগুলিকে প্রাথমিক কণা বা মৌলিক কণা বলে কেন?
ইলেকট্রন, প্রোটন ও নিউট্রন হল প্রত্যেক পরমাণুর গঠনগত আবশ্যিক উপাদান (ব্যতিক্রম – সাধারণ হাইড্রোজেনে নিউট্রন নেই)। এই তিনটি কণার বিভিন্ন সংখ্যায় সংযোগ ও বিন্যাসের ফলেই সকল মৌলের সৃষ্টি হয়েছে। সকল পদার্থ তৈরির মূলে এই কণাগুলি থাকায় এদের প্রাথমিক কণা বা আদি কণা বলে। কণাগুলি অবিভাজ্য ও স্বতন্ত্র ধর্ম বিশিষ্ট। তাই এদের মৌলিক কণাও বলে।
পরমাণুতে মূল উপাদান কণা ছাড়াও কিছু অস্থায়ী ও সংমিশ্র কণা উপস্থিত থাকে, যা পরমাণুতর (Sub-atomic) কণার অন্তর্ভুক্ত। নিচের কোনটি সংমিশ্র কণার উদাহরণ?
পরমাণুতে মূল উপাদান কণা ছাড়াও কিছু অস্থায়ী কণা – 1. পজিট্রন, 2. মেসন, 3. নিউট্রিনো, 4. অ্যান্টি-নিউট্রিনো, 5. অ্যান্টি-প্রোটন এবং সংমিশ্র কণা – 1. ডয়টেরন, 2. আলফা কণা উপস্থিত থাকে। মূল কণাসহ এই সকল কণাকে পরমাণুতর (Sub-atomic) কণা বলে।
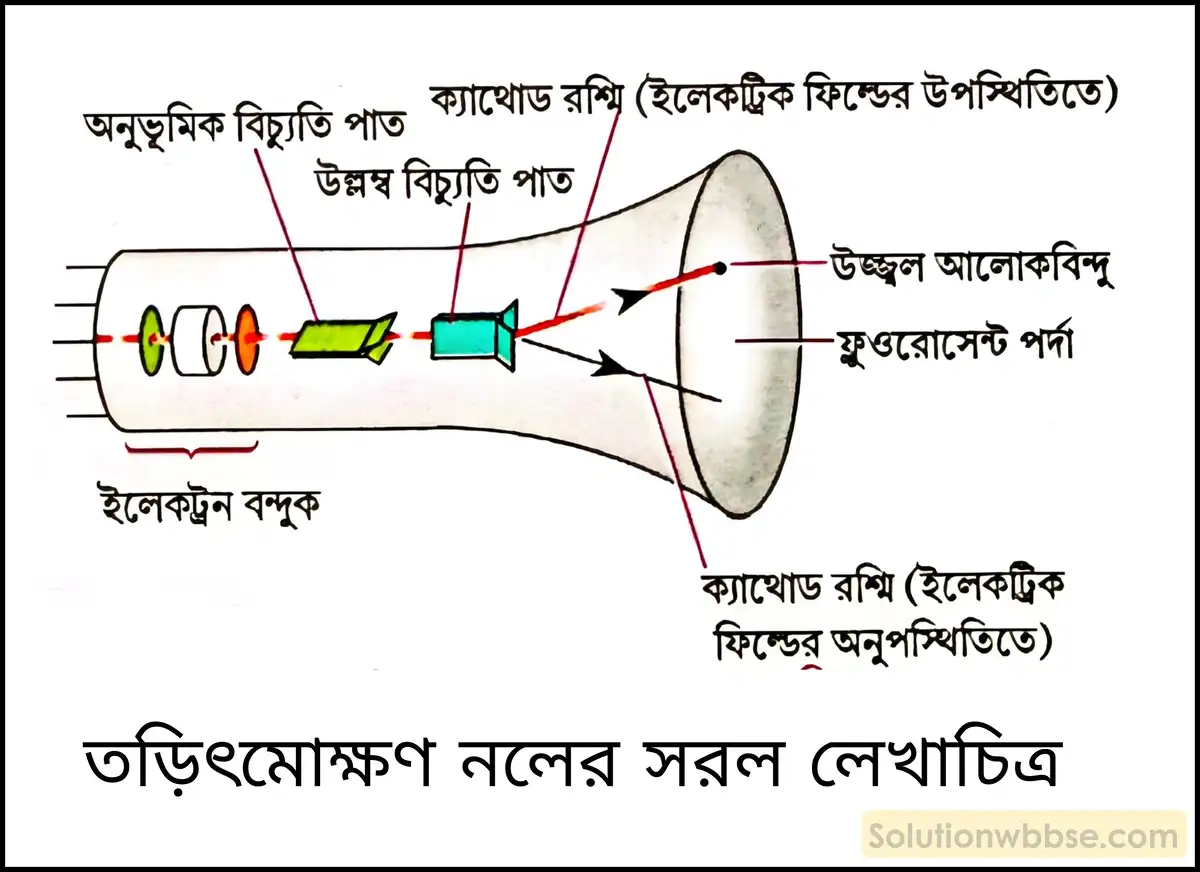
ক্যাথোড রশ্মি কী? তড়িৎমোক্ষণ নলে ক্যাথোড রশ্মি কীভাবে উৎপন্ন হয়?
অথবা, ইলেকট্রনের আবিষ্কার সংক্রান্ত পরীক্ষাটি বর্ণনা করো।
ক্যাথোড রশ্মি হল নির্দিষ্ট ভরবিশিষ্ট (অতিশয় নগণ্য) দ্রুতগামী ঋণাত্মক আধানযুক্ত একপ্রকার অতি ক্ষুদ্র কণার স্রোত। বিজ্ঞানী স্টোনি ঋণাত্মক আধানযুক্ত এই অতি ক্ষুদ্র কণাগুলির নাম দেন ইলেকট্রন।
ইলেকট্রন আবিষ্কার – নিম্নচাপে গ্যাসের তড়িৎমোক্ষণ সংক্রান্ত পরীক্ষার সূত্রে ব্রিটিশ বিজ্ঞানী উইলিয়াম ক্রুকস 1878 খ্রিস্টাব্দে ক্যাথোড রশ্মি আবিষ্কার করেন।
তড়িৎমোক্ষণ নলে প্রায় 0.01 mm পারদ চাপে (অতি নিম্নচাপে) গ্যাস রেখে নলের ধাতব তড়িদ্দ্বার দুটির মধ্যে প্রায় 10 kV বিভবপ্রভেদ প্রয়োগ করলে দেখা যায় যে নিঃশব্দে তড়িৎক্ষরণ ঘটে এবং ক্যাথোড থেকে অ্যানোড অভিমুখে গ্যাসটির মধ্যে দিয়ে একপ্রকার অদৃশ্য ক্ষুদ্র ঋণাত্মক তড়িৎবাহী কণার স্রোত রশ্মির আকারে প্রবাহিত হয়। এই রশ্মির নাম দেওয়া হয় ক্যাথোড রশ্মি।
পরবর্তীকালে বিজ্ঞানী জে জে থমসন 1897 খ্রিস্টাব্দে ক্যাথোড রশ্মি নিয়ে বিভিন্ন পরীক্ষার মাধ্যমে প্রমাণ করে দেখান যে –
- ক্যাথোড রশ্মি প্রকৃতপক্ষে ঋণাত্মক তড়িদ্গ্রস্ত কণার স্রোত,
- এটি তড়িৎ ও চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয়।
- এই রশ্মির আপেক্ষিক আধানের \(\left(\frac em\right)\) মান 1.76 × 1011 কুলম্ব/কিগ্রা এবং এই মান নলে গৃহীত গ্যাস বা ক্যাথোড হিসেবে ব্যবহৃত ধাতুর প্রকৃতি নিরপেক্ষ। ক্যাথোড রশ্মি তথা সমস্ত পরমাণুর অন্যতম মৌলিক উপাদান কণিকা হিসেবে স্বীকৃত এই কণার নাম দেওয়া হয় ইলেকট্রন।
ক্যাথোড রশ্মির বৈশিষ্ট্যগুলি লেখো।
ক্যাথোড রশ্মির নিম্নলিখিত বৈশিষ্ট্যগুলি আছে –
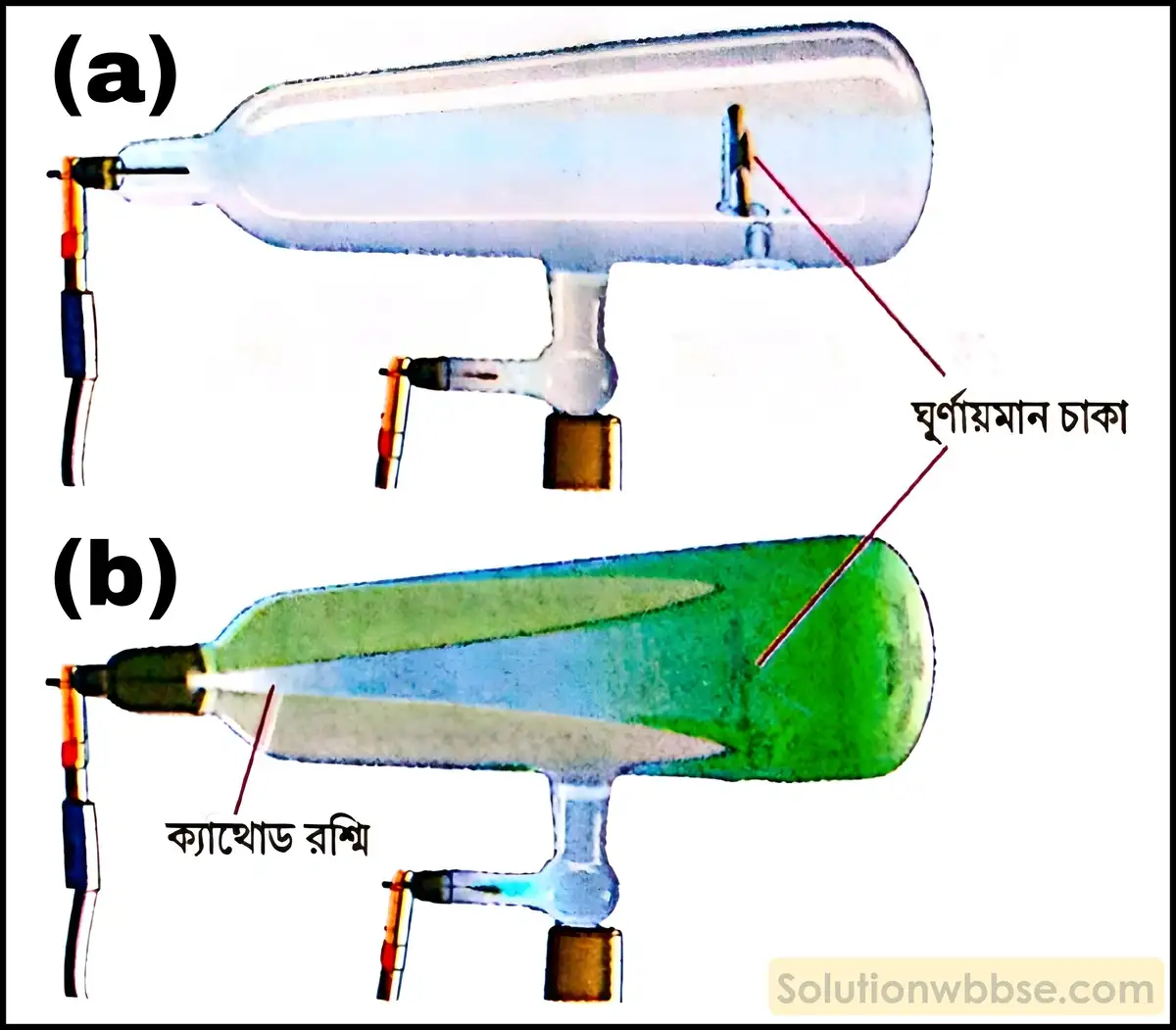
- ক্যাথোড থেকে নির্গত হয়ে এই রশ্মি তীব্রবেগে অ্যানোডের দিকে সরলরেখায় ধাবিত হয়। এই রশ্মির গতিবেগ আলোর গতিবেগের সমান।
- এই রশ্মির গতিপথে কোনো অস্বচ্ছ বস্তু রাখলে তার ছায়া উৎপন্ন হয়।
- রশ্মির গতিপথে পাতযুক্ত হালকা চাকা রাখলে রশ্মির আঘাতে চাকাটি ঘুরতে থাকে। এর থেকে প্রমাণিত হয় যে, ক্যাথোড রশ্মি কতকগুলি ভরযুক্ত কণার স্রোত।
- কোনো বস্তুর ওপর রশ্মিটি পড়লে বস্তুটির উষ্ণতা বৃদ্ধি পায়।
- কোনো গ্যাসের মধ্যে দিয়ে রশ্মিটি প্রবাহিত হলে গ্যাসটি আয়নিত হয়।
- ক্যাথোড রশ্মি ঋণাত্মক আধানযুক্ত কণার স্রোত।
- ক্যাথোড রশ্মির প্রকৃতি তড়িৎমোক্ষণ নলের গ্যাস ও ব্যবহৃত তড়িদ্দ্বারের উপাদানের ওপর নির্ভর করে না।
- এটি প্রতিপ্রভা সৃষ্টি করতে সক্ষম।
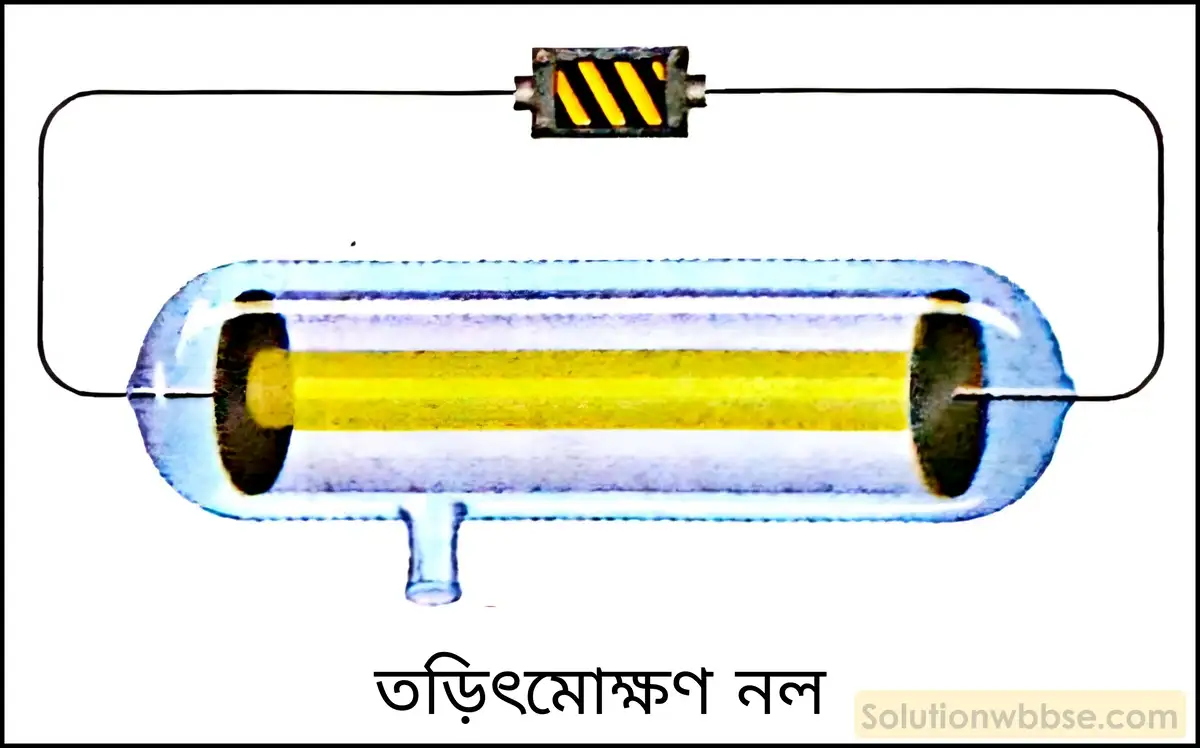
তড়িৎমোক্ষণ মোক্ষণ নলের সংক্ষিপ্ত বিবরণ দাও।
তড়িৎমোক্ষণ মোক্ষণ নলের সংক্ষিপ্ত বিবরণ – তড়িৎমোক্ষণ নল হল একটি আবন্ধ শক্ত কাচের নল (প্রায় 0.5 মিটার লম্বা) যার দুই প্রান্তে দুটি ধাতব তড়িদ্দ্বার যুক্ত থাকে। তড়িদ্দ্বার দুটির একটির সঙ্গে ব্যাটারির ধনাত্মক প্রান্ত যুক্ত থাকে যাকে অ্যানোড বলা হয় এবং অপরটির সঙ্গে ব্যাটারির ঋণাত্মক প্রান্ত যুক্ত থাকে যাকে ক্যাথোড বলে। এই কাচনলের সঙ্গে একটি নির্গম নল যুক্ত থাকে যার সঙ্গে একটি বায়ু নিষ্কাশক পাম্প যুক্ত করে নলের মধ্যস্থ বাতাস বা গ্যাসকে বের করে আনা হয়।
থমসনের তড়িৎমোক্ষণ নলের পরীক্ষায় কোন্ পর্যবেক্ষণ থেকে এই সিদ্ধান্তে আসা গিয়েছিল যে ক্যাথোড রশ্মি কোনো আলোকরশ্মি নয়?
বিজ্ঞানী জে জে থমসনের ক্যাথোড রশ্মি সংক্রান্ত বিভিন্ন পরীক্ষানিরীক্ষায় প্রাপ্ত পর্যবেক্ষণগুলির মধ্যে মূলত দুটি পর্যবেক্ষণ থেকে সিদ্ধান্ত নেওয়া যায় যে ক্যাথোড রশ্মি কোনো আলোকরশ্মি নয় –
- আলোকরশ্মি তড়িৎ-চুম্বকীয় তরঙ্গ – তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয় না। ক্যাথোড রশ্মি নেগেটিভ তড়িৎক্ষেত্র বা চৌম্বক ক্ষেত্র দ্বারা বিকর্ষিত হলেও পজিটিভ তড়িৎক্ষেত্র বা চৌম্বক ক্ষেত্র দ্বারা আকৃষ্ট হয় অর্থাৎ, ক্যাথোড রশ্মি ঋণাত্মক আধানযুক্ত কণার স্রোত, নিস্তড়িৎ নয়।
- আলোকরশ্মি হল ভরহীন, আধানহীন, ইন্দ্রিয়গ্রাহ্য বিকিরণ মাত্র। কিন্তু ক্যাথোড রশ্মির গতিপথে পাতযুক্ত হালকা চাকা রাখলে রশ্মির আঘাতে চাকা ঘুরতে থাকে। এর থেকে প্রমাণিত হয় যে, ক্যাথোড রশ্মি কোনো তরঙ্গ নয় ভরযুক্ত ক্ষুদ্র ক্ষুদ্র কণা সমবায়ে গঠিত।
নিম্নচাপে গ্যাসের মধ্যে দিয়ে তড়িৎমোক্ষণের চারটি ব্যাবহারিক প্রয়োগ উল্লেখ করো।
তড়িৎমোক্ষণের ব্যাবহারিক প্রায়াগ –
- টেলিভিশনের পিকচার টিউবে ব্যবহার করা হয়।
- Oscilloscope নামক যন্ত্রে সময়ের সঙ্গে ভোল্টেজ পরিবর্তন মাপা হয়। এই যন্ত্র তৈরিতে ক্যাথোড রশ্মি টিউব ব্যবহৃত হয়।
- পূর্বে বহুল ব্যবহৃত নিয়ন সাইন, এছাড়াও নিমো টিউব, র্যাডার -এর screen indicator, ফ্লুওরোসেন্ট টিউব, সোডিয়াম ভেপার ল্যাম্প প্রভৃতিতে এই নীতি ব্যবহৃত হয়।
- কম্পিউটার ও টিভির LCD পর্দায় ব্যবহৃত হয়।
বিজ্ঞানী জে জে থমসনের পরমাণু মডেলটি উপস্থাপন করো।
জে জে থমসনের পরমাণু মডেল – পরমাণুর অভ্যন্তরে ইলেকট্রনগুলি কীভাবে অবস্থান করে তা নির্ধারণ করার জন্য বিজ্ঞানী জে জে থমসন 1898 খ্রিস্টাব্দে পরমাণুর একটি মডেল উপস্থাপন করেন। এই মডেলটি থমসনের পরমাণু মডেল বা ‘Plum pudding মডেল‘ নামে পরিচিত।

থমসনের পরমাণু মডেল অনুযায়ী, পরমাণু একটি ধনাত্মক আধানযুক্ত নিরেট গোলক যার পৃষ্ঠতলে বা অভ্যন্তরে ইলেকট্রনগুলি দৃঢ়ভাবে আবদ্ধ থাকে।
থমসনের পরমাণু মডেলের স্বীকার্যগুলি নিম্নরূপ –

- পরমাণু প্রকৃতপক্ষে প্রায় 10-8 cm ব্যাসার্ধ বিশিষ্ট একটি ধনাত্মক তড়িদাহিত সুষম গোলক।
- ইলেকট্রনগুলি সমগ্র গোলক জুড়ে ইতস্তত ছড়িয়ে থাকে। ইলেকট্রনের এই বণ্টন তরমুজের মধ্যে তার বীজগুলি সাজানো বা পুডিং -এর মধ্যে কিশমিশ গাঁথা থাকার সঙ্গে তুলনীয়। পরমাণুর সমগ্র ধনাত্মক আধান এই ইলেকট্রনগুলির মোট আধানের সমান হয় বলে পরমাণু প্রশম বা নিস্তড়িৎ থাকে।
- পরমাণুর সমগ্র ভর তার সমগ্র আয়তন জুড়ে সমানভাবে বিস্তৃত থাকে।
জে জে থমসনের মডেলের সীমাবদ্ধতা উল্লেখ করো।
জে জে থমসালর মডেলের সীমাবদ্ধতা –
- এই পরমাণু মডেলের কোনো পরীক্ষালব্ধ প্রমাণ ছিল না।
- ধনাত্মক আধান ও ঋণাত্মক আধান কীভাবে অবস্থান করবে তার সঠিক ব্যাখ্যা দিতে অসমর্থ।
- রাদারফোর্ডের α-কণা বিচ্ছুরণ পরীক্ষার ফলাফল এই পরমাণু মডেল দ্বারা ব্যাখ্যা করা যায়নি।
কোন মডেলের জন্য 1906 খ্রিস্টাব্দে থমসন নোবেল পুরস্কার পান, যা ‘তরমুজ বা ওয়াটারমেলন মডেল’ নামেও পরিচিত?
এই মডেলের জন্য 1906 খ্রিস্টাব্দে থমসন নোবেল পুরস্কার পান। এই মডেলটিকে ‘তরমুজ বা ওয়াটারমেলন মডেল’-ও বলা হয়ে থাকে।
ক্যানাল রশ্মি কী? এরূপ নামকরণের কারণ কী?
1886 খ্রিস্টাব্দে বিজ্ঞানী গোল্ডস্টাইন খুব কম চাপে সামান্য বায়ুপূর্ণ তড়িৎমোক্ষণ নলে ছিদ্রযুক্ত ক্যাথোড ব্যবহার করে উচ্চ বিভব প্রয়োগ করলে ক্যাথোড রশ্মি উৎপত্তির সঙ্গে সঙ্গে ওই রশ্মির বিপরীতমুখী আর এক প্রকার রশ্মি অ্যানোড প্রান্ত থেকে ক্যাথোডের দিকে দ্রুত গতিতে সরলরেখায় নির্গত হয় এবং ক্যাথোডের ছিদ্রপথ অতিক্রম করে বেরিয়ে যায়। একেই ক্যানাল রশ্মি বা অ্যানোড রশ্মি বা পজিটিভ রশ্মি বলে।
ছিদ্রযুক্ত ক্যাথোড তড়িদ্দ্বার থেকে অর্থাৎ, নালিপথে এই রশ্মির নির্গমন ঘটে বলে একে ‘ক্যানাল রশ্মি’ বলা হয়।
ক্যাথোড রশ্মির \(\frac em\) (আধান/ভর) -এর মান তড়িৎমোক্ষণ নলে যে-কোনো গ্যাস নেওয়া হলেও অপরিবর্তিত থাকে কিন্তু অ্যানোড রশ্মির \(\frac em\) -এর মান গ্যাসের প্রকৃতির ওপর নির্ভর করে কেন?
তড়িৎমোক্ষণ নলে ব্যবহৃত ধাতব ক্যাথোড ও গ্যাসীয় পরমাণুগুলি থেকে নির্গত তীব্র গতিশক্তিসম্পন্ন ইলেকট্রন কণার স্রোতই হল ক্যাথোড রশ্মি। পরমাণুর অন্যতম মূলকণা হওয়ায় যে-কোনো ধাতব ক্যাথোড বা গ্যাসীয় পদার্থ ব্যবহার করা হোক না কেন নির্গত ইলেকট্রনগুলির প্রকৃতি সর্বদা একই থাকে অর্থাৎ, ক্যাথোড রশ্মির \(\left(\frac em\right)\) -এর মান অপরিবর্তিত থাকে।
ক্যাথোড রশ্মির আঘাতে গ্যাসীয় পরমাণুগুলি থেকে ইলেকট্রন বিচ্ছিন্ন হওয়ার ফলে যে ক্যাটায়নগুলি উৎপন্ন হয় তারাই অ্যানোড রশ্মি উৎপন্ন করে থাকে। তাই তড়িৎমোক্ষণ নলে বিভিন্ন গ্যাস ব্যবহার করলে উৎপন্ন ক্যাটায়নের ভর ও আধান স্বাভাবিকভাবেই বিভিন্ন হয়। তাই অ্যানোড রশ্মির \(\left(\frac em\right)\) -এর মান বিভিন্ন গ্যাসের ক্ষেত্রে বিভিন্ন হয় অর্থাৎ, গ্যাসের প্রকৃতির ওপর নির্ভর করে।
বিজ্ঞানী ইউগেন গোল্ডস্টাইন কত সালে প্রথম অ্যানোড রশ্মি তৈরি করেন, এবং কোন বিজ্ঞানী হাইড্রোজেন পরমাণুর ধনাত্মক কণাকে “প্রোটন” নামে নামকরণ করেন?
প্রোটন আবিষ্কার – 1886 খ্রিস্টাব্দে বিজ্ঞানী ইউগেন গোল্ডস্টাইন (Eugen Goldstein) তড়িৎমোক্ষণ নলে বায়ু নিয়ে সর্বপ্রথম অ্যানোড রশ্মি তৈরি করেন। তড়িৎমোক্ষণ নলে সবচেয়ে হালকা মৌলিক গ্যাস হাইড্রোজেন (H2) নিয়ে তড়িৎমোক্ষণ করলে অ্যানোড রশ্মির মধ্যে যে ধনাত্মক আধানযুক্ত কণা পাওয়া যায়, তার ভর অন্য যে-কোনো গ্যাস ব্যবহার করে প্রাপ্ত ধনাত্মক আধানযুক্ত কণার ভরের থেকে কম হয়। সাধারণ হাইড্রোজেন বা প্রোটিয়াম -এর নামানুসারে বিজ্ঞানী রাদারফোর্ড এই কণার নাম দেন প্রোটন।
ক্যাথোড রশ্মি সৃষ্টির কারণ লেখো।
ক্যাথোড রশ্মি সৃষ্টির কারণ – তড়িৎমোক্ষণ নলে উচ্চ ঋণাত্মক বিভবের প্রভাবে ক্যাথোড থেকে ঋণাত্মক আধানগ্রস্ত ইলেকট্রন বিকর্ষিত হয়ে বিচ্ছিন্ন হয়। এই ইলেকট্রনের সঙ্গে সংঘর্ষের ফলে ব্যবহৃত গ্যাসের অণু, পরমাণু থেকে আরো ইলেকট্রন বিচ্ছিন্ন হয়। অ্যানোডের উচ্চ ধনাত্মক আধানের আকর্ষণে মুক্ত ইলেকট্রনগুলি দ্রুত গতিতে স্রোতের আকারে অ্যানোডের দিকে ছুটে যায়।
অ্যানোড রশ্মি সৃষ্টির কারণ লেখো।
অ্যানোড রশ্মি সৃষ্টির কারণ – ক্যাথোড রশ্মির দ্রুত গতির ইলেকট্রনের সঙ্গে সংঘর্ষের কারণে তড়িৎমোক্ষণ নলে ব্যবহৃত গ্যাসের অণু-পরমাণু আয়নে পরিণত হয়। আয়নগুলি অ্যানোডের ধনাত্মক আধানের বিকর্ষণে ও ক্যাথোডের ঋণাত্মক আধানের আকর্ষণে সরলরেখায় দ্রুত বেগে ক্যাথোডের দিকে ছুটে আসে ও ক্যাথোডের ছিদ্রপথে বেরিয়ে যায়।
তেজস্ক্রিয়তা কাকে বলে? কোন্ বিজ্ঞানী কীভাবে তেজস্ক্রিয়তা আবিষ্কার করেন?
তেজস্ক্রিয়তা (Radioactivity) – যে ধর্মের প্রভাবে কতকগুলি ভারী মৌলের পরমাণুর নিউক্লিয়াস চাপ, তাপ, অনুঘটক ইত্যাদি বাহ্যিক শর্ত নিরপেক্ষভাবে অবিরাম ও স্বতঃস্ফূর্তভাবে তীব্র শক্তিশালী এক অদৃশ্য সক্রিয় বিকিরণ নিঃসরণের মাধ্যমে অপেক্ষাকৃত হালকা মৌলের নিউক্লিয়াসে পরিণত হয়, সেই ঘটনাকে তেজস্ক্রিয়তা বলে। ইউরেনিয়াম (U), থোরিয়াম (Th), রেডিয়াম (Ra), অ্যাক্টিনিয়াম (Ac), প্লুটোনিয়াম (Pu) ইত্যাদি হল তেজস্ক্রিয় মৌল।
তেজস্ক্রিয়তার আবিষ্কার – 1896 খ্রিস্টাব্দে ফরাসি বিজ্ঞানী হেনরি বেকেরেল পটাশিয়াম ইউরানিল সালফেটের প্রতিপ্রভার সঙ্গে X-রশ্মির ধর্মের মিল আছে কি না দেখার জন্য বিভিন্ন পরীক্ষানিরীক্ষা করছিলেন। প্রতিপ্রভ পদার্থ পটাশিয়াম ইউরানিল সালফেটের [K2UO2(SO4)2] টুকরোকে মোটা কালো কাগজে মোড়া ফোটোগ্রাফিক প্লেটের ওপর রেখে দেন। কয়েকদিন পর তিনি দেখেন ফোটোগ্রাফিক প্লেটের যে স্থানটির ওপর যৌগটি রাখা ছিল সেই স্থানটি কালো হয়ে গেছে। এর থেকে তিনি সিদ্ধান্তে আসেন যে, ইউরেনিয়ামঘটিত লবণ থেকে নিরন্তর ও স্বতঃস্ফূর্তভাবে উচ্চ ভেদন ক্ষমতাসম্পন্ন একপ্রকার অদৃশ্য রশ্মি বিকিরিত হয় যা ফোটোগ্রাফিক প্লেটকে আক্রমণ করে। এই বিকিরণ তার প্রতিপ্রভা ধর্মের ওপর আদৌ নির্ভর করে না এবং এর নির্গমনকে নিয়ন্ত্রণ করা যায় না। অতি সক্রিয় এই বিকিরণকে হেনরি বেকেরেলের নামানুসারে প্রথমে বলা হত ইউরানিক রশ্মি বা বেকেরেল রশ্মি। পরবর্তীকালে 1898 খ্রিস্টাব্দে মাদাম কুরি এই বিকিরণকে তেজস্ক্রিয় রশ্মি নাম দেন। বেকেরেল, কুরি দম্পতি ও রাদারফোর্ডের গবেষণায় প্রতিষ্ঠিত হয় যে, এই বিকিরণ নির্গমন ইউরেনিয়াম মৌলটির ধর্ম, ইউরেনিয়ামঘটিত যৌগের নয়।
তেজস্ক্রিয় বিকিরণের প্রধান তিনটি উপাদান কী কী এবং কে, কোন সালে \(\gamma\)-রশ্মি ও α ও β-কণার অস্তিত্ব আবিষ্কার করেন?
তেজস্ক্রিয় বিকিরণ α-কণা (He2+ আয়ন), β-কণা (ইলেকট্রন) ও \(\gamma\)-রশ্মির (উচ্চ ভেদন ক্ষমতাসম্পন্ন তড়িৎচুম্বকীয় তরঙ্গ) সমন্বয়। 1900 খ্রিস্টাব্দে পি ভিলার্ড \(\gamma\)-রশ্মি আবিষ্কার করেন ও 1902 খ্রিস্টাব্দে রাদারফোর্ড RaBr2 যৌগ থেকে নির্গত বিকিরণকে তীব্র তড়িৎক্ষেত্রে পাঠিয়ে সংশ্লিষ্ট বিক্ষেপের পর্যালোচনা করতে গিয়ে α ও β-কণার অস্তিত্ব প্রমাণ করেন।
তেজস্ক্রিয় পদার্থ থেকে কী কী রশ্মি নির্গত হয়?
তেজস্ক্রিয় পদার্থ থেকে তিন ধরনের রশ্মি নির্গত হয় –
- α-রশ্মি – ধনাত্মক আধানযুক্ত হিলিয়াম কণার (He2+) স্রোত।
- β-রশ্মি – দ্রুতগামী ইলেকট্রন কণার স্রোত।
- \(\gamma\)-রশ্মি – অতি ক্ষুদ্র তরঙ্গদৈর্ঘ্য বিশিষ্ট এবং উচ্চ শক্তিসম্পন্ন তড়িৎচুম্বকীয় তরঙ্গ।
α-কণার দুটি ধর্ম লেখো।
α-কণার ধর্ম –
- α-কণা হল দুই একক ধনাত্মক আধান বিশিষ্ট হিলিয়াম আয়ন (He2+)।
- α-কণার ভর 1টি প্রোটনের ভরের 4 গুণ অর্থাৎ, 6.644 × 10-27 kg এবং এর আধান 1টি প্রোটনের আধানের দ্বিগুণ অর্থাৎ, 3.204 × 10-19 কুলম্ব।
- α-কণার বেগ আলোর বেগের প্রায় 10% হয়।
নিউক্লিয়াসের আবিষ্কার সংক্রান্ত রাদারফোর্ডের α-কণা বিচ্ছুরণ পরীক্ষাটি ফলাফল ও সিদ্ধান্তসহ উপস্থাপন করো।
রাদারফোর্ডের আলফা কণা পরীক্ষা – বিজ্ঞানী রাদারফোর্ড একটি বায়ুশূন্য আবদ্ধ নলে খুব পাতলা, প্রায় 0.0004 mm পুরু সোনার পাত নিয়ে তার ওপর তেজস্ক্রিয় মৌল বিসমাথ থেকে উৎপন্ন তীব্র গতিসম্পন্ন α-কনা দ্বারা আঘাত করেন। সোনার পাতের পিছনদিকে একটি জিংক সালফাইডের পর্দা রাখেন। ওই পর্দার ওপর α-কণা আঘাত করলে আলোর ঝলক দেখা যায়।
রাদারফোর্ডের আলফা কণার পর্যবেক্ষণ – উপরিউক্ত পরীক্ষা থেকে তিনি নিম্নলিখিত বিষয়গুলি লক্ষ করেন –
- বেশিরভাগ আলফা কণা কোনো বিক্ষেপ না করেই ধাতুর পাত ভেদ করে সরলরেখায় চলে যায়।
- অল্পসংখ্যক আলফা কণা সামান্য কোণে বিক্ষিপ্ত হয়।
- খুব কম সংখ্যক আলফা কণা (20,000 -এর মধ্যে 1টি), 90° বা তার বেশি কোণে, কিছু ক্ষেত্রে এমনকি 180° কোণে বিক্ষেপিত হয়ে ফিরে আসে।
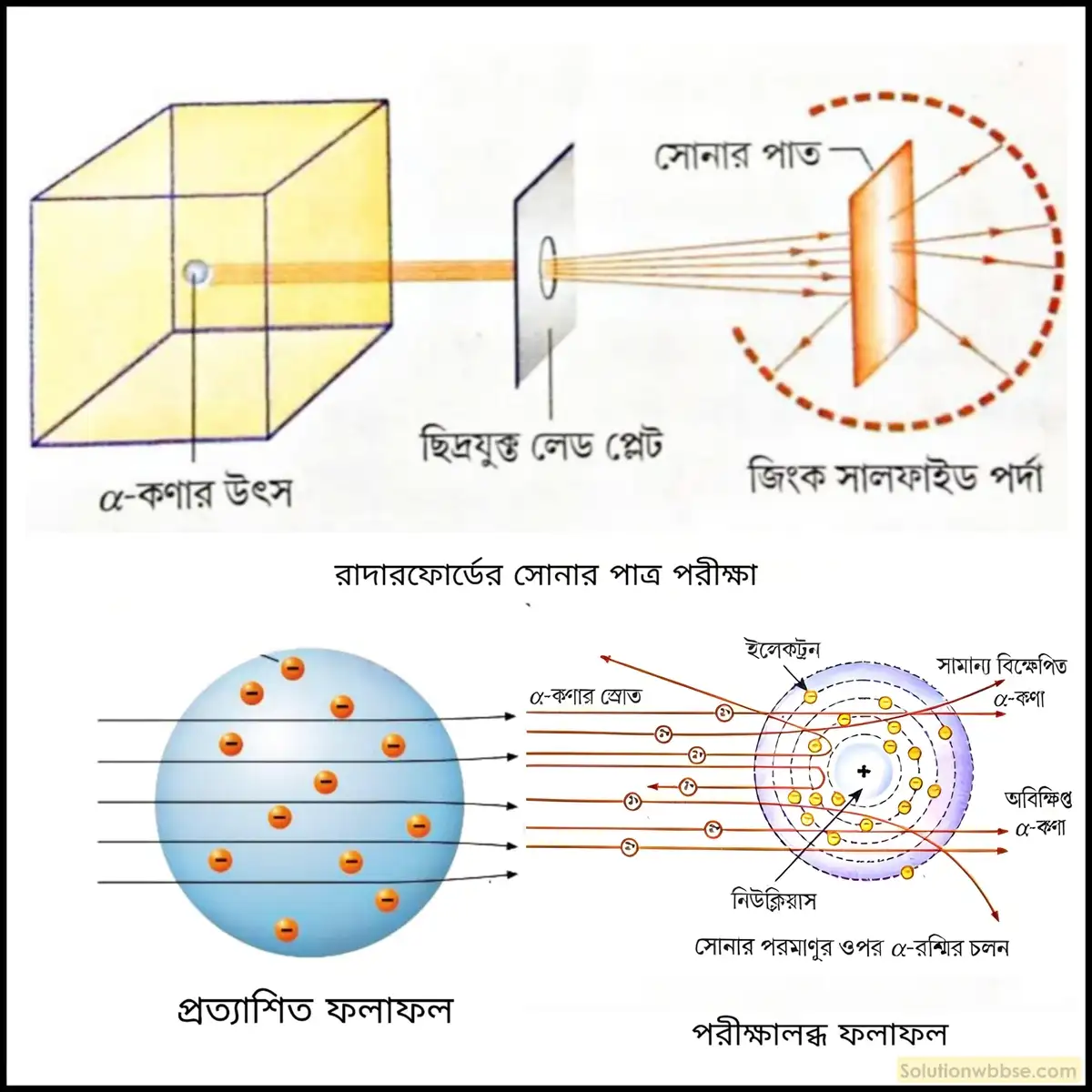
রাদারফোর্ডের আলফা কণার সিদ্ধান্ত – উপরিউক্ত পরীক্ষা থেকে তিনি নিম্নলিখিত সিদ্ধান্তগুলিতে উপনীত হন –
- যেহেতু, বেশিরভাগ আলফা কণা পরমাণু ভেদ করে চলে যায় তাই বলা যায়, পরমাণুর বেশিরভাগ স্থানই ফাঁকা।
- আলফা কণার ভর ইলেকট্রনের ভরের থেকে 7500 গুণ বেশি। তাই পরমাণুর ভিতর দিয়ে আলফা কণা যাবার সময় ইলেকট্রনের সঙ্গে ধাক্কা লেগে বেঁকে যেতে পারে না। সুতরাং, পরমাণুর ধনাত্মক তড়িদাহিত অংশের দ্বারা বিকর্ষণের কারণেই α-কণাগুলি অল্প কোণে বিক্ষিপ্ত হয়।
- α-কণা ধনাত্মক তড়িদ্গ্রস্ত এবং তা কেবল ধনাত্মক আধান দ্বারাই বিকর্ষিত হওয়া সম্ভব। 20,000 -এর মধ্যে 1টি α-কণা 180° কোণে বিক্ষিপ্ত হয়ে ফিরে (recoil) আসে। এই তথ্য থেকে সিন্ধান্তে আসা যায় যে, পরমাণুর কেন্দ্রে অত্যন্ত ক্ষুদ্র পরিসরে ধনাত্মক আধান কেন্দ্রীভূত থাকে। আবার এই পরিমাণ বিকর্ষণ সমতুল্য ভর দ্বারাই ঘটা সম্ভব। তাই বলা যায়, পরমাণুর সমগ্র ধনাত্মক আধান ও ভর তার অতি ক্ষুদ্র অংশে কেন্দ্রীভূত থাকে। এই অংশটিকে বলা হয় কেন্দ্রক বা নিউক্লিয়াস।
রাদারফোর্ডের পরমাণু মডেলের সংক্ষিপ্ত বিবরণ দাও।
রাদারফোর্ডের পরমাণু মডেল – পরমাণুর দুটি অংশ, যথা – পরমাণুর কেন্দ্রক বা নিউক্লিয়াস এবং নিউক্লিয়াসের বাইরের ইলেকট্রন মহল।

কেন্দ্রক বা নিউক্লিয়াস –
- সমগ্র পরমাণুর ভর, পরমাণুর কেন্দ্রে অতি অল্প স্থানে কেন্দ্রীভূত থাকে। একে কেন্দ্রক বা নিউক্লিয়াস বলে।
- পরমাণুর নিউক্লিয়াসে ধনাত্মক আধানযুক্ত প্রোটন কণা অবস্থান করে। তাই পরমাণুর কেন্দ্র বা নিউক্লিয়াস ধনাত্মক হয়।
- পরমাণুর ব্যাসের তুলনায় নিউক্লিয়াসের ব্যাস অনেক কম হয়। তাই বলা যায় পরমাণু নিরেট নয়, এর বেশিরভাগ অংশই ফাঁকা।
নিউক্লিয়াসের বাইরের ইলেকট্রন মহল –
- নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে ঋণাত্মক তড়িদ্গ্রস্ত ইলেকট্রন কণাগুলি ঘুরতে থাকে। পরমাণুর নিউক্লিয়াসে ঠিক যতগুলি প্রোটন থাকে নিউক্লিয়াসের বাইরেও ঠিক ততগুলি ইলেকট্রন থাকে। প্রোটন ও ইলেকট্রনের মোট আধান সমান ও বিপরীত হবার কারণে পরমাণু নিস্তড়িৎ হয়।
- রাদারফোর্ডের মডেল অনুসারে, নিউক্লিয়াসকে কেন্দ্র করে বৃত্তাকার কক্ষপথে ইলেকট্রনগুলি সমদ্রুতিতে নিউক্লিয়াসের চারপাশে আবর্তন করে। নিউক্লিয়াস ও ইলেকট্রনের মধ্যে ক্রিয়াশীল স্থির তাড়িতিক আকর্ষণ বল ইলেকট্রনকে বৃত্তপথে আবর্তনের জন্য প্রয়োজনীয় অভিকেন্দ্র বল সরবরাহ করে থাকে।
ইলেকট্রন মেঘ কী এবং আধুনিক ধারণা অনুযায়ী কক্ষ কীভাবে সংজ্ঞায়িত হয়?
নিউক্লিয়াসের চারপাশে বিভিন্ন দূরত্বে আবর্তনরত ইলেকট্রনগুলি পুঞ্জীভূত হয়ে যে আধান বণ্টন বা সমাবেশ গঠন করে তাকে ‘ইলেকট্রন মেঘ‘ বলে। আধুনিক ধারণা মতে, এই আধান বণ্টনের যে নির্দিষ্ট অঞ্চলগুলিতে ইলেকট্রনকে পাওয়ার সম্ভাবনা সর্বাধিক তাদেরই কক্ষ বলা হয়।
পরমাণুর নিউক্রিয় মডেল বলতে কী বোঝায়?
নিউক্লিয় মডেল – ধনাত্মক তড়িগ্রস্ত নিউক্লিয়াসকে কেন্দ্রে রেখে বিভিন্ন সমকেন্দ্রিক কক্ষপথে ঋণাত্মক তড়িদ্গ্রস্ত ইলেকট্রনের আবর্তন সংক্রান্ত যে পরমাণু চিত্র গড়ে ওঠে তাকে পরমাণুর নিউক্লিয় মডেল বলে।
রাদারফোর্ডের পরমাণু মডেলের বৈশিষ্ট্যগুলি লেখো।
রাদারফোর্ডের পরমাণু মডেলের বৈশিষ্ট্য –
- পরমাণুর বেশিরভাগ স্থানই ফাঁকা।
- পরমাণুর কেন্দ্রে অতি ক্ষুদ্র স্থানে পরমাণুর সমগ্র ভর এবং ধনাত্মক আধান কেন্দ্রীভূত থাকে।
- নিউক্লিয়াসের বাইরে অবস্থানকারী ইলেকট্রনগুলি নিউক্লিয়াসের সঙ্গে স্থির তড়িৎ আকর্ষণ বল দ্বারা আবদ্ধ থাকে।
- নিউক্লিয়াসকে কেন্দ্র করে এক বা একাধিক বৃত্তাকার পথে ইলেকট্রনগুলি প্রচণ্ড গতিতে ঘুরতে থাকে।
- নিউক্লিয়াসের মোট ধনাত্মক আধান ও ইলেকট্রনগুলির মোট ঋণাত্মক আধানের মান সমান হয়।
রাদারফোর্ডের পরমাণু মডেলের সীমাবদ্ধতাগুলি উল্লেখ করো।
অথবা, রাদারফোর্ডের পরমাণু মডেলের ত্রুটিগুলি আলোচনা করো।
রাদারফোর্ডের পরমাণু মডেলের সীমাবদ্ধতা –
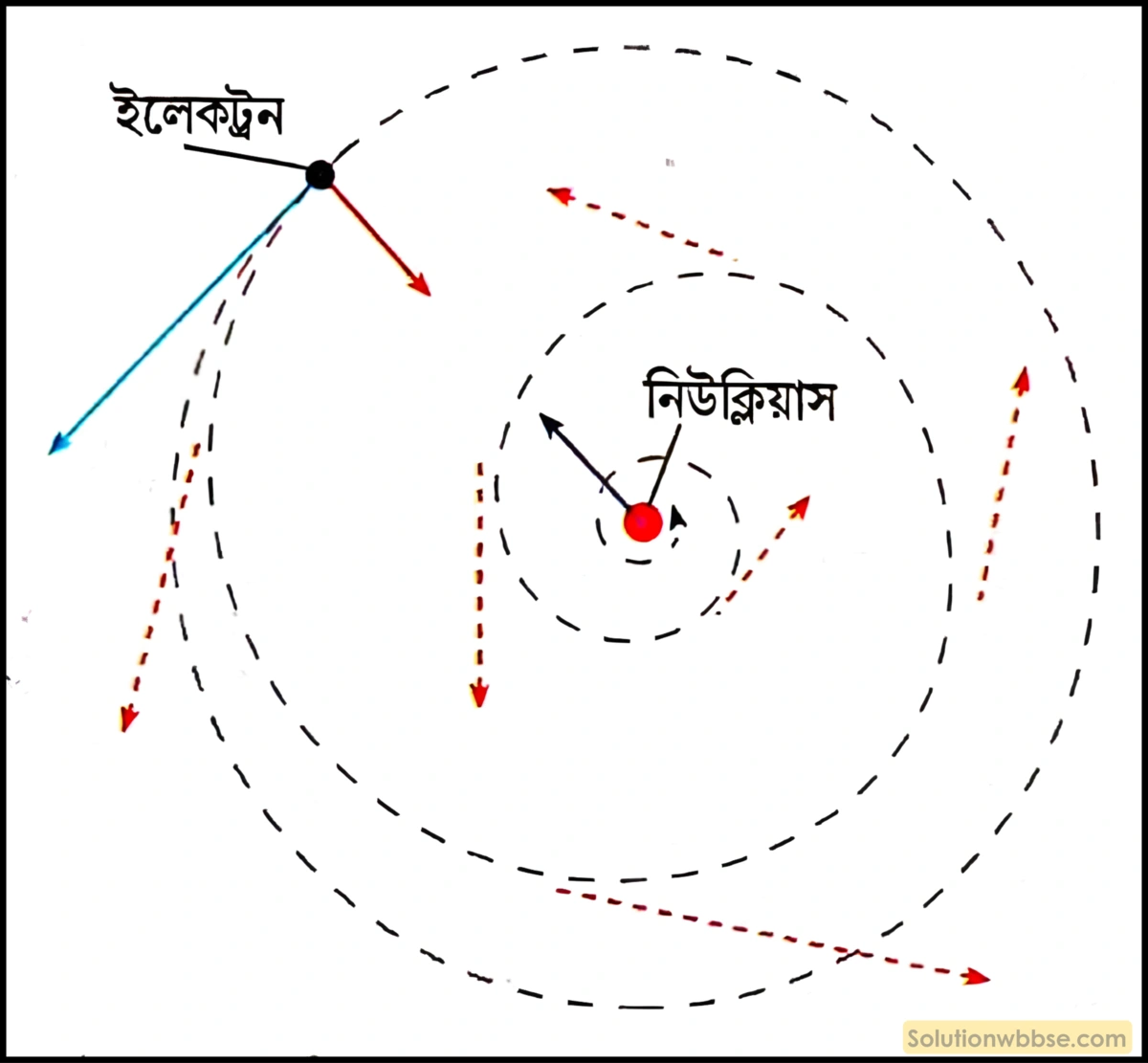
1. পরমাণুর স্থায়িত্ব ব্যাখ্যা করতে না পারা
- রাদারফোর্ডের তত্ত্ব – ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে ঘোরে।
- সমস্যা – ক্লাসিক্যাল ফিজিক্স বা সনাতন তড়িৎগতিবিদ্যা বলে, কোনো চার্জযুক্ত কণা (যেমন ইলেকট্রন) যদি ঘুরতে থাকে, তবে সে ক্রমাগত শক্তি বিকিরণ করবে (শক্তি ছাড়তে থাকবে)।
- ফলাফল – এইভাবে শক্তি হারাতে থাকলে, ইলেকট্রনটি সোজা পথে না ঘুরে, ক্রমশ ছোট হতে থাকা কুণ্ডলী (spiral) পথে ঘুরতে ঘুরতে একসময় নিউক্লিয়াসের ওপর আছড়ে পড়বে। হিসাব অনুযায়ী, এই ঘটনাটি এক সেকেন্ডেরও কম সময়ে (প্রায় $10^{-8}$ সেকেন্ডে) ঘটার কথা।
- বাস্তব – কিন্তু বাস্তবে পরমাণু অত্যন্ত সুস্থিত; এটি এভাবে ভেঙে পড়ে না।
- সিদ্ধান্ত – রাদারফোর্ডের মডেল পরমাণু কেন স্থায়ী হয়, তার ব্যাখ্যা দিতে পারেনি।
২. রেখা বর্ণালির ব্যাখ্যা দিতে না পারা
- তত্ত্ব অনুযায়ী – যেহেতু ইলেকট্রন ক্রমাগত শক্তি হারাচ্ছে, তাই তার থেকে ক্রমাগত সব ধরনের তরঙ্গদৈর্ঘ্যের আলো (বা বিকিরণ) বেরিয়ে আসার কথা। এর ফলে ‘নিরবচ্ছিন্ন বর্ণালি’ (Continuous Spectrum) তৈরি হওয়ার কথা (যেখানে সব রং একে অপরের সাথে মিশে থাকে, যেমন রামধনু)।
- সমস্যা – কিন্তু পরীক্ষায় দেখা যায়, হাইড্রোজেন বা অন্য মৌলের পরমাণুকে উত্তপ্ত করলে তা থেকে শুধু নির্দিষ্ট কয়েকটি উজ্জ্বল রঙের আলো (নির্দিষ্ট তরঙ্গদৈর্ঘ্য) বেরিয়ে আসে। একে ‘রেখা বর্ণালি’ (Line Spectrum) বলে।
- সিদ্ধান্ত – রাদারফোর্ডের মডেল কেন এই নির্দিষ্ট রেখা বর্ণালি তৈরি হয়, তার কোনো ব্যাখ্যা দিতে পারেনি।
৩. কক্ষপথ ও শক্তি সম্পর্কে ধারণা না দেওয়া
- এই মডেলটি পরমাণুর গঠন সম্পর্কে একটি সাধারণ ধারণা দিলেও, এটি ইলেকট্রনের কক্ষপথের সঠিক আকার বা ব্যাসার্ধ কেমন হবে, সে সম্পর্কে কিছু বলেনি।
- এছাড়াও, নির্দিষ্ট কক্ষপথে ঘোরার সময় ইলেকট্রনের বেগ বা গতিশক্তি কত হবে, সে বিষয়েও এই মডেল থেকে কোনো ধারণা পাওয়া যায় না।
রাদারফোর্ডের পরমাণু মডেলের মূল সংশোধন কী ছিল?
রাদারফোর্ডের পরমাণু মডেলের ত্রুটির মূল সংশোধন – 1913 খ্রিস্টাব্দে বিজ্ঞানী নীলস্ বোর প্ল্যাঙ্কের কোয়ান্টাম তত্ত্বের সাহায্য নিয়ে রাদারফোর্ডের পরমাণু মডেলের ত্রুটি সংশোধন করেন। বোরের মতবাদ অনুযায়ী, রাদারফোর্ডের পরমাণু মডেলের মূল সংশোধনটি ছিল স্থির কক্ষপথ বা সুস্থির কক্ষপথের (stationary orbit) ধারণা – ইলেকট্রন যখন কোনো স্থায়ী বা সুস্থির কক্ষপথে আবর্তন করে তখন কোনো শক্তি গ্রহণ বা বর্জন করে না। সুতরাং, নিউক্লিয়াসকে কেন্দ্র করে নির্দিষ্ট কক্ষপথে আবর্তনশীল ইলেকট্রনের কখনও নিউক্লিয়াসের ওপর ঝাঁপিয়ে পড়ার সম্ভাবনা থাকে না। ফলে রাদারফোর্ডের পরমাণু মডেলের প্রধান ত্রুটি দূরীভূত হয়।
রাদারফোর্ড কেন পরমাণুর নিউক্লিয়াসে নিউট্রনের অস্তিত্ব অনুমান করেছিলেন?
অথবা, পরমাণুর কেন্দ্রে যে নিউট্রন আছে বিজ্ঞানীগণ কীভাবে এই সিদ্ধান্তে আসেন?
ইলেকট্রন ও প্রোটনের আধানের পরিমাণ সমান ও বিপরীত হওয়ায় এবং পরমাণু সামগ্রিকভাবে নিস্তড়িৎ হওয়ায় বলা যায় যে, পরমাণুতে প্রোটন ও ইলেকট্রনের সংখ্যা সমান। এখন একটি প্রোটনের ভর প্রায় এক একক (1.00728 amu বা 1 amu) ও ইলেকট্রনের ভর নগণ্য (0.0005486 amu)। কিন্তু দেখা যায় যে, সাধারণ হাইড্রোজেন ছাড়া যে-কোনো পরমাণুর নিউক্লিয়াসে কেন্দ্রীভূত সামগ্রিক ভর তার অন্তর্গত সব প্রোটন কণাগুলির ভরের সমষ্টির থেকে বেশি হয়।

এই বিভ্রান্তি দূর করার জন্য 1920 খ্রিস্টাব্দে বিজ্ঞানী রাদারফোর্ড পরমাণুর মধ্যে প্রোটনের প্রায় সমান ভরসম্পন্ন এবং আধানবিহীন আরো একপ্রকার মূল কণার অস্তিত্বের কথা কল্পনা করেন। তিনি এই কণার নাম দেন নিউট্রন।
কোন্ নিউক্লিয় বিক্রিয়ার সাহায্যে নিউট্রন কণার অস্তিত্ব প্রমাণ করা গিয়েছিল?
নিউট্রন আবিষ্কার – বিজ্ঞানী স্যাডউইক বেরিলিয়াম ধাতুর পাতকে তেজস্ক্রিয় ধাতু পোলোনিয়াম থেকে নিঃসৃত α-কণা দ্বারা আঘাত করে দেখেন যে, বেরিলিয়াম পরমাণু থেকে একপ্রকার তড়িদাধানহীন ক্ষুদ্র কণার সৃষ্টি হয়।
দেখা যায় যে, এই ক্ষুদ্র কণাগুলির প্রতিটির ভর একটি প্রোটন বা H -পরমাণুর ভরের সমান এবং এই কণাগুলির স্রোত তড়িৎ বা চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয় না। অতএব, এই নিস্তড়িৎ কণাগুলিই রাদারফোর্ডের কল্পনাকৃত নিউট্রন বলে প্রমাণিত হয়।
পারমাণবিক গঠন সংক্রান্ত কোন্ সমস্যাটি নিউট্রন আবিষ্কারের ফলে সমাধান করা সম্ভব হয়?
ইলেকট্রন এবং প্রোটন আবিষ্কারের পর বিজ্ঞানীদের ধারণা ছিল সকল পরমাণু প্রোটন ও ইলেকট্রন দ্বারা গঠিত। অর্থাৎ, পরমাণুর ভর বলতে পরমাণুতে উপস্থিত প্রোটন ও ইলেকট্রনগুলির মিলিত ভরের সমষ্টি হওয়া উচিত। পরমাণুর ভর ব্যাখ্যা করতে গিয়ে বিজ্ঞানী রাদারফোর্ড দেখেছিলেন, একমাত্র সাধারণ হাইড্রোজেন (1H1) ব্যতীত অন্য যে-কোনো মৌলের পরমাণুর প্রকৃত ভর তার মধ্যে উপস্থিত প্রোটন ও ইলেকট্রনের মোট ভর অপেক্ষা অনেক বেশি। পরমাণুর ভরের এই অসামঞ্জস্য দূর করার জন্য 1920 খ্রিস্টাব্দে বিজ্ঞানী রাদারফোর্ড পরমাণুর মধ্যে নিস্তড়িৎ ও এক একক ভরযুক্ত একপ্রকার মৌলিক কণার অস্তিত্ব অনুমান করেন এবং এই কণার নাম দেন নিউট্রন। পরে 1932 খ্রিস্টাব্দে রাদারফোর্ডের ছাত্র বিজ্ঞানী স্যাডউইক নিউট্রনের অস্তিত্ব আবিষ্কার করলে পরমাণুর ভরজনিত অসামঞ্জস্য দূরীভূত হয়।
রাদারফোর্ডের পরীক্ষার ফলাফল থমসনের প্লাম পুডিং মডেলকে নস্যাৎ করে তা ব্যাখ্যা করো।
থমসনের প্লাম পুডিং মডেলের বক্তব্য – পরমাণুর সমস্ত ধনাত্মক আধান, গোলকাকার গঠনের সমগ্র অংশ জুড়ে সুষমভাবে বণ্টিত থাকে। এই ধনাত্মক আধানের গোলকের মধ্যে ঋণাত্মক ইলেকট্রনগুলি সুষমভাবে রোপন করা (embeded) থাকে।
রাদারফোর্ডের α-কণা বিচ্ছুরণ পরীক্ষায় প্রাপ্ত ফলাফল – সোনার পাত দ্বারা α-কণার যে বিচ্ছুরণ ঘটে, তা পরমাণুর সমগ্র অংশ থেকে সমানভাবে হয় না। পরমাণুর বেশিরভাগ অংশে α-কণার বিক্ষেপণ হয় না। পরমাণুর আয়তনের তুলনায় অত্যন্ত ক্ষুদ্র জায়গা (নিউক্লিয়াস) দ্বারা α-কণা বাইরের দিকে বিক্ষিপ্ত হয়।
রাদারফোর্ডের পরীক্ষার প্রাপ্ত ফলাফল দ্বারা, প্লাম পুডিং মডেল নস্যাৎ হওয়ার কারণ –
- প্লাম পুডিং মডেল অনুযায়ী, পরমাণুর সমগ্র অংশে ধনাত্মক আধান সমভাবে বণ্টিত থাকলে, α-কণার বিক্ষেপণ পরমাণুর সমস্ত অংশ থেকে সমভাবে ঘটার কথা, কিন্তু বাস্তবে তা হয় না। সুতারং, প্লাম পুডিং মডেল সঠিক নয়।
- পরমাণুর কেন্দ্রীয় অংশ (নিউক্লিয়াস) দ্বারা α-কণার বেশি মাত্রায় বিক্ষেপণের কারণ – প্লাম পুডিং মডেল দ্বারা ব্যাখ্যা করা যায় না।
- প্লাম পুডিং মডেল অনুসারে, ধনাত্মক আধানের মধ্যে ইলেকট্রনগুলি রোপন করা থাকে, অর্থাৎ, এই মডেল অনুসারে ইলেকট্রন স্থির। কিন্তু রাদারফোর্ডের পরীক্ষার দ্বারা প্রাপ্ত মডেল অনুসারে ইলেকট্রনগুলি কক্ষপথে আবর্তন করে অর্থাৎ, গতিশীল।
নিউক্লিয়ন কী?
নিউক্লিয়ন (Nucleon) – কোনো মৌলের পরমাণুর নিউক্লিয়াসে যেসব কণা উপস্থিত থাকে তাদের একত্রে নিউক্লিয়ন বলে। পরমাণুর নিউক্লিয়াসে ধনাত্মক তড়িদ্গ্রস্ত কণা প্রোটন এবং নিস্তড়িৎ কণা নিউট্রন থাকে। তাই এদের একত্রে নিউক্লিয়ন বলা যায়।
ইলেকট্রন, প্রোটন ও নিউট্রনের অনুপাতের তুলনা করো। কার ক্ষেত্রে এর মান সর্বাধিক?
ইলেকট্রনের ক্ষেত্রে, \(\frac em\)
=
=
এবং প্রোটনের ক্ষেত্রে, \(\frac em\)
=
=
এখন,
=
= \(\frac{1.6725\times10^{-24}}{9.11\times10^{-28}}\) (∵ প্রোটন ও ইলেকট্রনের আধান পরস্পর সমান ও বিপরীত)
ইলেকট্রনের ক্ষেত্রে, \(\frac em=1837\) × প্রোটনের \(\frac em\)
∴ নিউট্রনের \(\frac em\)
=
= \(\frac0{1.6725\times10^{-24}}\)
= শূন্য।
ভর, আধান, ব্যাসার্ধ ও অবস্থানের প্রেক্ষিতে পরমাণুর মৌলিক কণাগুলির তুলনা করো।
| কণার নাম ও চিহ্ন | ভর | আধান | ব্যাসার্ধ (সেমি) | অবস্থান |
| ইলেকট্রন (e, e– বা \({}_{-1}^0e\)) | 9.11 × 10-28 g/0.0005486 amu | 4.8 × 10-10 esu (CGS -এ) বা, 1.6 × 10-19 কুলম্ব (SI) | 2.8 × 10-13 | পরমাণুর নিউক্লিয়াসের বাইরের বিভিন্ন কক্ষ |
| প্রোটন (p বা \({}_1^1H\)) | 1.6725 × 10-24 g/1.0072 amu | 4.8 × 10-10 esu (CGS -এ) বা, 1.6 × 10-19 কুলম্ব (SI) | 1.2 × 10-13 | নিউক্লিয়াস |
| নিউট্রন (n বা \({}_1^0n\)) | 1.6725 × 10-24 g/1.0087 amu | 0 | 1.2 × 10-13 | নিউক্লিয়াস |
বিজ্ঞানী মিলিকান কী নির্ণয় করেন এবং কেন ইলেকট্রনের ঋণাত্মক তড়িদাধানকে তড়িতের ক্ষুদ্রতম একক হিসেবে গণ্য করা হয়?
বিজ্ঞানী মিলিকান ইলেকট্রনের তড়িদাধান নির্ণয় করেন। ইলেকট্রনের ঋণাত্মক তড়িদাধানের মান সবচেয়ে কম। কোনো ঋণাত্মক তড়িদাধানযুক্ত কণার তড়িৎ পরিমাণ ইলেকট্রনের আধানের পূর্ণসংখ্যার গুণিতক। তাই একে তড়িতের ক্ষুদ্রতম একক হিসেবে গণ্য করা হয়।
রাদারফোর্ডের পরমাণু মডেলের ত্রুটিগুলি কোন্ বিজ্ঞানী সংশোধন করেন?
1913 খ্রিস্টাব্দে ডেনমার্কের বিখ্যাত বিজ্ঞানী নীলস বোর রাদারফোর্ডের পরমাণু মডেলের ত্রুটিগুলি সংশোধন করেন।
বোর-রাদারফোর্ড পরমাণু মডেলের মূল স্বীকার্যগুলি উল্লেখ করো।
বিজ্ঞানী নীলস বোরের মতবাদ তিনটি স্বীকার্যের ওপর প্রতিষ্ঠিত – তদর্থক ভিত্তিতে গৃহীত কতকগুলি স্বীকার্যের (Ad-hoc basis propositions or postulates) ভিত্তিতে বোর রাদারফোর্ডের মডেলকে পরিমার্জিত করেন।
স্বীকার্যগুলি নিম্নরূপ –
- ইলেকট্রনগুলি নিউক্লিয়াসকে কেন্দ্র করে যে-কোনো ব্যাসার্ধের কক্ষপথে আবর্তন করে না। তারা কেবল নির্বাচিত বা ‘অনুমোদনযোগ্য’ কক্ষপথেই প্রদক্ষিণ করতে সক্ষম হয় যেখানে অবস্থানকালে ইলেকট্রনগুলির কৌণিক ভরবেগ \(\frac h{2\mathrm\pi}\) -এর পূর্ণ সংখ্যার সরল গুণিতক হয়ে থাকে। অর্থাৎ, ইলেকট্রনের কৌণিক ভরবেগ = \(mvr=\frac{nh}{2\mathrm\pi}\) (যেখানে m → ইলেকট্রনের ভর, r → কক্ষপথের ব্যাসার্ধ, v → ইলেকট্রনের বেগ, h→ প্ল্যাঙ্ক ধ্রুবক, n = 1, 2, 3 …… ইত্যাদি পূর্ণসংখ্যা)।
- অনুমোদনযোগ্য কক্ষপথে আবর্তনরত অবস্থায় ইলেকট্রন কোনো শক্তি শোষণ বা বর্জন করে না অর্থাৎ, তাদের শক্তির পরিমাণ নির্দিষ্ট থাকে। এ কারণে এই কক্ষগুলিকে সুস্থিত বা স্থায়ী কক্ষপথ (Stationary orbit) বলে।
- নিম্ন কক্ষ বা শক্তিস্তরে থাকা ইলেকট্রন শক্তি শোষণ করে উচ্চতর কক্ষে বা উচ্চ কক্ষস্থিত কোনো ইলেকট্রন শক্তি বর্জন করে নিম্নতর কক্ষে স্থানান্তরিত হতে পারে। উভয়ক্ষেত্রে শক্তিস্তর দুটির শক্তির যে পার্থক্য তার সমান শক্তি গৃহীত বা বর্জিত হয়। অর্থাৎ, শোষিত বা বর্জিত শক্তির পরিমাণ হয়, ΔE = E2 – E1 = hv, যেখানে হল শোষিত বা নিঃসৃত বিকিরণের কম্পাঙ্ক।
পরমাণুর গঠন সম্বন্ধীয় বোর-রাদারফোর্ড মডেলের একটি সংক্ষিপ্ত বিবরণ দাও।
অথবা, পরমাণুর আধুনিক গঠনচিত্র বর্ণনা করো
বোরের পরমাণু মডেল – রাদারফোর্ডের কল্পিত সৌরকেন্দ্রিক পরমাণু মডেলের মূল বৈশিষ্ট্যগুলি অপরিবর্তিত রেখে বিজ্ঞানী প্ল্যাঙ্ক প্রস্তাবিত কোয়ান্টাম মতবাদের ধারণা প্রয়োগ করে বিজ্ঞানী বোর পরমাণুর একটি সুস্থিত গঠনচিত্র উপস্থাপন করেন। এই মডেল বা গঠনচিত্রের মূল বৈশিষ্ট্যগুলি নিম্নরূপ –
- ইলেকট্রনগুলি নিউক্লিয়াসকে কেন্দ্র করে কতকগুলি নির্দিষ্ট বা অনুমোদনযোগ্য (permissible) কক্ষপথে ঘোরে যাদের বলা হয় মুখ্য শক্তিস্তর। এই শক্তিস্তরগুলিতে ইলেকট্রনের গড় গতিশক্তি নির্দিষ্ট হয়।
- অনুমোদনযোগ্য কক্ষপথে অবস্থানকালে ইলেকট্রন কোনো শক্তি বিকিরণ বা শোষণ করে না অর্থাৎ, তাদের শক্তির পরিমাণ ধ্রুবক হয়ে থাকে। কক্ষপথগুলিকে সুস্থির বা স্থায়ী কক্ষপথ বলে।
- স্থায়ী কক্ষপথে অবস্থানরত ইলেকট্রনের মোট শক্তি ঋণাত্মক হয়। নিউক্লিয়াস থেকে দূরত্ব বৃদ্ধির সঙ্গে সঙ্গে কক্ষের শক্তি বৃদ্ধি পায়। নিউক্লিয়াস থেকে ক্রমবর্ধমান দূরত্ব অনুসারে কক্ষপথগুলিকে K, L, M, N, O, P, Q ইত্যাদি অথবা, n = 1, n = 2, n = 3 ইত্যাদি প্রতীক দিয়ে চিহ্নিত করা হয়। কক্ষের সংখ্যা তাত্ত্বিকভাবে অসীম হওয়া সম্ভব হলেও এখনও পর্যন্ত শুধুমাত্র 7টি কক্ষ আবিষ্কার করা গেছে।
- কোনো কক্ষ বা শক্তিস্তরে উপস্থিত সর্বোচ্চ ইলেকট্রন সংখ্যা হয় 2n2 (n = শক্তিস্তরের ক্রমিক সংখ্যা বা মুখ্য কোয়ান্টাম সংখ্যা। এই সংখ্যা ও বিভিন্ন শক্তিস্তরে ইলেকট্রন সংখ্যার বণ্টন বোর-বুরি প্রস্তাবনা (Bohr-Bury Scheme) দ্বারা নির্ধারিত হয়ে থাকে।
বোর-বুরি প্রস্তাবনা কী?
বোর-বুরি প্রস্তাবনা – পরমাণুর বিভিন্ন কক্ষে (বা শক্তিস্তরে) ইলেকট্রনের ক্রমান্বয়ী সজ্জা বা ইলেকট্রন-বিন্যাস ব্যাখ্যা করার উদ্দেশ্যে 1912 সালে ‘বোর-বুরি’ প্রস্তাবনা পেশ করা হয়। এই প্রস্তাবনার মূল বক্তব্য হল –
- একটি নির্দিষ্ট কক্ষে বা শক্তিস্তরে উপস্থিত সম্ভাব্য সর্বোচ্চ ইলেকট্রন সংখ্যা = 2n2 (n= কক্ষের ক্রমিক সংখ্যা বা মুখ্য কোয়ান্টাম সংখ্যা।
- ইলেকট্রন প্রথমে নিউক্লিয়াসের নিকটতম K কক্ষে প্রবেশ করবে, K কক্ষ তার সম্পূর্ণ সীমায় (2টি) ভরতি হওয়ার পর ক্রমানুসারে L, M, N ইত্যাদি অন্য কক্ষগুলি পূর্ণ হবে।
| কক্ষ | ক্রমিক সংখ্যা | সর্বোচ্চ ইলেকট্রন সংখ্যা |
| K | n = 1 | 2⋅12 = 2 |
| L | n = 2 | 2⋅22 = 4 |
| M | n = 3 | 2⋅32 = 18 |
| N | n = 4 | 2⋅42 = 32 |
- পরমাণুর সবচেয়ে বাইরের কক্ষ বা যোজ্যতা কক্ষে কখনোই 8টির বেশি ইলেকট্রন থাকবে না (একমাত্র ব্যতিক্রম প্যালাডিয়াম 46Pd যেখানে যোজক ইলেকট্রন সংখ্যা 18)।
- n > 4 হলেও সংশ্লিষ্ট খোলকে সর্বোচ্চ 32টির বেশি ইলেকট্রন থাকে না। একইভাবে সবচেয়ে বাইরেরর কক্ষের ঠিক আগের কক্ষে কখনোই 18টির বেশি ইলেকট্রন থাকবে না।
সুস্থির কক্ষপথ কাকে বলে? সুস্থির কক্ষপথ নামকরণের তাৎপর্য কী?
সুস্থির কক্ষপথ (Stationary orbit) – বোরের মতানুযায়ী, পরমাণুর নিউক্লিয়াসকে কেন্দ্র করে ইলেকট্রনগুলি যে সমস্ত স্থির শক্তিসম্পন্ন নির্দিষ্ট ব্যাসার্ধবিশিষ্ট বৃত্তাকার পথে আবর্তন করে তাদের সুস্থির কক্ষপথ বা স্থায়ী কক্ষপথ বলা হয়।
সুস্থির কক্ষপথ নামকরণের তাৎপর্য – নিউক্লিয়াসকে কেন্দ্র করে নির্দিষ্ট ব্যাসার্ধবিশিষ্ট বৃত্তাকার কক্ষপথে ইলেকট্রনগুলি আবর্তন করার সময় কোনো শক্তি শোষণ বা বর্জন করে না অর্থাৎ, এই নির্বাচিত কক্ষপথগুলিতে ইলেকট্রনগুলি স্থির না থাকলেও এদের শক্তি স্থির থাকে, তাই এদের সুস্থির কক্ষপথ বলা হয়।
বোরের পরমাণু মডেলের উপযোগিতা কী?
বোরের পরমাণু মাডানর উপাযাগিতা –
- বোরের পরমাণু মডেল পরমাণুর স্থায়িত্ব সম্পর্কে যুক্তিপূর্ণ ব্যাখ্যা দিতে সক্ষম।
- বোরের পরমাণু মডেলের সাহায্যে একটিমাত্র ইলেকট্রন বিশিষ্ট পরমাণু বা আয়নের রেখা বর্ণালির উৎপত্তি ব্যাখ্যা করা যায়।
- এই তত্ত্বের সাহায্যে কক্ষপথের ব্যাসার্ধ, ইলেকট্রনের গতিবেগ ও শক্তি নির্ণয় করা যায়।
বোরের পরমাণু মডেলের ত্রুটিগুলি লেখো।
বোরের পরমাণু মডেলের ত্রুটি –
- বোরের পরমাণু মডেল শুধুমাত্র এক ইলেকট্রনীয় পরমাণুর রেখা বর্ণালি ব্যাখ্যা করতে পারে। দুই বা তার বেশি সংখ্যক ইলেকট্রন বিশিষ্ট মৌলের পরমাণুর রেখা বর্ণালি ব্যাখ্যা করতে পারে না।
- বোরের পরমাণু মডেল থেকে পরমাণুর ত্রিমাত্রিক গঠন সম্পর্কে কোনো ধারণা পাওয়া যায় না।
- তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্রের প্রভাবে পরমাণুর রেখা বর্ণালি আরও সূক্ষ্মতর রেখায় বিভাজিত হয়ে যায়। এই ঘটনার ব্যাখ্যা বোরের পরমাণু মডেল দিতে পারে না।
- বোর তত্ত্ব অনুযায়ী, ইলেকট্রনকে কেবলমাত্র কণারূপে কল্পনা করা হয়। কিন্তু প্রকৃতপক্ষে ইলেকট্রনের মধ্যে তরঙ্গ ও কণা উভয় ধর্মই বর্তমান।
পরমাণুর অভ্যন্তরস্থ কণা সরাসরি দেখা যায় না—এ সম্পর্কে বিজ্ঞানীরা কীভাবে ধারণা অর্জন করেন?
প্রকৃতপক্ষে পরমাণুর অভ্যন্তরস্থ কণা দেখা যায় না। পরস্পরের সঙ্গে সংঘর্ষের ফলে তাদের যে পথ তৈরি হয় সেই পথের চিত্র দ্বারা তাদের সম্পর্কে ধারণা করা যায়।
মৌলের পারমাণবিক সংখ্যা বা পরমাণু-ক্রমাঙ্ক কাকে বলে?
পারমাণবিক সংখ্যা বা পরমাণু-ক্রমাঙ্ক (Atomic Number) – কোনো মৌলের একটি পরমাণুর নিউক্লিয়াসে যত সংখ্যক প্রোটন থাকে, সেই সংখ্যাকে ওই মৌলের পারমাণবিক সংখ্যা বা পরমাণু-ক্রমাঙ্ক বলে।
পরমাণু-ক্রমাঙ্ক = মৌলের একটি পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যা
যেমন – অক্সিজেন পরমাণুতে 8টি প্রোটন আছে। সুতরাং, অক্সিজেনের পরমাণু-ক্রমাঙ্ক = 8।
নিউক্লিয় আধানের সঙ্গে এই সংখ্যার সম্পর্ক কী?
প্রোটনে ধনাত্মক আধানের পরিমাণ এক একক ধরা হয়। কোনো মৌলের পরমাণুর নিউক্লিয়াসে যতগুলি ধনাত্মক আধান থাকে পারমাণবিক সংখ্যা তার সমান হয়।
নিউক্লিয়াসের আধান = পারমাণবিক সংখ্যা × একক ধনাত্মক আধান
কোনো মৌলের পরমাণু-ক্রমাঙ্ক জানা থাকলে তার পরমাণুর ইলেকট্রন-বিন্যাস লেখা সম্ভব কি? এরূপ কেন হয় ব্যাখ্যা করো।
কোনো মৌলের পরমাণু-ক্রমাঙ্ক জানা থাকলে তার পরমাণুর ইলেকট্রন-বিন্যাস লেখা সম্ভব। কারণ – পরমাণু-ক্রমাঙ্ক হল একটি পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যা। পরমাণু নিস্তড়িৎ হওয়ায় প্রত্যেক পরমাণুর নিউক্লিয়াসে যতগুলি প্রোটন থাকে ঠিক ততগুলি ইলেকট্রন নিউক্লিয়াসের বাইরে বিভিন্ন ব্যাসার্ধের সমকেন্দ্রিক কক্ষপথে আবর্তন করে। নিউক্লিয়াস থেকে দূরত্ব অনুযায়ী এই কক্ষপথগুলি হল K (n = 1), L (n = 2), M (n = 3), N (n = 4), O (n = 5), P (n = 6), Q(n = 7)। প্রত্যেক কক্ষে সর্বাধিক কতগুলি ইলেকট্রন থাকতে পারে তা নির্দিষ্ট। এটি 2n2 সূত্র (Bohr-Bury scheme) দ্বারা নির্ধারিত হয় [n = কক্ষ বা মুখ্য শক্তিস্তরের সংখ্যা]। যেমন – একটি মৌলের পরমাণু-ক্রমাঙ্ক 12 হলে এর ইলেকট্রন সংখ্যা = 12। সর্বোচ্চ 2টি ইলেকট্রন যাবে K কক্ষে। বাকি ইলেকট্রন = (12 – 2) = 10টি। সর্বোচ্চ 8টি ইলেকট্রন যাবে L কক্ষে। বাকি (10 – 8)= 2টি ইলেকট্রন M কক্ষে স্থান গ্রহণ করবে।
∴ ইলেকট্রন-বিন্যাস – K(2) L(8) M(2)।
কোনো মৌলের ভরসংখ্যা কাকে বলে?
ভরসংখ্যা (Mass Number) – কোনো মৌলের পরমাণুর নিউক্লিয়াসে প্রোটন এবং নিউট্রনের মোট সংখ্যাকে ওই মৌলের পরমাণুর ভরসংখ্যা বলে।
ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা
যেমন – অক্সিজেন পরমাণুর নিউক্লিয়াসে 8টি প্রোটন ও 8টি নিউট্রন আছে। সুতরাং, অক্সিজেন পরমাণুর ভরসংখ্যা = (8 + 8) = 16।
মৌলের পারমাণবিক সংখ্যা এবং ভরসংখ্যার মধ্যে সম্পর্ক কী?
পারমাণবিক সংখ্যা ও ভরসংখ্যার মধ্যে সম্পর্ক – ধরি, কোনো মৌলের পরমাণুতে p সংখ্যক প্রোটন, n সংখ্যক নিউট্রন আছে। তাহলে মৌলের ভরসংখ্যা M হলে, M = (p + n)। আবার, মৌলের প্রোটন সংখ্যা = পারমাণবিক সংখ্যা বা পরমাণু-ক্রমাঙ্ক। অর্থাৎ, পারমাণবিক সংখ্যা = p। সুতরাং,
ভরসংখ্যা = (পারমাণবিক সংখ্যা + নিউট্রন সংখ্যা)
মৌলের ভরসংখ্যা এবং পরমাণু-ক্রমাঙ্ক কোন্ ক্ষেত্রে একই হতে পারে?
আমরা জানি, ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা। আবার, পরমাণু-ক্রমাঙ্ক = প্রোটন সংখ্যা। সুতরাং, ভরসংখ্যা = পরমাণু-ক্রমাঙ্ক + নিউট্রন সংখ্যা। এখন, নিউট্রন সংখ্যা = 0 হলে, ভরসংখ্যা = পরমাণু-ক্রমাঙ্ক। একমাত্র সাধারণ হাইড্রোজেনের \({}_1^1H\(\) ক্ষেত্রে, ভরসংখ্যা = পরমাণু-ক্রমাঙ্ক হয়, কারণ – এই ক্ষেত্রে নিউট্রন সংখ্যা = (1 – 1)=0 হয়।
পরিবর্তনশীল ভরসংখ্যা বলতে কী বোঝায়?
পরিবর্তনশীল ভরসংখ্যা – একই মৌলের বিভিন্ন আইসোটোপগুলির পারমাণবিক সংখ্যা একই হলে ও নিউট্রন সংখ্যার ভিন্নতার জন্য ভরসংখ্যা বিভিন্ন হয়। অর্থাৎ, একই মৌলের বিভিন্ন আইসোটোপগুলির পরিবর্তনশীল ভরসংখ্যা লক্ষ করা যায়। যেমন – \(\){}_1^1H\), \({}_1^2H\) এবং \({}_1^3H\) – হাইড্রোজেনের তিনটি আইসোটোপের ভরসংখ্যা পৃথক। কোনো তেজস্ক্রিয় মৌলের পরমাণুর নিউক্লিয়াস থেকে পরপর 1টি α-কণা ও 2টি β-কণা নির্গত হলে সেটি মূল পরমাণুর সমান পরমাণু-ক্রমাঙ্ক কিন্তু ভিন্ন ভরসংখ্যা বিশিষ্ট নিউক্লাইডে রূপান্তরিত হয়। এক্ষেত্রে জনক ও দুহিতা নিউক্লাইডের ভরসংখ্যাকে ‘পরিবর্তনশীল ভরসংখ্যা’ বলা হয়।
উদাহরণ –
,
এক্ষেত্রে উৎপন্ন মৌলের ভরসংখ্যা পূর্বের মৌল অপেক্ষা 4 একক হ্রাস পায়। বলাবাহুল্য যে, এক্ষেত্রে জনক ও দুহিতা নিউক্লাইডের ভরসংখ্যা পরিবর্তনশীল।
একটি পরমাণুর নিউক্লিয়াসকে সূচিত করা হয় কীভাবে? উদাহরণ দিয়ে বোঝাও।
মৌলের চিহ্নের ডানদিকে একটু উপরে ভরসংখ্যা ও বামদিকে একটু নীচে পরমাণু-ক্রমাঙ্ক লেখা হয়। যেমন – কোনো মৌলের চিহ্ন X, ভরসংখ্যা A এবং পরমাণু-ক্রমাঙ্ক Z হলে প্রতীকটি হবে ZXA। অনেকসময় ভরসংখ্যাকে মৌলের চিহ্নের বামপাশে উপরের দিকে লেখা হয়। সেক্ষেত্রে প্রতীকটি হবে \({}_Z^AX\)।
নিউক্লাইড কাকে বলে? উদাহরণ দাও।
নিউক্লাইড (Nuclide) – নির্দিষ্ট পারমাণবিক সংখ্যা এবং ভরসংখ্যাযুক্ত কোনো মৌলের চিহ্ন, যার দ্বারা মৌলটির পরমাণুর এবং নিউক্লিয়াসের গঠন জানা যায়, তাকে ওই মৌলের নিউক্লাইড বলে। যেমন – 6C12, 8O16 প্রভৃতি প্রত্যেকটি হল নিউক্লাইড।
দর্পণ নিউক্লিয়াস বলতে কী বোঝায়?
দর্পণ নিউক্লিয়াস একই ভরসংখ্যা কিন্তু পৃথক পারমাণবিক সংখ্যা বিশিষ্ট দুটি নিউক্লিয়াসের প্রোটন সংখ্যা এবং নিউট্রন সংখ্যা একক পার্থক্য বিশিষ্ট হলে, ওই নিউক্লিয়াস দুটিকে পরস্পরের দর্পণ নিউক্লিয়াস বলে। যেমন – \({}_1^3H\) ও \({}_2^3H\) এদের প্রোটন সংখ্যার পার্থক্য = (2 – 1) = 1 এবং নিউট্রন সংখ্যার পার্থক্য = (2 – 1) = 1।
আইসোটোপ কাকে বলে? উদাহরণ দাও।
আইসোটোপ (Isotope) – একই মৌলের বিভিন্ন পরমাণুর পরমাণু-ক্রমাঙ্ক একই কিন্তু নিউক্লিয়াসে ভিন্ন সংখ্যক নিউট্রন থাকার জন্য ভরসংখ্যা আলাদা হলে, তাদের পরস্পরকে আইসোটোপ বা সমস্থানিক বলে। যেমন – ক্লোরিনের দুটি আইসোটোপ হল 17Cl35 এবং 17Cl37। এই দুটি পরমাণুর পরমাণু-ক্রমাঙ্ক সমান অর্থাৎ, 17, কিন্তু ভরসংখ্যা আলাদা। প্রথম পরমাণুটিতে নিউট্রন সংখ্যা (35 – 17) = 18টি এবং দ্বিতীয় পরমাণুতে নিউট্রন সংখ্যা (37 – 17) = 20টি, তাই এরা পরস্পর আইসোটোপ।
গ্রিক ভাষায় ‘iso’ শব্দের অর্থ কী এবং ‘topos’ শব্দের অর্থ কী? আইসোটোপদের সমস্থানিক বলা হয় কেন?
গ্রিক ভাষায় ‘iso’ শব্দের অর্থ হল সমান এবং ‘topos’ শব্দের অর্থ হল অবস্থান। আইসোটোপগুলি পর্যায়-সারণিতে একই ঘরে অবস্থান করে বলে এদের সমস্থানিক বলা হয়।
আইসোটোপের বৈশিষ্ট্য উল্লেখ করো।
আহাসাটোপের বৈশিষ্ট্য –
- কোনো মৌলের আইসোটোপগুলির পারমাণবিক সংখ্যা (অর্থাৎ প্রোটন সংখ্যা) সমান কিন্তু ভরসংখ্যা আলাদা।
- আইসোটোপগুলির রাসায়নিক ধর্ম, যোজ্যতা, ইলেকট্রন-বিন্যাস অভিন্ন।
- আইসোটোপগুলির ভর, ঘনত্ব, গলনাঙ্ক, স্ফুটনাঙ্ক প্রভৃতি ভৌত ধর্মগুলি পৃথক হয়।
- একই মৌলের বিভিন্ন আইসোটোপগুলি পর্যায় সারণিতে একই অবস্থানে থাকে। তাই এদের সমস্থানিক বলে।
আইসোটোপের ব্যবহারগুলি লেখো।
আইসোটোপের ব্যবহার (Uses of Isotope) –
- চিকিৎসাবিজ্ঞানে ক্যানসার ও টিউমারের চিকিৎসায় তেজস্ক্রিয় আয়োডিন আইসোটোপ ( I131 ) ব্যবহার করা হয়।
- কৃষিক্ষেত্রে তেজস্ক্রিয় আইসোটোপ ব্যবহার করে উদ্ভিদের বৃদ্ধি ও রোগ সম্পর্কে বিভিন্ন তথ্য পাওয়া যায়।
- তেজস্ক্রিয় কার্বন (C14) আইসোটোপের সাহায্যে পুরাতন শিলা, গাছ এবং পৃথিবীর বয়স নির্ণয় করা যায়।
- বিভিন্ন রাসায়নিক বিক্রিয়ার গতিপ্রকৃতি নির্ণয়ের জন্য তেজস্ক্রিয় আইসোটোপ (C13, N15, O18, S35 ইত্যাদি) ব্যবহার করা হয়।
- কোবাল্টের আইসোটোপ \(\left({}_{22}^{60}Co\right)\) ক্যানসার কোশ ও ম্যালিগন্যান্ট টিউমার ঘটিত কোশ ধ্বংস করতে ব্যবহার করা হয়।
আইসোবার ও আইসোটোনের উদাহরণসহ সংজ্ঞা দাও।
আইসোবার (Isobar) – যেসব মৌলের ভরসংখ্যা সমান কিন্তু পরমাণু-ক্রমাঙ্ক আলাদা, তাদের পরস্পরকে আইসোবার বলে। এদের প্রোটন তথা ইলেকট্রন সংখ্যা আলাদা হবার কারণে রাসায়নিক ধর্ম আলাদা হয়। যেমন – 18Ar40, 19K40, 20Ca40 এরা পরস্পর পরস্পরের আইসোবার। কারণ – এদের প্রত্যেকের ভরসংখ্যা সমান অর্থাৎ, 40, কিন্তু পরমাণু-ক্রমাঙ্ক যথাক্রমে 18, 19, 20।
আইসোটোন (Isotone) – যেসব মৌলের নিউক্লিয়াসে নিউট্রন সংখ্যা একই কিন্তু প্রোটন সংখ্যা আলাদা, তাদের পরস্পরকে একে অপরের আইসোটোন বলে। যেমন – 14Si30 এবং 15P31 এরা পরস্পর আইসোটোন। কারণ – এদের উভয়ের নিউক্লিয়াসে নিউট্রন সংখ্যা সমান। অর্থাৎ, প্রথমটিতে (30 – 14) = 16টি এবং দ্বিতীয়টিতে (31 – 15) = 16টি, কিন্তু পরমাণু-ক্রমাঙ্ক আলাদা। অর্থাৎ, এরা পরস্পরের আইসোটোন।
আইসোইলেকট্রনিক বলতে কী বোঝায়? এদের রাসায়নিক ধর্ম একই না ভিন্ন কারণসহ লেখো।
সমইলেকট্রনীয় (Isoelectronic) – যেসব পরমাণু বা আয়নের মোট ইলেকট্রন সংখ্যা সমান তাদের পরস্পরকে সমইলেকট্রনীয় বা আইসোইলেকট্রনিক বলে।
| পরমাণু/আয়ন | ইলেকট্রন সংখ্যা |
| Na+ | 10 |
| Cl– | 18 |
| Ne | 10 |
| K+ | 18 |
| Ar | 18 |
| F– | 10 |
Na+, F–, Ne এরা পরস্পর সমইলেকট্রনীয়। আবার, Cr–, K+, Ar এরাও পরস্পর সমইলেকট্রনীয়।
আইসোস্টার কাদের বলে? উদাহরণ দাও।
আইসোস্টার (Isoster) – সমসংখ্যক পরমাণু দ্বারা গঠিত এবং সমসংখ্যক ইলেকট্রন বিশিষ্ট অণুগুলিকে পরস্পরের আইসোস্টার বলে। যেমন – CO2 ও N2O; এদের প্রত্যেকটিই 3টি পরমাণু বিশিষ্ট এবং মোট ইলেকট্রন সংখ্যা = 22।
আইসোডায়াফার কী?
আইসোডায়াফার (Isodiapher) – যেসব পরমাণুতে নিউট্রন ও প্রোটন সংখ্যার পার্থক্য সমান, তাদেরকে পরস্পরের আইসোডায়াফার বলে। যেমন – 92U238 ও 90Th234।
| পরমাণু | প্রোটন সংখ্যা (p) | নিউট্রন সংখ্যা (n) | n – p |
| 92U238 | 92 | 146 | 54 |
| 92Th234 | 90 | 144 | 54 |
পারমাণবিক ভর একক কাকে বলে?
অথবা, সংহত পারমাণবিক ভর একক কাকে বলে?
পারমাণবিক ভর একক (Atomic mass unit/amu) – কোনো মৌলের একটি পরমাণুর প্রকৃত ভরকে যে একক দ্বারা প্রকাশ করা হয়, সেই একককেই পারমাণবিক ভর একক বা সংহত পারমাণবিক ভর একক বলে। এক পারমাণবিক ভর একক হল কার্বনের সাধারণ ও স্থিতিশীল 12C আইসোটোপের পরমাণুর ভরের \(\frac1{12}\) গুণ ভর। এর মান হল 1.6605 × 10-24 গ্রাম।
মৌলের 1টি পরমাণুর প্রকৃত ভর ও মৌলের পারমাণবিক ভরের মধ্যে সম্পর্ক কী?
মৌলের 1টি পরমাণুর প্রকৃত ভর = মৌলের পারমাণবিক ভর × এক পারমাণবিক ভর একক (1 amu)।
নিউক্লিয় বল কাকে বলে? এর উৎপত্তি কীভাবে ঘটে?
নিউক্লিয় বল (Nuclear force) – নিউক্লিয় কণা বা নিউক্লিয়নগুলির মধ্যে কার্যকরী যে অতি শক্তিশালী আকর্ষণ বল প্রোটনগুলির মধ্যে সক্রিয় স্থির তাড়িতিক বিকর্ষণ বলের প্রভাব প্রতিমিত করে নিউক্লিয়াসকে সুস্থিত রাখে, তাকে নিউক্লিয় বল বলে।
নিউক্লিয় বল উৎপত্তির কারণ – বিজ্ঞানী ওয়ার্নার হাইসেনবার্গ তাঁর প্রস্তাবিত নিউট্রন-প্রোটন প্রকল্পের (নিউট্রন-প্রোটন hypothesis) মাধ্যমে নিউক্লিয় বলের সৃষ্টির কারণ ব্যাখ্যা করেন। এই ধারণা অনুযায়ী, নিউক্লিয়াস মধ্যস্থ প্রোটন ও নিউট্রনের মধ্যে প্রতিনিয়ত অবিরাম গতিতে আধান বিনিময়ের ফলে প্রোটন নিউট্রনে ও নিউট্রন প্রোটনে রূপান্তরিত হয়ে থাকে। এই রূপান্তর এত দ্রুত সংঘটিত হয় যে প্রোটনগুলির মধ্যে স্বাভাবিক স্থির তাড়িতিক বিকর্ষণ কার্যকরী হওয়ার সুযোগ পায় না, পরিবর্তে এক সুতীব্র আকর্ষণ বলের উদ্ভব হয় যা নিউক্লিয়নগুলিকে জোটবদ্ধ রাখে। একেই নিউক্লিয় বল বলা হয় যা প্রোটনগুলির তড়িৎ বিকর্ষণ বল অপেক্ষা অনেক বেশি শক্তিশালী (নিউক্লিয় বল মহাকর্ষ বল অপেক্ষা প্রায় 1038 গুণ শক্তিশালী)। পরবর্তীকালে জাপানি বিজ্ঞানী হিদেকি ইউকাওয়া দেখান যে, π-মেসন কণার আদানপ্রদানের মাধ্যমে নিউট্রন ও প্রোটনের এই পারস্পরিক রূপান্তর সংঘটিত হয় ও নিউক্লিয় বল সৃষ্টি হয়। এই বল নিউক্লিয়াসকে স্থায়িত্ব প্রদান করে।
n – π– → p, n → নিউট্রন, → π+ পজিটিভ মেসন
p – π+ → n, p প্রোটন, π– → নেগেটিভ মেসন
নিউক্লিয়নগুলির মধ্যে আকর্ষণী বলের মান সর্বাধিক কখন হয়?
নিউক্লিয়নগুলির পারস্পরিক দূরত্ব 0.5 f থেকে 4 f পাল্লার মধ্যে থাকলে আকর্ষণী বল কার্যকর হয়। দূরত্ব 0.5 f অপেক্ষা কম হলে তীব্র বিকর্ষণ ঘটে। দূরত্ব 4f অপেক্ষা বেশি হলে আকর্ষণ বা বিকর্ষণ উভয়ই লোপ পায়। 0.8 f দূরত্বে আকর্ষণ বলের মান সর্বোচ্চ হয়।
নিউক্লিয় বলের প্রকৃতি আলোচনা করো।
নিউক্লিয় বলের প্রকৃতি –
- নিউক্লিয় বল অত্যন্ত শক্তিশালী আকর্ষণ বল।
- এই বল শুধুমাত্র নিউক্লিয়াসের মধ্যেই কার্যকরী হয়। এই বলের পাল্লা প্রায় 10-12 সেমি।
- নিউক্লিয় বলের মান নিউক্লিয়ন অর্থাৎ, নিউট্রন ও প্রোটন যারা প্রভাবিত হয় না।
- এটি কুলম্বীয় বল ও মহাকর্ষীয় বল থেকে আলাদা।
- এটি মহাকর্ষীয় বলের চেয়ে প্রায় 1040 গুণ জোরালো।
- নিউক্লিয়াসের বাইরে এই বলের অস্তিত্ব নেই।
- এই বলের ক্রিয়ার পাল্লা অতি স্বল্প। দুটি নিউক্লিয়নের মধ্যে দূরত্ব 1.5 ফার্মির বেশি হলে এটি নগণ্য হয়ে দাঁড়ায়।
- এটি ব্যস্ত বর্গ সূত্র মেনে চলে না।
- নিউক্লিয় বল চার ধরনের –
- প্রোটন-প্রোটন বিকর্ষণ বল,
- প্রোটন-প্রোটন আকর্ষণ বল,
- প্রোটন-নিউট্রন আকর্ষণ বল,
- নিউট্রন-নিউট্রন আকর্ষণ বল।
একটি মৌলের পারমাণবিক সংখ্যা 20 হলে মৌলটির ইলেকট্রন-বিন্যাস লেখো।
মৌলটির পারমাণবিক সংখ্যা = 20। অতএব, মৌলটির প্রোটন সংখ্যা = 20 এবং ইলেকট্রন সংখ্যা 20। ইলেকট্রন-বিন্যাস হবে 2, 8, 8, 2। অর্থাৎ, K কক্ষে 2টি, L কক্ষে 8টি, কক্ষে 8টি ও N কক্ষে 2টি ইলেকট্রন আছে।
\({}_6^{13}A\) নিউক্লাইডটিতে প্রোটন ও নিউট্রনের সংখ্যা এবং ইলেকট্রন-বিন্যাস লেখো।
\({}_6^{13}A\) নিউক্লাইড -এর পারমাণবিক সংখ্যা 6, ভরসংখা 13। অতএব, প্রোটন সংখ্যা = 6, ইলেকট্রন সংখ্যা = 6 এবং নিউট্রন সংখ্যা = (13 – 6) = 7। \({}_6^{13}A\) নিউক্লাইডের ইলেকট্রন-বিন্যাস হবে K (2), L(4)। অর্থাৎ, এর K কক্ষে 2টি, কক্ষে 4টি ইলেকট্রন আছে।
হাইড্রোজেন থেকে শুরু করে ক্যালশিয়াম পর্যন্ত মৌলগুলির পরমাণুর ইলেকট্রন-বিন্যাস কেমন হবে চিত্রসহ দেখাও।
হাইড্রোজেন (Z = 1) থেকে শুরু করে ক্যালশিয়াম (Z = 20) পর্যন্ত মৌলগুলির পরমাণুর ইলেকট্রন-বিন্যাস –
| মৌলের নাম | চিহ্ন | পারমাণবিক সংখ্যা (Z) | ইলেকট্রন সংখ্যা | বিভিন্ন কক্ষে ইলেকট্রন-বিন্যাস | বিভিন্ন কক্ষে ইলেকট্রন-বিন্যাস | বিভিন্ন কক্ষে ইলেকট্রন-বিন্যাস | বিভিন্ন কক্ষে ইলেকট্রন-বিন্যাস |
| K | L | M | N | ||||
| হাইড্রোজেন | H | 1 | 1 | 1 | |||
| হিলিয়াম | He | 2 | 2 | 2 | |||
| লিথিয়াম | Li | 3 | 3 | 2 | 1 | ||
| বেরিলিয়াম | Be | 4 | 4 | 2 | 2 | ||
| বোরন | B | 5 | 5 | 2 | 3 | ||
| কার্বন | C | 6 | 6 | 2 | 4 | ||
| নাইট্রোজেন | N | 7 | 7 | 2 | 5 | ||
| অক্সিজেন | O | 8 | 8 | 2 | 6 | ||
| ফ্লুওরিন | F | 9 | 9 | 2 | 7 | ||
| নিয়ন | Ne | 10 | 10 | 2 | 8 | ||
| সোডিয়াম | Na | 11 | 11 | 2 | 8 | 1 | |
| ম্যাগনেশিয়াম | Mg | 12 | 12 | 2 | 8 | 2 | |
| অ্যালুমিনিয়াম | Al | 13 | 13 | 2 | 8 | 3 | |
| সিলিকন | Si | 14 | 14 | 2 | 8 | 4 | |
| ফসফরাস | P | 15 | 15 | 2 | 8 | 5 | |
| সালফার | S | 16 | 16 | 2 | 8 | 6 | |
| ক্লোরিন | Cl | 17 | 17 | 2 | 8 | 7 | |
| আর্গন | Ar | 18 | 18 | 2 | 8 | 8 | |
| পটাশিয়াম | K | 19 | 19 | 2 | 8 | 8 | 1 |
| ক্যালশিয়াম | Ca | 20 | 20 | 2 | 8 | 8 | 2 |
যোজ্যতা নির্ণয়ের নিয়ম – পরমাণুর ইলেকট্রন-বিন্যাস থেকে নিম্ন বর্ণিত নিয়ম অনুসারে সংশ্লিষ্ট পরমাণুর যোজ্যতা নির্ণয় করা যায় –
- যোজ্যতা পরমাণুর যোজ্যতা কক্ষস্থিত বা যোজক ইলেকট্রন সংখ্যা (যখন যোজক ইলেকট্রন সংখ্যা 4 বা তার কম),
- যোজ্যতা = 8 – যোজক ইলেকট্রন সংখ্যা (যখন যোজক ইলেকট্রন সংখ্যা 4 -এর বেশি।) যেমন – সোডিয়াম (Na) পরমাণুর ইলেকট্রন বিন্যাস – K(2), L(8), M(1), ∴ উহার যোজ্যতা = 1। আবার, ফসফরাসের (P) ইলেকট্রন-বিন্যাস – K(2), L(8), M(5)। ∴ উহার যোজ্যতা = 8 – 5 = 3।

নিষ্ক্রিয় মৌল বা বিরল গ্যাসের ইলেকট্রন বিন্যাস কেমন হয়?
কয়েকটি মৌলের পরমাণুর সর্বশেষ কক্ষে 8টি ইলেকট্রন আছে (নিয়ন, আর্থন), এদের নিষ্ক্রিয় মৌল বা বিরল গ্যাস বা নো গ্যাস বলে। হিলিয়ামও একটি নিষ্ক্রিয় মৌল যার সর্বশেষ কক্ষটি 2টি ইলেকট্রন দ্বারা পূর্ণ থাকে।
নিম্নলিখিত আয়নগুলির ইলেকট্রন-বিন্যাস লেখো এবং এদের মধ্যে কারা পরস্পর আইসোইলেকট্রনিক? Cl–, Ar, Ne, Ca2+, O2, Al3+।
| পরমাণু/আয়ন | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | মোট ইলেকট্রন সংখ্যা |
| K | L | M | N | O | P | Q | ||
| Cl– | 2 | 8 | 8 | 18 | ||||
| Ar | 2 | 8 | 8 | 18 | ||||
| Ne | 2 | 8 | 10 | |||||
| Ca2+ | 2 | 8 | 8 | 18 | ||||
| O2- | 2 | 8 | 10 | |||||
| Al3+ | 2 | 8 | 10 |
উপরিউক্ত পরমাণু ও আয়নগুলির মধ্যে Cl–, Ar, Ca2+ প্রত্যেকের 18টি ইলেকট্রন বর্তমান। তাই এরা পরস্পর আইসোইলেকট্রনিক। Ne, O2-, Al3+ এদের প্রত্যেকের 10টি করে ইলেকট্রন বর্তমান, তাই এরা পরস্পর আইসোইলেকট্রনিক।
\({}_{11}^{23}Na\) ও \({}_{17}^{35}Cl\) নিউক্লাইড দুটির ইলেকট্রন-বিন্যাস লেখো।
\({}_{11}^{23}Na\) -এর পারমাণবিক সংখ্যা প্রোটন সংখ্যা = 11। অতএব, ইলেকট্রন সংখ্যা 11। ইলেকট্রন-বিন্যাস হবে 2, 8, 11 অর্থাৎ, K কক্ষে 2টি, L কক্ষে 8টি, M কক্ষে 1টি ইলেকট্রন থাকবে।
\({}_{17}^{35}Cl\) -এর পারমাণবিক সংখ্যা প্রোটন সংখ্যা 17। অতএব, ইলেকট্রন সংখ্যা = 17। \({}_{17}^{35}Cl\) -এর K কক্ষে 2টি, কক্ষে 8টি, M কক্ষে 7টি ইলেকট্রন আছে। অর্থাৎ, এর ইলেকট্রন-বিন্যাস হল K(2), L(8), M(7)।
ইলেকট্রনের কক্ষীয় স্থানান্তর বলতে কী বোঝায়?
ইলেকট্রনের কক্ষীয় স্থানান্তর – উত্তেজিত অবস্থায় পরমাণুর নীচের কোনো কক্ষ থেকে ওই কক্ষস্থিত ইলেকট্রনের উচ্চতর কক্ষে উত্তরণ অথবা উচ্চতর কক্ষে থাকা ইলেকট্রনের নির্দিষ্ট পরিমাণ শক্তি বর্জনের মাধ্যমে নিম্নতর কক্ষে অবতরণের ঘটনাকে ইলেকট্রনের কক্ষীয় স্থানান্তর বলা হয়।
একটি কক্ষ থেকে অন্য কক্ষে ইলেকট্রনের স্থানান্তরের ফলে শক্তির যে শোষণ বা বিকিরণ ঘটে তা সংক্ষেপে বিবৃত করো।
ইলেকট্রনের স্থানান্তর –
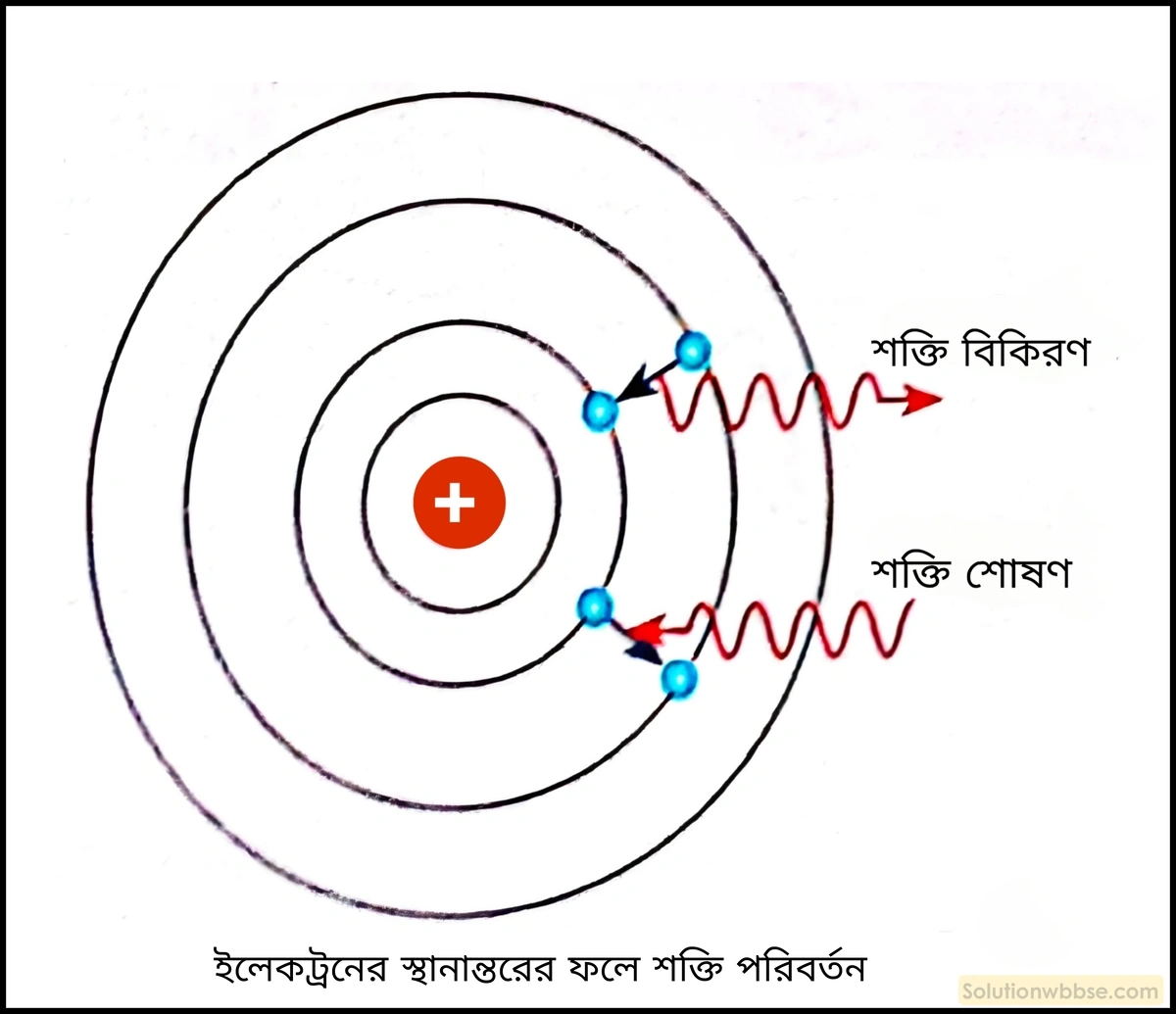
- যতক্ষণ কোনো ইলেকট্রন একটি নির্দিষ্ট কক্ষপথে ঘোরে ততক্ষণ ওই ইলেকট্রন থেকে কোনো শক্তি বিকীর্ণ হয় না বা ইলেকট্রনটি কোনো শক্তি গ্রহণ করে না। এই অবস্থায় পরমাণুটির অভ্যন্তরীণ শক্তি স্থির থাকে। একে পরমাণুর স্থিতাবস্থা বলে।
- কিন্তু বাইরে থেকে কোনো শক্তি (আলো, তাপ ইত্যাদি) প্রাপ্ত হলে ইলেকট্রন ওই শক্তি শোষণ করে, কেন্দ্রক থেকে দূরে এক কক্ষপথ থেকে অন্য কক্ষপথে চলে যায় এবং সেখান থেকে নিউক্লিয়াসকে ঘিরে আবর্তন করতে থাকে। তখন পরমাণুটির শক্তিও একটি নির্দিষ্ট পরিমাণে বাড়ে। এই অবস্থায় পরমাণুটি উচ্চতর শক্তিসম্পন্ন হয় ও স্থিতাবস্থায় আসে। পরমাণুর এই অবস্থাকে উদ্দীপ্ত অবস্থা (Excited state) বলে।
- ঠিক একইভাবে শক্তি বর্জন করে ইলেকট্রন উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তরে নেমে আসে। ইলেকট্রন কখনও দুটি কক্ষপথের মাঝে অর্থাৎ, সৃষ্টি শক্তিস্তরের মাঝে থাকে না।
- কোনো স্থায়ী উচ্চতর শক্তিস্তরে থেকে যদি কোনো ইলেকট্রন নিম্নতর শক্তিস্তরে নেমে আসে, তবে ওই ইলেকট্রন থেকে খানিকটা শক্তি বেরিয়ে আসে এবং তখনই ইলেকট্রনটি নির্দিষ্ট পরিমাণ শক্তি তরঙ্গের আকারে বিকিরণ করে। আবার, কোনো নির্দিষ্ট নিম্নতর শক্তিস্তর থেকে কোনো ইলেকট্রন উচ্চতর শক্তিস্তরে গেলে ইলেকট্রন নির্দিষ্ট পরিমাণ শক্তি শোষণ করে।
হাইড্রোজেন পরমাণুর বর্ণালি গঠনের পেছনে ইলেকট্রনের স্থানান্তরের কী ভূমিকা রয়েছে, এবং কীভাবে বিভিন্ন শক্তিস্তরে ইলেকট্রনের গমন ও পতন বিভিন্ন কম্পাঙ্কের বিকিরণের সৃষ্টি করে?
ইলেকট্রনের কক্ষে স্থানান্তরের ফলে শক্তির বিকিরণ ও শোষণ এবং হাইড্রোজেন বর্ণালি গঠন – হাইড্রোজেন পরমাণুর পারমাণবিক সংখ্যা 1, অর্থাৎ, এর একটিমাত্র ইলেকট্রন আছে। স্থিতাবস্থায় এই একটিমাত্র ইলেকট্রন প্রথম কক্ষ অর্থাৎ, K (n = 1) শক্তিস্তরে আবর্তন করে। বাইরে থেকে শক্তি প্রাপ্ত (তাপ, আলো ইত্যাদি) হলে ইলেকট্রনটি উত্তেজিত হয় এবং উচ্চতর শক্তিবিশিষ্ট কক্ষে চলে যায়। এখন যেহেতু, কিছু পরিমাণ হাইড্রোজেন গ্যাসের মধ্যে অসংখ্য H -পরমাণু বর্তমান, তাই বিভিন্ন H -পরমাণুর ইলেকট্রনগুলি বিভিন্ন পরিমাণ শক্তি শোষণ করে এবং বিভিন্ন উচ্চতর শক্তিস্তরে গমন করে। আবার, উচ্চ শক্তিস্তর থেকে ইলেকট্রনগুলি নিম্নতর শক্তিস্তরে নেমে আসে, তখন বিভিন্ন কম্পাঙ্কের বিকিরণ হয়। তাই দেখা যায় যে, H -পরমাণুতে একটিমাত্র ইলেকট্রন থাকলেও অনেকগুলি রেখাসম্পন্ন বর্ণালি পাওয়া যায়।
আয়ন কাকে বলে? আয়ন কয় প্রকার ও কী কী?
আয়ন (lon) – পরমাণু তার সর্ববহিস্থ কক্ষ থেকে এক বা একাধিক ইলেকট্রন বর্জন বা গ্রহণ করার ফলে তড়িদ্গ্রস্ত হলে তাকে আয়ন বলে। যেমন – Na+, Cl– ইত্যাদি।
আয়নের প্রকারভেদ – আয়ন দুই প্রকার –
- ক্যাটায়ন – ধনাত্মক তড়িদ্গ্রস্ত আয়নকে বলা হয় ক্যাটায়ন, যেমন – H+, Ca2+ ইত্যাদি।
- অ্যানায়ন – ঋণাত্মক তড়িদ্গ্রস্ত আয়ন অ্যানায়ন নামে পরিচিত, যেমন – Cl–, O2-।
স্বাভাবিক অবস্থায় থাকা একটি পরমাণু কীভাবে আয়নিত হয়? এজন্য প্রয়োজনীয় একটি বিষয়ের প্রভাব উল্লেখ করো।
পরমাণুর আয়নে রূপান্তর – নিউক্লিয়াস থেকে দূরত্ব সর্বোচ্চ হওয়ার জন্য পরমাণুর সর্ববহিস্থ কক্ষ বা যোজ্যতা কক্ষে থাকা ইলেকট্রনগুলি নিউক্লিয়াসের প্রতি অত্যন্ত দুর্বলভাবে আকৃষ্ট থাকে। তাই এই ইলেকট্রনগুলিকে প্রায় মুক্ত ইলেকট্রন বলা হয়। তাপ, আলো, তড়িৎ বা চৌম্বক ক্ষেত্র ইত্যাদির মাধ্যমে সামান্য বাহ্যিক শক্তি প্রয়োগ করে এরূপ এক বা একাধিক ইলেকট্রনকে পরমাণু থেকে বাইরে বের করে আনা অথবা যোজ্যতা কক্ষে বাইরে থেকে এক বা একাধিক ইলেকট্রন প্রবেশ করানো সম্ভব হয়। পরমাণু স্বাভাবিক অবস্থায় নিস্তড়িৎ। তাই ইলেকট্রন অপসারণের ফলে তার মধ্যে ইলেকট্রন ঘাটতি অর্থাৎ, ধনাত্মক আধান উদ্বৃত্ত হয় এবং ইলেকট্রন সংযোজিত হলে তা অতিরিক্ত ঋণাত্মক আধান লাভ করে। এই অবস্থায় প্রশম পরমাণু যথাক্রমে ক্যাটায়ন ও অ্যানায়নে পরিণত হয়।
পরমাণুর আয়নের উৎপত্তির কারণ – পরমাণুর আয়নে রূপান্তরণে প্রয়োজনীয় একটি বিষয় হল পরমাণুটির ইলেকট্রন-বিন্যাস। যে-সমস্ত মৌলের সর্ববহিস্থ কক্ষে 1, 2 বা 3টি ইলেকট্রন থাকে তারা এক বা একাধিক ইলেকট্রন বর্জন করে ক্যাটায়ন উৎপন্ন করার প্রবণতা দেখায়। আবার যে-সমস্ত মৌলের সর্ববহিস্থ কক্ষে 5, 6 বা 7টি ইলেকট্রন থাকে তারা এক বা একাধিক ইলেকট্রন গ্রহণ করে অ্যানায়ন উৎপন্ন করার প্রবণতা দেখায়। যে-সমস্ত পরমাণুর সর্ববহিস্থ কক্ষ ইলেকট্রন দ্বারা পরিপূর্ণ থাকে তারা সহজে আয়নিত হতে চায় না।
মৌলের পরমাণুর আয়নন শক্তি কাকে বলে?
আয়োলাইজেশন শক্তি (Ionisation Energy) – সর্বনিম্ন শক্তিস্তরে থাকা কোনো মৌলের একটি বিচ্ছিন্ন (Isolated) গ্যাসীয় পরমাণুর সর্ববহিস্থ কক্ষের (যোজন কক্ষ) সর্বাপেক্ষা শিথিলভাবে আবদ্ধ ইলেকট্রনটিকে নিউক্লিয়াসের আকর্ষণ থেকে সম্পূর্ণরূপে মুক্ত ও অপসারিত করে অসীম দূরত্বে নিয়ে গিয়ে ও পরমাণুটিকে এক একক ধনাত্মক আধানবিশিষ্ট ক্যাটায়নে পরিণত করতে যে ন্যূনতম শক্তির প্রয়োজন হয়, তাকে ওই মৌলের আয়োনাইজেশন শক্তি বা আয়নন বিভব বলে।
\({}_a^bA\) এবং \({}_x^yB\) পরস্পর সমস্থানিক হলে প্রমাণ করো যে, (a2 – x2) (b2 – y2) = 0।
\({}_a^bA\) এবং \({}_x^yB\) পরস্পর সমস্থানিক। সুতরাং, a = x।
∴ (a2 – x2) (b2 – y2) = (a2 – a2) (b2 – y2) = 0।
\({}_a^cX\) এবং \({}_b^qY\) এবং পরস্পর আইসোটোপ এবং \({}_m^nA\) ও \({}_p^qB\) পরস্পর আইসোবার হলে (a²-b²)(n-q) = 0।
এক্ষেত্রে X ও Y পরস্পর আইসোটোপ এবং A ও B পরস্পর আইসোবার হওয়ায় a = b এবং n = q।
∴ (a2 – b2)(n – q) = (a2 – a2)(n – n)
= 0 × 0
= 0
বোধমূলক প্রশ্নোত্তর
ইলেকট্রনকে পরমাণুর একটি মূল উপাদান কণিকারূপে গণ্য করা হয় কেন?
তড়িৎমোক্ষণ নলের ভিতরে নিম্নচাপে কোনো গ্যাস নিয়ে তড়িদ্বার দুটির মধ্যে উচ্চ বিভব প্রয়োগ করলে ক্যাথোড রশ্মি উৎপন্ন হয়। এই রশ্মি হল ঋণাত্মক তড়িদ্গ্রস্ত অতি ক্ষুদ্র কণা তথা ইলেকট্রনের স্রোত। দেখা গেছে তড়িৎমোক্ষণ নলে –
- বিভিন্ন ধাতু নির্মিত ক্যাথোড পাত ব্যবহার করে,
- যে-কোনো গ্যাস ব্যবহার করে সৃষ্ট ক্যাথোড রশ্মির ধর্ম ও প্রকৃতি একই এবং ক্যাথোড রশ্মি কণার (ইলেকট্রনের) আধান এবং ভরের অনুপাত \(\left(\frac em\right)\) সর্বদা একই থাকে। সুতরাং, বলা যেতে পারে ক্যাথোড রশ্মি কণা তথা ইলেকট্রন প্রত্যেক মৌলিক পদার্থের পরমাণুর মূল উপাদান।
ইলেকট্রনের আধানকে তড়িতের ক্ষুদ্রতম এককরূপে গণ্য করা হয় কেন?
1909 খ্রিস্টাব্দে বিজ্ঞানী রবার্ট মিলিকান বিখ্যাত তৈলবিন্দু পরীক্ষার সাহায্যে ইলেকট্রনের তড়িদাধান নির্ণয় করেন। এর মান 1.602 × 10-19 কুলম্ব অথবা 4.8 × 10-10 esu। এর চেয়ে কম আধানযুক্ত কণার অস্তিত্ব পাওয়া যায়নি। কোনো ধনাত্মক বা ঋণাত্মক তড়িদাধানযুক্ত কণার তড়িদাধানের পরিমাণ ইলেকট্রনের আধানের পূর্ণ সংখ্যার গুণিতক হয়। তাই ইলেকট্রনের আধানকে তড়িতের ক্ষুদ্রতম একক (অর্থাৎ 1 একক) রূপে গণ্য করা হয়।
পরমাণু নিস্তড়িৎ হয় কেন?
পরমাণুর তিনটি মূল বা প্রাথমিক কণা হল ধনাত্মক তড়িদ্গ্রস্ত প্রোটন, ঋণাত্মক তড়িদ্গ্রস্ত ইলেকট্রন এবং নিস্তড়িৎ নিউট্রন কণা। এখন পরমাণুর নিউক্লিয়াসে যতগুলি ধনাত্মক তড়িদ্গ্রস্ত প্রোটন কণা থাকে, নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথেও ঠিক ততগুলি ঋণাত্মক তড়িদ্গ্রস্ত ইলেকট্রন কণা থাকে। আবার, একটি ইলেকট্রন ও একটি প্রোটন উভয়ের আধানের মান সমান ও বিপরীত (1.602 × 10-19 কুলম্ব)। তাই এরা একে অপরকে প্রশমিত করে এবং পরমাণু সামগ্রিকভাবে নিস্তড়িৎ হয়।
নিউক্লিয়াস দ্বারা আকৃষ্ট হওয়া সত্ত্বেও আবর্তনরত ইলেকট্রনগুলি কেন নিউক্লিয়াসে গিয়ে ঝাঁপিয়ে পড়ে না?
অথবা, নিউক্লিয়াসের চারপাশে ইলেকট্রন ঘোরে কেন?
পরমাণুর নিউক্লিয়াসে উপস্থিত ধনাত্মক আধান ও কক্ষস্থিত ইলেকট্রনগুলির মধ্যে সক্রিয় স্থির তাড়িতিক আকর্ষণ বল অভিকেন্দ্র বল হিসেবে কাজ করায় ইলেকট্রনগুলি নিরবচ্ছিন্নভাবে স্থির দ্রুতিসহ বৃত্তাকার কক্ষপথে নিউক্লিয়াসকে প্রদক্ষিণ করে। ইলেকট্রনের তাৎক্ষণিক গতির অভিমুখ ও অভিকেন্দ্র বলের ক্রিয়ার অভিমুখ পরস্পর লম্বভাবে অবস্থান করায় গতির অভিমুখে অভিকেন্দ্র বলের কোনো উপাংশ থাকে না। তাই এই বল ইলেকট্রনের ভুতির কোনো পরিবর্তন ঘটায় না। কিন্তু এই বলের ক্রিয়া বজায় থাকায় প্রতি মুহূর্তে ইলেকট্রনের বেগের অভিমুখ পালটায় এবং ইলেকট্রন বৃত্তগতি বজায় রাখে। এ কারণেই নিউক্লিয়াসের আকর্ষণে ইলেকট্রন তার উপর গিয়ে ঝাঁপিয়ে পড়ে না।
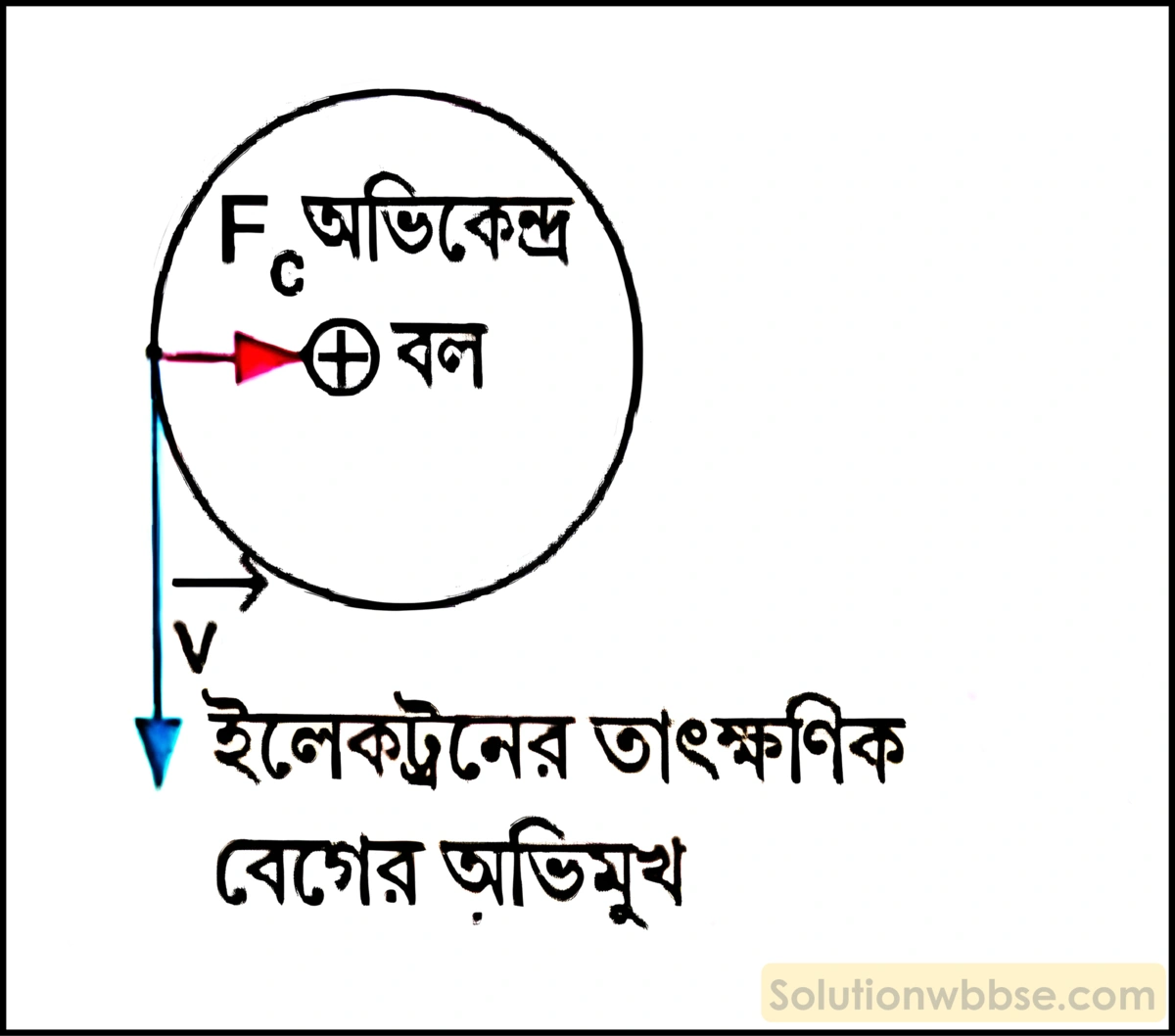
অপকেন্দ্র বলকে অলীক বল বলা হয় কেন? ব্যাখ্যা কর।
ঘূর্ণনরত অবস্থায় ইলেকট্রন সাম্যাবস্থায় আসার জন্য ইলেকট্রনের উপর অভিকেন্দ্র বলের সমান ও বিপরীতমুখী একটি বলের ক্রিয়া আপাত সত্য বলে বিবেচনা করা হয়। একে অপকেন্দ্র বা কেন্দ্রাতিগ বল বলে। অপকেন্দ্র বল ক্রিয়া-প্রতিক্রিয়াজনিত কারণে সৃষ্টি হয় না বলে একে অলীক বল বলে। এটি কোনো বাস্তব বল নয়। ঘূর্ণনরত নির্দেশতন্ত্র ছাড়া অন্যত্র এর অস্তিত্ব থাকে না। অভিকেন্দ্র বল বাস্তব বল হওয়ায় এটি কখনোই কোনো অলীক বল (অপকেন্দ্র বল) দ্বারা প্রতিমিত হয় না।
পরমাণুর নিউক্লিয়াসের মধ্যে অতিক্ষুদ্র স্থানে প্রোটন কণা একত্রে থাকে কীভাবে?
পরমাণুর নিউক্লিয়াসে পজিটিভ তড়িদ্গ্রস্ত কণা প্রোটন ও নিস্তড়িৎ কণা নিউট্রন বর্তমান। আমরা জানি, সমজাতীয় আধান পরস্পরকে বিকর্ষণ করে। তাই প্রোটন কণাগুলির মধ্যে বিকর্ষণ বল কাজ করা উচিত, কিন্তু বাস্তবে তা হয় না। প্রোটন ও নিউট্রনের মধ্যে অবিরাম গতিতে আধান বিনিময়ের ফলে প্রোটন নিউট্রনে এবং নিউট্রন প্রোটনে পরিণত হয়। ফলে, তাদের মধ্যে এক তীব্র আকর্ষণ বল সৃষ্টি হয়, যা নিউক্লিয় বল নামে পরিচিত। এই আকর্ষণ বলের কারণে নিউক্লিয়াসের মধ্যে অতি ক্ষুদ্র স্থানে প্রোটন কণা একত্রে থাকতে পারে।
পারমাণবিক সংখ্যাকে কেন মৌলের মূলগত ধর্মের নির্ণায়ক বলা হয়?
যে-কোনো পরমাণুর মোট ইলেকট্রন সংখ্যা, তাদের কক্ষীয় বণ্টন এবং সেই সূত্রে সংশ্লিষ্ট পরমাণুর ভৌত ও রাসায়নিক আচরণ প্রদর্শনের প্রকৃতি, যেমন – যোজ্যতা, ক্যাটায়ন বা অ্যানায়ন সৃষ্টির ক্ষমতা, ভৌত অবস্থা ইত্যাদি সবই মৌলটির পারমাণবিক-ক্রমাঙ্কের ওপর নির্ভর করে। দুটি ভিন্ন মৌলের ভরসংখ্যা বা নিউট্রন সংখ্যা ক্ষেত্রবিশেষে সমান হলেও প্রোটন সংখ্যা বা পারমাণবিক সংখ্যা কখনোই সমান হয় না। পারমাণবিক সংখ্যার পরিবর্তনে মৌলের রাসায়নিক ধর্মের আমূল পরিবর্তন ঘটে। এ কারণেই পারমাণবিক সংখ্যাকে মৌলের স্বকীয় বা মূলগত ধর্ম বলে। X-রশ্মি বর্ণালি সংক্রান্ত বিজ্ঞানী মোজলের গবেষণা সূত্রে এই ধারণা প্রতিষ্ঠিত হয়।
মৌলের পরমাণু ক্যাটায়ন বা অ্যানায়নে পরিণত হলে ওর পরমাণু-ক্রমাঙ্কের পরিবর্তন হয় না কেন?
মৌলের পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যাই হল ওই মৌলের পরমাণু-ক্রমাঙ্ক। পরমাণুর যোজ্যতা কক্ষ থেকে এক বা একাধিক ইলেকট্রন বর্জিত হলে বা বাইরে থেকে নির্দিষ্ট সংখ্যক ইলেকট্রন ওই কক্ষে প্রবেশ করলে পরমাণুটি ক্যাটায়ন বা অ্যানায়নে পরিণত হয়। এই প্রক্রিয়ায় পরমাণুর প্রোটন সংখ্যা অপরিবর্তিত থাকে বলে পরমাণু-ক্রমাঙ্কের কোনো পরিবর্তন হয় না।
পরমাণুর নিউক্লিয়াসে ইলেকট্রন না থাকা সত্ত্বেও তেজস্ক্রিয় বিকিরণের সময় β-কণা নির্গত হয় কেন?
তেজস্ক্রিয় ভাঙনের ফলে তেজস্ক্রিয় মৌলের নিউক্লিয়াস থেকে α-রশ্মি, β-রশ্মি প্রভৃতি নির্গমনের দ্বারা তেজস্ক্রিয় মৌলের নিউক্লিয়াস অপেক্ষাকৃত স্থায়ী মৌলের নিউক্লিয়াসে রূপান্তরিত হয়। পরমাণুর নিউক্লিয়াস থেকে নির্গত β-রশ্মি ঋণাত্মক (-ve) চার্জযুক্ত ইলেকট্রন কণার স্রোত।
যে-সমস্ত তেজস্ক্রিয় আইসোটোপের নিউক্লিয়াসের নিউট্রন ও প্রোটন সংখ্যার অনুপাত (\(\frac np\) অনুপাত) 1.512 অপেক্ষা বেশি সেই সমস্ত আইসোটোপের 1টি নিউট্রন (n) ভেঙে 1টি প্রোটন (p) ও 1টি ইলেকট্রনে (e–) পরিণত হয়। ফলে এই ইলেকট্রন নিউক্লিয়াসের স্বাভাবিক কণিকা না হওয়ায় নিউক্লিয়াস থেকে β-কণা রূপে নির্গত হয় এবং পরমাণুর \(\frac np\) অনুপাত হ্রাস করে।
(β-কণা)
মৌলের ভরসংখ্যা পূর্ণসংখ্যা হলেও অধিকাংশ ক্ষেত্রে পারমাণবিক ভর পূর্ণসংখ্যায় হয় না কেন?
মৌলের ভরসংখ্যা হল তার পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন ও নিউট্রন সংখ্যার যোগফল। স্বাভাবিকভাবেই ভরসংখ্যা সর্বদাই পূর্ণসংখ্যা। কিন্তু পারমাণবিক ভর নির্ণয়ের ক্ষেত্রে সংশ্লিষ্ট মৌলের বিভিন্ন আইসোটোপগুলির আনুপাতিক পরিমাণ বিবেচনা করে তাদের ভারযুক্ত গড় নির্ণয় করতে হয়। তাই অধিকাংশ ক্ষেত্রেই পারমাণবিক ভর ভগ্নাংশ হয়।
পরমাণুর নিউক্লিয়াস ভারী ও ধনাত্মক আধানযুক্ত কেন?
পরমাণুর নিউক্লিয়াসে ধনাত্মক আধানযুক্ত প্রোটন এবং নিস্তড়িৎ কণা নিউট্রন অবস্থান করে। তাই পরমাণুর কেন্দ্র বা নিউক্লিয়াস ধনাত্মক আধানযুক্ত হয়।
পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন ও নিউট্রনের মধ্যে অবিরাম গতিতে আধান বিনিময় হয়ে প্রোটন নিউট্রনে এবং নিউট্রন প্রোটনে পরিণত হয়। ফলে, সমআধানযুক্ত হওয়া সত্ত্বেও প্রোটন কণাগুলি পরস্পরকে বিকর্ষণ করে না। পরিবর্তে এক তীব্র আকর্ষণ বল বা নিউক্লিয় বলের সৃষ্টি হয় যা নিউক্লিয়াসের মধ্যে অতি ক্ষুদ্র স্থানে প্রোটন ও নিউট্রন কণাগুলিকে একত্রে আবদ্ধ রাখে। ফলে, সমগ্র পরমাণুর ভর (ইলেকট্রনের ভরকে নগণ্য ধরে) পরমাণুর কেন্দ্রে অতি অল্প স্থানে কেন্দ্রীভূত থাকে। তাই পরমাণুর নিউক্লিয়াস ভারী হয়।
পরমাণুর ভরের তুলনায় ইলেকট্রনের ভরকে নগণ্য ধরা হয় কেন?
পরমাণুর নিউক্লিয়াসে প্রোটন ও নিউট্রন থাকে এবং নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষে ইলেকট্রনগুলি আবর্তন করে। প্রোটন এবং নিউট্রন প্রায় সমান ভরবিশিষ্ট কণা। কিন্তু একটি প্রোটন একটি ইলেকট্রন অপেক্ষা প্রায় 1837 গুণ ভারী। কাজেই পরমাণুর সমস্ত ভর নিউক্লিয়াসে কেন্দ্রীভূত থাকে। ফলে, ইলেকট্রনের ভরকে পরমাণুর ভরের তুলনায় নগণ্য ধরে উপেক্ষা করা হয়।
রাদারফোর্ডের α-কণা বিক্ষেপণ পরীক্ষায় খুব পাতলা (0.0004 mm বেধ বিশিষ্ট) সোনার পাত ব্যবহার করা হয় কেন?
ধাতব পাত ধাতব মৌলের পরমাণুর সমবায়ে গঠিত। ধাতব পাতের বেধ যত কম হবে অর্থাৎ, পাতটি যত পাতলা হবে, তেজস্ক্রিয় আইসোটোপ থেকে নির্গত তীব্র গতিসম্পন্ন α-কণার সঙ্গে ধাতব পরমাণুর সংঘর্ষের সম্ভাবনা তত বৃদ্ধি পাবে। সোনার নমনীয়তা (Malleability) বেশি হওয়ায় একে পাতলা পাতে পরিণত করা সম্ভব।
আবার, কম বেধযুক্ত পাতে সংশ্লিষ্ট পরমাণুগুলির বিন্যাস ও বণ্টন প্রায় এক-স্তরীয় বলে ধারণা করা হয়, ফলে ওই পাত অতিক্রম করার পর α-কণাগুলির গতিপথের পরিবর্তন থেকে পরমাণুর উপাদানগুলির বণ্টন সম্পর্কে যথাযথ ধারণা পাওয়া সম্ভব হয়, যা বৃহৎ বেধযুক্ত পাতের ক্ষেত্রে ত্রুটিপূর্ণ হওয়ার সম্ভাবনা থাকে। কারণ সেক্ষেত্রে পাতটি ক্ষুদ্র বেধসম্পন্ন একাধিক স্তরের সমবায় হওয়ায় একটি স্তর অতিক্রম করে নির্গত α-রশ্মির গতিপথ পরবর্তী স্তরের পরমাণুর উপাদানগুলি দ্বারা প্রভাবিত হয়।
সুতরাং, α-কণা বিক্ষেপণ পরীক্ষাটির সাফল্যের অন্যতম অপরিহার্য শর্ত হল ব্যবহৃত পাতটির বেধ যথাসম্ভব কম থাকা।
রাদারফোর্ডের α-কণা বিচ্ছুরণ পরীক্ষায় সোনার পাতের পরিবর্তে অন্য কোনো হালকা ধাতুর পাত ব্যবহার করলে কী ঘটত?
রাদারফোর্ডের α-কণা বিচ্ছুরণ পরীক্ষায় সোনার পরিবর্তে অন্য কোনো হালকা ধাতুর পাত ব্যবহার করলে পরীক্ষাটি সফল হত না, কারণ α-কণা হল তেজস্ক্রিয় নিউক্লিয়াস থেকে নির্গত দ্রুতগামী ভারী কণা যার ভর 1টি প্রোটনের ভরের 4 গুণ। সোনার বদলে অন্য কোনো হালকা ধাতুর পাত ব্যবহার করলে ভারী তেজস্ক্রিয় α-কণার কোনো অংশই হালকা ধাতব পাত দ্বারা প্রতিফলিত হয়ে বিক্ষিপ্ত হত না বরং ভারী α-কণা ওই হালকা পাত ভেদ করে অগ্রসর হত। α-কণার কোনো অংশই তাদের সরলরৈখিক গতিপথ থেকে বিচ্যুত হয়ে ফিরে আসত না অর্থাৎ, α-কণার বিচ্ছুরণ ঘটত না। ফলে, পরমাণু মডেলের কোনো সঠিক ধারণা পাওয়া যেত না।
H+ আয়নকে প্রোটন বলা হয় কেন?
অথবা, একটি প্রোটন কণা এবং একটি H+ আয়ন অভিন্ন বলা হয় কেন?
একটি সাধারণ হাইড্রোজেন পরমাণুর নিউক্লিয়াসে একটি প্রোটন থাকে, কিন্তু কোনো নিউট্রন থাকে না। নিউক্লিয়াসকে কেন্দ্র করে 1টি ইলেকট্রন অনবরত ঘুরতে থাকে। হাইড্রোজেন পরমাণু 1টি ইলেকট্রন ত্যাগ করে হাইড্রোজেন আয়নে পরিণত হয়।
H – e– → H+
সুতরাং, H+ আয়নে শুধুমাত্র একটি প্রোটন থাকে। অর্থাৎ, একটি প্রোটন কণা এবং একটি H+ আয়ন কার্যত অভিন্ন।
\({}_{19}^{39}K\) এবং \({}_{17}^{37}Cl\) যদি যথাক্রমে K+ ও Cl– আয়ন গঠন করে তবে আয়ন দুটির মধ্যে কোন্ কণাগুলির সংখ্যা সমান থাকে?
\({}_{19}^{39}K\) পরমাণুর প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 19, নিউট্রন সংখ্যা = 39 – 19 = 20। \({}_{17}^{37}Cl\) পরমাণুর প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 17, নিউট্রন সংখ্যা = 37 – 17 = 20। K পরমাণু 1টি ইলেকট্রন বর্জন করে K+ আয়ন গঠন করে।
∴ K+ -এর ইলেকট্রন সংখ্যা = 19 – 1 = 18।
আবার Cl পরমাণু 1টি ইলেকট্রন গ্রহণ করে Cl– উৎপন্ন করে।
∴ Cl– -এর ইলেকট্রন সংখ্যা = 17 + 1 = 18। সুতরাং, আয়ন দুটির মধ্যে ইলেকট্রন ও নিউট্রন সংখ্যা সমান থাকে।
\({}_{92}^{238}U\) নিউক্লাইডটির ইলেকট্রন, প্রোটন ও নিউট্রন সংখ্যা নির্ণয় করো। যদি নিউক্লাইডটি থেকে 3টি নিউট্রন কণা বেরিয়ে যায় তবে নতুন নিউক্লাইডটিকে কীভাবে প্রকাশ করবে? পূর্বোত্ত ও শেষোক্ত নিউক্লাইড দুটির মধ্যে সম্পর্ক কী?
\({}_{92}^{238}U\) নিউক্লাইডটিতে প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 92, নিউট্রন সংখ্যা = 238 – 92 = 146। 3টি নিউট্রন বেরিয়ে গেলে নতুন নিউক্লাইডটির প্রতীক হবে \({}_{92}^{238}U\) [∵ নতুন ভরসংখ্যা = 238 – 3 = 235]।
পূর্বোক্ত ও শেষোক্ত নিউক্লাইড দুটি পরস্পর আইসোটোপ হবে কারণ এদের পারমাণবিক সংখ্যা সমান।
আইসোটোপের রাসায়নিক ধর্ম অভিন্ন হয় কেন?
একই মৌলের বিভিন্ন আইসোটোপের ভরসংখ্যা আলাদা হয়, কিন্তু পারমাণবিক সংখ্যা সমান হয়। অর্থাৎ, পরমাণুতে উপস্থিত প্রোটন সংখ্যা এবং ইলেকট্রন সংখ্যা একই হয়। মৌলের রাসায়নিক ধর্ম তার পারমাণবিক সংখ্যা ও ইলেকট্রন-বিন্যাসের ওপর নির্ভর করে। আইসোটোপের প্রোটন সংখ্যা ও ইলেকট্রন-বিন্যাস এক হবার কারণে আইসোটোপের রাসায়নিক ধর্ম অভিন্ন হয়।
নিউক্লাইডটিতে প্রোটন ও নিউট্রন সংখ্যা লেখো। মৌলটির ইলেকট্রন-বিন্যাস লেখো। \({}_6^{13}A\) ও \({}_6^{12}A\) এই দুটি নিউক্লাইডের কেন্দ্রকের গঠনে পার্থক্য কী? এদের রাসায়নিক ধর্ম এক হয় কেন?
\({}_6^{13}A\) নিউক্লাইডে প্রোটন সংখ্যা = 6টি, ইলেকট্রন সংখ্যা = 6টি, নিউট্রন সংখ্যা = (13 – 6) = 7টি।
মৌলটির ইলেকট্রন-বিন্যাস হল – K(2), L(4)।
\({}_6^{12}A\) নিউক্লাইডে প্রোটন সংখ্যা = 6টি, ইলেকট্রন সংখ্যা = 6টি, নিউট্রন সংখ্যা= (12 – 6) = 6টি। অর্থাৎ, \({}_6^{13}A\) পরমাণুর কেন্দ্রে পরমাণু অপেক্ষা একটি নিউট্রন কম আছে।
এরা পরস্পর আইসোটোপ হওয়ার কারণে রাসায়নিক ধর্ম এক হয়। কারণ – এদের ইলেকট্রন তথা প্রোটন সংখ্যা সমান।
17A35 এবং 17B37 পরমাণুদ্বয়ের মধ্যে সম্পর্ক কী? এদের রাসায়নিক ধর্ম কি সম্পূর্ণ পৃথক না কি মোটামুটি একই রকম হবে? উত্তরের সপক্ষে যুক্তি দাও।
17A35 পরমাণুতে প্রোটন সংখ্যা =17, ইলেকট্রন সংখ্যা = 17, নিউট্রন সংখ্যা = (35 – 17)=18।
17B37 পরমাণুতে প্রোটন সংখ্যা =17, ইলেকট্রন সংখ্যা = 17, নিউট্রন সংখ্যা = (37 – 17)=20।
A ও B পরমাণুর প্রোটন ও ইলেকট্রন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা তথা ভরসংখ্যা আলাদা। তাই এরা পরস্পর আইসোটোপ বা সমস্থানিক।
A ও B -এর রাসায়নিক ধর্ম একই রকম হবে কারণ – মৌলের রাসায়নিক ধর্ম তার ইলেকট্রন সংখ্যার ওপর নির্ভর করে। A ও B-এর পরমাণু-ক্রমাঙ্ক অর্থাৎ, প্রোটন সংখ্যা তথা ইলেকট্রন সংখ্যা সমান হবার কারণে এদের রাসায়নিক ধর্ম এক হবে।
ক্লোরিনের দুটি আইসোটোপ 17Cl35 ও 17Cl37 হওয়া সত্ত্বেও ক্লোরিনের পারমাণবিক ভর 35.5 কেন হয়?
কিছু কিছু মৌলের ভরসংখ্যা পূর্ণসংখ্যায় হলেও সাধারণ অবস্থায় এই মৌলগুলির পারমাণবিক ভর ভগ্নাংশে হয় কারণ – স্বাভাবিক অবস্থায় প্রকৃতির মধ্যে বেশিরভাগ মৌলকে তার আইসোটোপের মিশ্রণরূপে পাওয়া যায়। এই মিশ্রণের মধ্যে আইসোটোপগুলি এমন অনুপাতে থাকে যে, তার গড় করলে পারমাণবিক ভর পূর্ণসংখ্যায় না হয়ে ভগ্নাংশে হয়।
ক্লোরিনের আইসোটোপ 17Cl35 ও 17Cl37 প্রকৃতিতে যথাক্রমে 75.4% ও 24.6% ওজন অনুপাতে থাকে।
∴ ক্লোরিনের পারমাণবিক ভর = \(\frac{75.4\times35+24.6\times37}{100}\)
= 35.49 ≈ 35.5।
A, B, C পরমাণু তিনটির ভরসংখ্যা যথাক্রমে 30, 31, 33। এদের নিউট্রন সংখ্যা যথাক্রমে 16, 17 এবং 18। এদের মধ্যে কোন্ দুটি আইসোটোপ এবং কেন?
A, B, C -এর ভরসংখ্যা, নিউট্রন সংখ্যা ও প্রোটন সংখ্যা –
| পরমাণু | ভরসংখ্যা | নিউট্রন সংখ্যা | প্রোটন সংখ্যা = (ভরসংখ্যা – নিউট্রন সংখ্যা) |
| A | 30 | 16 | (30 – 16) = 14 |
| B | 31 | 17 | (31 – 17) = 14 |
| C | 33 | 18 | (33 – 18) = 15 |
এখানে, A ও B পরমাণুর প্রোটন সংখ্যা 14, কিন্তু ভরসংখ্যা আলাদা। এই জন্য, A ও B পরমাণু দুটি পরস্পর আইসোটোপ।
প্রদত্ত ক্ষেত্রগুলিতে A ও B মৌলগুলিকে শনাক্ত করো – (a) A মৌল দ্বিযোজী অ্যানায়ন গঠন করে, যার 10টি ইলেকট্রন আছে। (b) B মৌল ত্রিযোজী ক্যাটায়ন গঠন করে, যার 10টি ইলেকট্রন আছে। আয়ন দুটির মধ্যে সম্পর্ক লেখো।
প্রথম, A মৌল দ্বিযোজী অ্যানায়ন গঠন করে, যার 10টি ইলেকট্রন আছে। অর্থাৎ, A -এর ইলেকট্রন সংখ্যা = 10 – 2 = 8। A মৌলটির (নিস্তড়িৎ অবস্থায়) ইলেকট্রন সংখ্যা= প্রোটন সংখ্যা = পরমাণু-ক্রমাঙ্ক = 8। অর্থাৎ, A মৌলটি অক্সিজেন।
দ্বিতীয়, B মৌল ত্রিযোজী ক্যাটায়ন গঠন করে, যার 10 টি ইলেকট্রন আছে। অর্থাৎ, B -এর ইলেকট্রন সংখ্যা = 10 + 3 = 13। B মৌলটির (নিস্তড়িৎ অবস্থায়) ইলেকট্রন সংখ্যা = প্রোটন সংখ্যা = পরমাণু-ক্রমাঙ্ক 13। সুতরাং, B মৌলটি অ্যালুমিনিয়াম। আয়ন দুটির ইলেকট্রন সংখ্যা সমান হওয়ায় এরা আইসোইলেকট্রনিক।
পরমাণু ও আয়নের মধ্যে কোনটি বেশি স্থায়ী ও কেন? এর একটি ব্যতিক্রম লেখো।
একই মৌলের পরমাণু ও আয়নের মধ্যে আয়নটি বেশি সুস্থিত কারণ – কোনো মৌল এক বা একাধিক ইলেকট্রন গ্রহণ বা বর্জন করে নিকটবর্তী নিষ্ক্রিয় মৌলের অনুরূপ ইলেকট্রন-বিন্যাস লাভ করে যথাক্রমে অ্যানায়ন বা ক্যাটায়নে পরিণত হয়। আয়নগুলির সবচেয়ে বাইরের কক্ষ ডুপ্লেট (2টি e–) বা অক্টেট (8টি e–) দ্বারা পূর্ণ থাকায় পরমাণু অপেক্ষা আয়ন বেশি স্থায়িত্ব লাভ করে।
[তবে মনে রাখতে হবে যে, পরমাণু অপেক্ষা আয়নগুলি রাসায়নিকভাবে বেশি সক্রিয়।]
এর ব্যতিক্রম হল ফুওরিন পরমাণু ও ফুওরিন আয়ন (F–)। F– আয়নের তুলনায় F পরমাণুর সুস্থিতি বেশি।
আইসোবারদের ভরসংখ্যা সমান হলেও প্রকৃত ভরে সামান্য পার্থক্য থাকে – ব্যাখ্যা করো।
অথবা, আইসোবারদের প্রকৃত ভর কি সমান? যুক্তিসহ লেখো।
কোনো মৌলের একটি পরমাণুর ভর বলতে পরমাণুটির প্রকৃত ভরকেই বোঝায় এবং মৌলের পারমাণবিক ওজনকে 1 amu (1.6603 × 10-24 g) মান দ্বারা গুণ করলেই এর প্রকৃত ভর পাওয়া যায়। সুতরাং, আইসোবারদের ভরসংখ্যা সমান হলেও তাদের প্রকৃত পারমাণবিক ওজন সামান্য ভিন্ন হওয়ায় প্রকৃত ভরের মান আলাদা হয়। যেমন – 18Ar40 এবং 20Ca40, এদের মধ্যে Ar -এর পারমাণবিক ওজন = 39.944, অর্থাৎ, এর প্রকৃত ভর = 39.944 × 1.6603 × 10-24 g = 66.319 × 10-24 g। আবার, Ca -এর পারমাণবিক ওজন = 40.08, অর্থাৎ, প্রকৃত ভর = 40.08 × 1.6603 × 10-24 g = 66.544 × 10-24 g।
ধরে নাও, কোনোভাবে 13X30 মৌলটির একটি পরমাণুর মধ্যে 2টি প্রোটন, 2টি ইলেকট্রন ও 3টি নিউট্রন যোগ করা হল। চূড়ান্ত পরমাণুটির সঙ্গে 18Y35 পরমাণুটির সম্পর্ক কীরূপ হবে, তা বুঝিয়ে লেখো।
13X30 -এর প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 13।
13X30 -এর নিউট্রন সংখ্যা = 30 – 13 = 17।
13X30 -এর সঙ্গে 2টি প্রোটন, 2টি ইলেকট্রন ও 3টি নিউট্রন যোগ করলে চূড়ান্ত পরমাণুটির প্রোটন সংখ্যা বা ইলেকট্রন সংখ্যা হবে = 13 + 2 = 15 এবং নিউট্রন সংখ্যা হবে = 17 + 3 = 20। অতএব, চূড়ান্ত পরমাণুটির ভরসংখ্যা = 15+ 20 = 35।
18Y35 -এর নিউট্রন সংখ্যা = 35 – 18 = 17। চূড়ান্ত পরমাণু এবং 18Y35 -এদের ভরসংখ্যা (35) সমান।
অতএব, চূড়ান্ত পরমাণুটি এবং 18Y35 -পরস্পর আইসোবার।
M কক্ষে মোট 18টি ইলেকট্রন থাকলেও ক্যালশিয়ামের (পারমাণবিক সংখ্যা = 20) ইলেকট্রন-বিন্যাস 2, 8, 10 লেখা হয় না কেন?
ক্যালশিয়ামের ইলেকট্রন-বিন্যাস 2, 8, 10 লেখা যায় না, কারণ কোনো পরমাণুর সর্ববহিস্থ কক্ষে সর্বাধিক ইলেকট্রন সংখ্যা 8 -এর বেশি হতে পারে না। তাই M কক্ষ (n = 3) 8টি ইলেকট্রন দ্বারা পূর্ণ হবার পরই N -কক্ষ (n = 4) ইলেকট্রন দ্বারা পূর্ণ হতে শুরু করে। অর্থাৎ, ক্যালশিয়ামের সঠিক ইলেকট্রন বিন্যাস হল – 2, 8, 8, 2।
রাদারফোর্ডের α-কণা পরীক্ষায় α-কণার পরিবর্তে β(বিটা) কণা ব্যবহার করা হয় না কেন?
রাদারফোর্ডের আলফা কণা পরীক্ষায় β-কণা ব্যবহার করা হয় না কারণ – বিটা রশ্মি (β) প্রকৃতপক্ষে ঋণাত্মক আধানযুক্ত ইলেকট্রন কণার স্রোত, এর চিহ্ন -1e0। রাদারফোর্ডের আলফা কণা পরীক্ষায় 0.0004 mm বেধ বিশিষ্ট পাতলা সোনার পাতকে তীব্র গতিসম্পন্ন এমন কণা দ্বারা আঘাত করা উচিত যাতে তা পরমাণু ভেদ করে যেতে পারে।
পরমাণুর কেন্দ্র ধনাত্মক তড়িদ্গ্রস্ত হবার কারণে ঋণাত্মক বিটা কণা ব্যবহার করলে তা পরমাণুর কেন্দ্র দ্বারা আকৃষ্ট হবে এবং সবকটি β-কণা পরমাণুর কেন্দ্রে শোষিত হবে। ফলে, পরমাণুর বেশিরভাগ স্থান যে ফাঁকা তা প্রমাণিত হবে না। অর্থাৎ, পরমাণুর সঠিক গঠন সম্পর্কে ধারণা করা যাবে না।
ফুওরিনের পারমাণবিক গুরুত্ব পূর্ণসংখ্যার হয় কেন?
সাধারণ অবস্থায় অধিকাংশ মৌলেরই আইসোটোপ আছে। প্রকৃতিতে প্রতিটি মৌলকে তার আইসোটোপগুলির মিশ্রণরূপে পাওয়া যায়। মিশ্রণের মধ্যে আইসোটোপগুলি একটি নির্দিষ্ট অনুপাতে থাকে। মৌলের পারমাণবিক গুরুত্ব হল বিভিন্ন অনুপাতে পাওয়া আইসোটোপগুলির পারমাণবিক গুরুত্বের গড় হিসেব। তাই যেসব মৌলের আইসোটোপ আছে তাদের পারমাণবিক গুরুত্ব ভগ্নাংশে হয়।
কিন্তু প্রকৃতিতে ফ্লুওরিন মৌলের কোনো আইসোটোপ নেই – শুধুমাত্র \({}_9^{19}F\) পরমাণুটি 100% বর্তমান থাকে। তাই ফ্লুওরিনের পারমাণবিক গুরুত্ব (19) সর্বদা পূর্ণসংখ্যার হয়, কখনোই ভগ্নাংশে হয় না।
ইলেকট্রন যদি নিউক্লিয়াসের আকর্ষণ উপেক্ষা করে বেরিয়ে যাবার মতো শক্তি সংগ্রহ করে তবে কী ঘটত?
কোনো একটি পরমাণু থেকে একটি ইলেকট্রনকে বিচ্ছিন্ন করতে যে ন্যূনতম শক্তির প্রয়োজন হয় তাকে ওই পরমাণুটির আয়নন শক্তি (Ionisation energy) বলে। পরমাণুর সর্ববহিস্থ কক্ষে উপস্থিত ইলেকট্রন যদি নিউক্লিয়াসের আকর্ষণ বল উপেক্ষা করে বেরিয়ে যাবার মতো শক্তি তথা আয়নন শক্তি সংগ্রহ করে অর্থাৎ, নিউক্লিয়াসের আকর্ষণ বল অপেক্ষা বেশি শক্তি লাভ করে-তবে ইলেকট্রনটি পরমাণু থেকে নির্গত হয়ে যায় এবং পরমাণুটি ধনাত্মক তড়িগ্রস্ত আয়ন তথা ক্যাটায়নে পরিণত হয়।
পরমাণু + আয়নন শক্তি → ক্যাটায়ন + মুক্ত ইলেকট্রন।
পার্থক্যধর্মী প্রশ্নোত্তর
ইলেকট্রন (Electron) ও প্রোটনের (Proton) সাদৃশ্য ও বৈসাদৃশ্যগুলি লেখো।
ইলেকট্রন (Electron) ও প্রোটনের (Proton) সাদৃশ্য ও বৈসাদৃশ্যগুলি হল –
সাদৃশ্য –
- মূল উপাদান – ইলেকট্রন ও প্রোটন পরমাণুর মূল উপাদান কণিকা।
- তড়িদ্গ্রস্ততা – উভয়েই তড়িদ্গ্রস্ত কণা।
- সংখ্যা – পরমাণুর মধ্যে ইলেকট্রন ও প্রোটন সমসংখ্যায় থাকে।
- আধান – উভয় কণিকার আধানের পরিমাণ 4.8 × 10-10 esu বা 1.6 × 10-19 কুলম্ব।
- তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্রের প্রভাব – তড়িদগ্রস্ত কণা হওয়ায় উভয় কণাই তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয়।
বৈসাদৃশ্য –
| বিষয় | ইলেকট্রন (Electron) | প্রোটন (Proton) |
| আধানের প্রকৃতি | ইলেকট্রন ঋণাত্মক তড়িদ্গ্রস্ত কণা। | প্রোটন ধনাত্মক তড়িদ্গ্রস্ত কণা। |
| ভর | ইলেকট্রনের ভর (9.11 × 10-31 কেজি) অতি নগণ্য। | একটি প্রোটনের ভর (1.6725 × 10-27 কেজি) একটি ইলেকট্রনের ভরের প্রায় 1837 গুণ। |
| ব্যাসার্ধ | ইলেকট্রনের ব্যাসার্ধ = 2.8 × 10-13 সেমি। | প্রোটনের ব্যাসার্ধ = 1.2 × 10-13 সেমি। |
| অবস্থান | পরমাণুর নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে ইলেকট্রনগুলি আবর্তন করে। | প্রোটনগুলি পরমাণুর নিউক্লিয়াসে অবস্থান করে। |
| স্থানান্তরজনিত ফল | পরমাণু থেকে এক বা একাধিক ইলেকট্রন অপসারিত হলে পরমাণুটি ক্যাটায়নে এবং ইলেকট্রন গৃহীত হলে অ্যানায়নে পরিণত হয়। | বিশেষ উপায়ে নিউক্লিয়াস থেকে প্রোটন অপসারিত হলে বা নতুন প্রোটন যুক্ত হলে মৌলটি পরিবর্তিত হয়ে নতুন মৌলে পরিণত হয়। |
| কণার ওপর পরমাণুর ভরের নির্ভরশীলতা | ইলেকট্রন সংখ্যার ওপর পরমাণুর ভর নির্ভর করে না। | প্রোটন সংখ্যার ওপর পরমাণুর ভর নির্ভরশীল। |
প্রোটন (Proton) ও নিউট্রনের (Neutron) সাদৃশ্য ও বৈসাদৃশ্যগুলি লেখো।
প্রোটন (Proton) ও নিউট্রনের (Neutron) সাদৃশ্য ও বৈসাদৃশ্যগুলি হল –
সাদৃশ্য –
- মূল উপাদান – প্রোটন ও নিউট্রন হল পরমাণুর মূল উপাদান।
- অবস্থান – দুটি কণাই পরমাণুর নিউক্লিয়াসে অবস্থিত।
- ব্যাসার্ধ – উভয়েরই ব্যাসার্ধ প্রায় 1.2 × 10-13 cm।
- ভর – প্রোটন ও নিউট্রনের ভর প্রায় সমান।
- ভরের নির্ভরশীলতা – পরমাণুর ভর প্রোটন ও নিউট্রনের সংখ্যার ওপর নির্ভর করে।
বৈসাদৃশ্য –
| বিষয় | প্রোটন (Proton) | নিউট্রন (Neutron) |
| আধানের প্রকৃতি | প্রোটন ধনাত্মক তড়িদ্গ্রস্ত কণা। | নিউট্রন নিস্তড়িৎ কণা। |
| রাসায়নিক ধর্মের ওপর প্রভাব | পরমাণুর নিউক্লিয়াসে অবস্থিত নিউট্রন সংখ্যার ওপর মৌলের রাসায়নিক ধর্ম নির্ভর করে না। | পরমাণুর নিউক্লিয়াসে অবস্থিত প্রোটন সংখ্যার ওপর মৌলের রাসায়নিক ধর্ম নির্ভর করে। |
| প্রাচুর্য | সব মৌলের পরমাণুতে প্রোটন থাকে। | সাধারণ হাইড্রোজেন পরমাণু নিউট্রনবিহীন। |
| সংখ্যাগত প্রভাব | প্রোটনের ভর 1.6725 × 10-27 kg | নিউট্রনের ভর 1.675 × 10-27 kg |
| তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্রের প্রভাব | একই মৌলের সকল পরমাণুর প্রোটন সংখ্যা অভিন্ন হয়। | একই মৌলের বিভিন্ন পরমাণুর নিউট্রন সংখ্যা বিভিন্ন হলে আইসোটোপ সৃষ্টি হয়। |
| তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্রের প্রভাব | প্রোটন তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয়। | নিউট্রন তড়িৎক্ষেত্র ও চৌম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয় না। |
রাদারফোর্ডের পরমাণু মডেল ও বোরের পরমাণু মডেলের মধ্যে তুলনা করো।
রাদারফোর্ডের পরমাণু মডেল ও বোরের পরমাণু মডেলের মধ্যে তুলনাগুলি হল –
সাদৃশ্য –
- পরমাণুর কেন্দ্রক – উভয় বিজ্ঞানীর মতেই, পরমাণুর কেন্দ্রে নিউক্লিয়াসের মধ্যে পরমাণুর মোট ধনাত্মক আধান ও প্রায় সমগ্র ভর কেন্দ্রীভূত থাকে।
- ইলেকট্রনের অবস্থান – উভয় তত্ত্বেই নিউক্লিয়াসকে কেন্দ্র করে ঋণাত্মক আধানবিশিষ্ট ইলেকট্রনগুলির বিভিন্ন বৃত্তাকার কক্ষপথে আবর্তনের কথা বলা হয়েছে।
- পরমাণুর অভ্যন্তরীণ স্থান – উভয় মডেল অনুযায়ীই পরমাণুর অভ্যন্তরস্থ বেশিরভাগ স্থানই ফাঁকা।
- কুলম্বীয় আকর্ষণ বলের মান – দুটি তত্ত্ব অনুসারেই, ধনাত্মক আধানযুক্ত নিউক্লিয়াস এবং নিউক্লিয়াস বহির্ভূত ঋণাত্মক আধানযুক্ত ইলেকট্রনের মধ্যে ক্রিয়াশীল কুলম্বীয় আকর্ষণ বলের মান পরিভ্রমণরত ইলেকট্রনের কেন্দ্রাতিগ বলের মানের সঙ্গে সমান।
বৈসাদৃশ্য –
| বিষয় | রাদারফোর্ডের পরমাণু মডেল | বোরের পরমাণু মডেল |
| পরমাণু মডেলের ভিত্তি | রাদারফোর্ডের তত্ত্ব সাধারণ বলবিজ্ঞানের ওপর ভিত্তি করে প্রতিষ্ঠিত হয়েছে। | বোরের তত্ত্ব প্ল্যাঙ্কের কোয়ান্টাম মতবাদের ওপর ভিত্তি করে প্রতিষ্ঠিত হয়েছে। |
| কক্ষপথের বৈশিষ্ট্য | এই তত্ত্বানুযায়ী ইলেকট্রনগুলি নিউক্লিয়াসকে কেন্দ্র করে যে-কোনো ব্যাসার্ধের কক্ষপথে আবর্তন করতে পারে। | এই তত্ত্বানুযায়ী ইলেকট্রনগুলি নিউক্লিয়াসের চারপাশে কতকগুলি নির্দিষ্ট ও সুস্থির কক্ষপথে আবর্তন করে। |
| স্থায়িত্ব | রাদারফোর্ডের পরমাণু মডেল পরমাণুর স্থায়িত্ব ব্যাখ্যা করতে পারে না। | বোরের পরমাণু মডেল পরমাণুর সুস্থিতি ব্যাখ্যা করতে পারে। |
| রেখা বর্ণালির উৎস | রাদারফোর্ডের তত্ত্ব পরমাণুর রেখা বর্ণালির (Line Spectra) উৎপত্তি ব্যাখ্যা করতে পারে না। | বোরের তত্ত্ব পরমাণুর রেখা বর্ণালির উৎপত্তি ব্যাখ্যা করতে পারে। |
মৌলের ভরসংখ্যা (Mass Number) ও পারমাণবিক সংখ্যার (Atomic Number) মধ্যে পার্থক্য লেখো।
মৌলের ভরসংখ্যা (Mass Number) ও পারমাণবিক সংখ্যার (Atomic Number) মধ্যে পার্থক্যগুলি হল –
| বিষয় | ভরসংখ্যা (Mass Number) | পারমাণবিক সংখ্যা (Atomic Number) |
| সংজ্ঞা | পরমাণুর কেন্দ্রে উপস্থিত প্রোটন ও নিউট্রন সংখ্যার যোগফল হল ভরসংখ্যা। | পরমাণুর কেন্দ্রে উপস্থিত প্রোটন সংখ্যাই হল পরমাণু-ক্রমাঙ্ক বা পারমাণবিক সংখ্যা। |
| স্বকীয় ধর্ম | ভরসংখ্যা মৌলের স্বকীয় বা মূলগত ধর্ম নয়। | পরমাণু-ক্রমাঙ্ক মৌলের স্বকীয় বা মূলগত ধর্ম। |
| ইলেকট্রন সংখ্যার সঙ্গে তুলনা | পরমাণুর ভরসংখ্যা ওর ইলেকট্রন সংখ্যার চেয়ে বেশি হয় (ব্যতিক্রম – সাধারণ হাইড্রোজেন বা প্রোটিয়াম)। | সমস্ত পরমাণুর ক্ষেত্রে পরমাণু-ক্রমাঙ্ক ও ইলেকট্রন সংখ্যা সমান হয়। |
| একই মৌলের ক্ষেত্রে | একই মৌলের বিভিন্ন পরমাণুর ভরসংখ্যা পৃথক হতে পারে। (যেমন – আইসোটোপ)। | একই মৌলের সব পরমাণুর পরমাণু-ক্রমাঙ্ক সবসময় একই থাকে। |
আইসোটোপ-আইসোবার-আইসোটোন -এর তুলনামূলক আলোচনা করো।
আইসোটোপ-আইসোবার-আইসোটোন -এর তুলনাগুলি হল –
| বিষয় | আইসোটোপ (Isotope) | আইসোবার (Isober) | আইসোটোন (Isotone) |
| পরমাণু-ক্রমাঙ্ক | পরমাণু-ক্রমাঙ্ক এক হয়। | পরমাণু-ক্রমাঙ্ক আলাদা হয়। | পরমাণু-ক্রমাঙ্ক আলাদা হয়। |
| ভরসংখ্যা | আলাদা হয়। | একই হয়। | আলাদা হয়। |
| নিউট্রন সংখ্যা | আলাদা হয়। | আলাদা হয়। | একই হয়। |
| রাসায়নিক ধর্ম | একই হয়। | আলাদা হয়। | আলাদা হয়। |
| উদাহরণ | 1H1, 1H2, 1H3 এরা পরস্পর আইসোটোপ। | 20Ca40, 18Ar40 এরা পরস্পর আইসোবার। | 16S32, 15P31 এরা পরস্পর আইসোটোন। |
পারমাণবিক ভর (Atomic mass) এবং পরমাণুর ভরের (Mass of Atom) মধ্যে পার্থক্য লেখো।
পারমাণবিক ভর (Atomic mass) এবং পরমাণুর ভরের (Mass of Atom) মধ্যে পার্থক্যগুলি হল –
| বিষয় | পারমাণবিক ভর (Atomic mass) | পরমাণুর ভর (Mass of Atom) |
| সংজ্ঞা | কোনো মৌলের একটি পরমাণু একটি হাইড্রোজেন পরমাণুর ভরের বা একটি অক্সিজেন পরমাণুর ভরের \(\frac1{16}\) অংশের বাএকটি কার্বন পরমাণুর ভরের \(\frac1{12}\) অংশের তুলনায় যতগুণ ভারী সেই সংখ্যাকে মৌলের পারমাণবিক ভর বলে। | কোনো মৌলের 1টি পরমাণুর ভর বলতে ওই পরমাণু মধ্যস্থ সমস্ত কণাগুলির ভরের সমষ্টিকে বোঝায়। |
| ওজন | এটি পরমাণুর প্রকৃত ওজনকে বোঝায় না। | এটি পরমাণুর সঠিক বা প্রকৃত ওজন বোঝায়। |
| রাসায়নিক গণনায় ব্যবহার | পারমাণবিক ওজনের একক নেই, এটি একটি সংখ্যা মাত্র, কারণ এটি দুটি ভরের অনুপাত। | পরমাণুর ভরের একক আছে। CGS পদ্ধতিতে ভরের একক গ্রাম ও SI পদ্ধতিতে কেজি। |
| রাসায়নিক গণনায় ব্যবহার | রাসায়নিক গণনার ক্ষেত্রে এই মান ব্যবহার করা সুবিধাজনক। | রাসায়নিক গণনার ক্ষেত্রে এর ব্যবহার সুবিধাজনক নয় কারণ এর মান অত্যন্ত ক্ষুদ্র। |
ইলেকট্রন ও বিটা কণার মধ্যে পার্থক্য লেখো।
ইলেকট্রন ও বিটা কণার মধ্যে পার্থক্যগুলি হল –
| বিষয় | ইলেকট্রন (Electron) | β–কণা (β-particle) |
| অবস্থান | ইলেকট্রন পরমাণুর নিউক্লিয়াস বহির্ভূত বিভিন্ন কক্ষপথে অবস্থান করে, পরমাণুর নিউক্লিয়াসে ইলেকট্রন থাকে না। | β-কণা তেজস্ক্রিয় পরমাণুর নিউক্লিয়াস থেকে নির্গত হয়। |
| মৌলান্তর | পরমাণু কর্তৃক ইলেকট্রন গ্রহণ বা বর্জনের ফলে আয়ন উৎপন্ন হয়, কোনো মৌলান্তর ঘটে না। | নিউক্লিয়াস থেকে β-কণা নির্গমনের ফলে মৌলান্তর ঘটে। |
| গৃহীত বা বর্জিত হওয়ার প্রবণতা | পরমাণু ইলেকট্রন গ্রহণ বা বর্জন উভয়ই করতে পারে। | তেজস্ক্রিয় পরমাণুর নিউক্লিয়াস থেকে শুধুমাত্র β-কণা বর্জিত হয়, গৃহীত হয় না। |
আলফা রশ্মি, বিটা রশ্মি ও গামা রশ্মির মধ্যে পার্থক্য লেখো।
আলফা রশ্মি, বিটা রশ্মি ও গামা রশ্মির মধ্যে পার্থক্যগুলি হল –
| ধর্ম | আলফা রশ্মি (α-ray) | বিটা রশ্মি (β-ray) | গামা রশ্মি (\(\gamma\)-ray) |
| প্রকৃতি | দুই একক ধনাত্মক আধানবিশিষ্ট হিলিয়াম আয়ন (He2+) বা দ্রুতগামী α-কণার স্রোত। | β-কণা \(\left({}_{-1}^0e\right)\) দ্রুতগামী ইলেকট্রন কণার স্রোত। | অতি ক্ষুদ্র (10-3 Å ক্রমের) তরঙ্গদৈর্ঘ্যবিশিষ্ট এবং উচ্চ শক্তিসম্পন্ন তড়িৎচুম্বকীয় তরঙ্গ। |
| ভর | একটি প্রোটনের ভরের প্রায় চার গুণ। অর্থাৎ, 6.644 × 10-27 kg বা 4.0015 u। | একটি ইলেকট্রনের ভরের সমান। অর্থাৎ, 9.11 × 10-31 kg বা 0.000548 u। | এই রশ্মিটি ভরহীন। |
| আধান | প্রোটনের আধানের দ্বিগুণ অর্থাৎ, প্রায় 3.204 × 10-19 কুলম্ব। | ইলেকট্রনের আধানের সমান অর্থাৎ, 1.602 × 10-19 কুলম্ব। | নিস্তড়িৎ হওয়ায় আধানহীন। |
| ভেদন ক্ষমতা | আকারে বড়ো, গতিবেগ কম, ফলে, ভেদনশক্তিও কম। 0.01 mm পুরু Al পাত ব্যবহার করে এই রশ্মি আটকানো যায়। | আকারে বড়ো, গতিবেগ কম, ফলে, ভেদনশক্তিও কম। 0.01 mm পুরু Al পাত ব্যবহার করে এই রশ্মি আটকানো যায়। ভর নগণ্য, অথচ গতিবেগ বেশি। তাই ভেদনশক্তি α-কণার তুলনায় প্রায় 100 গুণ বেশি। 1 cm পুরু Al পাত দিয়ে এই রশ্মি আটকানো যায়। | আধানহীন এবং বেগ শূন্যস্থানে আলোর বেগের সমান বলে ভেদন ক্ষমতাও খুব বেশি, যা α-কণার প্রায় 10,000 গুণ। এই রশ্মি 100 cm পুরু Al পাতও ভেদ করতে পারে। |
| আয়নন ক্ষমতা | গ্যাসকে আয়নিত করতে পারে। α-রশ্মির আয়নন ক্ষমতা β বা \(\gamma\)-রশ্মির তুলনায় বেশি। | গ্যাসকে আয়নিত করতে পারে, যদিও আয়নন ক্ষমতা \(\gamma\)-রশ্মির তুলনায় বেশি, কিন্তু α-রশ্মি অপেক্ষা কম। | গ্যাসকে আয়নিত করতে পারে; তবে আয়নন ক্ষমতা ন্যূনতম। |
| গতিবেগ | α-কণার বেগ আলোর বেগের প্রায় 10% হয়। | β-কণার বেগ আলোর বেগের 90%। অর্থাৎ, প্রায় 2.7 × 108 m/s হয়। | \(\gamma\)-রশ্মির বেগ শূন্যস্থানে আলোর বেগের সমান। অর্থাৎ, 3 × 108 m/s |
| প্রতিপ্রভা সৃষ্টির ক্ষমতা | জিংক সালফাইড ও বেরিয়াম প্ল্যাটিনোসায়ানাইড প্রলেপের ওপর α-রশ্মি তীব্র প্রতিপ্রভা সৃষ্টি করে। | জিংক সালফাইড ও বেরিয়াম প্ল্যাটিনোসায়ানাইড প্রলেপের ওপর β-রশ্মি মৃদু প্রতিপ্রভা সৃষ্টি করে। | \(\gamma\)-রশ্মি দ্বারা সৃষ্ট প্রতিপ্রভা α, -রশ্মি দ্বারা সৃষ্ট প্রতিপ্রভার তুলনায় মৃদু। |
| তড়িৎ ও চৌম্বক ক্ষেত্রের প্রভাব | দুই প্রকার ক্ষেত্র দ্বারাই বিক্ষিপ্ত হয়। বিক্ষেপের পরিমাণ ও প্রকৃতি থেকে α-কণার আধানের প্রকৃতি নির্ণয় করা হয়। | তড়িৎ বা চৌম্বক ক্ষেত্রে এর গতিপথ α-রশ্মির বিপরীতে অনেক বেশি বাঁকে, যা নির্দেশ করে এর আধান ঋণাত্মক। | কোনো ক্ষেত্র দ্বারাই বিক্ষিপ্ত হয় না, যা প্রমাণ করে এর প্রকৃতি নিস্তড়িৎ। |
এগুলি ছাড়াও এই তিন প্রকার রশ্মির ধর্মে নিম্নোক্ত সাদৃশ্যগুলি বর্তমান।
- এরা সকলেই ফোটোগ্রাফিক প্লেটকে নষ্ট করে ও
- প্রত্যেকেই জীবকোশকে ধ্বংস করে জীবদেহে ক্ষতের সৃষ্টি করে।
গাণিতিক প্রশ্নাবলি
প্রয়োজনীয় সূত্রাবলি
নিউক্লিয়াসের আধান = প্রোটন কণাগুলির আধান।
পরমাণুর মোট তড়িদাধান = প্রোটন + ইলেকট্রনের আধান।
মৌলের ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা।
30Zn65 -মৌলের পরমাণুতে উপস্থিত প্রোটন, ইলেকট্রন ও নিউট্রন সংখ্যা নির্ণয় করো। পরমাণুতে কণাগুলির অবস্থান নির্ণয় করো।
30Zn65 পরমাণুটিতে উপস্থিত প্রোটন সংখ্যা = 30টি, ইলেকট্রন সংখ্যা = 30টি, নিউট্রন সংখ্যা = (65 – 30) = 35টি।
প্রোটন ও নিউট্রন কণা পরমাণুর কেন্দ্রে অবস্থিত। ইলেকট্রনগুলি নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষপথে আবর্তন করে।
57X141 -এ কটি প্রোটন, কটি নিউট্রন এবং কটি ইলেকট্রন আছেনির্ণয় করো।
57X141 পরমাণুটিতে উপস্থিত প্রোটন সংখ্যা = 57টি, ইলেকট্রন সংখ্যা = 57টি, নিউট্রন সংখ্যা = (141 – 57) = 84টি।
প্রোটন ও নিউট্রন কণা পরমাণুর কেন্দ্রে অবস্থিত। ইলেকট্রনগুলি নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষপথে আবর্তন করে।
92X235 -পরমাটির ভরসংখ্যা এবং পারমাণবিক সংখ্যা কত? পরমাণুটিতে যদি 3টি নিউট্রন বেশি থাকত তাহলে তার সংকেত কীভাবে লেখা হত?
92X235 পরমাণুটির ভরসংখ্যা = 235। পারমাণবিক সংখ্যা = 92।
92X235 পরমাণুটিতে যদি 3টি নিউট্রন যোগ করা যায়, তবে ভরসংখ্যা হবে = (235 + 3) = 238। এখন ওই পরমাণুটির সংকেত হবে 92X238।
32X66 পরমাণুতে 2টি প্রোটন এবং 2টি নিউট্রন যোগ করে Y পরমাণু পাওয়া গেল। Y পরমাণুর পরমাণু-ক্রমাঙ্ক ও ভরসংখ্যা নির্ণয় করো।
32X66 পরমাণুর ভরসংখ্যা = 66 এবং পরমাণু-ক্রমাঙ্ক = 32।
32X66 পরমাণুটির সঙ্গে 2টি প্রোটন এবং 2টি নিউট্রন যোগ করলে উৎপন্ন নতুন Y পরমাণুটির ভরসংখ্যা হবে = (66 + 2 + 2) = 70 এবং পরমাণু-ক্রমাঙ্ক হবে = 32 + 2 = 34।
সুতরাং, Y পরমাণুটির ভরসংখ্যা হবে 70 এবং পরমাণু-ক্রমাঙ্ক হবে 34।
92X238 পরমাণুতে উপস্থিত প্রোটন ও নিউট্রন সংখ্যা কত? এই পরমাণুতে 2টি নিউট্রন ও 4টি প্রোটন যুক্ত হলে পরমাণুটির ভরসংখ্যার কী পরিবর্তন হবে?
92X238 পরমাণুটির পরমাণু-ক্রমাঙ্ক = 92 এবং ভরসংখ্যা = 238।
92X238 পরমাণুতে উপস্থিত প্রোটন সংখ্যা = 92 এবং নিউট্রন সংখ্যা = 238 – 92 = 146।
এই পরমাণুটিতে 2টি নিউট্রন ও 4টি প্রোটন যুক্ত হলে নতুন মৌলটির ভরসংখ্যা হবে= 238 + 2 + 4 = 244।
∴ 92X238 পরমাণুতে2টি নিউট্রন ও 4টি প্রোটন যুক্ত হলে ভরসংখ্যা 6 ও একক বৃদ্ধি পেয়ে 244 হবে।
19K40 পরমাণুতে ইলেকট্রন সংখ্যা নির্ণয় করো। এই পরমাণুটির ইলেকট্রন-বিন্যাস নির্ণয় করো।
19K40 পরমাণুর পারমাণবিক সংখ্যা = 19। কোনো মৌলের পরমাণুর পারমাণবিক সংখ্যা ওই পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যার সমান। আবার যেহেতু পরমাণু নিস্তড়িৎ তাই নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যা, নিউক্লিয়াসের বাইরের কক্ষে থাকা ইলেকট্রন সংখ্যার সঙ্গে সমান। সুতরাং, 19K40 পরমাণুতে উপস্থিত ইলেকট্রন সংখ্যা = 19।
পরমাণুটির ইলেকট্রন-বিন্যাস নিম্নরূপ –
| কক্ষপথ | K | L | M | N |
| ইলেকট্রন সংখ্যা | 2 | 8 | 8 | 1 |
ইউরেনিয়ামের বিভিন্ন আইসোটোপগুলির পরমাণুর গঠন সারণির মাধ্যমে দেখাও।
ইউরেনিয়ামের আইসোটোপগুলি হল যথাক্রমে – 92U235, 92U238, 92U239।
| আইসোটোপ | ভরসংখ্যা | পরমাণু-ক্রমাঙ্ক | প্রোটন সংখ্যা | ইলেকট্রনসংখ্যা | নিউট্রন সংখ্যা |
| 92U235 | 235 | 92 | 92 | 92 | 143 |
| 92U238 | 238 | 92 | 92 | 92 | 146 |
| 92U239 | 239 | 92 | 92 | 92 | 147 |
একটি মৌলের পরমাণুতে K কক্ষে 2টি, L কক্ষে 8টি, M কক্ষে 7টি ইলেকট্রন আছে। মৌলটির পরমাণু-ক্রমাঙ্ক কত? মৌলটির যোজ্যতা কত? মৌলটির ভরসংখ্যা 37 হলে নিউট্রন সংখ্যা কত?
মৌলে উপস্থিত মোট ইলেকট্রন সংখ্যা = (2 + 8 + 7) = 17টি। অর্থাৎ, মৌলের প্রোটন সংখ্যা = 17টি। অতএব, মৌলের পরমাণু-ক্রমাঙ্ক = 17।
মৌলটির সর্ববহিস্থ কক্ষে 7টি ইলেকট্রন বর্তমান, তাই নিকটবর্তী নিষ্ক্রিয় গ্যাসের ইলেকট্রন-বিন্যাস লাভ করতে হলে মৌলটিকে 1টি ইলেকট্রন গ্রহণ করতে হবে। তাই এর যোজ্যতা 1 হবে।
মৌলের নিউট্রন সংখ্যা = (ভরসংখ্যা প্রোটন সংখ্যা) = (37 – 17) = 20টি।
একটি পরমাণুর K কক্ষে 2টি, L কক্ষে 8টি, M কক্ষে 3টি ইলেকট্রন আছে। মৌলটির ইলেকট্রন সংখ্যা ও পারমাণবিক সংখ্যা কত? মৌলটির ভরসংখ্যা 27 হলে নিউট্রন সংখ্যা কত? পরমাণুটিতে যাদি 2টি নিউট্রন বেশি থাকত তবে সেটিকে কীভাবে লেখা হত?
পরমাণুটিতে মোট ইলেকট্রন সংখ্যা = (2 + 8 + 3) = 13।
পরমাণুটির পারমাণবিক সংখ্যা প্রোটন সংখ্যা = 13। মৌলটির ভরসংখ্যা = 27।
নিউট্রন সংখ্যা = 27 – 13 = 14।
2টি নিউট্রন বেশি হলে, ভরসংখ্যা হত = (27 + 2) = 29, তখন মৌলের সংকেত হত \({}_{13}^{19}X\)।
একটি নিস্তড়িৎ পরমাণুর K কক্ষে 2টি, L কক্ষে 8টি ও M কক্ষে 2টি ইলেকট্রন আছে। মৌলটির পরমাণু-ক্রমাঙ্ক কত? মৌলের পরমাণুটির M কক্ষের ইলেকট্রন দুটি সরিয়ে নিলে যে আয়ন তৈরি হবে তার সংকেত লেখো।
মৌলটির পরমাণুর মোট ইলেকট্রন সংখ্যা = (2 + 8 + 2) = 12। নিস্তড়িৎ অবস্থায় পরমাণুর প্রোটন সংখ্যা এবং ইলেকট্রন সংখ্যা সমান হয়। অতএব, প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 12।
∴ মৌলটির পরমাণু-ক্রমাঙ্ক = প্রোটন সংখ্যা 12। সুতরাং, মৌলটি হল ম্যাগনেশিয়াম (Mg)। নিস্তড়িৎ মৌলের পরমাণুটির M কক্ষের 2টি ইলেকট্রন সরিয়ে নিলে যে আয়নটি তৈরি হবে তার সংকেত হল Mg2+।
একটি পরমাণুর তিনটি কক্ষ আছে। সবচেয়ে বাইরের কক্ষে 2টি ইলেকট্রন থাকলে পরমাণুটির সংখ্যা কত?
পরমাণুর তিনটি কক্ষ আছে এবং শেষ কক্ষপথে 2টি ইলেকট্রন উপস্থিত। সুতরাং, পরমাণুটির নিউক্লিয়াসকে ঘিরে K কক্ষ (প্রথম কক্ষপথ), L কক্ষ (দ্বিতীয় কক্ষপথ) এবং M কক্ষ (তৃতীয় কক্ষপথ) উপস্থিত।
∴ K কক্ষে সর্বোচ্চ 2টি এবং কক্ষে সর্বোচ্চ 8টি ইলেকট্রন প্রবেশ করার পর বাকি 2টি ইলেকট্রন M কক্ষে প্রবেশ করে। সুতরাং, পরমাণুতে ইলেকট্রন সংখ্যা = (2 + 8 + 2)= 12। যেহেতু, পারমাণবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা। সুতরাং, পরমাণুটির পারমাণবিক সংখ্যা = 12।
একটি মৌলের দ্বি-ঋণাত্মক আয়নে M কক্ষে 8টি ইলেকট্রন বর্তমান। প্রশম পরমাণুর ইলেকট্রন-বিন্যাস দেখাও ও যোজক ইলেকট্রনের সংখ্যা লেখো। মৌলের ভরসংখ্যা 34 হলে, নিউট্রন সংখ্যা কত?
একটি মৌলের দ্বি-ঋণাত্মক আয়নে কক্ষে 8টি ইলেকট্রন বর্তমান।
∴ প্রশম পরমাণুর M কক্ষে (সর্ববহিস্থ কক্ষে) উপস্থিত ইলেকট্রন সংখ্যা 8 – 2 = 6।
মৌলটির প্রশম পরমাণুর ইলেকট্রন-বিন্যাস K(2) L(8) M (6) এবং যোজক ইলেকট্রনের সংখ্যা = সর্ববহিস্থ কক্ষে (M কক্ষ) উপস্থিত ইলেকট্রন সংখ্যা = 6।
মৌলটির ভরসংখ্যা = 34
∴ মৌলটির প্রশম পরমাণুতে মোট ইলেকট্রন সংখ্যা = 2 + 8 + 6 = 16।
মৌলটির ইলেকট্রন সংখ্যা = প্রোটন সংখ্যা = পারমাণবিক সংখ্যা = 16।
∴ মৌলের নিউট্রন সংখ্যা = ভরসংখ্যা – পারমাণবিক সংখ্যা
= 34 – 16
= 18
∴ মৌলের নিউট্রন সংখ্যা = 18।
সোডিয়াম পরমাণু (পারমাণবিক সংখ্যা 11) 1টি ইলেকট্রন বর্জন করে Na+ গঠন করে, সোডিয়াম পরমাণুর K, L না M কক্ষ থেকে ইলেকট্রনটি বর্জিত হয়?
সোডিয়াম (Na) পরমাণুর ইলেকট্রন-বিন্যাস = 2, 8, 1 অর্থাৎ, K কক্ষে 2টি, L কক্ষে 8টি এবং M কক্ষে 1টি ইলেকট্রন আছে। নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন-বিন্যাস লাভ করার জন্য পরমাণু তার সর্ববহিস্থ কক্ষের ইলেকট্রনটি বর্জন করে।
Na পরমাণু M কক্ষের 1টি ইলেকট্রন বর্জন করে Na+ গঠন করে এবং নিকটতম নিষ্ক্রিয় গ্যাস নিয়নের ইলেকট্রন-বিন্যাস অর্জনের মাধ্যমে সুস্থিত হয়।
ম্যাগনেশিয়ামের পারমাণবিক সংখ্যা = 12, Mg2+ আয়নে ইলেকট্রন সংখ্যা কত?
ম্যাগনেশিয়ামের পারমাণবিক সংখ্যা= 12। পরমাণু যেহেতু নিস্তড়িৎ, পারমাণবিক সংখ্যা = প্রোটন সংখ্যা ইলেকট্রন সংখ্যা = 12।
নিস্তড়িৎ ম্যাগনেশিয়াম পরমাণু 2টি ইলেকট্রন ত্যাগ করলে ম্যাগনেশিয়াম আয়নে (Mg2+) পরিণত হয়।
∴ Mg2+ আয়নে ইলেকট্রন সংখ্যা = (12 – 2) = 10।
M পরমাণুকে M2- আয়নে পরিণত করা হল। M পরমাণুটির পরমাণু-ক্রমাঙ্ক এবং ভরসংখ্যা যথাক্রমে 16 এবং 32 হলে M2- আয়নটির নিউট্রন এবং ইলেকট্রন সংখ্যা নির্ণয় করো।
M পরমাণুর পরমাণু-ক্রমাঙ্ক এবং ভরসংখ্যা যথাক্রমে 16 এবং 32।
∴ M পরমাণুতে উপস্থিত নিউট্রন সংখ্যা ভরসংখ্যা পরমাণু-ক্রমাঙ্ক = 32 – 16 = 16।
কোনো পরমাণু যখন আয়নে পরিণত হয় তখন তার নিউক্লিয়াস মধ্যস্থ নিউট্রন কণার সংখ্যার কোনো পরির্বতন হয় না।
∴ M2- আয়নের নিউট্রন সংখ্যা= M পরমাণুর নিউট্রন সংখ্যা= 16। আবার, M পরমাণু তার সর্ববহিস্থ কক্ষে 2টি ইলেকট্রন গ্রহণ করে M2- আয়নে পরিণত হয়েছে, M + 2e– → M2-
M পরমাণুর ইলেকট্রন সংখ্যা = পরমাণু-ক্রমাঙ্ক = 16
∴ M2- আয়নের ইলেকট্রন সংখ্যা = 16 + 2 = 18
∴ M2- আয়নটির নিউট্রন সংখ্যা 16 এবং ইলেকট্রন সংখ্যা 18।
একটি পরমাণু X কে X– আয়নে পরিণত করা হল। X -এর পরমাণু-ক্রমাঙ্ক ও ভরসংখ্যা যথাক্রমে 17 ও 35 হলে, X– আয়নের নিউট্রন ও ইলেকট্রনের সংখ্যা লেখো। এর কোন্ কক্ষে কটি ইলেকট্রন আছে?
মৌলটি হল 17X35।
X -এর পরমাণু-ক্রমাঙ্ক = 17, X -এর ভরসংখ্যা = 35।
X- আয়নের ইলেকট্রন সংখ্যা = 17 + 1 = 18 [∵ x + e– → x–]
X– আয়নের নিউট্রন সংখ্যা = (35 – 17) = 18।
X– -এর K কক্ষে 2টি, L কক্ষে 8টি, M কক্ষে 8টি ইলেকট্রন আছে।
X2- আয়নে 10টি ইলেকট্রন ও 8টি নিউট্রন আছে। মৌলটির পরমাণু-ক্রমাঙ্ক ও ভরসংখ্যা কত? মৌলটির নাম লেখো।
X2- আয়নে 10টি ইলেকট্রন ও 8টি নিউট্রন আছে।
X2- আয়ন 2টি ইলেকট্রন বর্জন করলে তা নিস্তড়িৎ X পরমাণুতে পরিণত হবে। অতএব, X2- – 2e– → X
∴ X পরমাণুতে উপস্থিত ইলেকট্রন সংখ্যা = 10 – 2 = 8
যেহেতু নিস্তড়িৎ পরমাণুতে উপস্থিত ইলেকট্রন সংখ্যা = প্রোটন সংখ্যা = পরমাণু-ক্রমাঙ্ক।
∴ X মৌলটির পরমাণু-ক্রমাঙ্ক = 8
X মৌলটির পরমাণুতে 8টি নিউট্রন বর্তমান।
∴ ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা
= 8 + 8
= 16
∴ X মৌলটির পরমাণু-ক্রমাঙ্ক 8 ও ভরসংখ্যা 16।
∴ মৌলটি হল অক্সিজেন (8O16)।
অ্যালুমিনিয়ামের পরমাণু-ক্রমাঙ্ক ও ভরসংখ্যা যথাক্রমে 13 এবং 27 হলে Al3+ আয়নে ইলেকট্রন, প্রোটন ও নিউট্রনের সংখ্যা নির্ণয় করো।
Al – 3e– → Al3+
Al -এর পরমাণু-ক্রমাঙ্ক = Al -এর প্রোটন সংখ্যা = Al -এর ইলেকট্রন সংখ্যা= 13।
Al -এর ভরসংখ্যা = Al -এর প্রোটন সংখ্যা + Al -এর নিউট্রন সংখ্য = 27।
Al3+ আয়নে প্রোটন সংখ্যা = 13।
Al3+ আয়নে ইলেকট্রন সংখ্যা = (13 – 3) = 10 এবং
Al3+ আয়নে নিউট্রন সংখ্যা = (27 – 13) = 14।
10 cm3 আয়তনবিশিষ্ট একটি গোলক প্রোটন কণা দ্বারা পূর্ণ করতে হলে কতগুলি প্রোটনের প্রয়োজন হবে?
একটি প্রোটনের ব্যাসার্ধ \(\left(r\right)=1.2\times10^{-13}\;cm\)
একটি প্রোটনের আয়তন = \(\frac43\mathrm{πr}^3\)
= \(\frac43\times3.14\times\left(1.2\times10^{-13}\right)^3\;cm^3\)
= \(7.235\times10^{-39}\;cm^3\)
∴ আয়তনবিশিষ্ট গোলক প্রোটন দ্বারা পূর্ণ করতে প্রোটন প্রয়োজন।
= \(\frac{10}{7.235\times10^{-39}}\;cm^3\)
= \(1.382\times10^{30}\;cm^3\) টি।
একটি প্রোটন এবং একটি ইলেকট্রনের ভরের অনুপাত নির্ণয় করো।
একটি প্রোটনের ভর= 1.672 × 10-24 গ্রাম। একটি ইলেকট্রনের ভর = 9.108 × 10-28 গ্রাম।
∴
= \(\frac{1.672\times10^{-24}}{9.108\times10^{-28}}=1836\)
একটি প্রোটন কণার ভর একটি ইলেকট্রন কণার ভরের 1836 গুণ।
1H3 পরমাণুর ভর কত? (প্রদত্ত – প্রোটনের ভর = 1.00753 u, নিউট্রনের ভর = 1.00904 u)। ধরে নাও, ইলেকট্রনের ভর নগণ্য।
1H3 পরমাণুর ভরসংখ্যা = 3 এবং পারমাণবিক সংখ্যা = 1।
∴ 1H3 -এর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যা = পারমাণবিক সংখ্যা = 1
এবং নিউট্রন সংখ্যা = ভরসংখ্যা – পারমাণবিক সংখ্যা
= 3 – 1
= 2
∴ ইলেকট্রনের ভর নগণ্য ধরলে, 1H3 পরমাণুর ভর
= 1টি প্রোটনের ভর + 2 টি নিউট্রনের ভর
= (1 × 1.00753) u + (2 × 1.00904) u
= 3.02561 u
হাইড্রোজেনের পারমাণবিক ভর 1.008। হাইড্রোজেনের দুটি আইসোটোপ 1H1 ও 1D2 বর্তমান। 1D2 আইসোটোপটির শতকরা পরিমাণ নির্ণয় করো।
ধরি, 1D2 আইসোটোপটি আছে x%।
∴ 1H1 আছে= (100 – x)%।
∴ হাইড্রোজেনের পারমাণবিক ওজন = \(\frac{x\times2+\left(100-x\right)\times1}{100}\)
শর্তানুসারে, \(\frac{2x+\left(100-x\right)}{100}=1.008\)
বা, 2x + 100 – x = 100.8
বা, x = 100.8 – 100
বা, x = 0.8
∴ 1D2 আইসোটোপটির শতকরা পরিমাণ 0.8।
লিথিয়ামের গড় পারমাণবিক গুরুত্ব 6.95। এর দুটি আইসোটোপ 3Li6 এবং 3Li7। এদের শতকরা উপস্থিতি নির্ণয় করো।
ধরি, 3Li6 আইসোটোপটি x% আছে। ফলে, 3Li7 আইসোটোপটি আছে (100 – x)%।
লিখিয়ামের পারমাণবিক গুরুত্ব হবে আইসোটোপ দুটির গড় পারমাণবিক গুরুত্ব।
অর্থাৎ, লিথিয়ামের পারমাণবিক গুরুত্ব = \(\frac{6x+7\left(100-x\right)}{100}\)
প্রশ্নানুযায়ী, \(\frac{6x+7\left(100-x\right)}{100}=6.95\)
বা, 6x + 700 – 7x = 695
বা, – x = 695 – 700
বা, – x = – 5
∴ x = 5
এবং 100 – x
বা, x = 100 – 5 = 95
বা, x = 95
সুতরাং, 3Li6 আইসোটোপ আছে 5% এবং আইসোটোপটি 3Li7 আছে 95%।
পারমাণবিক ওজন নির্ণয় করো।
যদি কোনো মৌলের পারমাণবিক ওজন M হয় x, y, z মৌলটির বিভিন্ন আইসোটোপের পারমাণবিক ওজন বা পারমাণবিক ভর হয় এবং a, b, c, …. মৌলটির যথাক্রমে x, y, z, … পারমাণবিক ওজন বিশিষ্ট আইসোটোপগুলির শতকরা প্রাচুর্য হয় তবে –
\(M=\frac{ax+by+cz+…}{100}\\\)একটি মৌলের চারটি আইসোটোপের ভরসংখ্যা যথাক্রমে 28, 30, 31 ও 33। এরা প্রকৃতিতে যথাক্রমে 6%, 20%, 70% ও 4% থাকে। মৌলটির পারমাণবিক গুরুত্ব কত?
প্রকৃতিতে মৌলটি চারটি আইসোটোপের মিশ্রণ হিসেবে থাকে। মৌলটির পারমাণবিক গুরুত্ব হল ওই আইসোটোপগুলির গড় পারমাণবিক গুরুত্ব।
∴ মৌলটির পারমাণবিক গুরুত্ব
= \(\frac{28\times6+30\times20+31\times70+33\times4}{100}\)
= \(\frac{168+600+2170+132}{100}\)
= \(\frac{3070}{100}=30.7\)
∴ মৌলটির পারমাণবিক গুরুত্ব 30.7।
প্রকৃতিতে ক্লোরিনের দুটি আইসোটোপ 17Cl35 এবং 17Cl37 3 : 1 অনুপাতে মিশে থাকে। ক্লোরিনের পারমাণবিক ওজন গণনা করো।
ক্লোরিনের পারমাণবিক ওজন = \(\frac{3\times35+1\times37}{3+1}\)
= \(\frac{142}4=35.5\)
∴ ক্লোরিনের পারমাণবিক ওজন 35.5।
নৈর্ব্যক্তিক প্রশ্নোত্তর
সঠিক উত্তরটি নির্বাচন করো
স্যাডউইক যে কণার আবিষ্কর্তা সেটি হল –
- নিউট্রন
- ইলেকট্রন
- প্রোটন
- α-কণা
উত্তর – 1. নিউট্রন
α-কণা বিচ্ছুরণ পরীক্ষার সাহায্যে আবিষ্কৃত হয় –
- ইলেকট্রন
- প্রোটন
- নিউট্রন
- নিউক্লিয়াস
উত্তর – 2. প্রোটন
রাদারফোর্ডের আলফা কণা বিক্ষেপণ পরীক্ষায় গৃহীত সোনার পাতের বেধ ছিল –
- 0.0004 mm
- 0.004 mm
- 0.04 mm
- 0.4 mm
উত্তর – 1. 0.0004 mm
আলফা কণা বিক্ষেপণ পরীক্ষা করেন –
- বোর
- রাদারফোর্ড
- থমসন
- স্যাডউইক
উত্তর – 2. রাদারফোর্ড
নিউট্রনবিহীন মৌলটি হল –
- সাধারণ হাইড্রোজেন
- ডয়টেরিয়াম
- ট্রিটিয়াম
- অক্সিজেন
উত্তর – 1. সাধারণ হাইড্রোজেন
কোনো পরমাণুর ভরসংখ্যা = A, পরমাণুটির প্রকৃত ভর = Mamu নীচের সঠিক সম্পর্কটি চিহ্নিত করো
- A = M
- A > M
- A < M
- A ≤ M
উত্তর – 4. A ≤ M
\({}_{15}^{32}P\) ও \({}_{16}^{32}S\) সম্পর্কে কোন্ বিবৃতিটি সঠিক নয়? –
- নিউক্লিয়নগুলোর সমষ্টি সমান নয়
- নিউট্রন সংখ্যা P32 > S32
- যোজ্যতা ইলেকট্রনের সংখ্যা 5 ও 6
- উভয়েই পরিবর্তনশীল যোজ্যতা দেখায়।
উত্তর – 1. নিউক্লিয়নগুলির সমষ্টি সমান নয়
কোনটি তেজস্ক্রিয় আইসোটোপ?
- \({}_1^2H\\\)
- \({}_8^{16}O\\\)
- \({}_6^{14}C\\\)
- \({}_{17}^{35}Cl\\\)
উত্তর – 3. \({}_6^{14}C\)
\({}_{88}^{226}Ru\) নিউক্লিয়াসে রয়েছে –
- 138টি প্রোটন
- 88টি প্রোটন
- 88টি নিউট্রন
- 226টি নিউট্রন।
উত্তর – 2. 88টি প্রোটন
একটি পরমাণু M- এর ভরসংখ্যা 30 ও নিউট্রন সংখ্যা 14 হলে M3+ -এর ইলেকট্রন সংখ্যা হল –
- 10
- 11
- 12
- 13
উত্তর – 4. 13
O2- আয়নের যোজ্যতা কক্ষে ইলেকট্রন সংখ্যা –
- 2
- 4
- 6
- 8
উত্তর – 4. 8
কোন্ মৌলের পরমাণুর N কক্ষে 1টি ইলেকট্রন আছে? –
- সোডিয়াম
- পটাশিয়াম
- আর্গন
- লিথিয়াম
উত্তর – 2. পটাশিয়াম
19K+ -এর সঙ্গে সমইলেকট্রনীয় হল –
- 17CI
- 18Ar
- 20Ca+
- কোনোটিই নয়
উত্তর – 2. 18Ar
একটি প্রোটন ও নিউট্রনের ভরের অনুপাত হল –
- 1 : 1
- 1837 : 1839
- 1839 : 1837
- 1839 : 1
উত্তর – 1. 1 : 1
α ও β কণার আধানের অনুপাত –
- 1 : 2
- 4 : 1
- 1 : 1
- 2 : 1
উত্তর – 4. 2 : 1
একটি প্রোটনের ব্যাসার্ধ 10-15 m। একে এভাবেও প্রকাশ করা যায় –
- 1 পিকোমিটার
- 1 ন্যানোমিটার
- 1 মাইক্রোমিটার
- 1 ফেমটোমিটার
উত্তর – 4. 1 ফেমটোমিটার
নিষ্ক্রিয় গ্যাসের বহিস্থ কক্ষে সংখ্যা –
- 8
- 18
- 12
- 32
উত্তর – 1. 8
Fe3+ আয়ন একটি ইলেকট্রন গ্রহণ করলে সেটি পরিণত হয় –
- Fe4+ আয়নে
- Fe2- আয়নে
- Fe2+ আয়নে
- Fe+ আয়নে
উত্তর – 3. Fe2+ আয়নে
α -কণা সম্পর্কে প্রদত্ত কোন্ তথ্যটি সঠিক নয়? –
- এটি ধনাত্মক আধানযুক্ত
- এটি হিলিয়াম পরমাণু
- এটি হিলিয়াম পরমাণুর কেন্দ্রক
- এটি দ্বি-আয়নিক হিলিয়াম পরমাণু
উত্তর – 2. এটি হিলিয়াম পরমাণু
কোনটি র ব্যাসার্ধ বেশি?
- e–
- p
- n
- পজিট্রন
উত্তর – 1. e–
16টি প্রোটন, 18টি ইলেকট্রন ও 16টি নিউট্রন সংবলিত নমুনাটি চার্জসহ শনাক্ত করো –
- S2-
- Si2-
- P3-
- S-1
উত্তর – 1. S2-
নিউক্লিয়াসের ব্যাস হল –
- 10-15 m
- 10-16 m
- 10-17 m
- 10-18 m
উত্তর – 1. 10-15 m
6X12 -এর আইসোটোপ হল –
- 7X12
- 5X12
- 6X13
- 8X14
উত্তর – 3. 6X13
82Pb211 এবং 83Bi211 হল একজোড়া –
- আইসোটোপ
- আইসোবার
- আইসোটোন
- আইসোস্টার
উত্তর – 2. আইসোবার
\({}_{33}^{77}As\) ও \({}_{34}^{78}Se\) এর মধ্যে সম্পর্কটি হল –
- আইসোটোপ
- আইসোবার
- আইসোমার
- আইসোটোন
উত্তর – 4.আইসোটোন
A, B ও C পরমাণু তিনটির ভরসংখ্যা যথাক্রমে 31, 32 ও 34। এদের নিউক্লিয়াসে নিউট্রনের সংখ্যা যথাক্রমে 16, 17 এবং 18। এদের মধ্যে আইসোটোপ হল –
- A এবং B
- B এবং C
- C এবং A
- কোনোটিই নয়
উত্তর – 1. A এবং B
পরমাণুর মৌলিকত্ব প্রকাশ করে পরমাণুর –
- ভরসংখ্যা
- পরমাণু-ক্রমাঙ্ক
- পারমাণবিক গুরুত্ব
- নিউট্রন সংখ্যা
উত্তর – 2. পরমাণু-ক্রমাঙ্ক
বোরের পরমাণু মডেল সম্পর্কিত কোন্ তথ্যটি সঠিক? –
- প্ল্যাঙ্কের কোয়ান্টাম তত্ত্বের ভিত্তি
- H -এর রেখা বর্ণালি ব্যাখ্যা করতে পারে
- নির্দিষ্ট শক্তিবিশিষ্ট কক্ষপথের ধারণা দেয়
- সবকটিই ঠিক
উত্তর – 4. সবকটিই ঠিক
পরমাণুর নিউক্লিয়াস স্থায়ী হয় –
- নিউক্লিয় বলের প্রভাবে
- কেন্দ্রাতিগ বলের প্রভাবে
- তড়িৎচৌম্বকীয় আকর্ষণ বলের প্রভাবে
- প্রোটন ও ইলেকট্রনের আকর্ষণ বলের প্রভাবে
উত্তর – 1. নিউক্লিয় বলের প্রভাবে
একটি ইলেকট্রন প্রথম কক্ষ থেকে তৃতীয় কক্ষে লাফ দিলে সেটি –
- শক্তি শোষণ করবে
- শক্তি বর্জন করবে
- কোনো শক্তি লাভ করবে না
- উপরের কোনোটিই করবে না
উত্তর – 1. শক্তি শোষণ করবে
সাধারণ হাইড্রোজেন পরমাণুর নিউক্লিয়াসকে বলা হয় –
- নিউট্রন
- পজিট্রন
- প্রোটন
- প্রোটিয়াম
উত্তর – 3. প্রোটন
K -কক্ষপথে থাকা একটি ইলেকট্রনের শক্তি –
- L কক্ষপথে থাকা ইলেকট্রনের শক্তি অপেক্ষা বেশি হয়
- L কক্ষপথে থাকা ইলেকট্রনের শক্তি অপেক্ষা কম হয়
- শূন্য হয়, যতক্ষণ সে ওই কক্ষপথে থাকে
- পরমাণুর যে-কোনো ইলেকট্রনের শক্তি অপেক্ষা বেশি হয়
উত্তর – 2. L কক্ষপথে থাকা ইলেকট্রনের শক্তি অপেক্ষা কম হয়
ইলেকট্রন শক্তি শোষণ করে –
- বাইরের দিকের কক্ষপথে চলে যায়
- ভিতরের দিকের কক্ষপথে চলে আসে
- অন্য কোনো কক্ষপথে স্থানান্তরিত হয় না
- আরো দ্রুত আবর্তিত হয়
উত্তর – 2. ভিতরের দিকের কক্ষপথে চলে আসে
কোন্ জোড়টি আইসোস্টার? –
- CO2, SO2
- N2O, NO2
- NH3, PH3
- N2O, CO2
উত্তর – 2. N2O, NO2
পরমাণুর মূল কণাগুলির ভর হ্রাসের সঠিক ক্রম হল –
- p > e > n
- e > p > n
- p > n > e
- n > p > e
উত্তর – 4. n > p > e
পরমাণু নামকরণ করেন –
- জন ডালটন
- জে জে থমসন
- কণাদ
- স্যাডউইক
উত্তর – 3. কণাদ
একটি নিউট্রনের ভর হল –
- 1.6 × 10-19 g
- 1.6 × 10-24 g
- 9.11 × 10-28 g
- 2.3 × 10-7 g
উত্তর – 2. 1.6 × 10-24 g
ইলেকট্রনের আধান হল –
- 1.6 × 10-19 কুলম্ব
- 4.8 × 10-12 কুলম্ব
- শূন্য
- 5.2 × 10-19 কুলম্ব।
উত্তর – 1. 1.6 × 10-19 কুলম্ব
নিউক্লিয়াসের স্থায়িত্ব রক্ষাকারী বল হল –
- মহাকর্ষ বল
- নিউক্লিয় বল
- তড়িৎ আকর্ষণ বল
- বিকর্ষণ বল
উত্তর – 2. নিউক্লিয় বল
বিজ্ঞানী থমসন আবিষ্কৃত কণাটি হল –
- ইলেকট্রন
- প্রোটন
- নিউট্রন
- মেসন
উত্তর – 1. ইলেকট্রন
বোরের পরমাণু মডেল প্রযোজ্য হয় যে কণার জন্য –
- He+
- Li+
- Be
- Ca
উত্তর – 1. He+
বোরের পরমাণু মডেল অনুযায়ী স্বায়ী কক্ষপথের সংখ্যা –
- 9টি
- 5টি
- 7টি
- 11টি
উত্তর – 3. 7টি
আইসোটোপবিহীন মৌলটি হল –
- ক্লোরিন
- সোডিয়াম
- অক্সিজেন
- কার্বন
উত্তর – 2. সোডিয়াম
8O18 -এ নিউট্রন সংখ্যা –
- 10টি
- 8টি
- 9টি
- 50টি
উত্তর – 1. 10টি
F পরমাণুর ইলেকট্রন-বিন্যাস হল –
- 2, 8, 5
- 2, 7
- 2, 8, 1
- 2, 8, 4
উত্তর – 2. 2, 7
একটি নিউট্রন একটি ইলেকট্রনের তুলনায় –
- 1837 গুণ ভারী
- 1800 গুণ ভারী
- 1839 গুণ ভারী
- 1820 গুণ ভারী
উত্তর – 3. 1839 গুণ ভারী
আইসোবারদের ক্ষেত্রে প্রদত্ত যে কথাটি ঠিক তা হল এদের –
- ভর সমান
- প্রোটন সংখ্যা সমান
- নিউট্রন সংখ্যা সমান
- ভরসংখ্যা সমান
উত্তর – 4. ভরসংখ্যা সমান
ইলেকট্রনের \(\left(\frac em\right)\) অনুপাত হল –
- 1.602 × 10-19 কুলম্ব/কেজি
- 1.76 × 1011 কুলম্ব/কেজি
- 1.76 × 109 কুলম্ব/কেজি
- 5.02 × 10-7 কুলম্ব/কেজি।
উত্তর – 2. 1.76 × 1011 কুলম্ব/কেজি
আইসোটোপ আবিষ্কার করেন –
- সডি
- কুরি
- থমসন
- বোর
উত্তর – 1. সডি
প্রদত্ত যে জোড়টি সমইলেকট্রনীয় সেটি হল –
- Cl–, K+
- Na+, O–
- Mg2+, Ne
- He+, I
উত্তর – 1. Cl–, K+
হাইড্রোজেন পরমাণুর নিউক্লিয়াসকে বলা হয় –
- নিউট্রন
- ইলেকট্রন
- প্রোটন
- মেসন
উত্তর – 3. প্রোটন
ভরসংখ্যা এক, কিন্তু পরমাণু-ক্রমাঙ্ক আলাদা হয় –
- আইসোটোন -এর
- আইসোবার -এর
- আইসোটোপ -এর
- আইসোমার -এর
উত্তর – 2. আইসোবার -এর
প্রদত্ত আইসোটোপ জোড়টি হল –
- 17Cl35, 17Cl37
- 7N14, 6C14
- 8O16, 6C12
- 1H3, 2He4
উত্তর – 1. 17Cl35, 17Cl37
প্রদত্ত কোনটি স্বতঃস্ফূর্তভাবে ইউরেনিয়ামের মতো ভারী মৌলের কেন্দ্রক থেকে নির্গত হয় এবং ধনাত্মক আধানগ্রস্ত –
- প্রোটন
- আলফা কণা
- বিটা কণা
- গামা রশ্মি
উত্তর – 2. আলফা কণা
ইলেকট্রন শক্তি বর্জন করলে –
- একই স্থানে থাকে
- উচ্চ শক্তিস্তরে যায়
- নিম্ন শক্তিস্তরে যায়
- কক্ষপথ থেকে বেরিয়ে যায়
উত্তর – 3. নিম্ন শক্তিস্তরে যায়
নিউক্লিয় বলের জন্য দায়ী –
- α-কণা
- মেসন
- β-কণা
- γ-রশ্মি।
উত্তর – 2. মেসন
একটি α-কণার ভর কয়টি প্রোটনের ভরের সমান? –
- একটি
- দুটি
- তিনটি
- চারটি
উত্তর – 4. চারটি
একটি হাইড্রোজেন পরমাণু থেকে ইলেকট্রন বেরিয়ে গেলে তাতে যে কণা থাকে তা হল –
- প্রোটন
- নিউট্রন
- α-কণা
- কোনোটিই নয়
উত্তর – 1. প্রোটন
\({}_{15}^{31}P\) মৌলটির ইলেকট্রন-বিন্যাস হবে –
- 2, 10, 3
- 2, 10, 18
- 2, 8, 18
- 2, 8, 5
উত্তর – 4. 2, 8, 5
পরমাণুর L কক্ষে সর্বাধিক ইলেকট্রন থাকতে পারে –
- 2টি
- 8টি
- 18টি
- 25টি
উত্তর – 2. 8টি
মৌলের স্বকীয় ধর্ম হল –
- ভরসংখ্যা
- পরমাণু-ক্রমাঙ্ক
- কক্ষপথের সংখ্যা
- কোনোটিই নয়
উত্তর – 2. পরমাণু-ক্রমাঙ্ক
শূন্যস্থান পূরণ করো
ক্যাথোড রশ্মি প্রকৃতপক্ষে ___ কণার স্রোত।
উত্তর – ক্যাথোড রশ্মি প্রকৃতপক্ষে ইলেকট্রন কণার স্রোত।
রাদারফোর্ড বুঝতে পারেন পরমাণু ___ নয়।
উত্তর – রাদারফোর্ড বুঝতে পারেন পরমাণু নিরেট নয়।
অক্সিজেন পরমাণুর সর্ববহিস্থ কক্ষে ইলেকট্রন সংখ্যা ___।
উত্তর – অক্সিজেন পরমাণুর সর্ববহিস্থ কক্ষে ইলেকট্রন সংখ্যা 6টি।
স্থায়ী কক্ষপথে ইলেকট্রনের ___ স্থির থাকে।
উত্তর – স্থায়ী কক্ষপথে ইলেকট্রনের শক্তি স্থির থাকে।
ক্যালশিয়ামের (Ca) ইলেকট্রন-বিন্যাস হল ___।
উত্তর – ক্যালশিয়ামের (Ca) ইলেকট্রন-বিন্যাস হল K(2), L(8), M(8), N(2)।
ক্যাথোড রশ্মি উৎপাদনে ___ পারদস্তম্ভের চাপ লাগে।
উত্তর – ক্যাথোড রশ্মি উৎপাদনে 0.01 mm পারদস্তম্ভের চাপ লাগে।
\({}_{15}^{31}P\) -এ উপস্থিত নিউট্রন সংখ্যা হল ___।
উত্তর – -এ উপস্থিত নিউট্রন সংখ্যা হল 16।
কোনো মৌলের পরমাণুর কেন্দ্রকে অবস্থিত ___ তড়িদ্গ্রস্ত কণার নাম প্রোটন।
উত্তর – কোনো মৌলের পরমাণুর কেন্দ্রকে অবস্থিত ধনাত্মক তড়িদ্গ্রস্ত কণার নাম প্রোটন।
আর্গনের পরমাণুর শেষ কক্ষে ইলেকট্রনের সংখ্যা ___।
উত্তর – আর্গনের পরমাণুর শেষ কক্ষে ইলেকট্রনের সংখ্যা 8টি।
হাইড্রোজেন পরমাণুর ভর একটি প্রোটনের ভরের প্রায় ___।
উত্তর – হাইড্রোজেন পরমাণুর ভর একটি প্রোটনের ভরের প্রায় সমান।
পরমাণুর সবচেয়ে বাইরের কক্ষের ইলেকট্রনগুলিকে ___ ইলেকট্রন বলে।
উত্তর – পরমাণুর সবচেয়ে বাইরের কক্ষের ইলেকট্রনগুলিকে যোজ্যতা ইলেকট্রন বলে।
\({}_{11}^{23}Na\) পরমাণুতে নিউট্রন সংখ্যা হল ___।
উত্তর – পরমাণুতে নিউট্রন সংখ্যা হল 12।
Al -এর ইলেকট্রন-বিন্যাস ___।
উত্তর – Al -এর ইলেকট্রন-বিন্যাস K(2), L(8), M(3)।
কোনো মৌলের ভরসংখ্যা সাধারণত পারমাণবিক সংখ্যার অপেক্ষা ___ হয়।
উত্তর – কোনো মৌলের ভরসংখ্যা সাধারণত পারমাণবিক সংখ্যার অপেক্ষা বেশি হয়।
একটি পরমাণুর 3টি প্রোটন, 3টি ইলেকট্রন ও 4টি নিউট্রন থাকলে ভরসংখ্যা হবে ___।
উত্তর – একটি পরমাণুর 3টি প্রোটন, 3টি ইলেকট্রন ও 4টি নিউট্রন থাকলে ভরসংখ্যা হবে 7।
কোনো পরমাণুর K এবং L কক্ষ ইলেকট্রন দ্বারা সম্পূর্ণ ভরতি হলে মোট ইলেকট্রন সংখ্যা ___ টি হবে।
উত্তর – কোনো পরমাণুর K এবং L কক্ষ ইলেকট্রন দ্বারা সম্পূর্ণ ভরতি হলে মোট ইলেকট্রন সংখ্যা 10টি হবে।
পরমাণুর সর্ববহিস্থ কক্ষে সর্বাধিক ___ ইলেকট্রন থাকতে পারে।
উত্তর – পরমাণুর সর্ববহিস্থ কক্ষে সর্বাধিক 8টি ইলেকট্রন থাকতে পারে।
ক্যাথোড রশ্মি ___ আধানযুক্ত কণা দ্বারা গঠিত।
উত্তর – ক্যাথোড রশ্মি ঋণাত্মক আধানযুক্ত কণা দ্বারা গঠিত।
পরমাণুর মধ্যে বেশিরভাগ স্থানই ___।
উত্তর – পরমাণুর মধ্যে বেশিরভাগ স্থানই ফাঁকা।
পরমাণুর যে অংশে সমস্ত ভর ও আধান কেন্দ্রীভূত থাকে, তাকে ___ বলে।
উত্তর – পরমাণুর যে অংশে সমস্ত ভর ও আধান কেন্দ্রীভূত থাকে, তাকে নিউক্লিয়াস বলে।
পরমাণুর মধ্যে ___ হল ঋণাত্মক আধানবাহী কণা।
উত্তর – পরমাণুর মধ্যে ইলেকট্রন হল ঋণাত্মক আধানবাহী কণা।
নিউক্লিয়াসের ব্যাসের তুলনায় পরমাণুর ব্যাস ___ গুণ বেশি।
উত্তর – নিউক্লিয়াসের ব্যাসের তুলনায় পরমাণুর ব্যাস 1 লক্ষ গুণ বেশি।
একমাত্র ___ ছাড়া প্রত্যেক মৌলের পরমাণুর মধ্যে নিউট্রন কণা আছে।
উত্তর – একমাত্র সাধারণ হাইড্রোজেন ছাড়া প্রত্যেক মৌলের পরমাণুর মধ্যে নিউট্রন কণা আছে।
-1e0 দ্বারা ___ -কে প্রকাশ করা হয়।
উত্তর – -1e0 দ্বারা ইলেকট্রন -কে প্রকাশ করা হয়।
পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন এবং নিউট্রন কণাগুলিকে একত্রে ___ বলে।
উত্তর – পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন এবং নিউট্রন কণাগুলিকে একত্রে নিউক্লিয়ন বলে।
আইসোটোনে যে কণাটি সমান সংখ্যায় থাকে সেটি হল ___।
উত্তর – আইসোটোনে যে কণাটি সমান সংখ্যায় থাকে সেটি হল নিউট্রন।
পরমাণুর সবচেয়ে সুস্থিত অংশ হল ___।
উত্তর – পরমাণুর সবচেয়ে সুস্থিত অংশ হল নিউক্লিয়াস।
পরমাণুর সবচেয়ে ভারী প্রাথমিক কণা হল ___।
উত্তর – পরমাণুর সবচেয়ে ভারী প্রাথমিক কণা হল নিউট্রন।
___ কণার বিভিন্নতার জন্য আইসোটোপ পাওয়া যায়।
উত্তর – নিউট্রন কণার বিভিন্নতার জন্য আইসোটোপ পাওয়া যায়।
আইসোটোপগুলির রাসায়নিক ধর্ম ___।
উত্তর – আইসোটোপগুলির রাসায়নিক ধর্ম অভিন্ন।
আইসোটোপের পারমাণবিক সংখ্যা ___, কিন্তু ভরসংখ্যা ___।
উত্তর – আইসোটোপের পারমাণবিক সংখ্যা সমান, কিন্তু ভরসংখ্যা আলাদা।
একটি পরমাণুর প্রকৃত ভর = পরমাণু-ক্রমাঙ্ক × ___।
উত্তর – একটি পরমাণুর প্রকৃত ভর = পরমাণু-ক্রমাঙ্ক × 1.6603 × 10-24 গ্রাম।
Ax, By, Cz যৌগে A, B এবং C -এর পারমাণবিক ভর যথাক্রমে a, b এবং c হলে ওই যৌগের আণবিক ভর = ___।
উত্তর – Ax, By, Cz যৌগে A, B এবং C -এর পারমাণবিক ভর যথাক্রমে a, b এবং c হলে ওই যৌগের আণবিক ভর = ax + by + cz।
ভিন্ন পরমাণু-ক্রমাঙ্ক কিন্তু সমান নিউট্রন সংখ্যা বিশিষ্ট বিভিন্ন মৌলের পরমাণুগুলিকে পরস্পরের ___ বলা হয়।
উত্তর – ভিন্ন পরমাণু-ক্রমাঙ্ক কিন্তু সমান নিউট্রন সংখ্যা বিশিষ্ট বিভিন্ন মৌলের পরমাণুগুলিকে পরস্পরের আইসোটোন বলা হয়।
ঠিক বা ভুল নির্বাচন করো
নিউট্রন হল নিস্তড়িৎ কণা যার ভর ইলেকট্রনের ভরের সমান।
উত্তর – ভুল।
সঠিক উত্তর – 1839 গুণ বেশি।
পরমাণুর কেন্দ্রকে প্রোটন ও ইলেকট্রন থাকে।
উত্তর – ভুল।
সঠিক উত্তর – প্রোটন ও নিউট্রন।
পরমাণুতে প্রোটন সংখ্যা ও নিউট্রন সংখ্যা সমান হওয়ায় পরমাণু নিস্তড়িৎ হয়।
উত্তর – ভুল।
সঠিক উত্তর – প্রোটন ও ইলেকট্রন সংখ্যা।
সাধারণ হাইড্রোজেনের পারমাণবিক সংখ্যা ও ভরসংখ্যা সমান হয়।
উত্তর – ঠিক।
পারমাণবিক হাইড্রোজেনের বর্ণালি বিচ্ছিন্ন প্রকৃতির।
উত্তর – ঠিক।
নিষ্ক্রিয় মৌল হিলিয়াম পরমাণুর সর্ববহিস্থ কক্ষে 8টি ইলেকট্রন থাকে।
উত্তর – ভুল।
সঠিক উত্তর – 2টি।
মৌলের রাসায়নিক ধর্ম মৌলের পারমাণবিক সংখ্যার ওপর নির্ভর করে।
উত্তর – ঠিক।
ভরসংখ্যা সর্বদা ভগ্নাংশ হয়।
উত্তর – ভুল।
সঠিক উত্তর – পূর্ণসংখ্যা।
আইসোবারদের ভরসংখ্যা সমান হলেও ভর সমান নয়।
উত্তর – ঠিক।
রাদারফোর্ডের পরীক্ষায় ধনাত্মক আধানের তীব্র বিকর্ষণেই α-কণা ফিরে আসে, নিউক্লিয়াসের সঙ্গে সংঘর্ষ ঘটে না।
উত্তর – ঠিক।
একটি বাক্যে উত্তর দাও
হাইড্রোজেনের সবথেকে হালকা আইসোটোপটির নাম লেখো।
হাইড্রোজেনের সবথেকে হালকা আইসোটোপটির নাম হল প্রোটিয়াম।
অক্সিজেনের তিনটি আইসোটোপ কী কী?
অক্সিজেনের তিনটি আইসোটোপ হল \({}_8^{16}O,\;{}_8^{17}O,\;{}_8^{15}O\)।
নিয়নের মতো ইলেকট্রন-বিন্যাসযুক্ত একটি আয়নের উদাহরণ দাও।
নিয়নের মতো ইলেকট্রন-বিন্যাসযুক্ত একটি আয়নের হল Na+ আয়ন।
হাইড্রোজেনের তেজস্ক্রিয় আইসোটোপের নাম লেখো।
হাইড্রোজেনের তেজস্ক্রিয় আইসোটোপের হল ট্রিটিয়াম \(\left({}_1^3H\right)\)।
দুটি মৌলের নাম করো যাদের কোনো আইসোটোপ নেই।
দুটি মৌলের হল সোডিয়াম ও ফ্লুওরিন, যাদের কোনো আইসোটোপ নেই।
কার্বনের তেজস্ক্রিয় আইসোটোপটির ভরসংখ্যা কত?
কার্বনের তেজস্ক্রিয় আইসোটোপটির ভরসংখ্যা 14।
92U238 থেকে চারটি α-কণা নির্গত হলে অবশিষ্ট নিউক্লিয়াসটির ভরসংখ্যা ও প্রোটন সংখ্যা কত হবে?
92U238 থেকে চারটি α-কণা নির্গত হলে অবশিষ্ট নিউক্লিয়াসটির ভরসংখ্যা ও প্রোটন সংখ্যা A = 222, Z = 84 হবে।
H, H+, He+ এবং Li2+ কোনটির ক্ষেত্রে বোর তত্ত্ব প্রযোজ্য নয়?
H+ -এর ক্ষেত্রে বোর তত্ত্ব প্রযোজ্য নয়?
কোন্ নোবল্ গ্যাস এবং Mg2+ -এর ইলেকট্রন সংখ্যা সমান?
নিয়ন (Ne) নোবল্ গ্যাস এবং Mg2+ -এর ইলেকট্রন সংখ্যা সমান।
39B12, 6C13 মৌল দুটির পারস্পরিক সম্পর্ক কী?
39B12, 6C13 মৌল দুটির পারস্পরিক সম্পর্ক আইসোটোন।
3Li পরমাণুর বহিস্থ কক্ষের ইলেকট্রনটিকে তৃতীয় কক্ষে স্থানান্তরিত করলে শক্তির শোষণ না বর্জন ঘটবে?
3Li পরমাণুর বহিস্থ কক্ষের ইলেকট্রনটিকে তৃতীয় কক্ষে স্থানান্তরিত করলে শক্তির শোষণ ঘটবে।
পরীক্ষামূলকভাবে নিউট্রন আবিষ্কার করেন কোন্ বিজ্ঞানী?
পরীক্ষামূলকভাবে নিউট্রন আবিষ্কার করেন স্যাডউইক বিজ্ঞানী।
প্রাচীন আরব রসায়নবিদদের মতে, পৃথিবীর সমস্ত ধাতু মূলত কোন দুটি উপাদান দিয়ে গঠিত, এবং পরবর্তীতে পার্সিরা এতে কোন অতিরিক্ত উপাদান যোগ করেন?
প্রাচীন আরব রসায়নবিদরা মনে করতেন যে, পৃথিবীর সমস্ত ধাতুগুলি মাত্র 2টি উপাদান দিয়ে তৈরি। এরা হল সালফার এবং পারদ। পার্সিরা এতে ‘নুন’কে যোগ করেন।
মানবদেহে প্রায় 7 বিলিয়ন পরমাণু রয়েছে, যাদের প্রায় 98 শতাংশই প্রতি বছর প্রতিস্থাপিত হয়। এর ফলে দেহের গঠন ও কার্যকারিতায় কী ধরনের পরিবর্তন ঘটে?
মানবদেহে প্রায় 7 বিলিয়ন পরমাণু রয়েছে। এদের প্রায় 98 শতাংশই প্রতি বছর প্রতিস্থাপিত হয়ে থাকে।
এক চামচ জলে থাকা পরমাণুর সংখ্যা আটলান্টিক মহাসাগরে থাকা মোট জলকণার সংখ্যার কত গুণ?
আটলান্টিক মহাসাগরে যত চামচ জল থাকে, তার আটগুণ সংখ্যক পরমাণু থাকতে পারে এক চামচ জলে।
বামদিকের সঙ্গে ডানদিক মিল করো।
প্রথম স্তম্ভ মেলাও
| ডানদিক (নিউক্লাইড) | ডানদিক (সর্ববহিস্থ কক্ষে e– সংখ্যা) | উত্তর |
| 1. 17Cl35 | a. 6 | 1. → c. |
| 2. 11Na23 | b. 3 | 2. → e. |
| 3. 20Ca40 | c. 7 | 3. → f. |
| 4. 13Al27 | d. 5 | 4. → b. |
| 5. 8O16 | e. 1 | 5. → a. |
| 6. 7Na14 | f. 2 | 6. → d. |
দ্বিতীয় স্তম্ভ মেলাও
| বামদিক (মৌল) | ডানদিক (ইলেকট্রন-বিন্যাস) | উত্তর |
| 1. নিয়ন | a. 2, 8, 8, 1 | 1. → d. |
| 2. সোডিয়াম | b. 2 | 2. → e. |
| 3. ফ্লুওরিন | c. 2, 7 | 3. → c. |
| 4. হিলিয়াম | d. 2, 8 | 4. → b. |
| 5. পটাশিয়াম | e. 2, 8, 1 | 5. → a. |
তৃতীয় স্তম্ভ মেলাও
| বামদিক | ডানদিক | উত্তর |
| 1. হাইড্রোজেনের একটি আইসোটোপ | a. নিরবচ্ছিন্ন | 1. → e. |
| 2. আইসোটোন | b. বোরের মতবাদ | 2. → c. |
| 3. নিউক্লিয় বল | c. 1H3, 2He4 | 3. → d. |
| 4. স্থির শক্তির কক্ষপথ | d. মেসন কণা | 4. → b. |
| 5. সূর্যের বর্ণালি | e. ডয়টেরিয়াম | 5. → a. |
For High-Types
একটি মৌল X -এর পরমাণু-ক্রমাঙ্ক = a এবং ভরসংখ্যা = b হলে, X++ আয়নে আধানযুক্ত কণিকা এবং আধানশূন্য কণিকার সংখ্যা কত?
X মৌলের পরমাণু-ক্রমাঙ্ক = a এবং ভরসংখ্যা = b। পরমাণু-ক্রমাঙ্ক = পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যা = নিউক্লিয়াসের বাইরের কক্ষপথে উপস্থিত ইলেকট্রন সংখ্যা = a।
ভরসংখ্যা = (প্রোটন সংখ্যা + নিউট্রন সংখ্যা) = b।
∴ নিউট্রন সংখ্যা = (ভরসংখ্যা – প্রোটন সংখ্যা) = (b – a)। পরমাণুটি 2টি ইলেকট্রন ত্যাগ করে X++ ক্যাটায়নে পরিণত হয়েছে। অতএব, ওই ক্যাটায়নে উপস্থিত ইলেকট্রন = (a – 2) সংখ্যক। যেহেতু, প্রোটন ধনাত্মক আধানযুক্ত এবং ইলেকট্রন ঋণাত্মক আধানযুক্ত, X++ আয়নে আধানযুক্ত কণিকার সংখ্যা = প্রোটন সংখ্যা + ইলেকট্রন সংখ্যা = a + (a – 2) = (2a – 2)।
যেহেতু, নিউট্রন আধানহীন কণা, তাই X++ আয়নে আধানশূন্য কণার সংখ্যা = (b – a)।
একটি হাইড্রোজেন পরমাণুর ভর একটি প্রোটনের ভরের প্রায় সমান ব্যাখ্যা করো।
অথবা, প্রোটনের চিহ্ন হিসেবে 1H1 লেখা কতখানি যুক্তিপূর্ণ তা বুঝিয়ে লেখো।
হাইড্রোজেন পরমাণুর নিউক্লিয়াসে একটি প্রোটন এবং বাইরের কক্ষে একটি ইলেকট্রন থাকে। হাইড্রোজেন পরমাণুর ভর = 1টি প্রোটনের ভর + 1টি ইলেকট্রনের ভর। 1টি প্রোটন, 1টি ইলেকট্রনের তুলনায় প্রায় 1837 গুণ ভারী। তাই, ইলেকট্রনের ভরকে নগণ্য ধরে উপেক্ষা করলে হাইড্রোজেন পরমাণুর ভর = 1টি প্রোটনের ভর ধরা হয়।
দুটি মৌলের পরমাণুর পারমাণবিক সংখ্যা সমান নয় -এর থেকে মৌল দুটিকে নিশ্চিতভাবে পরস্পরের আইসোবার বলা যেতে পারে কি না তা যুক্তিসহ বুঝিয়ে লেখো।
বিভিন্ন মৌলের পরমাণু যাদের পারমাণবিক সংখ্যা আলাদা, কিন্তু ভরসংখ্যা সমান, তাদের পরস্পরকে আইসোবার বলে। দুটি মৌলের পরমাণুর পারমাণবিক সংখ্যা সমান নয় – এর থেকে মৌল দুটিকে নিশ্চিতভাবে পরস্পরের আইসোবার বলা যাবে, যদি তাদের ভরসংখ্যা সমান হয়। কিন্তু ভরসংখ্যা সমান না হলে মৌল দুটিকে পরস্পরের আইসোবার বলা যাবে না। যেমন – 18Ar40, 19K40, 20Ca40 এদের প্রত্যেকের ভরসংখ্যা সমান, কিন্তু পারমাণবিক সংখ্যা আলাদা। মৌলগুলি পরস্পরের আইসোবার। কিন্তু 15P31 এবং 16S32 উভয় মৌলে পারমাণবিক সংখ্যা এবং ভরসংখ্যা আলাদা কিন্তু নিউট্রন সংখ্যা সমান (16টি)। মৌলদুটি পরস্পরের আইসোটোন।
পরমাণুতর কণা কাকে বলে? 5টি পরমাণুতর কণার নাম করো।
পরমাণুর মধ্যে উপস্থিত বিভিন্ন প্রধান ও অপ্রধান কণাকে বলা হয় পরমাণুতর কণা।
5টি পরমাণুতর কণা হল – ইলেকট্রন, প্রোটন, নিউট্রন, পজিট্রন, মেসন ইত্যাদি।
অ্যানোডরূপে ব্যবহৃত ধাতুর প্রকৃতির উপর অ্যানোড রশ্মি কণার প্রকৃতি নির্ভর করে না – ব্যাখ্যা করো।
তড়িৎক্ষরণ নলে নিম্নচাপে কোনো গ্যাস নিয়ে তড়িদ্দ্বার দুটির মধ্যে উচ্চ বিভব প্রয়োগ করলে ক্যাথোড থেকে অ্যানোডের দিকে ক্যাথোড রশ্মি তথা ঋণাত্মক আধানযুক্ত ইলেকট্রন কণার স্রোত ধাবিত হয়। ওই ইলেকট্রনগুলি তাদের গতিপথে উপস্থিত গ্যাসের পরমাণুগুলির সঙ্গে সংঘর্ষে লিপ্ত হয়ে ওই পরমাণুগুলি থেকে এক বা একাধিক ইলেকট্রন বিচ্যুত করে ধনাত্মক আধানযুক্ত কণার সৃষ্টি করে। এই কণাগুলির স্রোত অ্যানোড থেকে ক্যাথোডের দিকে প্রবাহিত হওয়ায় এদের অ্যানোড রশ্মি বলে। সুতরাং, অ্যানোড রশ্মির উৎপত্তি অনুযায়ী এই রশ্মির প্রকৃতি তড়িৎক্ষরণ নলে ব্যবহৃত গ্যাসের প্রকৃতির উপর নির্ভরশীল হলেও অ্যানোডরূপে ব্যবহৃত ধাতুর প্রকৃতির ওপর নির্ভরশীল নয়।
Class 9 Physical Science – Notes for All Chapters
| Chapter Name | Tropics |
|---|---|
| পরিমাপ | পরিমাপ ও একক বিভিন্ন মাপের একক মাত্রা পরিমাপ |
| বল ও গতি | স্থিতি ও গতি গতির সমীকরণ নিউটনের প্রথম গতিসূত্র নিউটনের দ্বিতীয় গতি সূত্র নিউটনের তৃতীয় গতিসূত্র বিভিন্ন ধরনের বল রৈখিক ভরবেগ রৈখিক ভরবেগ সংরক্ষণ |
| পদার্থ : গঠন ও ধর্ম | তরল ও বায়ুর চাপ আর্কিমিডিসের নীতি পৃষ্ঠটান সান্দ্রতা বার্নোলির নীতি স্থিতিস্থাপকতা |
| পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ | পরমাণুর গঠন মোলের ধারণা দ্রবণ অ্যাসিড, ক্ষার, লবণ মিশ্রণের উপাদানের পৃথকীকরণ জল |
| শক্তির ক্রিয়া , কার্য, ক্ষমতা | শক্তির ক্রিয়া , কার্য, ক্ষমতা |
| তাপ | ক্যালোরিমিতি কার্য ও তাপের তুল্যতা লীনতাপ সম্পৃক্ত ও অসম্পৃক্ত বাষ্প জলের ব্যতিক্রান্ত প্রসারণ |
| শব্দ | শব্দের উৎস : কম্পন শব্দের বিস্তার : তরঙ্গ শব্দের কয়েকটি ধর্ম শব্দের বৈশিষ্ট্য মানুষের কান ও শব্দ শোনার কৌশল শব্দদূষণ |
আজকের আর্টিকেলে আমরা নবম শ্রেণির ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “পরমাণুর গঠন” থেকে পরীক্ষায় আসা গুরুত্বপূর্ণ প্রশ্ন ও উত্তরগুলো আলোচনা করেছি। এই প্রশ্নোত্তরগুলো নবম শ্রেণির বার্ষিক পরীক্ষা, এমনকি চাকরি বা যেকোনো প্রতিযোগিতামূলক পরীক্ষার জন্যও উপযোগী। কারণ, এই অধ্যায়ের প্রশ্ন প্রায়ই বিভিন্ন পরীক্ষায় কমন আসে।
আশা করি, এই আর্টিকেলটি আপনাদের পরীক্ষার প্রস্তুতিতে কিছুটা হলেও সাহায্য করবে। যদি কোনো প্রশ্ন, মতামত বা সাহায্যের প্রয়োজন হয়, নিচে কমেন্ট করে জানাতে পারেন কিংবা টেলিগ্রামে যোগাযোগ করুন—আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত।
ধন্যবাদ সবাইকে।






Leave a Comment