এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ “তেজস্ক্রিয়তা” নিয়ে আলোচনা করব। এই অংশটি মাধ্যমিক ভৌতবিজ্ঞান পরীক্ষার জন্য অত্যন্ত গুরুত্বপূর্ণ। এই “তেজস্ক্রিয়তা” অংশটি মাধ্যমিক ভৌতবিজ্ঞানের সপ্তম অধ্যায় “পরমাণুর নিউক্লিয়াস“ -এর একটি গুরুত্বপূর্ণ অংশ। এই “তেজস্ক্রিয়তা” থেকে গুরুত্বপূর্ণ প্রশ্ন মাধ্যমিক পরীক্ষায় এবং চাকরির পরীক্ষায় প্রায়ই দেখা যায়।

মাধ্যমিক ভৌতবিজ্ঞান – পরমাণুর নিউক্লিয়াস – তেজস্ক্রিয়তা
পরমাণুর নিউক্লিয়াস –
পরমাণুর কেন্দ্রে যে ক্ষুদ্রতম অংশে পরমাণুর সমস্ত ধনাত্মক আধান ও ভর অবস্থান করে সেই অংশটিকে পরমাণুর নিউক্লিয়াস বলে।
ধনাত্মক আধানযুক্ত কণিকা প্রোটন এবং তড়িৎ নিরপেক্ষ কণিকা নিউট্রন দ্বারা গঠিত নিউক্লিয়াস।
তেজস্ক্রিয়তা আবিষ্কার –
বিজ্ঞানী মাদাম কুরি পদার্থের তেজস্ক্রিয় রশ্মি নির্গমনের ধর্মকে তেজস্ক্রিয়তা আখ্যা দেন এবং এই রশ্মির নাম দেওয়া হয় তেজস্ক্রিয় রশ্মি।
তেজস্ক্রিয়তা –
ইউরেনিয়াম, থোরিয়াম, রেডিয়ামের মতো কতকগুলি ভারী মৌলের পরমাণুর নিউক্লিয়াস, যে-কোনো অবস্থায় নিজে থেকেই স্বতঃস্ফূর্তভাবে অবিরাম গতিতে বিভাজিত হয়ে নতুন মৌলের নিউক্লিয়াসে পরিণত হয় এবং সেই সঙ্গে এক বিশেষ ধরনের অদৃশ্য রশ্মি বিকিরণ করে। যা অন্ধকারে ফোটোগ্রাফিক প্লেটকে আক্রান্ত করে, পাতলা ধাতব পাত ভেদ করে এবং গ্যাসের মধ্যে দিয়ে যাওয়ার সময় গ্যাসকে আয়নিত করে। এই বিকিরিত রশ্মিগুলি আলোক, চাপ, উষ্ণতা, রাসায়নিক বিক্রিয়া প্রভৃতি কোনো কারণ দ্বারাই প্রভাবিত হয় না, ভারী মৌলের পরমাণুর এরূপ রশ্মি বিকিরণ ধর্মকে তেজস্ক্রিয়তা (Radioactivity) বলে।
তেজস্ক্রিয়তার কারণ –
মৌলের পরমাণুর নিউক্লিয়াসে নিউট্রন ও প্রোটন সংখ্যার অনুপাতের \(\left(\frac np\right)\) মান 1.5 অপেক্ষা বেশি হলে প্রোটন-প্রোটন (p – p) বিকর্ষণধর্মী বল অতি দ্রুত বৃদ্ধি পায়। ফলে নিউক্লিয় বল প্রোটন ও নিউট্রনগুলিকে একত্রে ধরে রাখতে পারে না। কাজেই নিউক্লিয়াস অস্থায়ী হয়ে স্বতঃস্ফূর্তভাবে ভাঙতে শুরু করে এবং তেজস্ক্রিয় রশ্মি বিকিরণ করে। সাধারণভাবে কোনো মৌলের ভরসংখ্যা 210 বা তার বেশি হলে \(\frac np\) -এর মান 1.5 অপেক্ষা বেশি হয়, তাই এদের তেজস্ক্রিয় ধর্ম বিদ্যমান।
তেজস্ক্রিয় পদার্থ ও রশ্মি –
যেসব মৌলগুলি থেকে এই রশ্মি বিকিরিত হয় সেগুলিকে তেজস্ক্রিয় পদার্থ (Radioactive substance) বলে এবং ওই নির্গত রশ্মিকে তেজস্ক্রিয় রশ্মি (Radioactive ray) বলে।
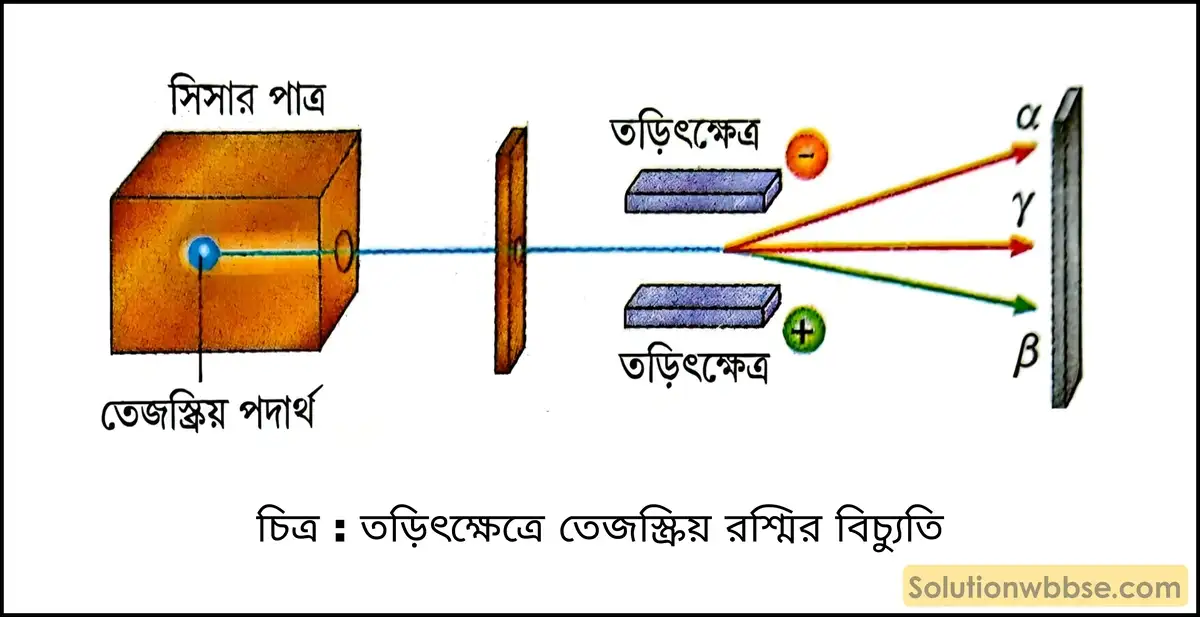
তেজস্ক্রিয় রশ্মির গতিপথে চৌম্বক বা তড়িৎক্ষেত্র স্থাপন করলে এটি তিনটি ভিন্ন ভিন্ন প্রকৃতির রশ্মিতে বিভক্ত হয়ে যায় –
- আলফা রশ্মি (α-ray),
- বিটা রশ্মি (β-ray) এবং
- গামা রশ্মি (γ-ray)
তেজস্ক্রিয় মৌল –
প্রকৃতিতে অবস্থিত মৌলগুলির মধ্যে পোলোনিয়াম (Po), রেডন (Rn), রেডিয়াম (Ra), অ্যাক্টিনিয়াম (Ac), থোরিয়াম (Th), প্রোট্যাক্টিনিয়াম (Pa) এবং ইউরেনিয়াম (U) তেজস্ক্রিয়। ইউরেনিয়ামোত্তর সকল মৌলই তেজস্ক্রিয়।
তেজস্ক্রিয় মৌলের নিউক্লিয়াস থেকে α-কণা কিংবা β-কণা নির্গত হলে নতুন মৌলের সৃষ্টি হয়।
α-রশ্মি –
- আলফা রশ্মি, তেজস্ক্রিয় মৌলের নিউক্লিয়ায় থেকে নির্গত দ্রুতগামী পজিটিভ আধানবিশিষ্ট কণার স্রোত। α-কণার আধানের মান 2 একক। প্রতিটি α-কণা প্রকৃতপক্ষে 2 একক ধনাত্মক আধানবিশিষ্ট হিলিয়াম আয়ন \(\left({}_2^4He^{2+}\right)\)।
- একটি α-কণার ভর 4 একক অর্থাৎ একটি প্রোটনের ভরের 4 গুণ mα = 4mp
- α-রশ্মি তড়িৎ ও চৌম্বকক্ষেত্র দ্বারা বিক্ষিপ্ত হয়।
- ভর বেশি বলে α-কণার ভেদন ক্ষমতা কম। α-কণা 0.02 mm পুরু অ্যালুমিনিয়াম পাত ভেদ করতে পারে কিন্তু 0.1 mm পুরু অ্যালুমিনিয়াম পাত ভেদ করে যেতে পারে না।
- α-কণার বেগ আলোর বেগের প্রায় \(\frac1{10}\) অংশ।
- কোনো গ্যাসের মধ্যে দিয়ে α-রশ্মি গেলে গ্যাসটি আয়নিত হয়।
β-রশ্মি –
- β-রশ্মি প্রকৃতপক্ষে কোনো রশ্মি নয়। এটি অতীব উচ্চ বেগসম্পন্ন ইলেকট্রন কণার স্রোত। এই কণার আধান ঋণাত্মক ও এর আধান একটি ইলেকট্রনের আধানের সমান।
- β-কণার ভর ইলেকট্রনের ভরের সমান। প্রোটনের তুলনায় ইলেকট্রনের ভর নগণ্য।
- β-রশ্মি ঋণাত্মক আধানযুক্ত কণার সমষ্টি হওয়ায় তড়িৎ বা চৌম্বকক্ষেত্রের প্রভাবে প্রতিমুহূর্তে বিক্ষিপ্ত হয়ে বক্র গতিপথ সম্পন্ন হয়।
- এর গতিবেগ অনেক বেশি। আলোর বেগের প্রায় 98% পর্যন্ত হতে পারে।
- কোনো গ্যাসের মধ্য দিয়ে যাওয়ার সময় β-কণা গ্যাসটির মধ্যে আয়নয়ন ঘটাতে পারে। তবে α-কণার তুলনায় এর আয়নয়ন ক্ষমতা প্রায় 100 গুণ কম।
- β-রশ্মি ভর কম ও গতিবেগ বেশি হওয়ায় এর ভেদন ক্ষমতা α-রশ্মির তুলনায় প্রায় 100 গুণ বেশি। β-রশ্মি 5 mm পুরু অ্যালুমিনিয়াম পাত ভেদ করতে পারে। তবে 1 cm পুরু অ্যালুমিনিয়াম পাত ভেদ করতে পারে না।
γ-রশ্মি –
- γ-রশ্মি হল প্রকৃতপক্ষে তেজস্ক্রিয় মৌলের নিউক্লিয়াস থেকে নির্গত খুব ক্ষুদ্র তড়িৎচুম্বকীয় তরঙ্গ, যার মধ্যে উচ্চ শক্তিসম্পন্ন ফোটোন কণা বর্তমান।
- এটি ভরহীন নিস্তড়িৎ। এর গতিবেগ আলোর গতিবেগের সমান কিন্তু এর কম্পাঙ্ক অনেক বেশি।
- তরঙ্গদৈর্ঘ্য খুব কম হওয়ায় (0.1Å থেকে 0.001Å) X-রশ্মির মতো γ-রশ্মিও কোনো দর্শানুভূতি সৃষ্টি করে না।
- নিস্তড়িৎ হওয়ায় γ-রশ্মির গ্যাস আয়নন ক্ষমতা খুব কম।
- γ-রশ্মির বেগ সর্বোচ্চ হওয়ায় এর ভেদন ক্ষমতা α, β-রশ্মির থেকে অনেক বেশি। γ-রশ্মি 100 cm পুরু পর্যন্ত অ্যালুমিনিয়াম পাত ভেদ করতে পারে, আবার 8 cm পুরু সিসার পাত ভেদ করতেও সক্ষম।
- কোনো তেজস্ক্রিয় পরমাণুর নিউক্লিয়ায় থেকে α বা β-কণা নির্গত হওয়ার পর নিউক্লিয়াসটি উচ্চ শক্তিসম্পন্ন হয়ে পড়ে। তখন সুস্থিতি লাভের জন্য অতিরিক্ত শক্তি γ-রশ্মি রূপে নির্গত হয়।
- কোনো পরমাণুর নিউক্লিয়াস থেকে একটি α-কণা নির্গত হলে তার পরমাণু-ক্রমাঙ্ক 2 ও ভরসংখ্যা 4 হ্রাস পায় এবং নতুন মৌলের সৃষ্টি হয়। \({}_{92}^{238}U\rightarrow{}_{90}^{234}Th+{}_2^4\alpha\)
- তেজস্ক্রিয় মৌলের পরমাণু থেকে একটি β-কণা নির্গত হলে মৌলটির ভরসংখ্যার কোনো পরিবর্তন হবে না কিন্তু পারমাণবিক সংখ্যা 1 একক বেড়ে যাবে। ফলে একই ভরসংখ্যা বিশিষ্ট নতুন মৌলের সৃষ্টি হবে। \({}_{90}^{234}Th\rightarrow{}_{91}^{234}Pa+\beta\left({}_{-1}^0e\right)\)
- তেজস্ক্রিয় পরমাণু থেকে γ-রশ্মির নির্গমনের ফলে পারমাণবিক সংখ্যার কোনো পরিবর্তন হয় না।
তেজস্ক্রিয়তার ব্যবহার –
| তেজস্ক্রিয় মৌল | ব্যবহার |
| তেজস্ক্রিয় কার্বন \(\left({}_6^{14}C\right)\) | জীবাশ্ম, প্রাচীন বস্তুর বয়স নির্ণয় করতে, সালোকসংশ্লেষ সম্পর্কে তথ্য জানতে। |
| তেজস্ক্রিয় ফসফরাস \(\left({}_{15}^{32}P\right)\) | লিউকোমিয়া রোগের চিকিৎসায়, মস্তিষ্কে টিউমারের সঠিক অবস্থান নির্ণয়ে। |
| তেজস্ক্রিয় আয়োডিন \(\left({}_{53}^{131}I\right)\) | থাইরয়েড রোগ নির্ণয়ে ও চিকিৎসায়। |
| তেজস্ক্রিয় সোডিয়াম \(\left({}_{11}^{24}Na\right)\) | হার্টের ক্রিয়াকৌশল জানার জন্য। |
| তেজস্ক্রিয় কোবাল্ট \(\left({}_{27}^{60}Co\right)\) ও তেজস্ক্রিয় সোনা \(\left({}^{198}Au\right)\) | ক্যানসার চিকিৎসায়। |
| তেজস্ক্রিয় ইউরেনিয়াম | পৃথিবী বা অন্যান্য ভূতাত্ত্বিক বস্তুর বয়স নির্ণয়ে। তাই একে ইউরেনিয়াম ঘড়ি বলে। |
| তেজস্ক্রিয় আমেরিসিয়াম \(\left({}_{p5}^{243}Am\right)\) | স্মোক ডিটেকটরে। |
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ “তেজস্ক্রিয়তা” নিয়ে আলোচনা করেছি। এই অংশটি মাধ্যমিক ভৌতবিজ্ঞান পরীক্ষার জন্য অত্যন্ত গুরুত্বপূর্ণ। এই “তেজস্ক্রিয়তা” অংশটি মাধ্যমিক ভৌতবিজ্ঞানের সপ্তম অধ্যায় “পরমাণুর নিউক্লিয়াস“ -এর একটি গুরুত্বপূর্ণ অংশ। এই “তেজস্ক্রিয়তা” অংশটি মাধ্যমিক পরীক্ষায় এবং চাকরির পরীক্ষায় প্রায়ই দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন।






Leave a Comment