এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘চার্লসের সূত্র ও চাপের সূত্র’ নিয়ে আলোচনা করব। এটি ‘গ্যাসের আচরণ’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশ থেকে প্রায় প্রতি বছর প্রশ্ন আসে। এছাড়া, চাকরির পরীক্ষার প্রস্তুতির জন্যও এই আর্টিকেলটি আপনার জন্য গুরুত্বপূর্ণ হবে।

চার্লসের সূত্র –
নির্দিষ্ট চাপে \(1^\circ C\) উষ্ণতা বৃদ্ধি বা হ্রাসের জন্য যে-কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন \(0^\circ C\) উষ্ণতায় ওই গ্যাসের যে আয়তন \(1\) থাকে যথাক্রমে তার \(\frac1{273}\) অংশ বৃদ্ধি বা হ্রাস পায়।
চার্লসের সূত্রের ধ্রুবক দুটি হল –
- গ্যাসের চাপ ও
- গ্যাসের ভর।
চার্লসের সূত্রের গাণিতিক রূপ –
\(0^\circ C\) তাপমাত্রায় কোনো গ্যাসের আয়তন \(V_0\) মিলি হলে
\(1^\circ C\) -এ আয়তন হবে \(V_0+\frac{V_0}{273}\) মিলি
\(2^\circ C\) -এ আয়তন হবে \(V_0+2⋅\frac{V_0}{273}\) মিলি।
এইভাবে, \(t^\circ C\) -এ আয়তন হবে \(V_t=V_0+t⋅\frac{V_0}{273}\) মিলি
এই আয়তনকে \(V_t\) বলা হলে, \(V_t=V_0\left(1+\frac t{273}\right)\) মিলি।
চার্লসের সূত্র থেকে পরম শূন্য উষ্ণতার ধারণা –
চার্লসের সূত্র থেকে জানা যায় যে, নির্দিষ্ট চাপে প্রতি ডিগ্রি সেলসিয়াস তাপমাত্রা বৃদ্ধি বা হ্রাসের জন্য কোনো নির্দিষ্ট পরিমাণ গ্যাসের আয়তন \(0^\circ C\) তাপমাত্রায় আয়তনের \(\frac1{273}\) অংশ বৃদ্ধি বা হ্রাস পায়। অতএব, নির্দিষ্ট চাপে \(0^\circ C\) উষ্ণতায় \(V\) আয়তনের কোনো নির্দিষ্ট ভরের গ্যাসের উষ্ণতা \(0^\circ C\) থেকে \(-273^\circ C\) -এ নামিয়ে আনলে চার্লসের সূত্র অনুযায়ী, \(-273^\circ C\) উষ্ণতায় তার আয়তন
\(V_{-273}=V_0-V_0\times\frac{273}{273}\\\)বা, \(V_{-273}=V_0\left(1-\frac{273}{273}\right)\)
বা, \(V_{-273}=0\)
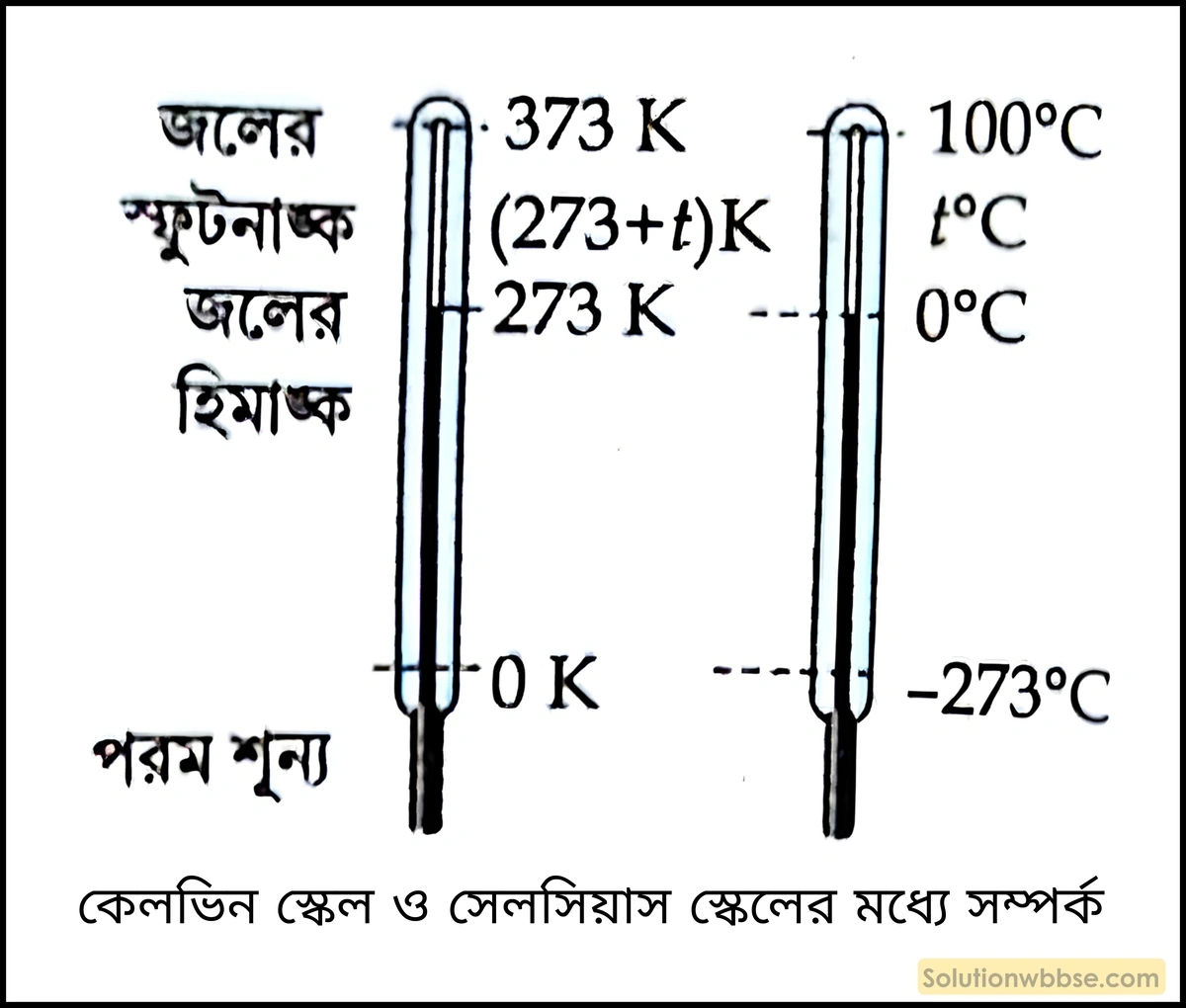
সুতরাং, \(-273^\circ C\) উষ্ণতায় গ্যাসের আয়তন শূন্য হবে অর্থাৎ আয়তন লোপ পাবে। স্থির চাপে \(-273^\circ C\) উষ্ণতায় যে-কোনো গ্যাসের আয়তন শূন্য হয় বলে এই উষ্ণতাকে পরম শূন্য (Absolute zero) উষ্ণতা বলে। প্রকৃতপক্ষে পরম শূন্য উষ্ণতার মান \(-273.15^\circ C\)। কিন্তু এই উষ্ণতায় গ্যাসের আয়তন শূন্য হয় কিনা তা নির্ণয় করা যায় না কারণ এই তাপমাত্রায় পৌঁছোনোর আগেই গ্যাসগুলি তরলে পরিণত হয়।
পরম স্কেল –
\(-273^\circ C\) উষ্ণতাকে \(0\) ধরে তাপমাত্রার প্রতি ডিগ্রিকে যদি এক ডিগ্রি সেলসিয়াসের সমান ধরে মাপা হয় তবে তাপমাত্রার যে স্কেল পাওয়া যায় তাকে তাপমাত্রার পরম স্কেল (Absolute scale) বা কেলভিন স্কেল (Kelvin scale) বলে।
পরম স্কেল ও সেলসিয়াস স্কেলের সম্পর্ক –
সেলসিয়াস স্কেলে কোনো উষ্ণতার মান \(t^\circ C\) হলে পরম স্কেলে ওই উষ্ণতার মান হবে \(T=\left(273+t\right)\) হবে। যেমন – বিশুদ্ধ জলের হিমাঙ্ক ও স্ফুটনাঙ্ক পরম স্কেলে যথাক্রমে \(273\;K\) ও \(373\;K\)।
পরম স্কেলে ঋণাত্মক তাপমাত্রা সম্ভব নয়।
কেলভিন স্কেল অনুসারে চার্লসের সূত্র –
\(t^\circ C\) তাপমাত্রায় চালর্সের সূত্রটি হল \(V_t=V_0\left(1+\frac t{273}\right)\)
বা, \(V_t=\frac{V_0}{273}\left(273+t\right)\)
∴ \(V_t=\frac{V_0}{273}⋅T\;\left(T=273+t\right)\)
বা, \(V\propto T\) [∵ \(\frac{V_0}{273}\) হল ধ্রুবক]
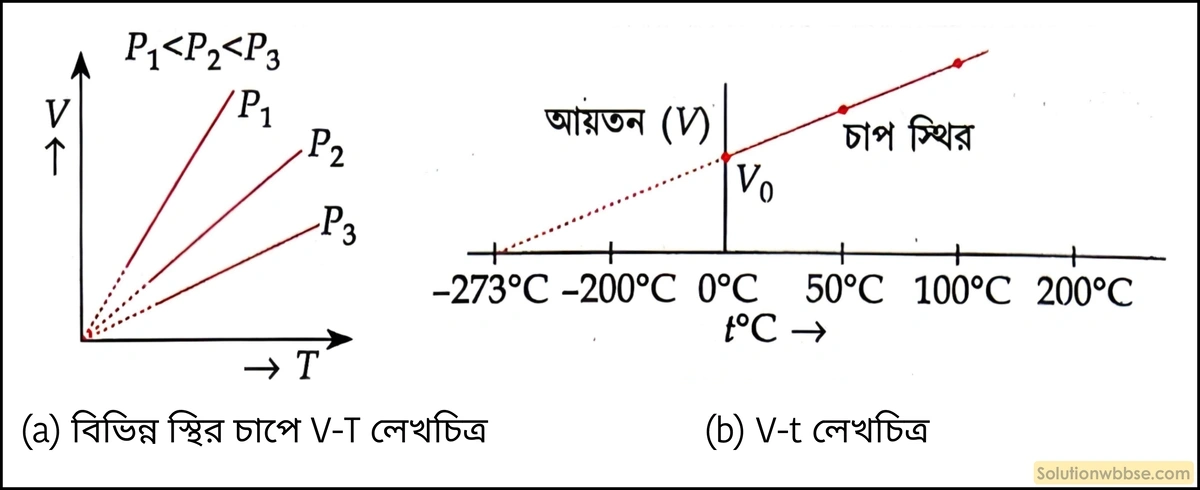
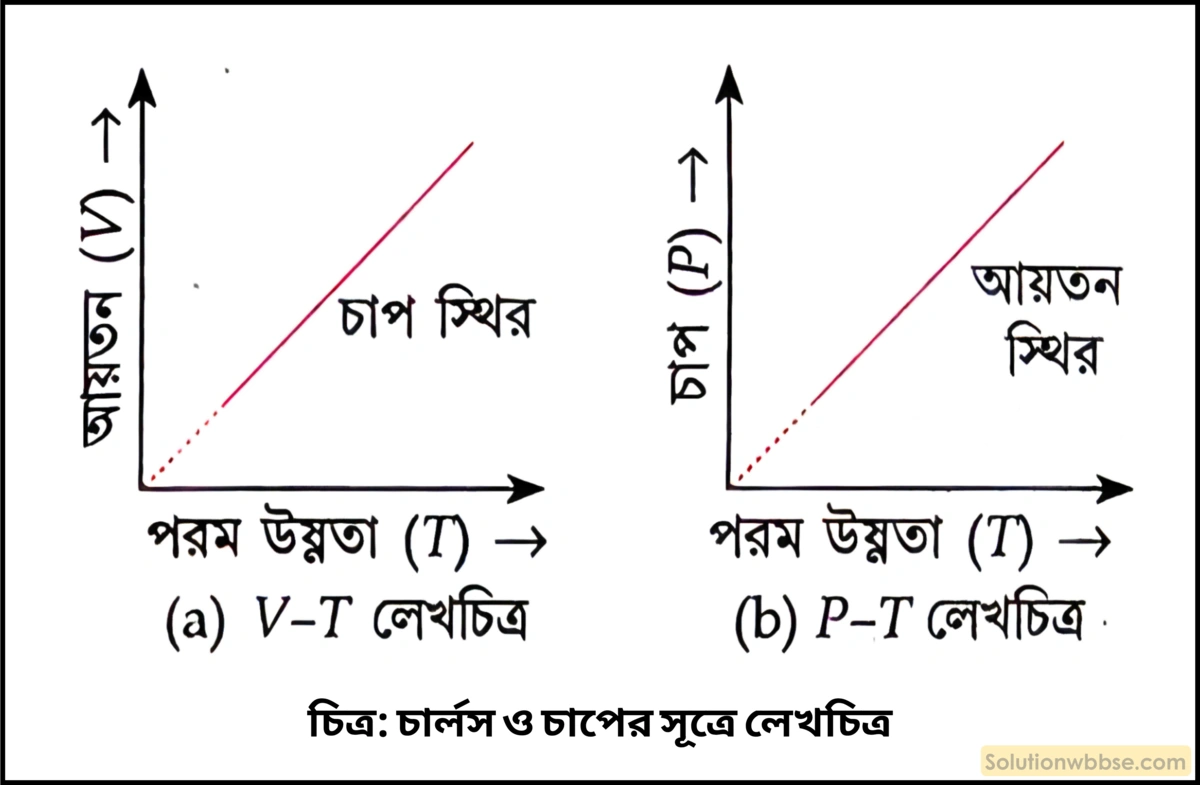
স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন ওর পরম উষ্ণতার সমানুপাতিক হয়।
অর্থাৎ, ভর ও চাপ স্থির রেখে কোনো গ্যাসের আয়তন \(V_1\) থেকে \( V_2\) হল এবং তাপমাত্রা \(T_1 \) থেকে \(T_2\) হলে,
\(\frac{V_1}{V_2}=\frac{T_1}{T_2}\\\)বা \(\frac{V_1}{T_1}=\frac{V_2}{T_2} \)
বয়েল ও চার্লসের সূত্র বিবৃত করার সময় নির্দিষ্ট ভরের গ্যাসের কথা উল্লেখ করা হয় কারণ, গ্যাসের আয়তন ও চাপ গ্যাসের ভরের ওপর নির্ভর করে। অর্থাৎ, গ্যাসের ভরের পরিবর্তন করলে গ্যাসের আয়তন এবং চাপের পরিবর্তন হয়।
লেখচিত্র – আয়তন ও পরম উষ্ণতা সমানুপাতিক যখন চাপ স্থির থাকে।
চাপের সূত্র –
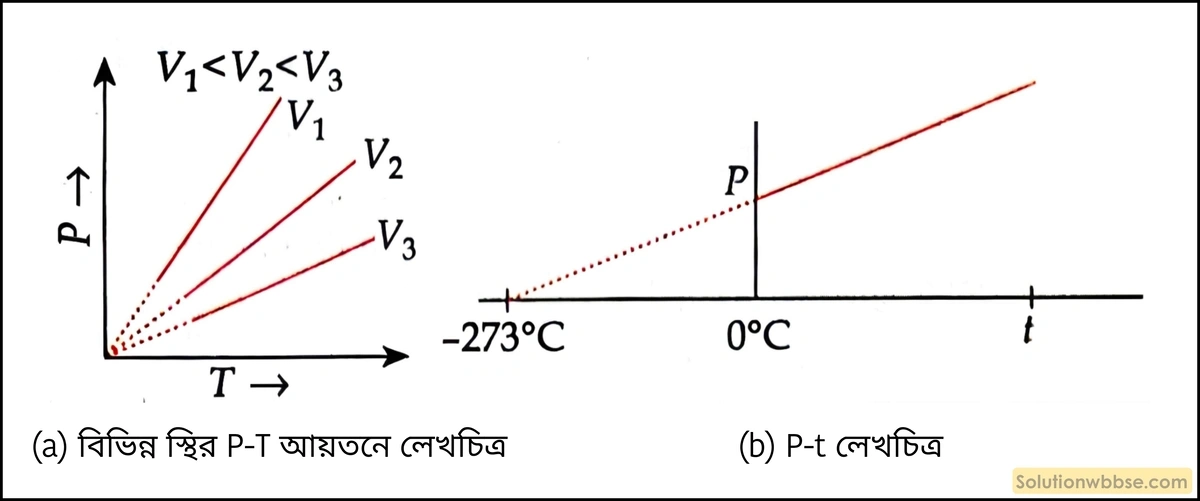
স্থির আয়তনে \(1^\circ C \) উষ্ণতা বৃদ্ধি বা হ্রাসের জন্য যে-কোনো নির্দিষ্ট ভরের গ্যাসের চাপ \( 0^\circ C\) উষ্ণতায় ওই গ্যাসের যে চাপ থাকে যথাক্রমে তার \(\frac1{273}\)অংশ বৃদ্ধি বা হ্রাস পায়।
এই সূত্রানুযায়ী গ্যাসের ভর ও আয়তন স্থির থাকলে \(t^\circ C\) -এ চাপ \(P_t\) ও \(0^\circ C\) -এ চাপ \(P_0\) -র মধ্যে সম্পর্ক হল
বা, \(P_t=P_0\left(1+\frac t{273}\right)\)
বা, \(P_t=\frac{P_0}{273}\left(273+t\right)\)
বা, \(P_t=\frac{P_0}{273}\cdot T \) [\(T=273+t\) পরম স্কেলে তাপমাত্রা]
∴ \(P_t\propto T\)
অর্থাৎ, \(\frac{P_1}{P_2}=\frac{T_1}{T_2}\)
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের একটি গুরুত্বপূর্ণ অংশ ‘বয়েলের সূত্র’ নিয়ে আলোচনা করেছি, যা ‘চার্লসের সূত্র ও চাপের সূত্র’ অধ্যায়ের অন্তর্ভুক্ত। মাধ্যমিক পরীক্ষায় এই অংশটি থেকে প্রায় প্রতি বছর প্রশ্ন আসে এবং চাকরির পরীক্ষার প্রস্তুতির জন্যও এটি অত্যন্ত গুরুত্বপূর্ণ। তাই শিক্ষার্থী ও প্রার্থী সকলের জন্য এই আলোচনা বিশেষভাবে সহায়ক হবে বলে আমরা আশা করি। আশা করি আর্টিকেলটি আপনাদের উপকারে এসেছে। কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের টেলিগ্রামে যোগাযোগ করতে পারেন—আমরা উত্তর দেওয়ার চেষ্টা করব। পাশাপাশি, যাদের এই তথ্যগুলি প্রয়োজন মনে করছেন, তাদের সাথে এই পোস্টটি শেয়ার করুন। ধন্যবাদান্তে, Team SolutionWbbse






মন্তব্য করুন