এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “Pt তড়িৎদ্বারের সাহায্যে লঘু H₂SO₄ -এর জলীয় দ্রবণের তড়িৎবিশ্লেষণে ক্যাথোড এবং অ্যানোডে কী কী উৎপন্ন হয় তা ব্যাখ্যা করো। অথবা, লঘু H₂SO₄ মিশ্রিত জলের তড়িৎবিশ্লেষণ করলে অ্যানোডে SO₄²⁻ আয়ন ইলেকট্রন বর্জন করে না কেন?” — নিয়ে আলোচনা করব। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “তড়িৎপ্রবাহ ও রাসায়নিক বিক্রিয়া” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ।

Pt তড়িৎদ্বারের সাহায্যে লঘু H₂SO₄ -এর জলীয় দ্রবণের তড়িৎবিশ্লেষণে ক্যাথোড এবং অ্যানোডে কী কী উৎপন্ন হয় তা ব্যাখ্যা করো।
অথবা, লঘু H₂SO₄ মিশ্রিত জলের তড়িৎবিশ্লেষণ করলে অ্যানোডে SO₄²⁻ আয়ন ইলেকট্রন বর্জন করে না কেন?
লঘু H₂SO₄ -এর জলীয় দ্রবণের তড়িৎবিশ্লেষণ – জলীয় দ্রবণে লঘু H₂SO₄ বিয়োজিত হয়ে H⁺ এবং SO₄²⁻ আয়ন উৎপন্ন করে। জলের সামান্য সংখ্যক অণু বিয়োজিত হয়ে H⁺ এবং OH⁻ আয়ন উৎপন্ন করে।
H₂SO₄ → 2H⁺ + SO₄²⁻
H₂O ⇌ H⁺ + OH⁻
এখন প্ল্যাটিনাম তড়িৎদ্বারের মাধ্যমে লঘু H₂SO₄ -এর জলীয় দ্রবণে তড়িৎ চালনা করলে H⁺ আয়ন ক্যাথোডে যায় এবং সেখানে H⁺ আয়ন একটি ইলেকট্রন গ্রহণ করে H-পরমাণুতে পরিণত হয়। দুটি H-পরমাণু যুক্ত হয়ে H₂ অণু উৎপন্ন হয়।
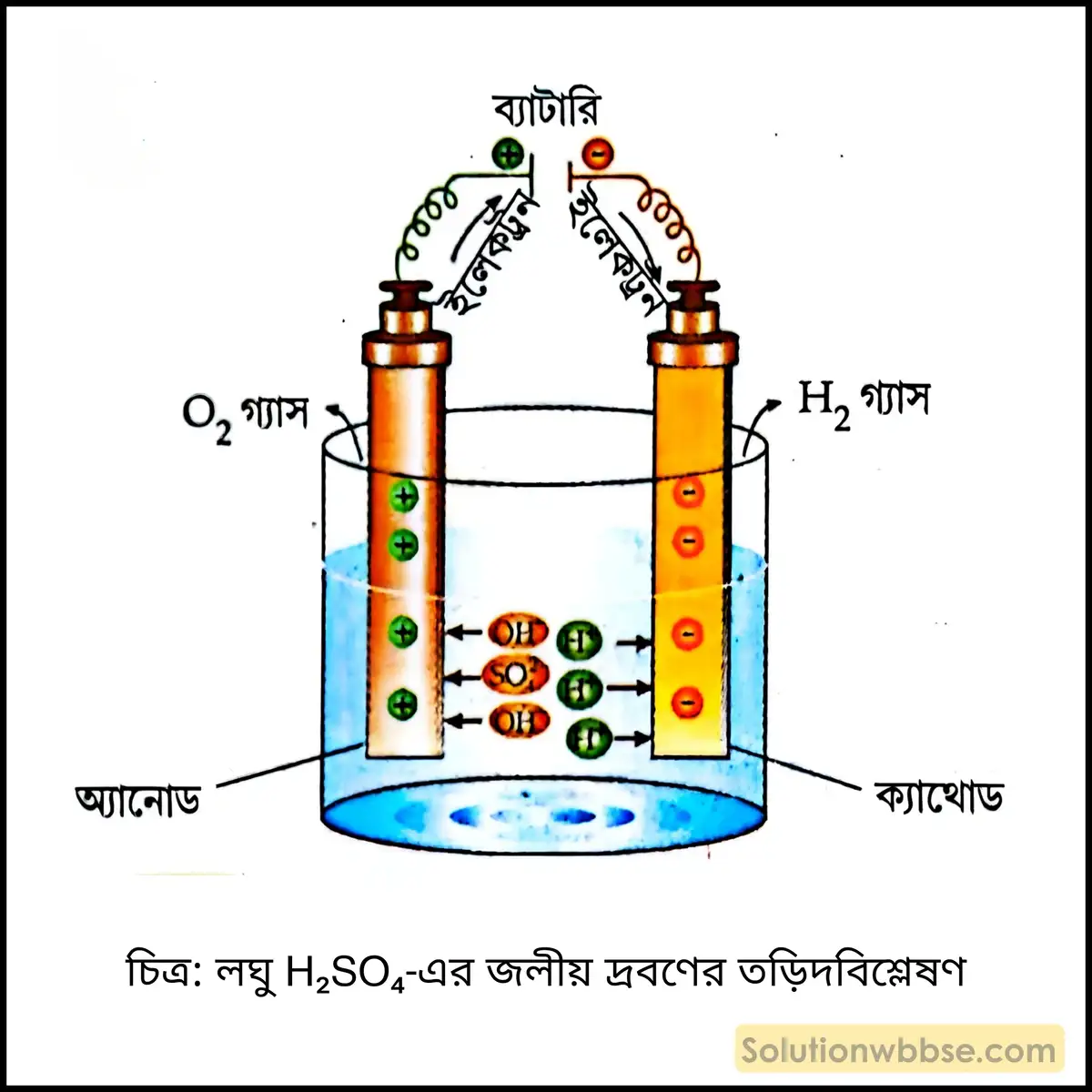
অন্যদিকে অ্যানোডে SO₄²⁻ এবং OH⁻ আয়ন আকর্ষিত হয়। কিন্তু SO₄²⁻ এবং OH⁻ আয়নগুলির মধ্যে SO₄²⁻ আয়নের চেয়ে OH⁻ আয়ন কম তড়িৎ ঋণাত্মক হওয়ায় এবং SO₄²⁻ এবং OH⁻ আয়ন দুটির মধ্যে OH⁻ আয়নের গাঢ়ত্ব দ্রবণে বেশি থাকায় OH⁻ আয়ন অ্যানোডে ইলেকট্রন বর্জন করে নিস্তড়িৎ OH মূলকে পরিণত হয়। SO₄²⁻ আয়ন ইলেকট্রন বর্জন করতে পারে না। 4টি করে OH মূলক যুক্ত হয়ে জল এবং O₂ উৎপন্ন করে।
ক্যাথোড বিক্রিয়া – H⁺ + e⁻ → H; H + H → H₂
অ্যানোড বিক্রিয়া – OH⁻ – e⁻ → OH; 4OH → 2H₂O + O₂
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বিষয়ের একটি অত্যন্ত গুরুত্বপূর্ণ প্রশ্ন — “Pt তড়িৎদ্বারের সাহায্যে লঘু H₂SO₄ -এর জলীয় দ্রবণের তড়িৎবিশ্লেষণে ক্যাথোড এবং অ্যানোডে কী কী উৎপন্ন হয় তা ব্যাখ্যা করো। অথবা, লঘু H₂SO₄ মিশ্রিত জলের তড়িৎবিশ্লেষণ করলে অ্যানোডে SO₄²⁻ আয়ন ইলেকট্রন বর্জন করে না কেন?” — নিয়ে আলোচনা করেছি। এই প্রশ্নটি মাধ্যমিক ভৌতবিজ্ঞানের অষ্টম অধ্যায় “পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” -এর “তড়িৎপ্রবাহ ও রাসায়নিক বিক্রিয়া” অংশ থেকে নেওয়া হয়েছে। মাধ্যমিক পরীক্ষা এবং বিভিন্ন চাকরির পরীক্ষায় এই প্রশ্নটি প্রায়ই আসে, তাই এটি শিক্ষার্থীদের জন্য বিশেষভাবে গুরুত্বপূর্ণ। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা থাকলে, আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন।






Leave a Comment