আজকের আর্টিকেলে আমরা নবম শ্রেণীর ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “অ্যাসিড, ক্ষার, লবণ” থেকে সহজ ও সংক্ষিপ্ত প্রশ্ন-উত্তর শেয়ার করবো। এই প্রশ্নগুলো নবম শ্রেণির ইউনিট টেস্ট থেকে বার্ষিক পরীক্ষা এর জন্য যেমন গুরুত্বপূর্ণ, তেমনি চাকরি বা বিভিন্ন প্রতিযোগিতার পরীক্ষাতেও কাজে লাগবে। এই অধ্যায় থেকে স্কুল পরীক্ষা থেকে শুরু করে চাকরির পরীক্ষায় প্রায়ই প্রশ্ন আসে, তাই এই প্রশ্নোত্তরগুলো সবাইকে সাহায্য করবে। প্রতিটি প্রশ্নের উত্তর সহজ ভাষায় লেখা হয়েছে, যাতে সবাই বুঝতে পারেন। পড়ার শেষে এই অধ্যায়ের মুখ্য বিষয়গুলো আপনার আয়ত্তে চলে আসবে এবং যেকোনো পরীক্ষায় আত্মবিশ্বাসের সঙ্গে লিখতে পারবেন।

জ্ঞানমূলক প্রশ্নোত্তর
আরহেনিয়াসের আয়নীয় তত্ত্ব অনুসারে উদাহরণসহ অ্যাসিড ও ক্ষারকের সংজ্ঞা দাও।
অ্যাসিড (Acid) – যেসব হাইড্রোজেনঘটিত যৌগ জলীয় দ্রবণে বিয়োজিত হয়ে ক্যাটায়নরূপে শুধুমাত্র H+ আয়ন দেয়, তাদের অ্যাসিড বলে। যেমন – HCl, H2SO4, HNO3 ইত্যাদি হল অ্যাসিড।
\(HCl\rightleftharpoons H^++Cl^-\)
\(H_2SO_4\rightleftharpoons2H^++SO_4^{2-}\)
\(HNO_4\rightleftharpoons H^++NO_3^-\)

ক্ষারক (Base) – যেসব ধাতব অক্সাইড বা হাইড্রক্সাইড জলীয় দ্রবণে বিয়োজিত হয়ে OH– (হাইড্রক্সিল) আয়ন দেয় এবং OH– আয়ন ব্যতীত অন্য কোনো অ্যানায়ন উৎপন্ন করে না, তাদের ক্ষারক বলে। যেমন – Na2O, MgO, CaO ইত্যাদি।
Na2O + H2O ⇌ 2NaOH
NaOH ⇌ Na+ + OH–
MgO + H2O = Mg(OH)2
Mg(OH)2 ⇌ Mg2+ + 2OH–
CaO + H2O = Ca(OH)2
Ca(OH)2 ⇌ Ca2+ + 2OH–
আরহেনিয়াসের আয়নীয় তত্ত্বের সীমাবদ্ধতা উল্লেখ করো।
আরহেনিয়াসের তত্ত্বের সীমাবদ্ধতা –
- আরহেনিয়াসের অ্যাসিড ও ক্ষারক সম্বন্ধীয় তত্ত্ব কেবল জলীয় দ্রবণের ক্ষেত্রেই সীমাবদ্ধ। জল ভিন্ন অন্য দ্রাবকে যৌগের অ্যাসিড ও ক্ষারকীয় ধর্মের ব্যাখ্যা এই তত্ত্ব দিতে পারে না।
- আরহেনিয়াস তত্ত্বে কেবল ধাতব হাইড্রক্সাইডগুলিকেই ক্ষারক আখ্যা দেওয়া হয়েছে। ধাতব অক্সাইডগুলির ক্ষারকীয় ধর্মের কোনো ব্যাখ্যা দেওয়া হয়নি।
- আম্লিক অক্সাইডগুলি ক্ষারের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে, কিন্তু H+ আয়ন মুক্ত করে না, এই ঘটনা সম্বন্ধে কোনো ব্যাখ্যা এই তত্ত্ব দিতে পারে না।
2NaOH + CO2 = Na2CO3 + H2O
অপরদিকে, NH3 -এর মতো যৌগগুলি অ্যাসিডের সঙ্গে বিক্রিয়া করে লবণ গঠন করে, কিন্তু OH– আয়ন মুক্ত করে না এই সম্বন্ধেও কোনো ব্যাখ্যা আরহেনিয়াসের তত্ত্ব দিতে পারে না।
NH3 + HCl = NH4Cl
ক্ষার কাকে বলে? উদাহরণ দাও।
ক্ষার (Alkali) – যেসব ধাতব অক্সাইড বা হাইড্রক্সাইড জলে দ্রবীভূত হয়, তাদের ক্ষার বলে। এরা অ্যাসিডের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে এবং লাল লিটমাসের বর্ণকে নীল করে। যেমন – পটাশিয়াম হাইড্রক্সাইড (KOH), ক্যালশিয়াম হাইড্রক্সাইড [Ca(OH)2], সোডিয়াম হাইড্রক্সাইড (NaOH)।
অধ্যাপক আশিস সিদ্ধান্ত ও সুবীর রায় রচিত অ্যাসিড ও ক্ষার চিহ্নিত করার সহজ উপায় –
লিটমাসের ক্ষেত্রে,
acid │ base
red │blue
লুইস ক্ষারক কাকে বলে?
লুইস ক্ষারক যে-সমস্ত অণু, আয়ন বা পরমাণুপুঞ্জ ইলেকট্রন জোড় দান করতে পারে, বিজ্ঞানী লুইসের তত্ত্ব অনুযায়ী তাদেরকে লুইস ক্ষারক বলা হয়।
যেমন – NH3, PH3, OH–, Cl– ইত্যাদি।
লুইস অ্যাসিড কাকে বলে?
লুইস অ্যাসিড – যেসব পরমাণু, অণু বা আয়ন ইলেকট্রন জোড় গ্রহণ করতে পারে, তাদের লুইস অ্যাসিড বলে। যেমন – H+, S, BF3 ইত্যাদি।
অ্যাসিড ও ক্ষারকের সাধারণ ধর্মগুলি উল্লেখ করো।
অ্যাসিডের ধর্ম (Properties of Acid) –
- অ্যাসিড জলীয় দ্রবণে আয়নিত হয়ে এক বা একাধিক H+ আয়ন দেয়।
- এটি ক্ষার বা ক্ষারকের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে।
- এটি নীল লিটমাসের বর্ণকে লাল করে।
- অ্যাসিড স্বাদে টক হয়।
- অ্যাসিডের জলীয় দ্রবণ তড়িৎ পরিবহণ করে।
- অ্যাসিড হাইড্রোজেন অপেক্ষা বেশি তড়িৎ ধনাত্মক ধাতুর সঙ্গে বিক্রিয়ায় H2 মুক্ত করে। বাইকার্বনেট ও কার্বনেট ঘটিত লবণের সঙ্গে বিক্রিয়ায় CO2 উৎপন্ন করে।
ক্ষারকের ধর্ম (Properties of Base) –
- ক্ষারক জলে দ্রবীভূত হয়ে শুধুমাত্র এক বা একাধিক OH– আয়ন দেয়।
- ক্ষারক স্বাদে কষাটে হয়।
- এটি অ্যাসিডের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে।
- ক্ষারকের জলীয় দ্রবণে লাল লিটমাস দিলে নীল বর্ণ ধারণ করে।
- ক্ষারকের জলীয় দ্রবণ পিচ্ছিল হয়।
- তীব্র ক্ষার কার্বন ডাইঅক্সাইড গ্যাসকে শোষণ করে কার্বনেট লবণ উৎপন্ন করে।
অ্যাসিড ও ক্ষারের ধর্মে জলীয় মাধ্যমের গুরুত্ব উদাহরণসহ লেখো।
অ্যাসিড ও ক্ষারের ধর্মে জলীয় মাধ্যমের গুরুত্ব –
জলীয় দ্রবণে অ্যাসিড অণুগুলি আয়নিত হয়ে হাইড্রোজেন আয়ন (বা প্রোটন) উৎপন্ন করে। জলীয় দ্রবণে H+ আয়নের অস্তিত্ব থাকে না। অতি ক্ষুদ্র H+ আয়ন জলের অণুর অক্সিজেন পরমাণুতে উপস্থিত ঋণাত্মক আধানবিশিষ্ট নিঃসঙ্গ ইলেকট্রন জোড়কে আকর্ষণ করে হাইড্রক্সোনিয়াম আয়ন (H3O+) গঠন করে। এই হাইড্রক্সোনিয়াম আয়ন দ্রবণে স্বাধীনভাবে থাকতে পারে।
HCl + H2O ⇌ H3O+ + Cl–
জলীয় মাধ্যম ছাড়া অন্য দ্রাবকে এই H3O+ আয়ন গঠিত হয় না। তাই অ্যাসিডগুলি অ্যাসিড ধর্ম প্রদর্শন করে না। যখন অনার্দ্র নীল লিটমাস কাগজ অনার্দ্র হাইড্রোজেন ক্লোরাইড গ্যাসের সংস্পর্শে রাখা হয়, তখন কোনো বর্ণের পরিবর্তন হয় না। কিন্তু আর্দ্র নীল লিটমাস কাগজ HCl (g) -এর সংস্পর্শে রাখলে লাল হয়ে যায়। ক্ষার জলীয় মাধ্যমে আয়নিত হয়ে OH– আয়ন উৎপন্ন করে।
\(NaOH\left(s\right)+H_2O\rightleftharpoons Na^+\left(aq\right)+OH^-\left(aq\right)\\\)
\(NH_3\left(g\right)+H_2O\rightleftharpoons Na_4^+\left(aq\right)+OH^-\left(aq\right)\)
টারটারিক অ্যাসিড কেলাস ও সোডিয়াম বাইকার্বনেটের মিশ্রণে জল যোগ করলে কী হবে তা সমীকরণসহ ব্যাখ্যা করো।
টারটারিক অ্যাসিডের কেলাস ও সোডিয়াম বাইকার্বনেটের মিশ্রণে জল যোগ করলে কার্বন ডাইঅক্সাইড গ্যাসের বুদ্বুদ উৎপন্ন হয়। এই গ্যাসকে স্বচ্ছ চুনজলে চালনা করলে স্বচ্ছ চুনজল ঘোলা হয়ে যায়।
জৈব অ্যাসিড ও অজৈব অ্যাসিড বা খনিজ অ্যাসিড কাকে বলে? উদাহরণ দাও।
জৈব অ্যাসিড (Organic Acid) – কার্বন পরমাণুযুক্ত যেসব অ্যাসিড উদ্ভিদ বা প্রাণীদেহ থেকে পাওয়া যায় তাদের জৈব অ্যাসিড বলে। যেমন – লেবুতে উপস্থিত সাইট্রিক অ্যাসিড, পিঁপড়ের হুলে উপস্থিত ফরমিক অ্যাসিড ও দইতে উপস্থিত ল্যাকটিক অ্যাসিড ইত্যাদি।
অজৈব অ্যাসিড (Inorganic Acid) বা খনিজ অ্যাসিড (Minearal Acid) – যেসব অ্যাসিডকে অজৈব বা খনিজ পদার্থ থেকে প্রস্তুত করা হয়, তাদের অজৈব বা খনিজ অ্যাসিড বলা হয়। যেমন – সালফার থেকে সালফিউরিক অ্যাসিড, নাইটার থেকে নাইট্রিক অ্যাসিড, ক্লোরাইড লবণ থেকে হাইড্রোক্লোরিক অ্যাসিড তৈরি হয়। সালফার, নাইটার, ক্লোরাইড লবণ প্রভৃতি খনি থেকে পাওয়া যায় বলে এই অ্যাসিডগুলিকে খনিজ অ্যাসিডও বলা হয়।
হাইড্রাসিড ও অক্সি অ্যাসিড কাকে বলে? উদাহরণ দাও।
হাইড্রাসিড (Hydracid) – যে-সমস্ত অ্যাসিডের অণুতে অক্সিজেন থাকে না, হাইড্রোজেন এবং অন্য কোনো অধাতব মৌল বা মূলক থাকে, তাদের হাইড্রাসিড বলে। যেমন – হাইড্রোক্লোরিক অ্যাসিড (HCl), হাইড্রোব্রোমিক অ্যাসিড (HBr), হাইড্রোআয়োডিক অ্যাসিড (HI), হাইড্রোফ্রওরিক অ্যাসিড (HF) ইত্যাদি।
অক্সি অ্যাসিড (Oxy Acid) – যেসব অ্যাসিডের অণুর অ্যানায়ন অংশে এক বা একাধিক অক্সিজেন পরমাণু বর্তমান, তাদেরকে অক্সি অ্যাসিড বলে। অক্সি অ্যাসিডে হাইড্রোজেনের সঙ্গে অক্সিজেন ও কমপক্ষে অপর একটি মৌল উপস্থিত থাকে। যেমন – নাইট্রিক অ্যাসিড (HNO3), নাইট্রাস অ্যাসিড (HNO2), সালফিউরাস অ্যাসিড (H2SO3), সালফিউরিক অ্যাসিড (H2SO4), ফসফরিক অ্যাসিড (H2PO4) ইত্যাদি।
পার অ্যাসিড কাকে বলে?
যে-সমস্ত অ্যাসিডের অণুতে আমিক পারঅক্সো (-O-O-H) গ্রুপ উপস্থিত থাকে, তাদেরকে পার অ্যাসিড বলে।
অন্যভাবে বলা যায়, যে-সমস্ত অজৈব অক্সি অ্যাসিডের অ্যানায়ন অংশে অক্সিজেন ব্যতীত অন্য মৌল অর্থাৎ, কেন্দ্রীয় পরমাণু তার সর্বোচ্চ জারণ স্তরে অবস্থান করে, তাকে পার অ্যাসিড বলে।
অন্যান্য অক্সি অ্যাসিডের (যেমন – আস্ অ্যাসিড বা ইক্ অ্যাসিড বা হাইপো অ্যাসিড) তুলনায় পার অ্যাসিডে অক্সিজেন পরমাণুর সংখ্যা তুলনামূলকভাবে বেশি থাকে।
অজৈব পার অ্যাসিড ও জৈব পার অ্যাসিডের উদাহরণ।
অজৈব পার অ্যাসিড – পারঅক্সি মনোসালফিউরিকঅ্যাসিড (H2SO5)
\(H-O-\overset{\underset\Arrowvert O}{\underset{\overset\Arrowvert O}S}-O-O-H\)জৈব পার অ্যাসিড – পারঅক্সিট্রাইফ্লুওরো অ্যাসিটিক অ্যাসিড (CF3CO3H)
\(CF_3-\overset{\underset\Arrowvert O}C-O-O-H\)জারক অ্যাসিড ও অজারক অ্যাসিড কাকে বলে? উদাহরণ দাও।
জারক অ্যাসিড (Oxidant Acid) – যে-সমস্ত অ্যাসিডের জারণ ক্ষমতা আছে এবং বিক্রিয়া করার সময় জায়মান অক্সিজেন উৎপন্ন করে, তাকে জারক অ্যাসিড বলে। যেমন – নাইট্রিক অ্যাসিড (HNO3), সালফিউরিক অ্যাসিড (H2SO4) ইত্যাদি।
অজারক অ্যাসিড (Non-oxidant Acid) – যে-সমস্ত অ্যাসিডের জারণ ক্ষমতা নেই এবং বিয়োজিত হয়ে জায়মান অক্সিজেন উৎপন্ন করে না, তাদের অজারক অ্যাসিড বলে। যেমন – হাইড্রোক্লোরিক অ্যাসিড, লঘু সালফিউরিক অ্যাসিড, হাইড্রোব্রোমিক অ্যাসিড, হাইড্রোআয়োডিক অ্যাসিড।
উষ্ণ ও গাঢ় H2SO4 -এর ভূমিকা কী এবং এটি কার্বনের সাথে কীভাবে বিক্রিয়া করে কার্বন ডাইঅক্সাইড উৎপন্ন করে? রাসায়নিক সমীকরণসহ ব্যাখ্যা কর।
উষ্ণ ও গাঢ় H2SO4 বিয়োজিত হয়ে জায়মান অক্সিজেন উৎপন্ন করে।
2H2SO4 = 2H2O + 2SO2 + 2[O]
C + 2[O] = CO2
_________________________________________
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
এক্ষেত্রে গাঢ় H2SO4 কার্বনকে জারিত করে কার্বন ডাইঅক্সাইডে পরিণত করে।
গাঢ় নাইট্রিক অ্যাসিডের জারণ ধর্ম কীভাবে প্রমাণ করা যায়?
গাঢ় HNO3 সহজেই বিশ্লিষ্ট হয়ে নাইট্রোজেন ডাইঅক্সাইড, জল এবং জায়মান অক্সিজেন উৎপন্ন করে। এই জায়মান অক্সিজেন HNO3 -এর জারণ ধর্মের জন্য দায়ী।
2HNO3 = H2O + 2NO2 + [O]
H2S + [O] = H2O + S
_________________________________________
2HNO3 + H2S = 2H2O + 2NO2 + S
এক্ষেত্রে হাইড্রোজেন সালফাইড নাইট্রিক অ্যাসিড দ্বারা জারিত হয়ে হলুদ বর্ণের সালফারে পরিণত হয়।
বিভিন্ন প্রকার অ্যাসিডের উৎস ও সংকেত লেখো।
অ্যাসিটিক অ্যাসিড
- উৎস – ভিনিগার
- সংকেত – CH3COOH
ফরমিক অ্যাসিড
- উৎস – মৌমাছি ও পিঁপড়ের হুলে
- সংকেত – HCOOH
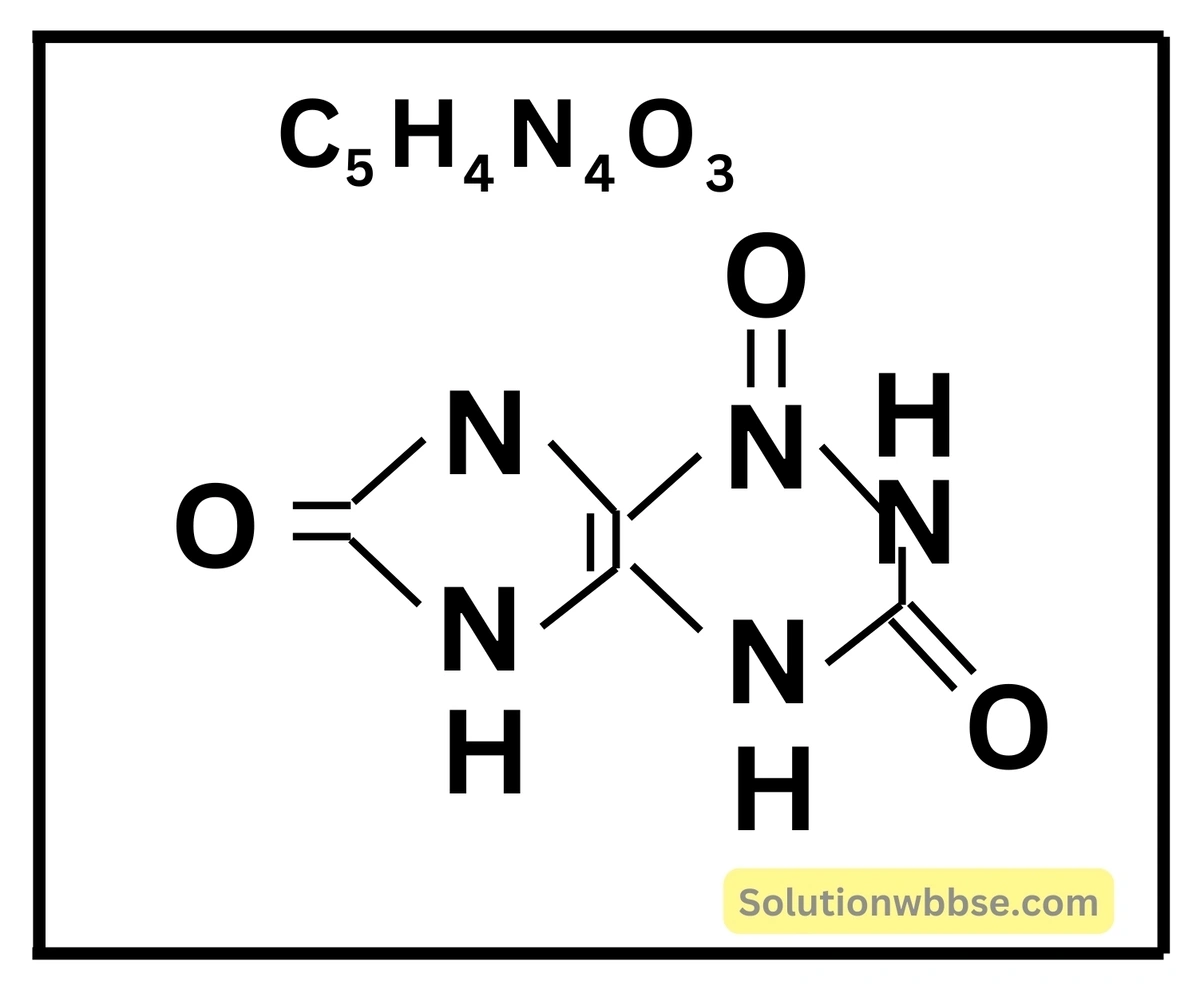
ইউরিক অ্যাসিড
- উৎস – মুত্র
- সংকেত –
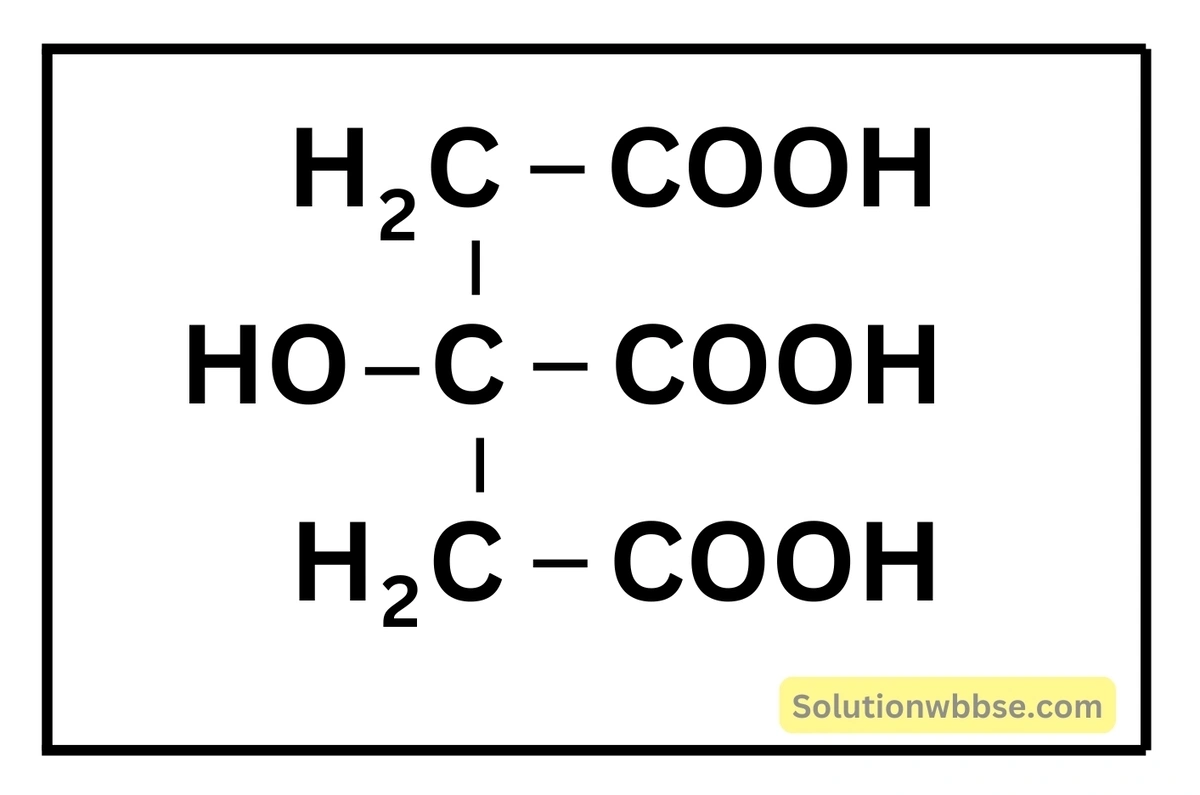
সাকসিনিক অ্যাসিড
- উৎস – আঙুরের রস
- সংকেত – (CH2COOH)2
ওলেইক অ্যাসিড
- উৎস – অলিভ অয়েল
- সংকেত – C18H34COOH
ফসফরিক অ্যাসিড
- উৎস – পিঁপড়ের হুল
- সংকেত – H3PO4
ম্যালিক অ্যাসিড
- উৎস – আপেল
- সংকেত – \(HOOC-CH_2-\underset{\underset{OH}┃}CH-COOH\)
স্টিয়ারিক অ্যাসিড
- উৎস – ফ্যাট বা চর্বি
- সংকেত – C17H35COOH
হাইড্রোক্লোরিক অ্যাসিড
- উৎস – পাকস্থলী
- সংকেত – HCl
সাইট্রিক অ্যাসিড
- উৎস – লেবু জাতীয় ফল
- সংকেত –
ল্যাকটিক অ্যাসিড
- উৎস – দুধ বা দই
- সংকেত – \(H_3C-\underset{\underset{OH}┃}{\overset{\overset H┃}C}-COOH\)
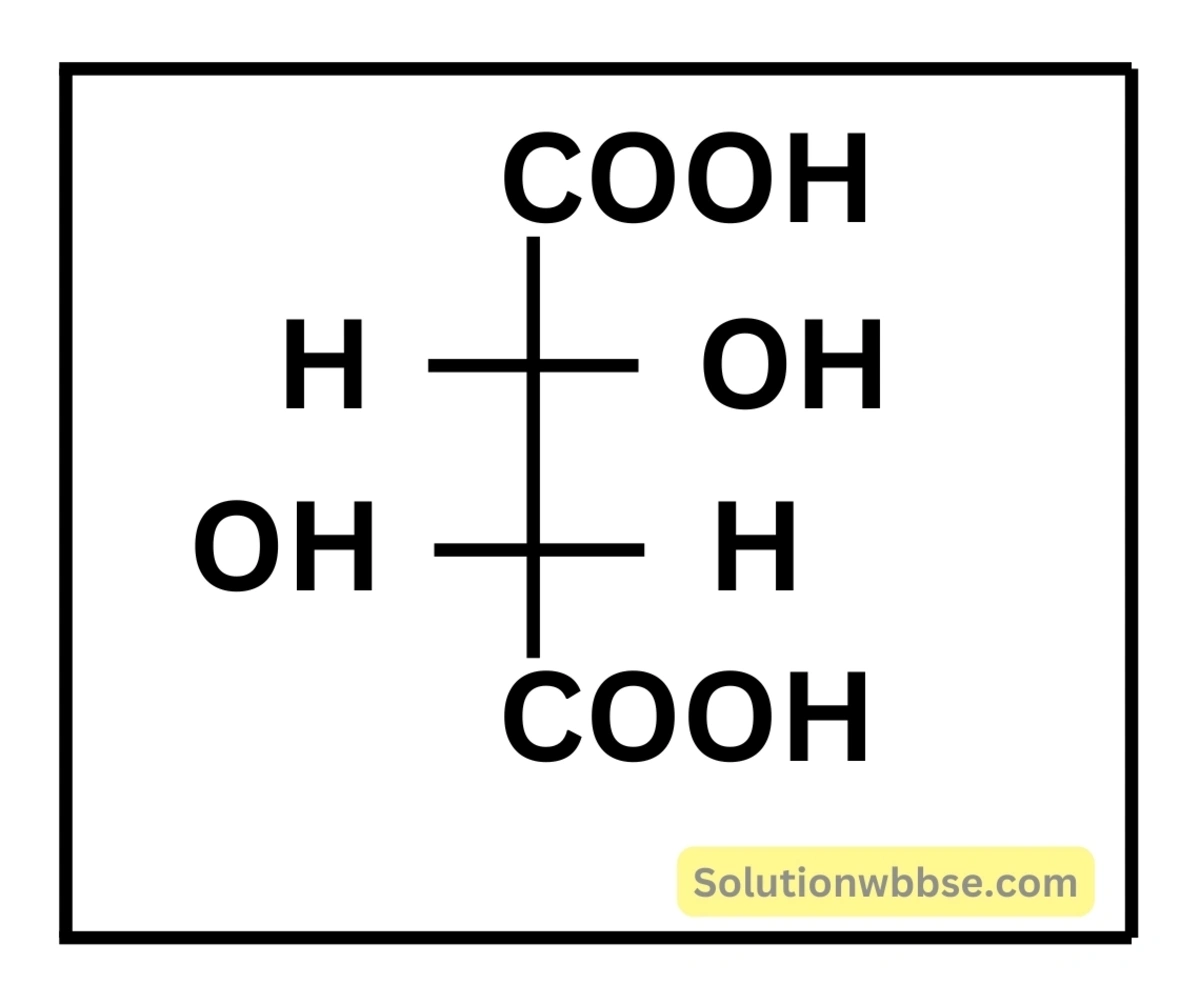
টারটারিক অ্যাসিড
- উৎস – তেঁতুল
- সংকেত –
পামিটিক অ্যাসিড
- উৎস – ফ্যাট বা চর্বি
- সংকেত – C15H31COOH
আয়নীভবন বলতে কী বোঝায়?
আয়নীভবন (Ionization) – কোনো তড়িদবিশ্লেষ্য পদার্থ বা অ্যাসিড বা ক্ষারের গলিত অবস্থায় বা জলে দ্রবীভূত অবস্থায় অথবা কোনো উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় তার উপাদান আয়নে বিয়োজিত হওয়ার ঘটনাকে আয়নীভবন বলা হয়।
আয়নীভবনের ভিত্তিতে অ্যাসিড ও ক্ষার কত প্রকার ও কী কী? প্রত্যেক প্রকারের উদাহরণসহ সংজ্ঞা দাও।
অ্যাসিড ও ক্ষারের প্রকারভেদ – আয়নীভবনের ভিত্তিতে অ্যাসিড ও ক্ষারকে দুই ভাগে ভাগ করা যায়, যথা – তীব্র অ্যাসিড ও মৃদু অ্যাসিড এবং তীব্র ক্ষার ও মৃদু ক্ষার।
তীব্র অ্যাসিড (Strong Acid) – যেসব অ্যাসিড জলীয় দ্রবণে প্রায় সম্পূর্ণরূপে বিয়োজিত হয় এবং প্রচুর মাত্রায় হাইড্রক্সোনিয়াম আয়ন উৎপন্ন করে, তাদের তীব্র অ্যাসিড বলে।
HCl + H2O ⇌ H3O+ + Cl–, H+ + H2O ⇌ H3O+
যেমন – সালফিউরিক অ্যাসিড (H2SO4), হাইড্রোক্লোরিক অ্যাসিড (HCl) ইত্যাদি।
মৃদু অ্যাসিড (Weak Acid) – যেসব অ্যাসিড জলীয় দ্রবণে আংশিকভাবে বিয়োজিত হয়ে অল্প মাত্রায় H3O+ আয়ন উৎপন্ন করে এবং বেশিরভাগ অণুই অবিয়োজিত অবস্থায় থাকে, তাদের মৃদু অ্যাসিড বলে। যেমন – অ্যাসিটিক অ্যাসিড (CH3COOH), ফরমিক অ্যাসিড (HCOOH) ইত্যাদি।
তীব্র ক্ষার (Strong Base) – যে ক্ষারের বেশিরভাগ অণুই জলীয় দ্রবণে আয়নিত হয়ে অধিক পরিমাণ OH– (হাইড্রক্সিল) আয়ন উৎপন্ন করে এবং খুব কম সংখ্যক অণু আণবিক অবস্থায় থাকে, সেই ক্ষারকে তীব্র ক্ষার বলে। উদাহরণ – NaOH, KOH, Ca(OH)2 প্রভৃতি তীব্র ক্ষার।
NaOH ⇌ Na+ + OH–
মৃদু ক্ষার (Weak Base) – যে ক্ষারের বেশিরভাগ অণু জলীয় দ্রবণে আণবিক অবস্থায় থাকে, খুব কম সংখ্যক অণু আয়নিত হয়ে কম সংখ্যক OH– আয়ন উৎপন্ন করে, সেই ক্ষারকে মৃদু ক্ষার বলে। উদাহরণ – NH2OH, Cu(OH)2, Ba(OH)2 প্রভৃতি মৃদু ক্ষার।
\(NH_4OH\rightleftharpoons NH_4^++OH^-\)
নিম্নলিখিত যৌগগুলিকে তীব্র ও মৃদু অ্যাসিড ও ক্ষারের ভিত্তিতে পৃথক করো – H3PO4, H2SO4, Ca(OH)2, CH3COOH, HCN, NH4OH, HClO4, NaOH।
তীব্র অ্যাসিড – H2SO4, HClO4
তীব্র ক্ষার – Ca(OH)2, NaOH
মৃদু অ্যাসিড – H3PO4, CH3COOH, HCN
মৃদু ক্ষার – NH4OH
নিম্নলিখিত ক্ষারকগুলির মধ্যে ক্ষারকে চিহ্নিত করো – Fe(OH)3, NaOH, Ca(OH)2, Αl(ΟΗ)3, Κ2Ο।
প্রদত্ত ক্ষারকগুলির মধ্যে NaOH ও Ca(OH)2 হল ক্ষার কারণ – এরা জলে দ্রাব্য।
অ্যাসিড কয় প্রকার ও কী কী?
অ্যাসিডের ক্ষারগ্রাহিতার সংজ্ঞা দাও।
অ্যাসিডের ক্ষারগ্রাহিতা (Basicity of acid) – কোনো অ্যাসিডের অণুতে উপস্থিত প্রতিস্থাপনযোগ্য হাইড্রোজেন পরমাণুর সংখ্যাকে ওই অ্যাসিডের ক্ষারগ্রাহিতা বলা হয়। যেমন – HCl -এর ক্ষারগ্রাহিতা 1, H2SO4 -এর ক্ষারগ্রাহিতা 2, H3PO4 -এর ক্ষারগ্রাহিতা 3।
ক্ষারগ্রাহিতা অনুযায়ী অ্যাসিড কত প্রকার? এদের উদাহরণসহ সংজ্ঞা দাও।
অথবা , এক-ক্ষারীয় অ্যাসিড, দ্বি-ক্ষারীয় অ্যাসিড এবং ত্রি-ক্ষারীয় অ্যাসিড বলতে কী বোঝায়? উদাহরণ দাও।
ক্ষারগ্রাহিতা অনুযায়ী অ্যাসিড প্রধানত তিন প্রকার, যথা –
- এক-ক্ষারীয় অ্যাসিড,
- দ্বি-ক্ষারীয় অ্যাসিড,
- ত্রি-ক্ষারীয় অ্যাসিড।
এক-ক্ষারীয় অ্যাসিড – যে-সকল অ্যাসিডে একটিমাত্র প্রতিস্থাপনীয় হাইড্রোজেন পরমাণু থাকে, তাদের এক-ক্ষারীয় অ্যাসিড বলে। যেমন – HCl, HF, HBr, HI ইত্যাদি।
দ্বি-ক্ষারীয় অ্যাসিড – যে-সকল অ্যাসিডের একটি অণুতে দুটি প্রতিস্থাপনযোগ্য হাইড্রোজেন পরমাণু থাকে, তাদের দ্বি-ক্ষারীয় অ্যাসিড বলে। যেমন – H2SO4, H2SO3, H2CO3 ইত্যাদি।
ত্রি-ক্ষারীয় অ্যাসিড – যে-সকল অ্যাসিডের একটি অণুতে তিনটি প্রতিস্থাপনীয় হাইড্রোজেন পরমাণু থাকে, তাকে ত্রি-ক্ষারীয় অ্যাসিড বলে। যেমন – H3PO4।
নিম্নলিখিত অ্যাসিডগুলি থেকে এক-ক্ষারীয়, দ্বি-ক্ষারীয়, ত্রি-ক্ষারীয় ও চতুঃক্ষারীয় অ্যাসিডগুলিকে পৃথক পৃথক ভাবে বেছে নিয়ে লেখো – C3H2(OH)3(COOH)3, H2SO4, H3PO2, H3PO4, H4SiO4, H3PO3, H4P2O7, C6H5OH।
এক-ক্ষারীয় অ্যাসিড – H3PO2. C6H5OH
দ্বি-ক্ষারীয় অ্যাসিড – H2SO4, H3PO3
ত্রি-ক্ষারীয় অ্যাসিড – H3PO4 এবং C3H2(OH)3(COOH)3
চতুঃক্ষারীয় অ্যাসিড – H4SiO4, H4P2O7।
ক্ষারের অম্লগ্রাহিতা বলতে কী বোঝায়?
ক্ষারের অল্পগ্রাহিতা (Acidity of base) – জলীয় দ্রবণে ক্ষারের একটি অণু বিয়োজিত হয়ে যত সংখ্যক OH– আয়ন উৎপন্ন করে, তাকে ওই ক্ষারের অম্লগ্রাহিতা বলে। যেমন – NaOH -এর অম্লগ্রাহিতা 1, Ca(OH)2 -এর অম্লগ্রাহিতা 2। –
অম্লগ্রাহিতা অনুযায়ী ক্ষার কত প্রকার ও কী কী? প্রত্যেক প্রকারের উদাহরণসহ সংজ্ঞা দাও।
অম্লগ্রাহিতা অনুযায়ী ক্ষার তিন প্রকার। যথা –
- এক-আম্লিক ক্ষার,
- দ্বি-আম্লিক ক্ষার,
- ত্রি-আম্লিক ক্ষার।
এক-আম্লিক ক্ষার – যে-সকল ক্ষার জলীয় দ্রবণে বিয়োজিত হয়ে একটি মাত্র OH– আয়ন দেয়, তাদের এক-আম্লিক ক্ষার বলে। যেমন – NaOH, KOH, NH4OH ইত্যাদি।
দ্বি-আম্লিক ক্ষার – যে-সকল ক্ষার জলীয় দ্রবণে বিয়োজিত হয়ে দুটি OH– আয়ন দেয়, তাদের দ্বি-আম্লিক ক্ষার বলে। যেমন – Ca(OH)2, Mg(OH)2, Zn(OH)2 ইত্যাদি।
ত্রি-আম্লিক ক্ষার – যে-সকল ক্ষার জলীয় দ্রবণে বিয়োজিত হয়ে তিনটি OH– আয়ন দেয়, তাদের ত্রি-আম্লিক ক্ষার বলে। যেমন – Fe(OH)3, Al(OH)3 ইত্যাদি।
সামুদ্রিক অ্যাসিড বা মিউরিয়েটিক অ্যাসিড কী? এর সংকেত লেখো।
সামুদ্রিক অ্যাসিড বা মিউরিয়েটিক অ্যাসিড হল হাইড্রোক্লোরিক অ্যাসিড। মিউরিয়েটিক কথার অর্থ হল ‘সামুদ্রিক’। 1772 খ্রিস্টাব্দে বিজ্ঞানী প্রিস্টলি সামুদ্রিক লবণ থেকে হাইড্রোজেন ক্লোরাইড প্রস্তুত করেন এবং এই হাইড্রোজেন ক্লোরাইড জলে দ্রবীভূত হয়ে উৎপন্ন হাইড্রোক্লোরিক অ্যাসিডের নাম দেন মিউরিয়েটিক অ্যাসিড বা সামুদ্রিক অ্যাসিড। এর সংকেত HCl।
একটি গ্যাস ভরতি জারে হাইড্রোক্লোরিক অ্যাসিডে সিক্ত একটি কাচদণ্ড প্রবেশ করানো হল। একটি সাদা ধোঁয়ার সৃষ্টি হল। জারের গ্যাসটি কী? সাদা ধোঁয়া কোন্ যৌগের? সমীকরণ দাও।
একটি গ্যাস ভরতি জারে হাইড্রোক্লোরিক অ্যাসিডে সিক্ত একটি কাচদণ্ড প্রবেশ করালে সাদা ধোঁয়া উৎপন্ন হয়। জারের গ্যাসটি হল অ্যামোনিয়া (NH3)। সাদা ধোঁয়াটি হল অ্যামোনিয়াম ক্লোরাইডের (NH4Cl)।
HCl (g) + NH3 (g) → NH4Cl (সাদা ধোঁয়া)
অক্সিজেনের উপস্থিতিতে কপার ধাতুর সঙ্গে গাঢ় হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়ায় কী উৎপন্ন হয়, সমতাযুক্ত সমীকরণসহ লেখো।
তড়িৎ-রাসায়নিক শ্রেণিতে হাইড্রোজেনের নীচে অবস্থান করার জন্য কপার সাধারণ অবস্থায় হাইড্রোক্লোরিক অ্যাসিডের সঙ্গে বিক্রিয়া করে না। কিন্তু অক্সিজেনের উপস্থিতিতে গাঢ় ও উত্তপ্ত হাইড্রোক্লোরিক অ্যাসিডের সঙ্গে কপার ধীরে ধীরে বিক্রিয়া করে কিউপ্রিক ক্লোরাইড (CuCl2) এবং জল উৎপন্ন করে।
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
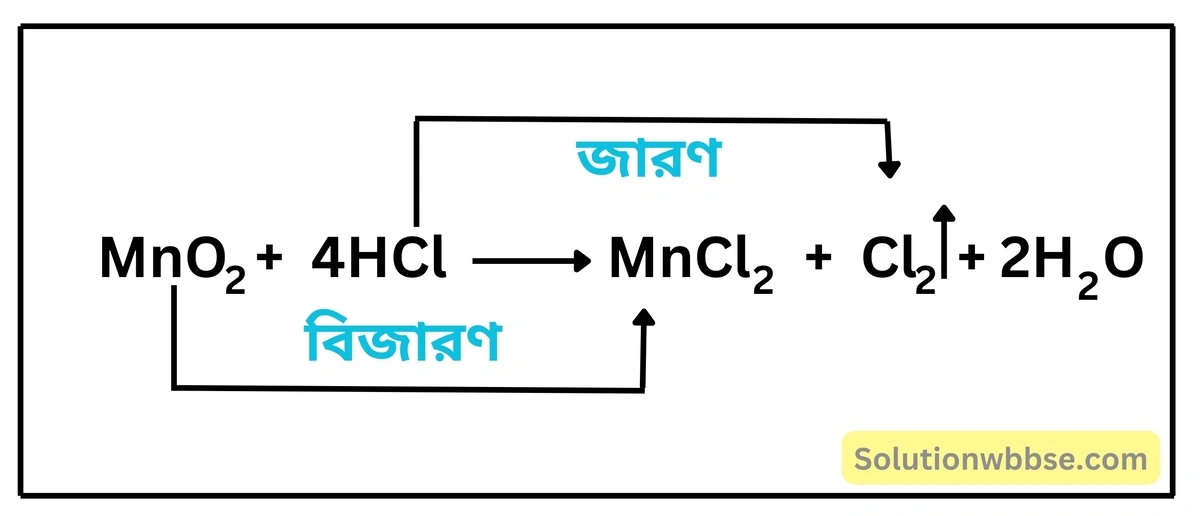
HCl -এর বিজারণ ধর্মের উদাহরণ দাও।
HCl -এর বিজারণ ধর্ম – কালো বর্ণের ম্যাঙ্গানিজ ডাইঅক্সাইড (MnO2) -এর সঙ্গে গাঢ় HCl মিশিয়ে উত্তপ্ত করলে HCl, ম্যাঙ্গানিজ ডাইঅক্সাইডকে ম্যাঙ্গানাস ক্লোরাইডে (MnCl2) বিজারিত করে এবং নিজে জারিত হয়ে সবুজাভ হলুদ বর্ণের ক্লোরিন গ্যাস (Cl2) উৎপন্ন করে। এর দ্বারা প্রমাণিত হয় HCl -এর বিজারণ ধর্ম আছে। অর্থাৎ, এটি একটি বিজারক।
ধাতব কার্বনেটের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়া লেখো।
ধাতব কার্বনেটের সঙ্গে হাইাড্রাক্লোরিক অ্যাসিডের বিক্রিয়া – ধাতব কার্বনেটের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়ায় ওই ধাতুর ক্লোরাইড লবণ, জল এবং বুদ্বুদ সহকারে কার্বন ডাইঅক্সাইড গ্যাস নির্গত হয়।
ধাতব কার্বনেট + HCl → ধাতব ক্লোরাইড + CO2↑ + H2O
যেমন –
ধাতব বাইকার্বনেটের সঙ্গে ধাতব কার্বনেটের বিক্রিয়া লেখো।
ধাতব বাইকার্বনেটের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়া – ধাতব বাইকার্বনেটের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়ায় ধাতব ক্লোরাইড লবণ, কার্বন ডাইঅক্সাইড এবং জল উৎপন্ন হয়।
ধাতব বাইকার্বনেট + HCl → ধাতব ক্লোরাইড + CO2↑ + H2O
যেমন –
ক্ষারের সঙ্গে ধাতব কার্বনেটের বিক্রিয়া লেখো।
ক্ষারের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়া – ক্ষারের সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়ায় ক্লোরাইড লবণ ও জল উৎপন্ন হয়।
যেমন –
ধাতুর সঙ্গে ধাতব কার্বনেটের বিক্রিয়া লেখো।
ধাতুর (Zn, Mg) সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়া – তড়িৎ-রাসায়নিক শ্রেণিতে হাইড্রোজেনের উপরে অবস্থানকারী ধাতু (যেমন – Zn, Mg প্রভৃতি) লঘু হাইড্রোক্লোরিক অ্যাসিড থেকে হাইড্রোজেন প্রতিস্থাপন করে ওই সমস্ত ধাতুর ক্লোরাইড লবণ উৎপন্ন করে।
যেমন –
হাইড্রোক্লোরিক অ্যাসিডকে কীভাবে শনাক্ত করবে?
হাইড্রোক্লোরিক অ্যাসিডের শনাক্তকরণ – হাইড্রোক্লোরিক অ্যাসিডের মধ্যে সিলভার নাইট্রেট (AgNO3) দ্রবণ যোগ করলে অদ্রাব্য সিলভার ক্লোরাইডের সাদা থকথকে অধঃক্ষেপ উৎপন্ন হয়, যা নাইট্রিক অ্যাসিডে (HNO3) অদ্রাব্য কিন্তু অতিরিক্ত অ্যামোনিয়াম হাইড্রক্সাইডে (NH4OH) দ্রাব্য।
হাইড্রোক্লোরিক অ্যাসিডের ব্যবহার লেখো।
হাইড্রোক্লোরিক অ্যাসিডের ব্যবহার –
- চর্মশিল্পে, রঞ্জন শিল্পে HCl ব্যবহৃত হয়।
- স্টার্চ থেকে গ্লুকোজের শিল্পোৎপাদনে HCl ব্যবহৃত হয়।
- ঔষধ, আঠা, সিরাপ, ফটোগ্রাফি সংক্রান্ত রাসায়নিক দ্রব্য প্রস্তুতিতে ব্যবহার করা হয়।
- ক্লোরিন গ্যাস, বিভিন্ন ধাতুর ক্লোরাইড লবণ প্রস্তুতিতে ব্যবহৃত হয়।
- পরীক্ষাগারে বিকারক হিসেবে, অম্লরাজ প্রস্তুতিতে, লোহার ওপর জিংক বা টিনের প্রলেপ দিতে ব্যবহৃত হয়।
অ্যাকোয়া ফর্টিস বা শক্তিশালী জল কী?
অ্যাকোয়া ফর্টিস – অ্যাকোয়া ফর্টিস বা শক্তিশালী জল হল নাইট্রিক অ্যাসিড (HNO3)। বেশিরভাগ ধাতু (ব্যতিক্রম – সোনা, প্ল্যাটিনাম প্রভৃতি বর ধাতু) এবং অধাতু এই অ্যাসিডে দ্রবীভূত হয় বলে এই অ্যাসিডকে অ্যাকোয়া ফর্টিস বা শক্তিশালী জল বা তেজি জল বলে।
ধাতব কার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া লেখো।
ধাতব কার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া – ধাতব কার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়ায় ধাতব নাইট্রেট লবণ, কার্বন ডাইঅক্সাইড এবং জল উৎপন্ন হয়।
ধাতব কার্বনেট + HNO3 → ধাতব নাইট্রেট + CO2↑ + H2O
যেমন –
ধাতব বাইকার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া লেখো।
ধাতব বাইকার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া – ধাতব বাইকার্বনেটের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়ায় ধাতব নাইট্রেট, কার্বন ডাইঅক্সাইড এবং জল উৎপন্ন হয়।
ধাতব বাইকার্বনেট + HNO3 → ধাতব নাইট্রেট + CO2↑ + H2O
ক্ষারের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া লেখো।
ক্ষারের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া – ক্ষারের সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়ায় নাইট্রেট লবণ এবং জল উৎপন্ন হয়।
ক্ষার + HNO3 → নাইট্রেট লবণ + জল
যেমন –
NaOH + HNO3 → NaNO3 + H2O
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
NH4OH + HNO3 → NH4NO3 + H2O
Mg, Zn, Cu -এর সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া লেখো।
ধাতুর সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া – নাইট্রিক অ্যাসিড হল তীব্র আরক অ্যাসিড অর্থাৎ, এটি একাধারে অ্যাসিড হিসেবে যেমন কাজ করে তেমনই জারক পদার্থ হিসেবেও কাজ করে। অ্যাসিড ধর্মের জন্য তড়িৎ-রাসায়নিক শ্রেণিতে হাইড্রোজেনের উপরে অবস্থানকারী ধাতুর সঙ্গে বিক্রিয়ায় নাইট্রেট লবণ ও হাইড্রোজেন গ্যাস উৎপন্ন করে। উৎপন্ন হাইড্রোজেন, অ্যাসিডের জারণ ধর্মের জন্য জারিত হয়ে জলে পরিণত হয় এবং অ্যাসিড নিজে বিজারিত হয়ে গাঢ়ত্ব অনুযায়ী এবং ধাতু বিশেষে নাইট্রোজেনের বিভিন্ন অক্সাইড, অ্যামোনিয়া বা নাইট্রোজেনে পরিণত হয়। সাধারণত গাঢ় অ্যাসিড NO2, মধ্যম গাঢ় অ্যাসিড N2O এবং লঘু অ্যাসিড NO উৎপন্ন করে।
ম্যাগনেশিয়াম ধাতুর সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| অতি লঘু (1%) | শীতল | Mg + 2HNO3 → Mg(NO3)2 + H2↑ |
| লঘু | উষ্ণ | 4Mg + 10HNO3 → 4Mg(NO)2 + N2O↑ (নাইট্রাস অক্সাইড) + 5H2O |
| নাতি গাঢ় ( 1 : 1 ) | শীতল | 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO↑ (নাইট্রিক অক্সাইড) + 4H2О |
| গাঢ় | উষ্ণ | Mg + 4HNO3 → Mg(NO3)2 + 2NO2↑ (নাইট্রোজেন ডাইঅক্সাইড) + 2H2O |
জিংকের (Zn) সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| গাঢ় | উষ্ণ | Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O |
| নাতি গাঢ় ( 1 : 1 ) | শীতল | 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO+ 4H2О |
| লঘু | শীতল | 4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O |
| অতি লঘু | শীতল | 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O |
কপারের (Cu) সঙ্গে নাইট্রিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| গাঢ় | উষ্ণ | Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O |
| নাতি গাঢ় ( 1 : 1 ) | শীতল | 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO+ 4H2О |
| অতি লঘু | শীতল | 4Cu + 10HNO3 → 4Cu(NO3)2 + N2O + 5H2O |
| নাইট্রিক অ্যাসিড বাষ্পের সঙ্গে উত্তপ্ত কপারের বিক্রিয়া | নাইট্রিক অ্যাসিড বাষ্পের সঙ্গে উত্তপ্ত কপারের বিক্রিয়া | 5Cu + 2HNO3 → 5CuO + N2↑+ H2O |
বিক্রিয়াসহ নাইট্রিক অ্যাসিডের জারণ ধর্মের উদাহরণ দাও।
নাইট্রিক অ্যাসিড, একটি শক্তিশালী জারক দ্রব্য।
কপার কুচির সঙ্গে উত্তপ্ত ও গাঢ় নাইট্রিক অ্যাসিড যোগ করলে কপার জারিত হয়ে নীল বর্ণের কিউপ্রিক নাইট্রেটে পরিণত হয় এবং HNO3 নিজে বিজারিত হয়ে বাদামি বর্ণের NO2 গ্যাসে পরিণত হয়।
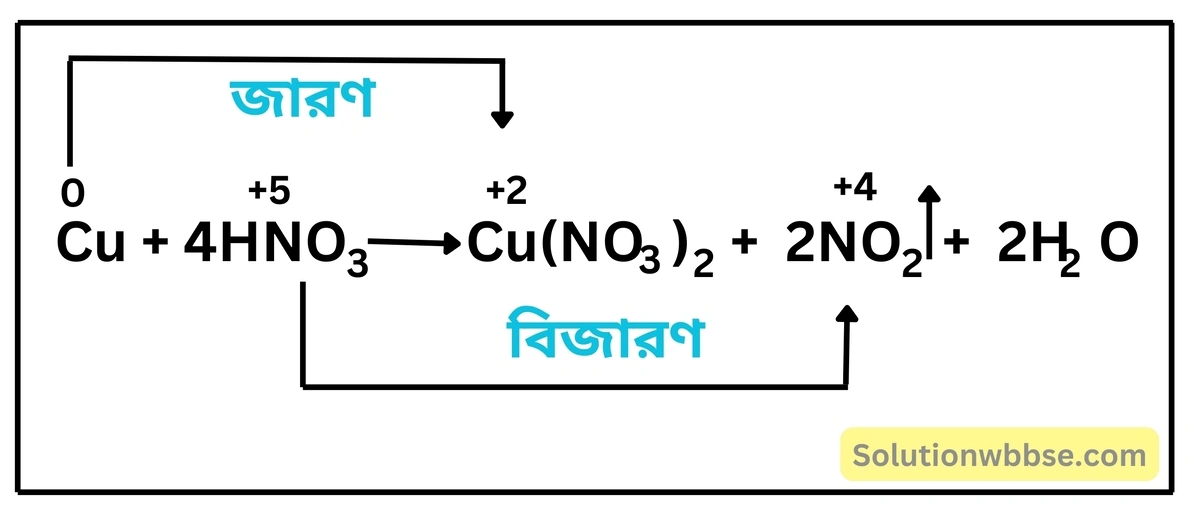
এর দ্বারা প্রমাণিত হয় যে, HNO3 একটি তীব্র জারক অ্যাসিড।
জ্বলন্ত চারকোল (কার্বন) গাঢ় ও উত্তপ্ত নাইট্রিক অ্যাসিডের উপস্থিতিতে উজ্জ্বলভাবে জ্বলতে থাকে। নাইট্রিক অ্যাসিড (HNO3) চারকোল বা কার্বনকে কার্বন ডাইঅক্সাইডে (CO2) জারিত করে এবং নিজে বিজারিত হয়ে বাদামি বর্ণের নাইট্রোজেন ডাইঅক্সাইড (NO2) উৎপন্ন করে।
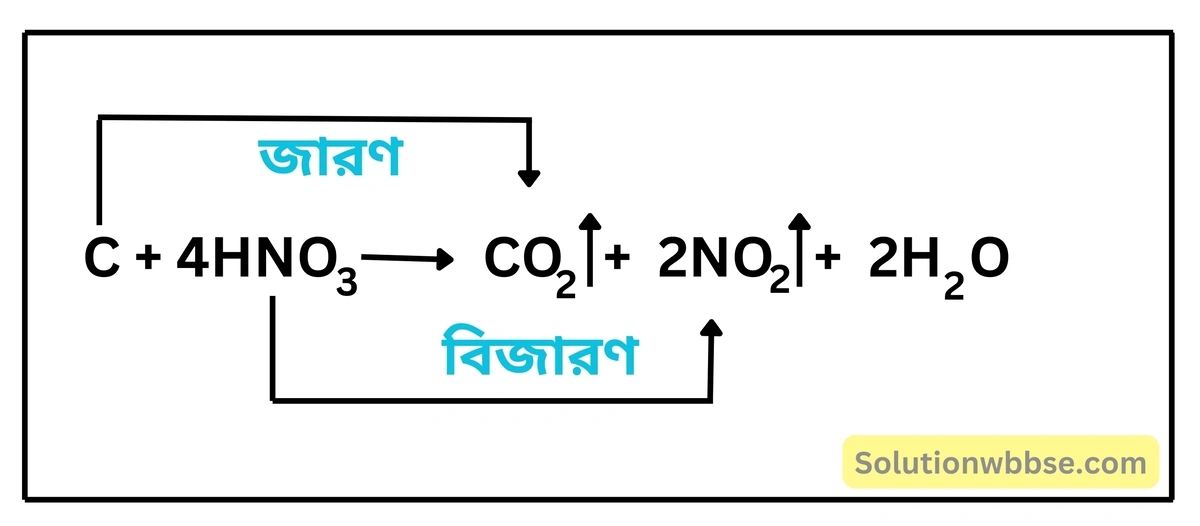
নাইট্রিকঅ্যাসিডে অক্সিজেন আছে – বিক্রিয়ার মাধ্যমে দেখাও।
উত্তপ্ত ঝামাপাথরের ওপর ফোঁটা ফোঁটা করে নাইট্রিক অ্যাসিড ফেললে, নাইট্রিক অ্যাসিড বিয়োজিত হয়ে কতকগুলি গ্যাস উৎপন্ন করে। উৎপন্ন গ্যাসগুলিকে প্রথমে বরফে ডোবানো U-টিউবের মধ্যে এবং পরে হিমমিশ্রের মধ্যে রাখা U টিউবের মধ্যে দিয়ে চালনা করলে নির্গম নল দিয়ে একটি বর্ণহীন, গন্ধহীন গ্যাস নির্গত হয়। এই গ্যাসের মধ্যে শিখাহীন জ্বলন্ত পাটকাঠি ধরলে পাটকাঠিটি তীব্রভাবে জ্বলে ওঠে এবং গ্যাসটি ক্ষারীয় পটাশিয়াম পাইরোগ্যালেট দ্রবণ দ্বারা শোষিত হয়। সুতরাং, বর্ণহীন গ্যাসটি অক্সিজেন এবং এটি HNO3 অ্যাসিডের বিয়োজনে উৎপন্ন হয়েছে।
4HNO3 → 4NO2 + 2H2O + O2
এর দ্বারা প্রমাণিত হয় যে, নাইট্রিক অ্যাসিডে অক্সিজেন আছে।
তুমি কীভাবে প্রমাণ করবে যে, নাইট্রিক অ্যাসিডের মধ্যে হাইড্রোজেন ও নাইট্রোজেন আছে?
নাইট্রিক অ্যাসিডে নাইট্রোজেন আছে তার প্রমাণ – উত্তপ্ত কপারের উপর দিয়ে নাইট্রিক অ্যাসিড বাষ্প চালনা করলে একটি বর্ণহীন, গন্ধহীন গ্যাস উৎপন্ন হয়, যা নিজে জ্বলে না এবং অপরকে জ্বলতেও সাহায্য করে না। গ্যাসটি উত্তপ্ত ম্যাগনেশিয়ামের সঙ্গে যুক্ত হয়ে যে যৌগ গঠন করে, তা ফুটন্ত জলের সঙ্গে বিক্রিয়া করে ঝাঁজালো গন্ধযুক্ত অ্যামোনিয়া গ্যাস উৎপন্ন করে। সুতরাং, উৎপন্ন যৌগটি হল ম্যাগনেশিয়াম নাইট্রাইড (Mg3N2) এবং বর্ণহীন গ্যাসটি হল নাইট্রোজেন (N2), যা নাইট্রিক অ্যাসিড থেকে এসেছে। এর দ্বারা প্রমাণিত হয় যে, নাইট্রিক অ্যাসিডে নাইট্রোজেন আছে।
5Cu + 2HNO3 → 5CuO + N2 + H2O
3Mg + N2 → Mg3N2
Mg3N2 + 6H2O3 → Mg(OH)2 + 2NH3↑
নাইট্রিক অ্যাসিডে হাইড্রোজেন আছে তার প্রমাণ – HNO3 অ্যাসিডকে লঘু ও শীতল করে তার মধ্যে কয়েক টুকরো ম্যাগনেশিয়াম যোগ করলে একটি বর্ণহীন, গন্ধহীন গ্যাস উৎপন্ন হয়, যার মধ্যে জ্বলন্ত পাটকাঠি ধরলে পাটকাঠিটি নিভে যায়, কিন্তু গ্যাসটি নিজে নীল শিখায় জ্বলে। আবার, গ্যাসটি প্যালাডিয়াম ধাতু দ্বারা শোষিত হয়। সুতরাং, গ্যাসটি হাইড্রোজেন যা নাইট্রিক অ্যাসিড থেকে এসেছে। এর দ্বারা প্রমাণিত হয় যে, নাইট্রিক অ্যাসিডে হাইড্রোজেন আছে।
Mg + 2HNO3 → Mg(NO3)2 + H2↑
নাইট্রিক অ্যাসিডকে কীভাবে শনাক্ত করবে?
অথবা, বলয় পরীক্ষা কী?
নাইট্রিক অ্যাসিডের শনাক্তকরণ –
বলয় পরীক্ষা (Ring test) – একটি টেস্টটিউবে নাইট্রিক আসিড নিয়ে তার মধ্যে সদ্য প্রস্তুত ফেরাস সালফেটের (FeSO4) জলীয় দ্রবণ যোগ করা হল। মিশ্রণটিকে কলের জলের তলায় ঠান্ডা করা হল। এবার ওই টেস্টটিউবের গা বেয়ে ধীরে ধীরে টেস্টটিউবটিকে না নাড়িয়ে গাঢ় H2SO4 ঢালা হল। গাঢ় H2SO4 ভারী হওয়ায় তা দ্রবণের নীচে চলে যায় এবং দুই দ্রবণের সংযোগস্থলে বাদামি বর্ণের অস্থায়ী বলয় গঠিত হয়। এই পরীক্ষাকে বলয় পরীক্ষা বলে। এই পরীক্ষার সাহায্যে নাইট্রিক অ্যাসিডকে শনাক্ত করা হয়।

বিক্রিয়া –
6FeSO4 + 3H2SO4 + 2HNO3 = 3Fe2(SO4)3 + 2NO + 4H2O
FeSO4 + 6H2O = [Fe(H2O)6]SO4
এক্ষেত্রে নাইট্রিক অ্যাসিড ফেরাস সালফেট দ্বারা বিজারিত হয়ে যে নাইট্রিক অক্সাইড (NO) উৎপন্ন করে তা ফেরাস সালফেটের সঙ্গে বিক্রিয়া করে বাদামি বর্ণের জটিল যৌগ পেন্টাঅ্যাকুয়া নাইট্রোসিল আয়রন (II) সালফেট গঠন করে।
নাইট্রিক অ্যাসিডের শিল্প ব্যবহার লেখো।
নাইট্রিক অ্যাসিডের ব্যবহার –
- TNT, পিকরিক অ্যাসিড, নাইট্রোগ্লিসারিন, গানবাটন প্রভৃতি বিস্ফোরক দ্রব্য তৈরি করতে ব্যবহৃত হয়।
- নাইট্রেট লবণ, সার, ওষুধ প্রস্তুতিতে ব্যবহার করা হয়।
- কৃত্রিম রং, কৃত্রিম সিল্ক, রেয়ন, সেলুলয়েড প্রভৃতি তৈরিতে নাইট্রিক অ্যাসিড কাজে লাগে।
- অম্লরাজ প্রস্তুতিতে, সোনা, প্ল্যাটিনাম প্রভৃতি ধাতুকে দ্রবীভূত করতে কাজে লাগে।
- মূল্যবান ধাতু, যেমন – সোনা, রূপো, প্ল্যাটিনাম প্রভৃতির পরিশোধনে কাজে লাগে।
শনাক্ত করো।
A → অ্যামোনিয়া (NH3)
B → অক্সিজেন (O2)
C → নাইট্রিক অক্সাইড (NO)
D → নাইট্রোজেন ডাইঅক্সাইড (NO2)
E → নাইট্রিক অ্যাসিড (HNO3)
সংশ্লিষ্ট বিক্রিয়াগুলি হল –
2NO + O2 → 2NO2
2NO2 + H2O → HNO2 + HNO3
অম্লরাজ কী? বিক্রিয়াটি লেখো। এর ব্যবহার লেখো।
অম্লরাজ (Aqua regia) – তিন আয়তন গাঢ় হাইড্রোক্লোরিক অ্যাসিডের সঙ্গে এক আয়তন গাঢ় HNO3 -এর মিশ্রণকে অম্লরাজ বা অ্যাকোয়া রিজিয়া বলা হয়।
ব্যবহার – সোনা (Au), ইরিডিয়াম (Ir), প্ল্যাটিনাম (Pt) প্রভৃতি বর ধাতু দ্রবীভূত করতে অম্লরাজ ব্যবহৃত হয়।
অয়েল অফ ভিট্রিয়ল কাকে বলে?
সালফিউরিক অ্যাসিডকে অয়েল অফ ভিট্রিয়ল বলে।
ধাতব কার্বনেটের সঙ্গে সালফিউরিক অ্যাসিডের সঙ্গে বিক্রিয়াটি লেখো।
ধাতব কার্বনেটের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়া – ধাতব কার্বনেটের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়ায় ধাতব সালফেট লবণ, কার্বন ডাইঅক্সাইড এবং জল উৎপন্ন হয়।
ধাতব কার্বনেট + H2SO4 → ধাতব সালফেট + CO2↑ + H2O
যেমন –
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
CuCO3 + H2SO4 → CuSO4 + CO2↑ + H2O
ধাতব বাইকার্বনেটের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়াটি লেখো।
ধাতব বাইকার্বনেটের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়ায় ধাতব সালফেট, কার্বন ডাইঅক্সাইড ও জল উৎপন্ন হয়।
ধাতব বাইকার্বনেট + H2SO4 → ধাতব সালফেট + CO2↑ + H2O
যেমন –
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2H2O
ক্ষারের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়াটি লেখো।
ক্ষারের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়ায় সালফেট লবণ এবং জল উৎপন্ন হয়।
ক্ষার + H2SO4 → সালফেট লবণ + জল
যেমন –
2NH4OH + H2SO4 → (NH4)2SO4 + 2H2O
ধাতুর সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়াটি লেখো।
ধাতুর সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়া –
- তড়িৎ-রাসায়নিক শ্রেণিতে যে-সমস্ত ধাতুর অবস্থান হাইড্রোজেনের উপরে (যেমন – Zn, Mg) তারা শীতল ও লঘু সালফিউরিক অ্যাসিডের সঙ্গে বিক্রিয়া করে হাইড্রোজেন প্রতিস্থাপিত করে এবং ওই ধাতুর সালফেট লবণ উৎপন্ন করে।
- তড়িৎ-রাসায়নিক শ্রেণিতে যে-সমস্ত ধাতুর অবস্থান হাইড্রোজেনের নীচে (যেমন – কপার) তারা শীতল এবং লঘু সালফিউরিক অ্যাসিডের সঙ্গে বিক্রিয়া করে না।
- Zn, Mg, Cu এরা প্রত্যেকেই উত্তপ্ত ও গাঢ় সালফিউরিক অ্যাসিডের সঙ্গে বিক্রিয়া করে সালফেট লবণ, পোড়া বারুদের গন্ধযুক্ত সালফার ডাইঅক্সাইড গ্যাস এবং জল উৎপন্ন করে।
জিংক (Zn) ধাতুর সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| লঘু | শীতল | Zn + H2SO4 = ZnSO4 + H2↑ |
| গাঢ় | উত্তপ্ত | Zn + 2H2SO = ZuSO4 + SO2 + 2H2О |
ম্যাগনেশিয়াম (Mg) ধাতুর সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| লঘু | শীতল | Mg + H2SO4 = MgSO4 + H2↑ |
| গাঢ় | উত্তপ্ত | Mg + 2H2SO4 = MgSO4 + SO2 + 2H2О |
কপারের (Cu) সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়া –
| অ্যাসিডের গাঢ়ত্ব | অ্যাসিডের উষ্ণতা | বিক্রিয়া |
| লঘু | শীতল | কপারের সঙ্গে লঘু ও শীতল H2SO4 -এর বিক্রিয়া হয় না। |
| গাঢ় | উত্তপ্ত | Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O |
ধূমায়মান সালফিউরিক অ্যাসিড বা ওলিয়াম কী?
ধূমায়মান সালফিউরিক অ্যাসিড বা ওলিয়াম – 98% গাঢ় সালফিউরিক অ্যাসিডের মধ্যে অতিরিক্ত সালফার ট্রাইঅক্সাইড চালনা করলে যে অ্যাসিড উৎপন্ন হয় তাকে ধূমায়মান সালফিউরিক অ্যাসিড বা ওলিয়াম বলে। ওলিয়ামের সংকেত H2S2O7। একে পাইরো সালফিউরিক অ্যাসিডও বলা হয়।
H2SO4 + SO3 = H2S2O7
বিক্রিয়াসহ সালফিউরিক অ্যাসিডের জারণ ধর্মের উদাহরণ দাও।
সালফিউরিক অ্যাসিডের জারণ ধর্ম – চারকোলের (কার্বন) সঙ্গে গাঢ় সালফিউরিক অ্যাসিড (H2SO4) মিশিয়ে উত্তপ্ত করলে H2SO4 কার্বনকে কার্বন ডাইঅক্সাইডে জারিত করে নিজে সালফার ডাইঅক্সাইডে বিজারিত হয়।
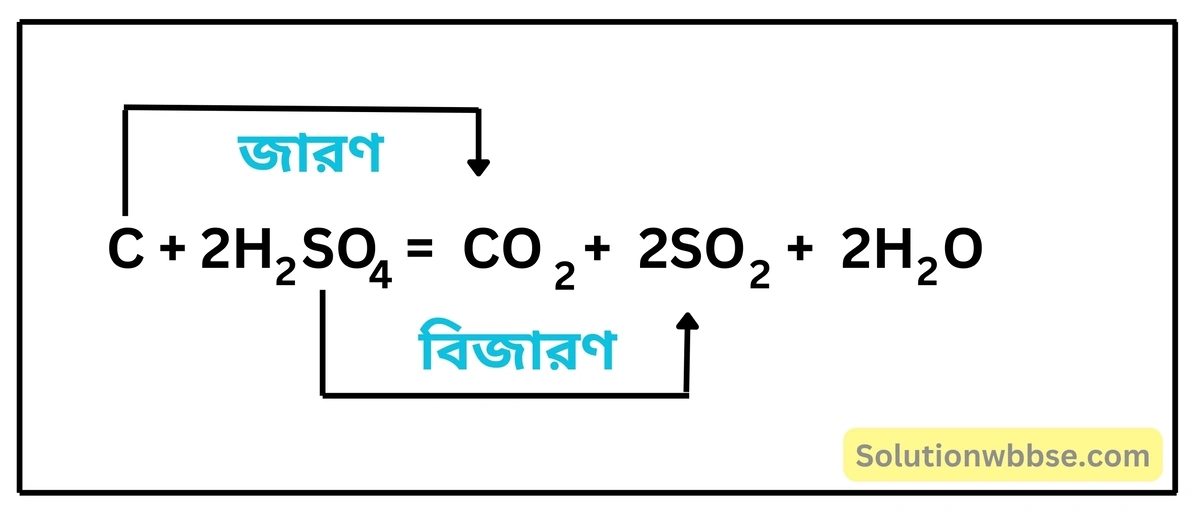
এর দ্বারা প্রমাণিত হয় গাঢ় H2SO4 -এর জারণ ক্ষমতা আছে।
H2SO4 -এ H2 -এর অস্তিত্বের প্রমাণ করো।
সালফিউরিক অ্যাসিডে হাইড্রোজেন আছে তার প্রমাণ – সাধারণ উষ্ণতায় জিংকের ছিবড়ার সঙ্গে লঘু H2SO4 -এর বিক্রিয়ায় একটি বর্ণহীন, গন্ধহীন গ্যাস উৎপন্ন হয়। উৎপন্ন গ্যাসটিকে গ্যাসজারে সংগ্রহ করে গ্যাসটির মধ্যে জ্বলন্ত পাটকাঠি প্রবেশ করালে পাটকাঠিটি নিভে গিয়ে গ্যাসটি নীল শিখায় জ্বলতে থাকে। আবার উৎপন্ন গ্যাসটি প্যালাডিয়াম ধাতু দ্বারা শোষিত হয়। সুতরাং, উৎপন্ন গ্যাসটি হাইড্রোজেন।
Zn + H2SO4 ⇌ ZnSO4 + H2↑
এর দ্বারা প্রমাণিত হয় যে, সালফিউরিক অ্যাসিডে হাইড্রোজেন আছে।
দেখাও যে, সালফিউরিক অ্যাসিডে অক্সিজেন ও সালফার আছে।
H2SO4 -এ অক্সিজেনের অস্তিত্ব – উত্তপ্ত ঝামা পাথরের ওপর ফোঁটা ফোঁটা করে গাঢ় সালফিউরিক অ্যাসিড ফেললে তাপের প্রভাবে সালফিউরিক অ্যাসিড বিশ্লিষ্ট হয়ে জলীয় বাষ্প, সালফার ডাইঅক্সাইড ও অক্সিজেন গ্যাসের মিশ্রণ উৎপন্ন হয়।
2H2SO4 = 2H2O + 2SO2 + O2
উৎপন্ন গ্যাস মিশ্রণকে প্রথমে বরফে রাখা একটি U নলের মধ্যে দিয়ে এবং পরে হিমমিশ্রণে রাখা একটি U নলের মধ্যে দিয়ে চালনা করলে শেষে U নলের নির্গম নল দিয়ে একটি বর্ণহীন, গন্ধহীন গ্যাস নির্গত হয় যা ক্ষারীয় পটাশিয়াম পাইরোগ্যালেট দ্রবণ দ্বারা শোষিত হয়। এই গ্যাসে একটি শিখাহীন জ্বলন্ত পাটকাঠি প্রবেশ করালে পাটকাঠিটি উজ্জ্বল শিখাসহ জ্বলতে থাকে। সুতরাং, গ্যাসটি অক্সিজেন। এর দ্বারা প্রমাণিত হয় সালফিউরিক অ্যাসিডে অক্সিজেন আছে।
H2SO4 -এ সালফারের অস্তিত্ব – কপার কুচি এবং গাঢ় সালফিউরিক অ্যাসিডের মিশ্রণকে উত্তপ্ত করলে পোড়া বারুদের গন্ধযুক্ত সালফার ডাইঅক্সাইড (SO2) গ্যাস উৎপন্ন হয়।
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
উৎপন্ন গ্যাসকে জলে দ্রবীভূত করে প্রাপ্ত তরলকে একটি বন্ধ কাচের বাল্বের মধ্যে নিয়ে 150°C উষ্ণতায় উত্তপ্ত করলে একটি হলুদ রঙের অধঃক্ষেপ উৎপন্ন হয়। এই অধঃক্ষেপ কার্বন ডাইসালফাইডে (CS2) দ্রবীভূত হয় এবং অধঃক্ষেপটিকে পোড়ালে পোড়া বারুদের গন্ধযুক্ত গ্যাস উৎপন্ন হয়। সুতরাং, অধঃক্ষেপটি হল সালফার। এই সালফার এসেছে সালফিউরিক অ্যাসিড থেকে।
SO2 + H2O = H2SO3 (সালফিউরাস অ্যাসিড)
S + O2 = SO2↑ (পোড়া বারুদের গন্ধযুক্ত গ্যাস)
সুতরাং, সালফিউরিক অ্যাসিডে অবশ্যই সালফার আছে।
গাঢ় H2SO4 -এর জলাকর্ষী ধর্মের উদাহরণ সমীকরণসহ লেখো।
অথবা, H2SO4 এর নিরুদন ধর্মের উদাহরণ দাও।
গাঢ় H2SO4 তীর জলাকর্ষী বা নিরুদক পদার্থ। কোনো পদার্থে উপস্থিত সামান্য পরিমাণ জলকেও শোষণ করতে পারে।
যেমন – চিনির (C12H22O11) মধ্যে গাঢ় H2SO4 যোগ করলে সালফিউরিক অ্যাসিড চিনির চিনির থেকে জল শোষণ করে এবং কালো রং -এর কার্বন কণা (চারকোল) অবশেষরূপে পাওয়া যায়।
সালফিউরিক অ্যাসিডকে কীভাবে শনাক্ত করবে?
সালফিউরিক অ্যাসিডের শনাক্তকরণ – একটি টেস্টটিউবে সালফিউরিক অ্যাসিডের (H2SO4) জলীয় দ্রবণ নিয়ে তার মধ্যে বেরিয়াম ক্লোরাইডের (BaCl2) স্বচ্ছ জলীয় দ্রবণ যোগ করলে অদ্রাব্য সাদা বর্ণের বেরিয়াম সালফেটের অধঃক্ষেপ পড়ে, যা লঘু HCl বা HNO3 -তে অদ্রাব্য।
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
সালফিউরিক অ্যাসিডের ব্যবহার লেখো।
H2SO4 -এর ব্যবহার-
- হাইড্রোক্লোরিক অ্যাসিড, নাইট্রিক অ্যাসিড এবং ফসফরিক অ্যাসিডের শিল্প প্রস্তুতিতে সালফিউরিক অ্যাসিড ব্যবহৃত হয়।
- অ্যামোনিয়াম সালফেট, সুপার ফসফেট অফ লাইম প্রভৃতি সার উৎপাদনে ব্যবহৃত হয়।
- বিভিন্ন বিস্ফোরক পদার্থ, যেমন – TNT, নাইট্রোগ্লিসারিন, গানবাটন প্রভৃতি প্রস্তুতিতে কাজে লাগে।
- বিভিন্ন রঞ্জক, ফটকিরি, ইথার, গ্লুকোজ, অ্যালকোহল উৎপাদনে ব্যবহৃত হয়।
- পেট্রোলিয়াম শোধনে, ধাতু নিষ্কাশনে, কৃত্রিম রেশম প্রস্তুতিতে ব্যবহৃত হয়।
বিলীয়মান রং কী?
বিলীয়মান রং – ফেনলপ্থ্যালিনযুক্ত অ্যামোনিয়াম হাইড্রক্সাইডের (NH4OH) জলীয় দ্রবণকে বিলীয়মান রং বলে।
এই মিশ্রণ কোনো সাদা কাপড়ে দিলে তৎক্ষণাৎ ওই সাদা কাপড় গোলাপি বর্ণ ধারণ করলেও কিছুক্ষণ পর দ্রবণ থেকে NH3 গ্যাস বাষ্পীভূত হয়ে গেলে, দ্রবণটি ক্ষারকীয়তা হারিয়ে প্রশম হয়ে যায়। প্রশম দ্রবণে ফেনলপ্থ্যালিন বর্ণহীন হয়, তাই কাপড়টি আবার আগের মতো সাদা হয়ে যায়। এটি সাদা কাপড়ে দেওয়ায় তৎক্ষণাৎ গোলাপি হয়ে গেলেও উদ্বায়ী বলে কিছুক্ষণ পরে ওই রং বিলীন হয়ে যায়। তাই একে বিলীয়মান রং বলা হয়।
অ্যালুমিনিয়াম চূর্ণ কস্টিক সোডার গাঢ় জলীয় দ্রবণ সহযোগে ফোটানো হল। – কী ঘটে সমীকরণসহ লেখো।
অ্যালুমিনিয়াম (Al) চূর্ণকে কস্টিক সোডার গাঢ় জলীয় দ্রবণ সহযোগে ফোটালে সোডিয়াম অ্যালুমিনেট (NaAlO2) এবং হাইড্রোজেন গ্যাস উৎপন্ন হয়।
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
দস্তাকে গাঢ় কস্টিক সোডা দ্রবণে উত্তপ্ত করা হল। – কী ঘটে সমীকরণসহ লেখো।
দস্তাকে (Zn) গাঢ় কস্টিক সোডার দ্রবণে উত্তপ্ত করলে সোডিয়াম জিংকেট (Na2ZnO2) এবং হাইড্রোজেন গ্যাস উৎপন্ন হয়।
Zn + 2NaOH = Na2ZnO2 + H2↑
কস্টিক সোডার সঙ্গে HCl, HNO3 এবং H2SO4 -এর বিক্রিয়া লেখো।
কস্টিক সোডার (NaOH) সঙ্গে হাইড্রোক্লোরিক অ্যাসিডের (HCl) বিক্রিয়ায় নর্মাল লবণ সোডিয়াম ক্লোরাইড (NaCl) এবং জল উৎপন্ন হয়।
NaOH + HCl = NaCl + H2O
কস্টিক সোডার (NaOH) সঙ্গে নাইট্রিক অ্যাসিডের (HNO3) বিক্রিয়ায় নর্মাল লবণ সোডিয়াম নাইট্রেট (NaNO3) এবং জল উৎপন্ন হয়।
NaOH + HNO3 = NaNO3 + H2O
কষ্টিক সোডার (NaOH) সঙ্গে সালফিউরিক অ্যাসিডের (H2SO4) বিক্রিয়ায় অ্যাসিড লবণ সোডিয়াম বাইসালফেট (NaHSO4) ও নর্মাল লবণ সোডিয়াম সালফেট উৎপন্ন হয়।
কারণ – H2SO4 একটি দ্বি-ক্ষারীয় অ্যাসিড।
NaOH + H2SO4 → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
NaOH -এর ব্যবহার উল্লেখ করো।
NaOH -এর ব্যবহার –
- সাবান, কাগজ, কৃত্রিম রেশম প্রভৃতি প্রস্তুতিতে NaOH ব্যবহৃত হয়।
- জৈব রঞ্জকপদার্থ উৎপাদনে ব্যবহার করা হয়।
- পেট্রোলিয়াম শোধনে ব্যবহৃত হয়।
- সোডিয়াম ধাতু নিষ্কাশনে NaOH ব্যবহৃত হয়।
- পরীক্ষাগারে বিকারক হিসেবে ব্যবহৃত হয়।
20 g NaOH -কে প্রশমিত করতে কত g H2SO4 লাগবে?
জলীয় দ্রবণে তুল্যাঙ্ক পরিমাণ ক্ষারের সঙ্গে তুল্যাঙ্ক পরিমাণ অ্যাসিডের বিক্রিয়ায় লবণ ও জল উৎপন্ন হয়।
40 g NaOH -কে প্রশমিত করতে H2SO4 প্রয়োজন 49 g
1 g NaOH -কে প্রশমিত করতে H2SO4 প্রয়োজন \(\frac{49}{40}\) g
∴ 20 g NaOH -কে প্রশমিত করতে H2SO4 প্রয়োজন \(\frac{49}{40}\times20\) g = 24.5 g
∴ 20 g NaOH -কে প্রশমিত করতে 24.5 g H2SO4 প্রয়োজন।
বিকল্প পদ্ধতি,
\(\underset{\left(2\times40\right)=80}{2NaOH}+\underset{\left(2\times1\right)+32+\left(16\times4\right)=98}{H_2SO_4}\rightarrow Na_2SO_4+2H_2O\\\)80 g NaOH -কে প্রশমিত করতে H2SO4 প্রয়োজন 98 g
∴ 20 g NaOH -কে প্রশমিত করতে H2SO4 প্রয়োজন \(\left(\frac{98}{80}\times20\right)=24.5\) g
উত্তপ্ত চারকোলের ওপর গাঢ় HNO3 ফেলা হল – কী ঘটে সমীকরণসহ লেখো।
জ্বলন্ত চারকোল (কার্বন) গাঢ় ও উত্তপ্ত নাইট্রিক অ্যাসিডের উপস্থিতিতে উজ্জ্বলভাবে জ্বলতে থাকে। নাইট্রিক অ্যাসিড (HNO3) চারকোল বা কার্বনকে কার্বন ডাইঅক্সাইডে (CO2) জারিত করে এবং নিজে বিজারিত হয়ে বাদামি বর্ণের নাইট্রোজেন ডাইঅক্সাইড (NO2) উৎপন্ন করে।

লোহিততপ্ত ঝামা পাথরের উপর কয়েক ফোঁটা গাঢ় H2SO4 ফেলা হল – কী ঘটে সমীকরণসহ লেখো।
H2SO4 -এ অক্সিজেনের অস্তিত্ব – উত্তপ্ত ঝামা পাথরের ওপর ফোঁটা ফোঁটা করে গাঢ় সালফিউরিক অ্যাসিড ফেললে তাপের প্রভাবে সালফিউরিক অ্যাসিড বিশ্লিষ্ট হয়ে জলীয় বাষ্প, সালফার ডাইঅক্সাইড ও অক্সিজেন গ্যাসের মিশ্রণ উৎপন্ন হয়।
2H2SO4 = 2H2O + 2SO2 + O2
উৎপন্ন গ্যাস মিশ্রণকে প্রথমে বরফে রাখা একটি U নলের মধ্যে দিয়ে এবং পরে হিমমিশ্রণে রাখা একটি U নলের মধ্যে দিয়ে চালনা করলে শেষে U নলের নির্গম নল দিয়ে একটি বর্ণহীন, গন্ধহীন গ্যাস নির্গত হয় যা ক্ষারীয় পটাশিয়াম পাইরোগ্যালেট দ্রবণ দ্বারা শোষিত হয়। এই গ্যাসে একটি শিখাহীন জ্বলন্ত পাটকাঠি প্রবেশ করালে পাটকাঠিটি উজ্জ্বল শিখাসহ জ্বলতে থাকে। সুতরাং, গ্যাসটি অক্সিজেন। এর দ্বারা প্রমাণিত হয় সালফিউরিক অ্যাসিডে অক্সিজেন আছে।
গাঢ় KOH-এর সঙ্গে Al2O3 মেশানো হল – কী ঘটে সমীকরণসহ লেখো।
গাঢ় KOH -এর সঙ্গে Al2O3 মেশানো হলে অ্যালুমিনা (Al2O3) কস্টিক পটাশের (KOH) সঙ্গে বিক্রিয়া করে পটাশিয়াম অ্যালুমিনেট (KAlO2) লবণ ও জল উৎপন্ন করে।
Al2O3 + 2KOH = 2KAlO2 + H2O
HCl -এর মধ্যে AgNO3 দ্রবণ যোগ করা হল, উৎপন্ন পদার্থে পুনরায় ধীরে ধীরে অ্যামোনিয়াম হাইড্রক্সাইড যোগ করা হল – কী ঘটে সমীকরণসহ লেখো।
হাইড্রোক্লোরিক অ্যাসিডের শনাক্তকরণ – হাইড্রোক্লোরিক অ্যাসিডের মধ্যে সিলভার নাইট্রেট (AgNO3) দ্রবণ যোগ করলে অদ্রাব্য সিলভার ক্লোরাইডের সাদা থকথকে অধঃক্ষেপ উৎপন্ন হয়, যা নাইট্রিক অ্যাসিডে (HNO3) অদ্রাব্য কিন্তু অতিরিক্ত অ্যামোনিয়াম হাইড্রক্সাইডে (NH4OH) দ্রাব্য।
ফরমিক অ্যাসিডের মধ্যে গাঢ় H2SO4 ঢালা হল – কী ঘটে সমীকরণসহ লেখো।
ফরমিক অ্যাসিডের মধ্যে গাঢ় H2SO4 যোগ করলে তীব্র জলাকর্ষী গাঢ় H2SO4, ফরমিক অ্যাসিড থেকে জল শোষিত করে এবং এটিকে কার্বন মনোক্সাইডে (CO) পরিণত করে। –
HCOOH + H2SO4 → CO↑ + [H2O + H2SO4]
গাঢ় HCl -এর সঙ্গে MnO2 সঙ্গে মিশিয়ে উত্তপ্ত করা হল – কী ঘটে সমীকরণসহ লেখো।
গাঢ় HCl -এর সঙ্গে MnO2 মিশিয়ে উত্তপ্ত করলে ম্যাঙ্গানিজ ডাইঅক্সাইড বিজারিত হয়ে ম্যাঙ্গানাস ক্লোরাইডে পরিণত হয় এবং HCl নিজে জারিত হয়ে সবুজাভ হলুদ বর্ণের ঝাঁজালো গন্ধযুক্ত ক্লোরিন গ্যাস (Cl2) উৎপন্ন করে।
নীচের বিক্রিয়াগুলি সম্পূর্ণ করো ও সমিত সমীকরণ লেখো।
1. ___ + 2HNO3 → Ca(NO3)2 + 2CO2 + 2H2O
2. Cu + 4HNO3 → Cu(NO3)2 + ___ + 2H2O
3. Zn + 2NaOH → Na2ZnO2+ + ___
সমিত সমীকরণ হল –
1. Ca(HCO3)2 + 2HNO3 → Ca(NO3)2 + 2CO2↑ + 2H2O
2. Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
3. Zn + 2NaOH → Na2ZnO2+ + H2↑
বিক্রিয়াগুলি সম্পূর্ণ করে সমিত সমীকরণ লেখো।
1. NaHCO3 (s) + HNO3(aq) → ?
2. CH3COOH (aq) + NaOH (aq) → ?
3. [Fe(H2O)6]SO4 + NO → ?
সমিত সমীকরণ হল –
1. NaHCO3 (s) + HNO3 (aq) → NaNO3 + CO₂↑ + H2O
2. CH3COOH (aq) + NaOH (aq) → CH3COONa + H2O
3. [Fe(H2O)6]SO4 + NO → [Fe(H2O)NO]5SO4 + H2O
অ্যাসিড এবং ক্ষার ব্যবহারের সময় অবশ্য পালনীয় সতর্কতাগুলি কী কী?
অ্যাসিড ও ক্ষার ব্যবহারের সতর্কতা –
- পরীক্ষাগারে কাজ করার সময় খেয়াল রাখতে হবে যাতে হাতে, চোখে বা শরীরের কোনো উন্মুক্ত জায়গায় অ্যাসিড না পড়ে।
- অ্যাসিডের লঘু দ্রবণ তৈরির সময় সর্বদা জলের মধ্যে অ্যাসিড যোগ করা উচিত, নাহলে প্রচুর তাপ উৎপন্ন হয়ে বিস্ফোরণ ঘটতে পারে।
- পিপেটে গাঢ় ক্ষার দ্রবণ নেবার সময় খেয়াল রাখতে হবে যাতে অসাবধানতাবশত তা মুখে চলে না যায়।
- খেয়াল রাখতে হবে যেন গাঢ় অ্যাসিড ও ক্ষার দ্রবণ আগুনের কাছাকাছি না থাকে।
অ্যাসিড বার্ন এবং অ্যালকালি বার্ন বলতে কী বোঝায়?
অ্যাসিড বার্ন (Acid Burn) ও অ্যালকালি বার্ন (Alkali Burn) – কোনো তীব্র অ্যাসিড বা কোনো তীব্র ক্ষার যখন কোনো জীবন্ত কোশের ওপর পড়ে তখন সেই কোশগুলি পুড়ে যায়। এই ঘটনাকে অ্যাসিড বার্ন ও অ্যালকালি বার্ন বলা হয়। অ্যাসিড বা ক্ষারের প্রকৃতি, শক্তিমাত্রা এবং কত সময় ধরে তা ত্বকের সংস্পর্শে আছে তার ওপর এর পরিমাণ নির্ভর করে। এটি শুধুমাত্র ত্বকের বা ক্ষতিগ্রস্ত স্থানের উপরিভাগে প্রভাব ফেলে।
সাধারণত প্রাথমিকভাবে ক্ষতিগ্রস্ত স্থানটিকে প্রচুর পরিমাণে ঠান্ডা জল দিয়ে ধোয়া উচিত। এরপর যথাযথ চিকিৎসা ব্যবস্থা গ্রহণ করা উচিত।
অ্যাসিড ও ক্ষারের সংস্পর্শে এলে আমাদের কী কী ক্ষতি হতে পারে? এর প্রতিকার কী?
অথবা, পরীক্ষাগারে অ্যাসিড বার্ন বা অ্যালকালি বার্ন হলে কী কী পদক্ষেপ নেবে?
অ্যাসিড ও ক্ষারের ক্ষতিকর প্রভাব –
- গাঢ় অ্যাসিড বা ক্ষারের সংস্পর্শে চামড়ায় ক্ষতের সৃষ্টি হয়।
- চামড়া পুড়ে যেতে পারে।
- জামাকাপড়ে পড়লে তার ক্ষতি হতে পারে।
- চোখের পক্ষেও এটি ক্ষতিকর।
প্রতিকার –
- অ্যাসিডে কোনো স্থান পুড়ে গেলে ওই স্থানে প্রথমে জল দিয়ে তারপর NaHCO3 -এর দ্রবণ ও শেষে আবার জল দিয়ে ধুয়ে নিতে হবে। তারপর বার্নল লাগাতে হবে।
- ক্ষার দ্বারা কোনো স্থান পুড়ে গেলে ওই স্থান প্রথমে জল দিয়ে ধুয়ে তারপর 1% CH3COOH দ্রবণ দ্বারা ধুয়ে শেষে আবার জল দিয়ে ধুতে হবে। তারপর ক্ষতস্থানে বার্নল লাগাতে হবে।
- কোনো কারণে অ্যাসিড খেয়ে ফেললে বেশি পরিমাণ জল খেতে হবে, পরে দু-চামচ চুনজল খেতে হবে।
- কোনো কারণে ক্ষার খেয়ে ফেললে বেশি পরিমাণে জল খেতে হবে, পরে এক গ্লাস লেবুর রস খেয়ে নিতে হবে।
জায়মান হাইড্রোজেনের ধারণা বর্তমানে অপ্রয়োজনীয় বলে পরিগণিত হয়েছে – উদাহরণের সাহায্যে ব্যাখ্যা করো।
লঘু সালফিউরিক অ্যাসিডমিশ্রিত হলুদ বর্ণের ফেরিক ক্লোরাইডের আম্লিক দ্রবণে H2 গ্যাস চালনা করলে কোনো পরিবর্তন হয় না। কিন্তু দ্রবণে কয়েক টুকরো জিংকের ছিবড়া যুক্ত করলে দেখা যাবে ফেরিক ক্লোরাইডের হলুদ বর্ণ ধীরে ধীরে বর্ণহীন হয়ে গেল। এক্ষেত্রে হলুদ বর্ণের ফেরিক ক্লোরাইড (FeCl2) বিজারিত হয়ে বর্ণহীন ফেরাস ক্লোরাইডে (FeCl2) পরিণত হয়। আগে এই ঘটনাকে ব্যাখ্যা করার জন্য জায়মান হাইড্রোজেনের ধারণা দেওয়া হত। মনে করা হত, জিংক ও লঘু H2SO4 -এর বিক্রিয়ায় উৎপন্ন জায়মান হাইড্রোজেন পারমাণবিক অবস্থায় অধিক সক্রিয় থাকায় বিজারণ ক্রিয়া সম্পন্ন করে। কিন্তু পরে এই ধারণা পরিত্যন্ত হয়। বর্তমানে ইলেকট্রন গ্রহণ বা বর্জনের মাধ্যমে জারণ-বিজারণ ব্যাখ্যা করা সম্ভবপর হয়েছে।
হাইড্রোজেন নয়, ধাতুই বিজারকের ভূমিকা পালন করে। প্রকৃতপক্ষে, Zn ইলেকট্রন বর্জন করে Zn2+ -এ পরিণত হয় এবং Fe3+ ওই ইলেকট্রন গ্রহণ করে Fe2+ -এ বিজারিত হয়। আবার দ্রবণে উপস্থিত H+ আয়নগুলি Zn দ্বারা বর্জিত ইলেকট্রন গ্রহণ করে প্রথমে পরমাণুতে বিজারিত হয় এবং পরে H2 গ্যাস উৎপন্ন করে।
Zn – 2e– → Zn2+ (জারণ ক্রিয়া)
Fe3+ + e– → Fe2+ (বিজারণ ক্রিয়া)
H+ + e → H (বিজারণ ক্রিয়া); H + H → H2↑
প্রশমন বিক্রিয়া কাকে বলে? উদাহরণ দাও।
প্রশমন বিক্রিয়া (Neutralization Reaction) – তুল্য পরিমাণ অ্যাসিডের সঙ্গে তুল্য পরিমাণ ক্ষারের বিক্রিয়ায় অ্যাসিড ও ক্ষারের ধর্ম সম্পূর্ণ লোপ পেয়ে প্রশম লবণ এবং জল উৎপন্ন হয়। এই বিক্রিয়াকে প্রশমন বিক্রিয়া বলে।
প্রশমন বিক্রিয়ার উদাহরণ – তুল্য পরিমাণ হাইড্রোক্লোরিক অ্যাসিডের (HCl) সঙ্গে তুল্য পরিমাণ সোডিয়াম হাইড্রক্সাইডের (NaOH) বিক্রিয়ায় সোডিয়াম ক্লোরাইড ও জল উৎপন্ন হয়। দ্রবণে অ্যাসিড ও ক্ষারের ধর্ম সম্পূর্ণ লোপ পায়।
HCl + NaOH = NaCl + H2O
নির্দেশক কাকে বলে?
নির্দেশক (Indicator) – যে-সকল পদার্থ অ্যাসিড-ক্ষার বিক্রিয়া মাধ্যমে উপস্থিত থেকে নিজেদের বর্ণ পরিবর্তনের মাধ্যমে অ্যাসিড-ক্ষার প্রশমন ক্রিয়ার সমাপ্তিক্ষণ নির্দেশ করে, সেই পদার্থগুলিকে অ্যাসিড-ক্ষার নির্দেশক বলে। উদাহরণ – লিটমাস, মিথাইল অরেঞ্জ, ফেনলপ্থ্যালিন ইত্যাদি।
আম্লিক ও ক্ষারীয় দ্রবণে বিভিন্ন নির্দেশকের বর্ণ পরির্তন উল্লেখ করো।
কয়েকটি নির্দেশকের নাম এবং তাদের বর্ণ প্রশম দ্রবণে, অ্যাসিড দ্রবণে ও ক্ষার দ্রবণে কীভাবে পরিবর্তিত হয় তা নিম্নরূপ-
| নির্দেশকের নাম | প্রশম দ্রবণে বর্ণ বা স্বাভাবিক বর্ণ | অ্যাসিড দ্রবণে বর্ণ | ক্ষার দ্রবণে বর্ণ |
| লিটমাস | বেগুনি | লাল | নীল |
| ফেনলপ্থ্যালিন | বর্ণহীন | বর্ণহীন | গোলাপি |
| মিথাইল অরেঞ্জ | কমলা | লাল | হলুদ |
| মিথাইল রেড | কমলা | লাল | হলুদ |
নীচের যৌগগুলির জলীয় দ্রবণে ফেনলপ্থ্যালিন যোগ করলে দ্রবণের বর্ণ কী হবে? Ca(OH)2, HCl, Na2CO3, MgCl2, NaCl, NaHCO3।
| যৌগ | যৌগের জলীয় দ্রবণে ফেনলপ্থ্যালিনের বর্ণ |
| Ca(OH)2 | গোলাপি |
| HCl | বর্ণহীন |
| Na2CO3 | গোলাপি |
| MgCl2 | বর্ণহীন |
| NaCl | বর্ণহীন |
| NaHCO3 | গোলাপি |
প্রশমনক্ষণ কী? কীভাবে প্রশমনক্ষণ নির্ণয় করা হয়?
প্রশমনক্ষণ – অ্যাসিড-ক্ষার প্রশমন ক্রিয়ার যে মুহূর্তে তুল্য পরিমাণ অ্যাসিডের সঙ্গে তুল্য পরিমাণ ক্ষারের বিক্রিয়ায় অ্যাসিড ও ক্ষারের ধর্ম সম্পূর্ণ লোপ পেয়ে প্রশম লবণ ও জল উৎপন্ন হয়, সেই মুহূর্ত বা ক্ষণটিকেই প্রশমনক্ষণ বলে।
অ্যাসিড-ক্ষার প্রশমন বিক্রিয়ায় প্রশমনক্ষণ নির্ণয় করার জন্য উপযুক্ত নির্দেশক ব্যবহার করা হয় যা নিজ বর্ণ পরিবর্তনের মাধ্যমে অ্যাসিড ও ক্ষারের প্রশমন ক্রিয়ার সম্পূর্ণতা অর্থাৎ, প্রশমনক্ষণ নির্দেশ করে।
প্রশমন বিক্রিয়ায় নির্দেশকের প্রয়োজনীয়তা কী?
প্রশমন বিক্রিয়ায় নির্দেশকের প্রয়োজনীয়তা – অ্যাসিড ও ক্ষার উভয়েই বর্ণহীন দ্রবণ হওয়ায় তাদের প্রশমন বিক্রিয়ায় সমাপ্তি ক্ষণ বা প্রশমন ক্ষণ নির্ণয় করার জন্য নির্দেশক ব্যবহার করা হয়। কারণ – নির্দেশকগুলি অ্যাসিড ও ক্ষার দ্রবণে ভিন্ন ভিন্ন বর্ণ ধারণ করে এবং নিজের বর্ণ পরিবর্তনের মাধ্যমে অ্যাসিড ও ক্ষারের প্রশমন বিক্রিয়া সম্পূর্ণ হওয়ার সঠিক মুহূর্ত বা প্রশমনক্ষণ সঠিকভাবে নির্দেশ করে।
প্রশমন ক্রিয়ার প্রয়োগগুলি কী কী?
প্রশমন বিক্রিয়ার প্রয়োগ –
- মাটির আম্লিকতা হ্রাস করার জন্য এতে কলিচুন যোগ করা হয়। ফলে প্রশমন বিক্রিয়া ঘটে মাটির অম্লত্ব হ্রাস পায়। মাটির অম্লত্ব বৃদ্ধি পেলে গাছের বৃদ্ধি ব্যাহত হয়।
- মানুষের পাকস্থলীতে HCl -এর ক্ষরণ বৃদ্ধি পেলে অ্যাসিডিটি হয়। এই অবস্থায় অ্যান্টাসিড জাতীয় ট্যাবলেট খেলে অতিরিক্ত HCl প্রশমিত হয়।
2HCI + Mg(OH)2 → MgCl2 + 2H2O
- পিঁপড়ে বা মৌমাছি কামড়ালে এদের হুলে উপস্থিত অ্যাসিডের জন্য জ্বালা করে। ওই স্থানে NaOH যুক্ত সাবান ঘষলে তৎক্ষণাৎ প্রশমিত হয়।
- সাবমেরিন ও মহাকাশযানে যে দূষিত CO2 গ্যাস উৎপন্ন হয় তা দূর করার জন্য লিথিয়াম হাইড্রক্সাইড (ক্ষার) ব্যবহৃত হয়।
- দুধ খেলে তা পাকস্থলীতে উপস্থিত অতিরিক্ত HCl -কে প্রশমিত করতে পারে।
টাইট্রেশন কাকে বলে?
টাইট্রেশন (Titration) – জ্ঞাত মাত্রার অ্যাসিডের সাহায্যে অজ্ঞাত মাত্রার ক্ষার দ্রবণকে বা জ্ঞাত মাত্রার ক্ষার দ্রবণের সাহায্যে অজ্ঞাত মাত্রার অ্যাসিড দ্রবণকে প্রশমিত করার পদ্ধতিকে টাইট্রেশন বলে। টাইট্রেশনের দ্বারা অ্যাসিড বা ক্ষারের অজ্ঞাত মাত্রা নির্ণয় করা যায়।
লঘু অ্যাসিড (HCl) ও লঘু ক্ষার (NaOH) দ্রবণের টাইট্রেশন পদ্ধতিটি লেখো।
লঘু হাইড্রোক্লোরিক অ্যাসিড এবং লঘু কস্টিক সোডা দ্রবণের টাইট্রেশন –
প্রয়োজনীয় উপকরণ – ব্যুরেট, পিপেট, বিকার, স্ট্যান্ড, ক্ল্যাম্প, কাচদণ্ড, লঘু হাইড্রোক্লোরিক অ্যাসিড দ্রবণ, লঘু কস্টিক সোডার দ্রবণ, ফেনলপ্থ্যালিন।
পদ্ধতি –
একটি স্ট্যান্ড ও ক্ল্যাম্পের সাহায্যে একটি ব্যুরেটকে খাড়াভাবে রেখে তার মধ্যে লঘু NaOH দ্রবণ ঢেলে ব্যুরেটের শূন্য দাগ পর্যন্ত ভরতি করা হল।
একটি পিপেটের সাহায্যে একটি কনিক্যাল ফ্ল্যাস্কে 25 mL লঘু HCl দ্রবণ নিয়ে ওই দ্রবণের মধ্যে কয়েক ফোঁটা ফেনলপ্থ্যালিন নির্দেশক যোগ করা হল।

ব্যুরেটের নীচে নির্দেশকযুক্ত বর্ণহীন অ্যাসিড দ্রবণ সমেত কনিক্যাল ফ্লাস্কে বসানো হল। ব্যুরেটের নীচের স্টপকক খুলে ফোঁটা ফোঁটা করে ক্ষার দ্রবণ অ্যাসিড দ্রবণে যোগ করা হল এবং একটি কাচদণ্ডের সাহায্যে ক্রমাগত কনিক্যালের দ্রবণটিকে নাড়তে থাকা হল।
এভাবে ক্ষার যোগ করতে করতে এক সময় দেখা গেল আর এক ফোঁটা ক্ষার যোগ করার সঙ্গে সঙ্গে ফ্লাস্কের দ্রবণের বর্ণ বর্ণহীন থেকে হালকা গোলাপি হল। এটাই হল প্রশমনক্ষণ। এরপর আর এক ফোঁটা ক্ষার যোগ করলে দ্রবণের বর্ণ গোলাপি হয়ে গেল। ব্যুরেটের স্টপকক বন্ধ করে প্রশমনের জন্য ব্যবহৃত ক্ষারের দ্রবণের আয়তন ব্যুরেটের পাঠ থেকে জানা যাবে।

প্রশমন বিক্রিয়ার ব্যবহৃত নির্দেশকগুলি কীরূপ হওয়া প্রয়োজন? কীভাবে নির্দেশক নির্বাচন করা হয়? উদাহরণ দাও।
অথবা, অ্যাসিড ক্ষার প্রশমনের ক্ষেত্রে নির্দেশক নির্বাচনের জন্য মূল নীতি কী? অ্যাসিড ক্ষার প্রশমনের ক্ষেত্রে নির্দেশক নির্বাচন কীরূপে করা হয় – ব্যাখ্যা করো।
প্রশমন বিক্রিয়ায় ব্যবহৃত নির্দেশকগুলি এমন হতে হবে যে তারা যেন আম্লিক এবং ক্ষারীয় দ্রবণে ভিন্ন ভিন্ন বর্ণ প্রদর্শন করে। যেমন – মিথাইল অরেঞ্জ এই অম্ল-ক্ষারক নির্দেশকটি ক্ষারীয় দ্রবণে হলুদ এবং আম্লিক দ্রবণে লাল বর্ণ প্রদর্শন করে।
অ্যাসিড-ক্ষার প্রশমনের সময় প্রশমনক্ষণে দ্রবণের pH -এর মানের একটি দ্রুত ও বৃহৎ পরিবর্তন ঘটে। যেসব নির্দেশক এই pH পরিবর্তনের সীমার মধ্যে নিজেদের বর্ণ পরিবর্তনে সক্ষম, সেই সব নির্দেশকই ওই প্রশমন বিক্রিয়ায় ব্যবহারের পক্ষে উপযুক্ত।
ব্যাখ্যা – তীব্র অ্যাসিড ও তীব্র ক্ষারের প্রশমনের ক্ষেত্রে pH -এর পরিবর্তনের পাল্লাটি সবচেয়ে বেশি, প্রায় 4 – 10। তাই প্রায় সমস্ত নির্দেশকই এই pH সীমার মধ্যে বর্ণ পরিবর্তন করতে পারে। এক্ষেত্রে যে-কোনো নির্দেশকই ব্যবহার করা যায়। যেমন – HCl ও NaOH -এর প্রশমনক্ষণে pH -এর পাল্লা 3.34 – 9.7 (প্রায়), তাই এক্ষেত্রে মিথাইল অরেঞ্জ (pH সীমা 3.4 – 4.3) ব্যবহার করা যেতে পারে।
আবার, মৃদু অ্যাসিড ও মৃদু ক্ষারের প্রশমনের ক্ষেত্রে pH পরিবর্তনের সীমা খুব অল্প বিস্তারের। কোনো অ্যাসিড-ক্ষারক নির্দেশক এই pH সীমার মধ্যে বর্ণ পরিবর্তন করতে পারে না, তাই এক্ষেত্রে প্রশমনক্ষণে উপযুক্ত নিদের্শক পাওয়া যায় না।
মৃদু ‘অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় প্রশমনক্ষণে দ্রবণের pH -এর পরিবর্তন হয় 7 – 10 এই পাল্লার মধ্যে। যেহেতু ফেনলপ্থ্যালিন নির্দেশকের বর্ণ পরিবর্তনের pH সীমা 8.2 – 10, তাই মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় ফেনলপ্থ্যালিন নির্দেশক ব্যবহার করা হয়।
অ্যাসিড ও ক্ষারের প্রকৃতি অনুযায়ী বিভিন্ন প্রশমন বিক্রিয়া ও উপযোগী নির্দেশকের নাম লেখো।
অ্যাসিড ও ক্ষারের প্রকৃতি অনুযায়ী কোন্ ধরনের প্রশমন বিক্রিয়ায় কোন্ নির্দেশক উপযোগী তা নিম্নরূপ –
| প্রশমন ক্রিয়া | অ্যাসিড | ক্ষার | ব্যবহৃত নির্দেশক |
| তীব্র অ্যাসিড ও তীব্র ক্ষার | HCl | NaOH | যে-কোনো নির্দেশক |
| তীব্র অ্যাসিড ও মৃদু ক্ষার | H2SO4 | NH4OH | মিথাইল অরেঞ্জ |
| মৃদু অ্যাসিড ও তীব্র ক্ষার | CH3COOH | NaOH | ফেনলপ্থ্যালিন |
| মৃদু অ্যাসিড ও মৃদু ক্ষার | CH3COOH | NH4OH | কোনো উপযুক্ত নির্দেশক নেই |
মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমনক্ষণ কোন্ নির্দেশকের সাহায্যে নির্ণয় করবে এবং কেন উদাহরণসহ ব্যাখ্যা করো।
মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় প্রশমনক্ষণ নির্ণয় করার জন্য ফেনলপ্থ্যালিন নির্দেশক হিসেবে ব্যবহার করা হয়।
মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় দ্রবণের pH -এর মান ধীরে ধীরে বাড়তে থাকে এবং প্রশমণক্ষণের কাছাকাছি pH -এর মান আকস্মিকভাবে বৃদ্ধি পেয়ে প্রায় 7 থেকে 10 হয়। মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষণ ঘটায় প্রশমনক্ষণে দ্রবণের pH সর্বদা 7 -এর চেয়ে বেশি হয়। যে-সমস্ত নির্দেশক ক্ষারীয় অঞ্চলে (pH > 7) বর্ণ পরিবর্তন করে তাদের এই ধরনের প্রশমনে ব্যবহার করা হয়। যেহেতু ফেনল্যালিন নির্দেশকের বর্ণ পরিবর্তনের pH সীমা 8.2 – 10 তাই মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমন বিক্রিয়ায় ফেনলপ্থ্যালিন নির্দেশক ব্যবহার করা হয়।
pH বলতে কী বোঝায়? POH কী?
pH – কোনো দ্রবণের H3O+ আয়নের মোলার গাঢ়ত্বের কণায়ক লগারিদমকে (base 10) ওই দ্রবণের pH বলা হয়। pH = -log10 [H3O+]।
[H3O+] হল H3O+ আয়নের মোলার গাঢ়ত্ব। দ্রবণে H3O+ আয়নের গাঢ়ত্ব বৃদ্ধি পেলে pH হ্রাস পায় এবং দ্রবণের H3O+ আয়নের গাঢ়ত্ব হ্রাস পেলে pH বৃদ্ধি পায়।
pOH – কোনো দ্রবণের OH– আয়নের মোলার গাঢ়ত্বের ঋণাত্মক লগারিদমকে (base 10) ওই দ্রবণের pOH বলা হয়। pOH = -log10[OH–]। [OH–] হল OH– আয়নের মোলার গাঢ়ত্ব।
25°C উষ্ণতায় বিশুদ্ধ জলের pH ও pOH এর মধ্যে সম্পর্ক কী?
25°C উষ্ণতায় বিশুদ্ধ জলের pH এ pOH -এর মাধ্য সম্পর্ক – pH + pOH = 14
25°C উষ্ণতায় কোনো দ্রবণে H3O+ আয়নের গাঢ়ত্ব যদি 10-4 mol⋅L-1 হয় তবে ওই দ্রবণের pOH -এর মান কত হবে?
25°C উষ্ণতায় কোনো দ্রবণে H3O+ আয়নের গাঢ়ত্ব = 10-4 mol⋅L-1
∴ [H3O+] = 10-4 mol⋅L-1
25°C উষ্ণতায় দ্রবণের pH = -log [H3O+]
= -log 10-4
= -(-4)
= +4
25°C উষ্ণতায় = pH + pOH = 14
বা, pOH = 14 – pH
বা, pOH = 14 – 4
বা, pOH = 10
∴ দ্রবণটির pOH = 10
কোনো জলীয় দ্রবণে H3O+ আয়নের গাঢ়ত্ব যদি 1 × 10-9 mol⋅L-1, ওই দ্রবণের pH -এর মান কত হবে?
কোনো জলীয় দ্রবণের H3O+ আয়নের গাঢ়ত্ব = [H3O+] = 1 × 10-9 mol⋅L-1
দ্রবণের pH = -log [H3O+]
= -log 1 × 10-9
= -(-9)
= +9
∴ দ্রবণটির pH = 9
pH স্কেল কী? কোনো দ্রবণের pH -এর মান থেকে দ্রবণটির প্রকৃতি সম্বন্ধে কীরূপ ধারণা পাওয়া যায়?
pH স্কেল (pH scale) – তরল জলের কিছু পরিমাণ অণু H+ ও OH– আয়নে বিয়োজিত অবস্থায় উপস্থিত থাকে। বিশুদ্ধ জলে এই H+ ও OH– আয়নের সংখ্যা সমান হয়। তাই বিশুদ্ধ জল একটি প্রশম পদার্থ। আম্লিক দ্রবণে H+ -এর গাঢ়ত্ব OH– আয়নের গাঢ়ত্বের তুলনায় বৃদ্ধি পায়। আবার ক্ষারীয় দ্রবণে H+ আয়নের তুলনায় OH– -এর গাঢ়ত্ব বেশি হয়। হাইড্রোজেন আয়নের গাঢ়ত্বের ওপর নির্ভর করে আম্লিক ও ক্ষারীয় দ্রবণের শক্তি নির্ণয় করার জন্য বিজ্ঞানী সোরেনসন যে স্কেল উদ্ভাবন করেন, তাকে pH স্কেল বলে।
কোনো দ্রবণ কতটা আম্লিক বা ক্ষারকীয় তা মাপা হয় pH স্কেলের সাহায্যে। কোনো দ্রবণের pH ওই দ্রবণের হাইড্রোজেন আয়ন গাঢ়ত্বের ব্যস্তানুপাতি হয়।
নির্দিষ্ট উষ্ণতায় (সাধারণত 25°C) সুতরাং, pH -এর পাল্লার ওপর ভিত্তি করে কোনো দ্রবণের প্রকৃতি নির্বাচন করা যায়। যেমন –
- প্রদত্ত দ্রবণটির pH -এর মান যদি 7 -এর কম হয় (< 7 হয়) তাহলে দ্রবণটি আম্লিক।
- প্রদত্ত দ্রবণটির pH -এর মান যদি 7 -এর বেশি হয় (> 7 হয়) তাহলে দ্রবণটি ক্ষারকীয়।
- প্রদত্ত দ্রবণটির pH -এর মান যদি 7 হয় (= 7 হয়) তবে দ্রবণটি প্রশম হয়।
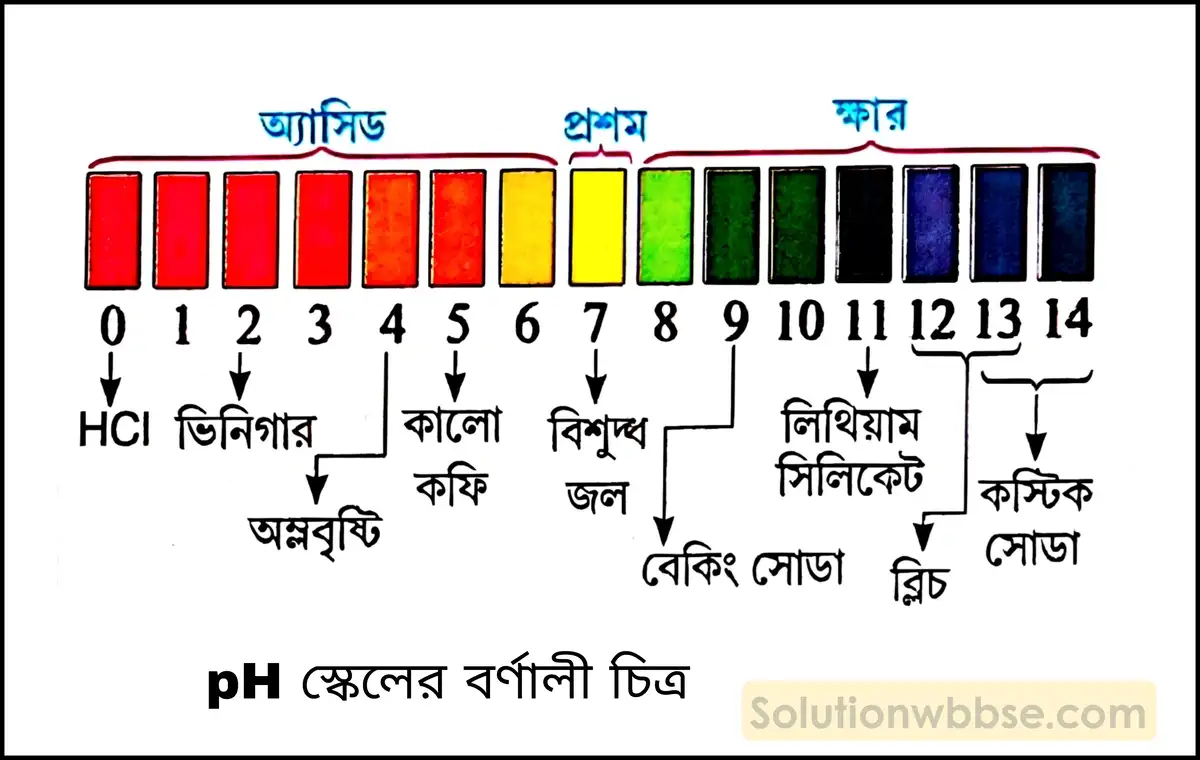
কোনো দ্রবণের pH -এর মান শূন্য অপেক্ষা কম বা 14 -এর বেশি হতে পারে কি?
ব্যাবহারিক ক্ষেত্রে pH -এর মান 0 থেকে 14 -এর মধ্যবর্তী হয়। এটি কেবলমাত্র লঘু দ্রবণের ক্ষেত্রে প্রযোজ্য। কিন্তু দ্রবণে H3O+ আয়নের গাঢ়ত্ব 1 গ্রাম আয়ন/লিটারের বেশি হলে pH -এর মান 0 -এর থেকে কম হয় বা ঋণাত্মক হতে পারে। আবার দ্রবণে OH– আয়নের গাঢ়ত্ব 1 গ্রাম আয়ন/লিটারের বেশি হলে pH -এর মান 14 -এর বেশি হতে পারে। অর্থাৎ, 0 -এর কম অথবা 14 -এর বেশি হতে হলে অ্যাসিড বা ক্ষার দ্রবণের গাঢ়ত্ব বেশি হতে হবে।
একটি জলীয় দ্রবণে pH -এর মান 1 একক বৃদ্ধি পেলে ওই দ্রবণে H3O+ আয়নের গাঢ়ত্বের কী পরিবর্তন হবে?
দ্রবণের H3O+ আয়নের গাঢ়ত্ব = 10-pH
ধরা যাক, কোনো জলীয় দ্রবণে pH = x
∴ ওই দ্রবণে H3O+ আয়নের গাঢ়ত্ব = 10-x
দ্রবণটির pH 1 একক বৃদ্ধি করলে হয় (x + 1)
এক্ষেত্রে দ্রবণের H3O+ আয়নের গাঢ়ত্ব = 10-(x+1)
অর্থাৎ, দ্রবণের pH -এর মান এক একক বৃদ্ধি করলে দ্রবণের H3O+ আয়নের গাঢ়ত্ব 10 গুণ হ্রাস পাবে।
চারটি দ্রবণ M, N, O এবং P -এর H3O+ আয়নের গাঢ়ত্ব যথাক্রমে 10-2, 10-3, 10-4 এবং 10-5 mol⋅L-1। দ্রবণগুলির pH -এর মান নির্ণয় করো। দ্রবণগুলিকে তাদের আম্লিক চরিত্র বৃদ্ধির ক্রমানুসারে সাজাও।
M দ্রবণের H3O+ আয়নের গাঢ়ত্ব = 10-2 mol⋅L-1
∴ M দ্রবণের pH = -log1010-2 = -(-2) = 2
N দ্রবণের H3O+ আয়নের গাঢ়ত্ব = 10-3 mol⋅L-1
∴ N দ্রবণের pH = -log1010-3 = -(-3) = 3
O দ্রবণের H3O+ আয়নের গাঢ়ত্ব 10-4 mol·L-1
∴ O দ্রবণের pH = -log1010-4 = (-4) = 4
P দ্রবণের H3O+ আয়নের গাঢ়ত্ব = 10-5 mol⋅L-1
∴ P দ্রবণের pH = -log1010-5 = -(-5) = 5
কোনো দ্রবণের pH -এর মান যত বাড়ে তত দ্রবণটির আম্লিক চরিত্র হ্রাস পায়। অপরপক্ষে pH -এর মান যত হ্রাস পায় দ্রবণটির আম্লিক চরিত্র তত বৃদ্ধি পায়।
সুতরাং, চারটি দ্রবণকে তাদের আম্লিক চরিত্র বৃদ্ধির ক্রমানুসারে সাজালে হয় – P < O < N < M।
সর্বজনীন pH নির্দেশক ও pH পেপার কী?
সর্বজনীন pH নির্দেশক – নির্দেশকের সাহায্যে আমরা কোনো দ্রবণ আম্লিক, ক্ষারীয় না প্রশম তা জানতে পারি, কিন্তু ওই অ্যাসিড বা ক্ষারের শক্তি অজানা থাকে। সর্বজনীন pH নির্দেশক হল একাধিক বহুল ব্যবহৃত নির্দেশকের মিশ্রণ যা সম্পূর্ণ pH স্কেলের বিভিন্ন pH মানের জন্য বিভিন্ন বর্ণ প্রদর্শন করে।
সর্বজনীন নির্দেশক বিভিন্ন pH মানের জন্য যেভাবে বর্ণ পরিবর্তন করে তা নিম্নরূপ –
| pH | বর্ণ |
| 0 | গাঢ় লাল |
| 1 | লাল |
| 2 | লাল |
| 3 | কমলা লাল |
| 4 | কমলা |
| 5 | কমলা হলুদ |
| 6 | সবুজাভ হলুদ |
| 7 | সবুজ |
| 8 | সবুজাভ নীল |
| 9 | নীল |
| 10 | ঘন নীল (নেভি ব্লু) |
| 11 | বেগুনি |
| 12 | বেগুনি |
| 13 | বেগুনি |
| 14 | বেগুনি |
pH পেপার – সর্বজনীন নির্দেশক দ্রবণরূপে ও টেস্ট কাগজ রূপে পাওয়া যায়। এই টেস্ট কাগজকে pH পেপার বলে।
pH পেপারের সাহায্যে বিভিন্ন দ্রবণের pH নির্ণয় পদ্ধতি আলোচনা করো।
pH পেপারের সাহায্যে বিভিন্ন দ্রবণের pH নির্ণয় পদ্ধতি – কোনো দ্রবণের pH নির্ণয় করার জন্য ওই দ্রবণের একফোঁটা সর্বজনীন নির্দেশক কাগজ বা pH পেপারের ওপর ফেলা হয়। কিছুক্ষণ পরে দেখা যায় যে, pH পেপারের টুকরোটি একটি নির্দিষ্ট বর্ণ সৃষ্টি করেছে। ওই বর্ণ pH বর্ণ তালিকায় (pH colour chart) প্রদত্ত কোন্ বর্ণের সঙ্গে মিলছে তা ভালোভাবে পর্যবেক্ষণ করে প্রদত্ত দ্রবণের pH নির্ণয় করা হয়। যেমন – কোনো দ্রবণের এক ফোঁটা নিয়ে pH পেপারে ফেললে কাগজটি গাঢ় লাল রং দেখায়। এর থেকে বোঝা যায় যে, দ্রবণটি তীব্র আম্লিক প্রকৃতির। আবার কমলা বর্ণ নির্দেশ করে যে দ্রবণের pH মান প্রায় 4 এবং দ্রবণটি মৃদু অ্যাসিড প্রকৃতির। বিভিন্ন শক্তিমাত্রার ক্ষারীয় দ্রবণের জন্য pH পেপারও বিভিন্ন বর্ণ প্রদর্শন করে। প্রশম প্রকৃতির দ্রবণের জন্য pH পেপারের বর্ণ হয় সবুজ। তাই জলের ফোঁটা যোগ করলে pH পেপারের বর্ণ সবুজ হয়ে যায়।

দ্রবণের H+ আয়নের গাঢ়ত্বের সঙ্গে pH কীরূপে সম্পর্কিত?
আমরা জানি, pH = -log [H3O+]
এখন, pH 1 একক বাড়লে H3O+ আয়নের গাঢ়ত্ব 10-1 mol/L পরিবর্তিত হয় অর্থাৎ, দ্রবণে H3O+ আয়নের গাঢ়ত্ব 10-1 mol/L হ্রাস পাবে।
দাঁতের ক্ষয়ের ওপর pH -এর প্রভাব ও প্রতিরোধের উপায় সম্বন্ধে লেখো।
দাঁতের ক্ষয়ের ওপর pH -এর প্রভাব – আমরা কোনো শর্করাযুক্ত খাবার খেলে, আমাদের মুখে উপস্থিত কিছু ব্যাকটেরিয়া সেই শর্করাকে ভেঙে অ্যাসিড উৎপন্ন করে। অর্থাৎ, মিষ্টি কোনো কিছু খেলে আমাদের মুখের pH মাত্রা কমে যায়। pH মাত্রা যখন 5.5 -এর নীচে নেমে যায় তখন আমাদের দাঁতের ক্ষয় শুরু হয়। কারণ – 5.5 -এর নীচে আসলে অ্যাসিডের তীব্রতা যথেষ্ট বৃদ্ধি পায় এবং এই অ্যাসিড তখন দাঁতের এনামেলের ক্ষয় শুরু করে। যদিও আমাদের দাঁতের এনামেল গঠিত হয় ক্যালশিয়াম ফসফেট [Ca3(PO4)2] যৌগ দ্বারা, যা আমাদের শরীরস্থিত সর্বাপেক্ষা শক্ত পদার্থ, কিন্তু pH -এর মান 5.5 -এর নীচে নামলে, সেটিও ক্ষয় হতে শুরু করে।
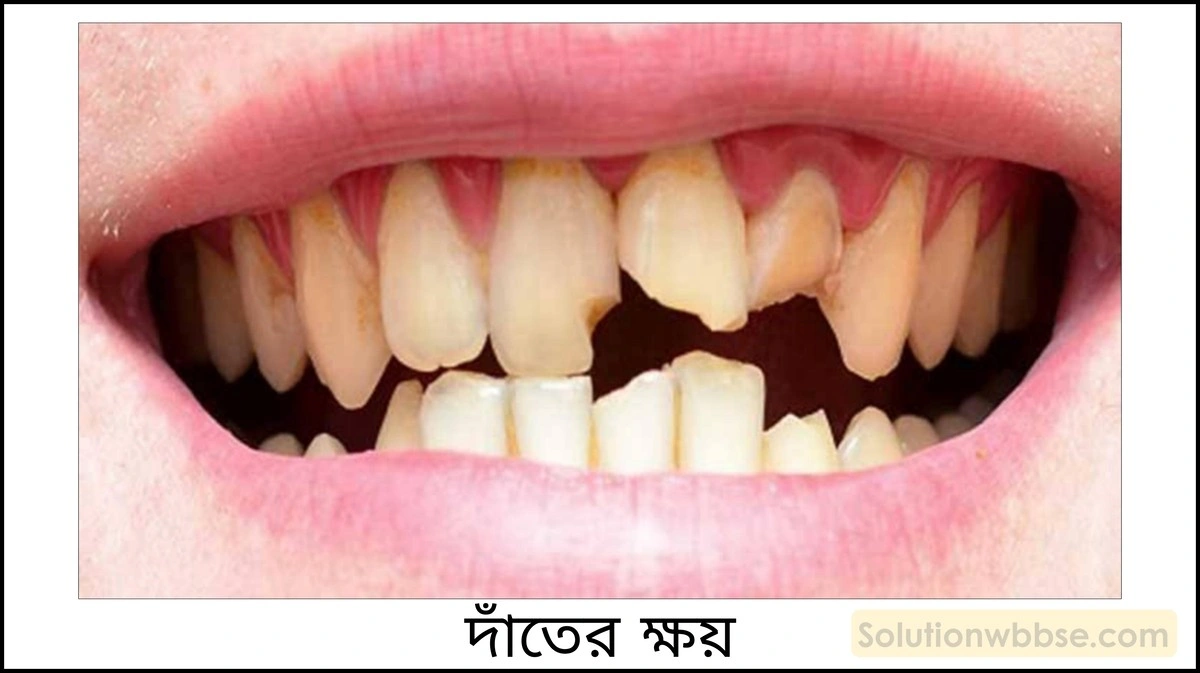
দাঁতের ক্ষয়ের প্রতিরোধের উপায় – দাঁতের ক্ষয় রোধ করার সর্বাপেক্ষা কার্যকরী উপায় হল খাওয়ার পর ভালো করে মুখ ধোয়া। বেশির ভাগ টুথপেস্টে ক্ষারজাতীয় পদার্থ যোগ করে এর pH -এর মান 8.0 করা হয় যা মুখের অ্যাসিডকে প্রশমিত করে এবং দাঁতকে ক্ষয়ের হাত থেকে রক্ষা করে। দন্তক্ষয় রোধের অন্য উপায় হল বেশি লজেন্স, চকোলেট, আইসক্রিম, মিষ্টিজাতীয় জিনিস খাওয়া থেকে বিরত থেকে দাঁত ভালো রাখা।
কৃষিক্ষেত্রে pH -এর প্রভাব উল্লেখ করো।
কৃষিক্ষেত্রে pH -এর প্রভাব – মাটির pH -এর মান 7.0 -এর কাছাকাছি থাকলে অধিকাংশ উদ্ভিদের বৃদ্ধি সর্বাধিক হয়। কোনো কারণে মাটির অম্লত্ব বা ক্ষারকত্ব বৃদ্ধি পেলে উদ্ভিদের বৃদ্ধি ব্যাহত হয় অথবা একেবারেই ফলন হয় না। মাটির অম্লত্ব বা ক্ষারকত্ব প্রাকৃতিক কারণেও বৃদ্ধি পেতে পারে, আবার নানা রাসায়নিক সার যোগ করার ফলেও বৃদ্ধি পেতে পারে। অম্লত্ব বৃদ্ধি পেলে pH -এর মান 4 হতে পারে আবার ক্ষারকত্ব বৃদ্ধির সঙ্গে সঙ্গে pH -এর মান 8.3 অবধি হতে পারে। মাটির pH পরীক্ষা করে সেই অনুযায়ী রাসায়নিক পদার্থ যোগ করে মাটিকে চাষের উপযোগী করা হয়।

সাধারণত জমির অম্লত্ব অত্যধিক বৃদ্ধি পেলে তা প্রশমিত করার জন্য পোড়াচুন (CaO), কলিচুন [Ca(OH)2] বা চক (CaCO3) ব্যবহার করা হয়। এরা ক্ষারকীয় হওয়ায় মাটির অতিরিক্ত অ্যাসিডের সঙ্গে বিক্রিয়া করে অম্লত্ব কমায়। আবার কখনো মাটির ক্ষারকত্ব বৃদ্ধি পেলে মাটিতে ম্যানুয়র বা কম্পোস্ট জাতীয় জৈব সার যোগ করা হয়, যার মধ্যে অম্লজাতীয় উপাদান বর্তমান থাকে।
মাটির অম্লত্ব নির্ণয় কীভাবে করা হয়?
মাটির অম্লত্ব নির্ণয় – নমুনা মাটির 2 g সংগ্রহ করে একটি টেস্টটিউবে নিয়ে 5 mL জল যোগ করা হয়। টেস্টটিউবটিকে ভালো করে ঝাঁকানোর পর ফিলটার কাগজের সাহায্যে দ্রবণটিকে ফিলটার। করা হয়। এবার একটি pH পেপার ও এই পরিসুতের সাহায্যে pH মান নির্ণয় করা হয়।
মৎস্যচাষে pH -এর মান বজায় রাখার প্রয়োজনীয়তা কী? জলাশয়ের pH মান কীভাবে বজায় রাখা হয়?
মৎস্যচাষে pH -এর গুরুত্ব – মাছের মতো জলজ প্রাণীরা 7.0 থেকে 7.8 -এর সংকীর্ণ pH মানের পাল্লার মধ্যে বেঁচে থাকে। বৃষ্টির জলের pH মান 5.6 বা তার কম হলে, সেই বৃষ্টিকে আমরা অ্যাসিড বৃষ্টি বলে থাকি। অতিরিক্ত পরিমাণ অ্যাসিড বৃষ্টির ফলে জলাশয়ের pH -এর মান হ্রাস পায়, যা জলজ প্রাণীদের মৃত্যুর কারণ হতে পারে।
জলের pH মাত্রা স্বাভাবিক রাখার জন্য এবং অ্যাসিড বৃষ্টির ফলে জলে বৃদ্ধিপ্রাপ্ত অম্লত্বকে হ্রাস করার জন্য জলাশয়ে কলিচুন বা ক্যালশিয়াম কার্বনেটের মতো ক্ষারকীয় পদার্থ যোগ করা হয়।
মানবদেহের খাদ্যের হজমে pH -এর ভূমিকা কী?
মানবদেহের পাকস্থলীতে HCl নিঃসৃত হয়। ফলে, পাকরসের pH -এর মান 1 – 2 -এর মধ্যে হয়। বদহজম হলে এই pH -এর মান 1.4 -এর কম হয়। কারণ তখন আরও বেশি পরিমাণে HCl নিঃসৃত হয়। ফলে, পাকস্থলীতে জ্বালা ও ব্যথা হয়। এর থেকে মুক্তি পেতে অ্যান্টাসিড খাওয়া হয়। কারণ – অ্যান্টাসিডগুলি মৃদু ক্ষার। ফলে, অতিরিক্ত অ্যাসিডের সঙ্গে প্রশমন বিক্রিয়া ঘটে ও পাকরসের pH -এর মান বৃদ্ধি পায়।
মানবদেহের রক্তে pH -এর ভূমিকা কী?
মানবদেহে রক্তের pH সামান্য ক্ষারীয় প্রকৃতির হয়। এর মান 7.36 – 7.42 -এর মধ্যে হয়। রক্তের pH -এর মান এই স্বাভাবিক মাত্রা অতিক্রম করলে মানুষের দেহে নানা রোগের সংক্রমণ ঘটে। তাই মানবদেহের রক্তের pH -এর একটি নির্দিষ্ট মান বজায় থাকা উচিত।
CO2 -এর জলীয় দ্রবণ ও Na2O -এর জলীয় দ্রবণকে pH পরিমাপের দ্বারা কীভাবে শনাক্ত করবে?
CO2 আম্লিক অক্সাইড, তাই এর জলীয় দ্রবণে কার্বনিক অ্যাসিড উৎপন্ন হয়। এই দ্রবণে pH কাগজ ডোবালে কাগজটি হালকা লাল বর্ণ ধারণ করে ও দ্রবণের pH -এর মান 7 অপেক্ষা কম হয়। প্রকৃতপক্ষে 1 মোলার H2CO3 দ্রবণের pH -এর মান 4.68।
CO2 + H2O = H2CO3 -এর থেকে বোঝা যায় CO2 -এর জলীয় দ্রবণ আম্লিক প্রকৃতির হয়।
অন্যদিকে, Na2O -এর জলীয় দ্রবণে pH কাগজ ডোবালে কাগজটি গাঢ় নীল বর্ণ ধারণ করে ও দ্রবণের pH -এর মান 7 অপেক্ষা বেশি হয়। প্রকৃতপক্ষে 1 মোলার NaOH দ্রবণের pH -এর মান 10.98। এ থেকে বোঝা যায় Na2O -এর জলীয় দ্রবণ ক্ষারীয় প্রকৃতির হয়। বাস্তবে Na2O -এর জলীয় দ্রবণ NaOH ক্ষার উৎপন্ন করে।
Na2O + H2O = 2NaOH
অক্সাইড কাকে বলে?
অক্সাইড (Oxide) – অক্সিজেনের সঙ্গে অন্য কোনো মৌলিক পদার্থের বিক্রিয়ায় যে দ্বিমৌল যৌগ গঠিত হয়, তাকে অক্সাইড বলে। যেমন – কার্বনকে বায়ুতে দহন করলে এটি বায়ুর অক্সিজেনের সঙ্গে যুক্ত হয়ে কার্বন ডাইঅক্সাইড গঠন করে।
C + O2 = CO2
অক্সাইড কয় প্রকার ও কী কী? প্রত্যেক প্রকার অক্সাইডের উদাহরণসহ সংজ্ঞা দাও।
অক্সাইড প্রধানত চার প্রকার –
- ক্ষারকীয় অক্সাইড;
- প্রশম অক্সাইড;
- আম্লিক অক্সাইড;
- উভধর্মী অক্সাইড।
আম্লিক অক্সাইড (Acidic oxide) – যে-সমস্ত অক্সাইড ক্ষারের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে, তাদের আম্লিক অক্সাইড বলে। উদাহরণ – কার্বন ডাইঅক্সাইড (CO2), নাইট্রোজেন ডাইঅক্সাইড (NO2), ফসফরাস পেন্টক্সাইড (P2O5), সালফার ডাইঅক্সাইড (SO2)। এরা আম্লিক অক্সাইড।
ক্ষারকীয় অক্সাইড (Basic oxide) – যে-সকল অক্সাইড অ্যাসিডের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে, তাদের ক্ষারকীয় অক্সাইড বলে। উদাহরণ – সোডিয়াম অক্সাইড (Na2O), ক্যালশিয়াম অক্সাইড (CaO) প্রভৃতি হল ক্ষারকীয় অক্সাইড।
প্রশম অক্সাইড (Neutral oxide) – যে-সকল অক্সাইড অ্যাসিড বা ক্ষারের সঙ্গে বিক্রিয়া করে না, তাদের প্রশম অক্সাইড বলে। উদাহরণ – কার্বন মনোক্সাইড (CO), নাইট্রাস অক্সাইড (N2O), নাইট্রিক অক্সাইড (NO), জল (H2O) প্রভৃতি হল প্রশম অক্সাইড।
উভধর্মী অক্সাইড (Amphoteric oxide) – যে-সকল অক্সাইড অ্যাসিড ও ক্ষার উভয়ের সঙ্গেই বিক্রিয়া করে লবণ ও জল উৎপন্ন করে, তাদের উভধর্মী অক্সাইড বলে। উদাহরণ – জিংক অক্সাইড (ZnO) ও অ্যালুমিনিয়াম অক্সাইড (Al2O3) প্রভৃতি হল উভধর্মী অক্সাইড। এদের মধ্যে আম্লিক ও ক্ষারকীয় উভয় ধর্মই বর্তমান।
আম্লিক ধর্ম –
ক্ষারকীয় ধর্ম –
ধাতব অক্সাইড এবং অধাতব অক্সাইড কোনটি কী ধরনের অক্সাইড হয়?
সাধারণত ধাতব অক্সাইডগুলি ক্ষারকীয় প্রকৃতির এবং অধাতব অক্সাইডগুলি আম্লিক প্রকৃতির হয়ে থাকে। যেমন – সোডিয়াম, ক্যালশিয়াম, ম্যাগনেশিয়াম প্রভৃতি ধাতুর অক্সাইডগুলি হল যথাক্রমে সোডিয়াম অক্সাইড (Na2O), ক্যালশিয়াম অক্সাইড (CaO), ম্যাগনেশিয়াম অক্সাইড (MgO) যারা অ্যাসিডের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে, অর্থাৎ, এরা ক্ষারকীয় অক্সাইড।
আবার কার্বন ডাইঅক্সাইড (CO2), সালফার ডাইঅক্সাইড (SO2) প্রভৃতি অধাতব অক্সাইড আম্লিক প্রকৃতির যারা ক্ষারের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে।
প্রদত্ত অক্সাইডগুলির কোনটি কোন্ শ্রেণির? – N2O, MgO, Na2O, H2O, CO2, CO, Al2O3, CaO
প্রদত্ত অক্সাইডগুলিকে নিম্নোক্তরূপে শ্রেণিভুক্ত করা যায় –
| আম্লিক অক্সাইড | ক্ষারকীয় অক্সাইড | উভধর্মী অক্সাইড | প্রশম অক্সাইড |
| CO2 | MgO, Na2O, CaO | Al2O3 | N2O, H2O, CO |
জিংক অক্সাইডকে উভধর্মী অক্সাইড বলা হয় – উপযুক্ত সমীকরণসহ ব্যাখ্যা করো।
জিংক অক্সাইডকে (ZnO) উভধর্মী অক্সাইড বলা হয় কারণ – জিংক অক্সাইড অ্যাসিড ও ক্ষার উভয়ের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে। যেমন – জিংক অক্সাইড (ZnO) হাইড্রোক্লোরিক অ্যাসিডের (HCl) সঙ্গে বিক্রিয়ায় জিংক ক্লোরাইড (ZnCl2) লবণ ও জল উৎপন্ন হয়।
ZnO + 2HCl = ZnCl2 + H2O
জিংক অক্সাইড সোডিয়াম হাইড্রক্সাইডের (NaOH) সঙ্গে বিক্রিয়ায় সোডিয়াম জিংকেট লবণ (Na2ZnO2) ও জল উৎপন্ন করে।
ZnO + 2NaOH = Na2ZnO2 + H2O
Al2O3 -কে উভধর্মী অক্সাইড বলা হয় কেন?
Al2O3 -কে উভধর্মী অক্সাইড বলা হয় কারণ – অ্যাসিডের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে।
Al2O3 ক্ষারের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে।
পলি অক্সাইড, মিশ্র অক্সাইড, সাব অক্সাইড ও সুপার অক্সাইডের সংজ্ঞা দাও।
পলি অক্সাইড – যেসব ধাতব অক্সাইডে যত পরিমাণ অক্সিজেন থাকা দরকার তার চেয়ে বেশি পরিমাণ অক্সিজেন থাকে, কিন্তু অ্যাসিডের সঙ্গে বিক্রিয়ায় হাইড্রোজেন পারক্সাইড উৎপন্ন করে না, তাদের পলি অক্সাইড বলে। যেমন – ম্যাঙ্গানিজ হেপ্টক্সাইড (Mn2O7)।
মিশ্র অক্সাইড – একই ধাতুর একাধিক যোজ্যতার অক্সাইডের সংমিশ্রণে গঠিত অক্সাইডকে মিশ্র অক্সাইড বলে। যেমন – ফেরোসোফেরিক অক্সাইড (Fe3O4), ফেরিক অক্সাইড (Fe2O3) এবং ফেরাস অক্সাইডের (FeO) সংমিশ্রণে গঠিত।
সাব অক্সাইড – যেসব মৌলের অক্সাইডে যত পরিমাণ অক্সিজেন থাকা দরকার তার চেয়ে কম পরিমাণ অক্সিজেন থাকলে, তাকে সাব অক্সাইড বলে। যেমন – কার্বন সাবঅক্সাইড (C3O2)।
সুপার অক্সাইড – যে-সমস্ত অক্সাইডে অ্যানায়ন হিসেবে [O-O]– বা \(O_2^-\) আয়ন উপস্থিত থাকে, তাদের সুপার অক্সাইড বলে। যেমন – পটাশিয়াম সুপার অক্সাইড (KO2), ক্যালশিয়াম সুপার অক্সাইড [Ca(O2)2]।
অম্লবৃষ্টি কাকে বলে? এর কারণ উল্লেখ করো।
অম্লবৃষ্টি (Acid Rain) – বৃষ্টির জলের pH মান 5.6 -এর নীচে নেমে গেলে অর্থাৎ অম্লত্ব বৃদ্ধি পেলে, সেই বৃষ্টিকে অম্লবৃষ্টি বলে।
অম্লবৃষ্টির কারণ – গাড়ির ধোঁয়া, তাপবিদ্যুৎ কেন্দ্র, কলকারখানা ও তৈলশোধনাগার থেকে নিঃসৃত হয়ে SO2, NO2 -এর মতো আম্লিক প্রকৃতির গ্যাসীয় অক্সাইডগুলি বায়ুর সঙ্গে মেশে। আবার, বৃষ্টির সময় বিদ্যুৎ স্ফুলিঙ্গের ফলে N2 ও SO2 বায়ুর অক্সিজেনের সঙ্গে যুক্ত হয়ে NO2 ও SO2 -তে পরিণত হয়।
N2 + O2 = 2NO; 2NO + O2 = 2NO2; 2SO2 + O2 = 2SO3
বৃষ্টির জলে এই গ্যাসগুলি দ্রবীভূত হয়ে HNO2, HNO3, H2SO3 এবং H2SO4 উৎপন্ন করে।
NO2 + H2O = HNO3 + HNO2; SO2 + H2O = H2SO3; SO3 + H2O = H2SO4
আবার, বাতাসে উপস্থিত CO2 জলের সঙ্গে যুক্ত হয়ে H2CO3 উৎপন্ন করে।
CO2 + H2O = H2CO3
এই অ্যাসিডগুলি শিশির, তুষার বা বৃষ্টির জলে মিশে pH -এর মান 5.6 -এর নীচে নামিয়ে দেয় এবং অম্লবৃষ্টির সৃষ্টি হয়।
কে প্রথম Acid rain কথাটি প্রচলন করেন?
বিজ্ঞানী রবার্ট অ্যানজাস স্মিথ প্রথম Acid rain কথাটি প্রচলন করেন।
পরিবেশের ওপর অম্লবৃষ্টির প্রভাব সম্বন্ধে আলোচনা করো।
পরিবেশের ওপর অম্লবৃষ্টির প্রভাব – অম্লবৃষ্টির ফলে আমাদের পরিবেশের বিভিন্ন জৈব উপাদান, যেমন – উদ্ভিদ, জলজ প্রাণী, মানুষ এমনকি অট্টালিকা, স্মৃতিসৌধ, ইমারতের মতো অজৈব উপাদানও ক্ষতিগ্রস্ত হয়।
উদ্ভিদের ওপর প্রভাব – অম্লবৃষ্টির ফলে বিস্তীর্ণ অঞ্চলের ফসল ক্ষতিগ্রস্ত হয়। গাছের পাতা ঝলসে যায়, পাতা কুঁকড়ে যায়, মাটির অম্লত্ব বৃদ্ধি পাওয়ায় উর্বরতা হ্রাস পায় ও ফসল উৎপাদন ব্যাহত হয়। আবার অম্লবৃষ্টির ফলে, সালোকসংশ্লেষ প্রক্রিয়া ব্যাহত হয়। মাটির কিছু ব্যাকটেরিয়া মারা যায় এবং মাটিতে উপস্থিত ধাতব, অধাতব লবণগুলি দ্রবীভূত হয়ে গিয়ে উদ্ভিদদেহে প্রবেশ করে ও ক্ষতির কারণ হয়।

জলজ জীবের ওপর প্রভাব – জলজ জীবেরা pH মানের সংকীর্ণ ব্যাপ্তির মধ্যে জীবনধারণ করে। অম্লবৃষ্টির ফলে pH -এর মান 5.6 -এর নীচে নেমে যায়। ফলে, পুকুর, নদী, খাল প্রভৃতি জলাশয়ের জলের অম্লত্বও বৃদ্ধি পায়। জলজ উদ্ভিদ ও প্রাণীর উৎপাদন ব্যাহত হয় এবং অম্লত্ব বেশি হয়ে গেলে এরা মৃত্যুমুখে পতিত হয়।
মানুষের ওপর প্রভাব – অম্লবৃষ্টির ফলে বিভিন্ন ক্ষতিকর ধাতব পদার্থ ভূগর্ভস্থ জলের সঙ্গে মেশে। যা পানীয় জল হিসেবে গ্রহণ করলে শরীরে প্রবেশ করে, স্নায়ুতন্ত্র ও পরিপাক ক্রিয়ার কাজ ব্যাহত করে। এছাড়া অম্লবৃষ্টির ফলে মানুষের ত্বক ও চুল ক্ষতিগ্রস্ত হয়।
বিভিন্ন স্থাপত্যের ওপর প্রভাব – মারবেল পাথর নির্মিত বিভিন্ন প্রকার ঘরবাড়ি, স্মৃতিসৌধ, ইমারত, যেমন – তাজমহল, ভিক্টোরিয়া মেমোরিয়ালের মতো ঐতিহাসিক স্থাপত্যগুলি ক্ষতিগ্রস্ত হয়। বৃষ্টিতে উপস্থিত অ্যাসিড মারবেল পাথরের সঙ্গে বিক্রিয়া করে ক্ষতের সৃষ্টি করে, যা স্টোন ক্যানসার নামে পরিচিত।

তাজমহলের মতো স্থাপত্যগুলির উজ্জ্বলতা হ্রাসে অম্লবৃষ্টির ভূমিকা কী? প্রতিকারের সম্ভাব্য উপায়গুলি লেখো।
পৃথিবী বিখ্যাত স্মৃতিসৌধ তাজমহল মারবেল পাথর দ্বারা নির্মিত। বৃষ্টির জলের সঙ্গে উৎপন্ন অ্যাসিড মারবেলের সঙ্গে বিক্রিয়া করে CaSO4 ও Ca(NO3)2 উৎপন্ন করে।
CaCO3 + H2SO4 = CaSO4↓ + CO2↑ + H2O
CaCO3 + 2HNO3 = Ca(NO3)2↓ + CO2↑ + H2O
এই সালফেট ও নাইট্রেট লবণের উপস্থিতিতে তাজমহলের শ্বেতশুভ্র মারবেল পাথর ক্রমশ বিবর্ণ ও অনুজ্জ্বল হয়ে পড়ছে। আসিডের সঙ্গে বিক্রিয়া করে পাথরও ক্রমশ ক্ষয়প্রাপ্ত হচ্ছে, ছোটো ছোটো গর্তযুক্ত হচ্ছে, মারবেলের আঁশ ও অনুস্তর অপসারিত হচ্ছে। এভাবে তাজমহলের উজ্জ্বলতা দিন দিন হ্রাস পাচ্ছে।
প্রতিরোধের উপায় –
- তাজমহলকে ক্ষয়ের হাত থেকে বাঁচানোর জন্য তাজমহলের আশপাশের কারখানাগুলিকে সালফারযুক্ত জ্বালানির পরিবর্তে CNG বা LPG ব্যবহার করার সুপারিশ করা হয়েছে। নতুন কলকারখানা তৈরির ওপর নিষেধাজ্ঞা জারি ও যান চলাচল নিয়ন্ত্রণ করতে হবে। এছাড়া পার্শ্ববর্তী গৃহস্থালির কাজেও জীবাশ্ম জ্বালানির পরিবর্তে LPG ব্যবহার করার কথা বলা হয়েছে।
- ধাতু নিষ্কাশন কেন্দ্রে চুল্লির মধ্যে চুনাপাথর রাখলে উৎপন্ন SO2 উৎপাদনস্থলেই ক্যালশিয়াম সালফাইড ও ক্যালশিয়াম সালফেটে পরিণত হয়।
- মোটর গাড়ি থেকে নির্গত ধোঁয়া বায়ুতে মেশার আগে Pt যুক্ত Al2O3 -এর উপর দিয়ে চালনা করলে SO2 বায়ুতে মিশতে পারে না।
স্বর্ণকারের কর্মশালায় উৎপন্ন বায়ুদূষক গ্যাসটি কী? এটি কীভাবে উৎপন্ন হয়? স্বর্ণকারের কারখানায় দূষণ প্রতিরোধের উপায় কী কী?
স্বর্ণকারের কর্মশালায় উৎপন্ন বায়ুদূষক গ্যাসটি হল নাইট্রোজেন ডাইঅক্সাইড (NO2)।
পুরোনো সোনার গয়না থেকে খাদ অপসারিত করার জন্য খাঁটি সোনাকে গাঢ় HNO3 সহযোগে ফোটানো হয়। অবিশুদ্ধ সোনার মধ্যে থাকা কপার ও সিলভার গাঢ় HNO3 -এর সঙ্গে বিক্রিয়ায় ধাতুগুলির নাইট্রেট লবণ, জলীয় বাষ্প ও বাদামি বর্ণের নাইট্রোজেন ডাইঅক্সাইড (NO2) উৎপন্ন করে।
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
Ag + 2HNO3 = AgNO3 + NO2↑ + H2O
নাইট্রোজেন ডাইঅক্সাইড (NO2) একটি বায়ুদূষক গ্যাস যা প্রশ্বাসের মাধ্যমে শরীরে প্রবেশ করে শ্বাসকষ্ট, ব্রংকাইটিস, ফুসফুসের রক্তক্ষরণ ইত্যাদি রোগের সৃষ্টি করে। এছাড়া কাজের শেষে উদ্বৃত্ত অ্যাসিড যেখানে সেখানে বা নর্দমায় ফেললে তা মাটি ও জলকে দূষিত করে।
স্বর্ণকারের কারখানায় দূষণ প্রতিরোধের উপায় –
- অবিশুদ্ধ সোনা থেকে খাদ অপসারণের প্রক্রিয়াটি একটি আবদ্ধ বিক্রিয়া কক্ষে করা উচিত। এছাড়া নির্গম নল দিয়ে উৎপন্ন গ্যাস বাতাসে মেশার পূর্বে রাসায়নিক শোষণ পদ্ধতিতে NO2 গ্যাস অপসারণ করা দরকার। এই পদ্ধতিতে অ্যাসিড শোষক হিসেবে H2SO4 বা ক্ষারীয় শোষক হিসেবে Mg(OH)2 এবং Ca(OH)2 ব্যবহার করা হয়।
- উদ্বৃত্ত অ্যাসিডকে নির্দিষ্ট জায়গায় ফেলে অতিরিক্ত চুন প্রয়োগ করে প্রশমিত করা উচিত।
বাতাসে SO2 গ্যাসের প্রধান উৎসগুলি উল্লেখ করো।
যানবাহনের ধোঁয়া, ভারী ধাতুর শিল্পোৎপাদন এবং পেট্রোলিয়াম পরিশোধন প্রভৃতিতে কলকারখানার চুল্লি থেকে SO2 গ্যাস বাতাসে নির্গত হয়।
অ্যাসিড নিরুদক কাকে বলে?
অ্যাসিড নিরুদক (acid anhydride) – কোনো আম্লিক অক্সাইডে জল যোগ করলে যে অ্যাসিড পাওয়া যায়, সেই অক্সাইডটিকে উৎপন্ন অ্যাসিডের নিরুদক বলা হয়। যেমন – সালফার ডাইঅক্সাইড (SO2) সালফিউরাস অ্যাসিডের (H2SO4) নিরুদক, কারণ – SO2 জলে দ্রবীভূত হয়ে সালফিউরাস অ্যাসিড উৎপন্ন করে।
SO2 + H2O = H2SO3
মিশ্র অ্যাসিড নিরুদক বলতে কী বোঝায়? উদাহরণ দিয়ে বোঝাও।
মিশ্র অ্যাসিড নিরুদক – কোনো আম্লিক অক্সাইড জলের সঙ্গে বিক্রিয়া করে একাধিক অ্যাসিড গঠন করলে ওই অক্সাইডটিকে উৎপন্ন অ্যাসিডগুলির নিরুদকরূপে গণ্য করা হয় এবং এই ধরনের অক্সাইডকে মিশ্র অ্যাসিড নিরুদক বলে। এছাড়া এই ধরনের অক্সাইড ক্ষারের সঙ্গে বিক্রিয়া করে উভয় অ্যাসিডের লবণ গঠন করে। যেমন – নাইট্রোজেন ডাইঅক্সাইড (NO2) ঠান্ডা জলের সঙ্গে বিক্রিয়া করে নাইট্রিক অ্যাসিড (HNO3) এবং নাইট্রাস অ্যাসিড (HNO2) উৎপন্ন করে।
2NO2 + H2O = HNO3 + ΗΝΟ2
এছাড়া, ক্ষারের সঙ্গে বিক্রিয়া করে নাইট্রেট ও নাইট্রাইট লবণ উৎপন্ন করে।
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
সোডা ওয়াটার কী?
সোডা ওয়াটার – উচ্চচাপে জলে দ্রবীভূত কার্বন ডাইঅক্সাইডের (CO2) জলীয় দ্রবণকে সোডা ওয়াটার বলে। এখানে জল হল দ্রাবক এবং কার্বন ডাইঅক্সাইড গ্যাস হল দ্রাব।
CO2 ও N2O -এর মধ্যে কী সম্পর্ক?
CO2 ও N2O -এর সম্পর্ক –
- CO2 ও N2O উভয়েই অধাতব অক্সাইড।
- উভয়েরই পারমাণবিকতা ‘3’ ও আণবিক গুরুত্ব 44।
- উভয়েরই ইলেকট্রন সংখ্যা একই (22), তাই এরা পরস্পরের আইসোস্টার।
অ্যান্টাসিড কাকে বলে?
অ্যান্টাসিড (Antacid) – যে-সমস্ত ক্ষারীয় পদার্থ পাকস্থলী নিঃসৃত অতিরিক্ত অ্যাসিডকে (হাইড্রোক্লোরিক অ্যাসিড) সাময়িকভাবে শোষণ বা প্রশমিত করে পাকস্থলীর pH বৃদ্ধি করে যথাযথ মাত্রায় উন্নীত করে, তাদের অ্যান্টাসিড বা অম্লনাশক বলে।
অ্যান্টাসিড কয় প্রকার ও কী কী? প্রত্যেক প্রকারের একটি করে উদাহরণ দাও।
অ্যান্টাসিড দু-ধরনের –
- সিস্টেমিক অ্যান্টাসিড
- নন-সিস্টেমিক অ্যান্টাসিড
সিস্টেমিক অ্যান্টাসিড – এই ধরনের অ্যান্টাসিড বিশেষ নিয়মে কাজ করে। এরা সহজেই জলে দ্রবীভূত হয় এবং শোষিত হয়। এইরূপ শোষণের ফলে দেহের অম্লত্ব এবং ক্ষারত্বের ভারসাম্য বিঘ্নিত হয়। যেমন – সোডিয়াম বাইকার্বনেট।
নন-সিস্টেমিক অ্যান্টাসিড – এই ধরনের অ্যান্টাসিড বিশেষ নিয়মে কাজ করে না। এরা সহজে জলে দ্রবীভূত হয় না বা শোষিত হয় না। ফলে দেহের অম্লত্ব ও ক্ষারত্বের ভারসাম্য নষ্ট হয় না। যেমন – ম্যাগনেশিয়াম হাইড্রক্সাইড।
কয়েকটি অ্যান্টাসিডের নাম ও সংক্ষিপ্ত বিবরণ দাও।
বিভিন্ন প্রকার অ্যান্টাসিডের নাম এবং বিবরণ –
| অ্যান্টাসিড | সংক্ষিপ্ত বিবরণ |
| সোডিয়াম বাইকার্বনেট | জলে অত্যন্ত দ্রাব্য, দ্রুত কার্যকরী। এর ক্রিয়াকালীন সময় কম। এটি শরীরে অম্ল ও ক্ষারের ভারসাম্য নষ্ট করে। |
| অ্যালুমিনিয়াম হাইড্রক্সাইড | এর ক্রিয়া ধীরে ধীরে শুরু হয়। ফলে, আরাম পেতে কিছুটা সময় লাগে। এটি মৃদু অ্যান্টাসিড। |
| ম্যাগনেশিয়াম হাইড্রক্সাইড | ম্যাগনেশিয়াম হাইড্রক্সাইডের জলীয় প্রলম্বন মিল্ক অব ম্যাগনেশিয়া নামে পরিচিত। এটি অ্যান্টাসিড হিসাবে দ্রুত কাজ করে। |
কখন অ্যান্টাসিড গ্রহণ প্রয়োজন হয় এবং কেন?
আমাদের গৃহীত খাদ্যবস্তুর হজমের জন্য পাকস্থলীতে হাইড্রোক্লোরিক অ্যাসিড স্বাভাবিক নিয়মেই ক্ষরিত হয়। অনেকসময় খাদ্যের প্রকৃতি, অসময়ে খাদ্যগ্রহণ বা অসুখজনিত কারণে অতিরিক্ত অ্যাসিড উৎপন্ন হয়ে স্বাভাবিক হজম প্রক্রিয়ায় বিঘ্ন ঘটায়। অতিরিক্ত অ্যাসিড ক্ষরণের ফলে পাকস্থলীর অন্তর্গাত্রে ক্ষতের সৃষ্টি হয়ে প্রদাহের সৃষ্টি করে এবং এই ক্ষত থেকে পেপটিক আলসার পর্যন্ত হতে পারে। এই সমস্ত ক্ষতির হাত থেকে পাকস্থলী এবং পৌষ্টিকতন্ত্রকে রক্ষা করার জন্য আমরা অ্যান্টাসিড গ্রহণ করি। অ্যান্টাসিড পাকস্থলীর অ্যাসিড উৎপাদন কমাতে পারে না কিন্তু সাময়িকভাবে পাকস্থলী রসের আম্লিকতা কমিয়ে পৌষ্টিকতন্ত্রকে স্বাভাবিক রাখে।
রাসায়নিক সমীকরণসহ যে-কোনো অ্যান্টাসিডের ক্রিয়া ব্যাখ্যা করো।
অ্যান্টাসিড ক্ষারীয় প্রকৃতির হওয়ায় পাকস্থলী থেকে নিঃসৃত প্রয়োজনাতিরিক্ত অ্যাসিডকে (HCl) প্রশমিত করে পাকস্থলী মধ্যস্থ তরলের pH -এর মান বৃদ্ধি করে। প্রচলিত অ্যান্টাসিডগুলির প্রধান উপাদান অ্যালুমিনিয়াম হাইড্রক্সাইড [Al(OH)3] ও ম্যাগনেশিয়াম হাইড্রক্সাইড [Mg(OH)2]। ট্যাবলেট বা জলীয় প্রলম্বন (Suspension) রূপে এগুলি ব্যবহৃত হয়। পাকস্থলী থেকে নিঃসৃত হাইড্রোক্লোরিক অ্যাসিডের সঙ্গে নিম্নলিখিত রাসায়নিক বিক্রিয়ার মাধ্যমে অ্যান্টাসিডগুলি দেহে অম্ল ও ক্ষারের ভারসাম্য বজায় রাখে।
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
পরিচিত অ্যান্টাসিড জেলুসিল ও ডায়োভলের উপাদানগুলি কী কী? মিল্ক অব ম্যাগনেশিয়া কী? এর ব্যবহার ও পার্শ্বপ্রতিক্রিয়া লেখো।
জেলুসিল (Gelusil) – জেলুসিলের উপাদান হল অ্যালুমিনিয়াম হাইড্রক্সাইড [Al(OH)3], ম্যাগনেশিয়াম ট্রাইসিলিকেট (MgSiO3), এছাড়াও জেলুসিলে সিমেথিকন নামক একপ্রকার সিলোক্সেন (Siloxane) জাতীয় তরল পদার্থ থাকে।
ডায়োভল (Diovol) – ডায়োভলের উপাদান হল অ্যালুমিনিয়াম হাইড্রক্সাইড (Al(OH)3) ম্যাগনেশিয়াম হাইড্রক্সাইড [Mg(OH)2] এবং ম্যাগনেশিয়াম কার্বনেট [MgCO3]। এছাড়া PDMS বা ডাইমেথিকন নামে সিলোক্সেনের এক প্রকার পলিমারজাতীয় যৌগ থাকে।

মিল্ক অব ম্যাগনেশিয়া – ম্যাগনেশিয়াম হাইড্রক্সাইডের জলীয় প্রলম্বনকে মিল্ক অব ম্যাগনেশিয়া বলে। এতে শতকরা 7 – 8 ভাগ ম্যাগনেশিয়াম হাইড্রক্সাইড থাকে।

মিল্ক অব ম্যাগনেশিয়া -এর ব্যবহার (uses) –
- মিল্ক অব ম্যাগনেশিয়া অ্যান্টাসিড হিসেবে কাজ করে। এটি খুব দ্রুত পাকস্থলীতে উৎপন্ন অতিরিক্ত মিল্ক অব ম্যাগনেশিয়া HCl -কে প্রশমিত করে অথচ দেহে অ্যাসিড ও ক্ষারের ভারসাম্য নষ্ট করে না।
- ম্যাগনেশিয়াম হাইড্রক্সাইডকে অ্যালুমিনিয়াম হাইড্রক্সাইডের সঙ্গে মিশিয়ে অ্যান্টাসিডরূপে ব্যবহার করলে এর কার্যকারিতা দ্রুত ও দীর্ঘস্থায়ী হয় কিন্তু কোষ্ঠকাঠিন্য হয় না।
পার্শ্বপ্রতিক্রিয়া (side effects) –
- এটি পেটে প্রবেশ করে MgCl2 উৎপন্ন করে যা উদরাময় ঘটায়।
- এর অতিরিক্ত ব্যবহারে কিডনির সমস্যা দেখা দিতে পারে।
- দেহে ম্যাগনেশিয়াম জমে বিষক্রিয়া হতে পারে।
ডায়োভলে উপস্থিত ডাইমেথিকনের অপর নাম কী? এবং জেলুসিলে উপস্থিত সিমেথিকন কী দিয়ে তৈরি?
ডায়োভলে উপস্থিত ডাইমেথিকনের অপর নাম PDMS বা পলি ডাইমিথাইল সিলোক্সেন (Poly Dimethyl Siloxane)। এটি আসলে সিলোক্সেন জাতীয় যৌগের পলিমার। আবার, জেলুসিলে উপস্থিত সিমেথিকন (Simethicone) যৌগটি প্রকৃতপক্ষে পলিডাইমিথাইল সিলোক্সেন ও আর্দ্র সিলিকা জেলের মিশ্রণ।
ধাতব হাইড্রক্সাইড জাতীয় অ্যান্টাসিড ব্যবহারের সীমাবদ্ধতা কী?
ধাতব হাইড্রক্সাইড জাতীয় অ্যান্টাসিড ব্যবহারের সীমাবদ্ধতা – ধাতব হাইড্রক্সাইড [যেমন – Al(OH)3, Mg(OH)2] অ্যান্টাসিড হিসেবে বহুল প্রচলিত। এগুলি পাকস্থলীতে উৎপন্ন অতিরিক্ত HCl -কে প্রশমিত করে অম্ল ও ক্ষারের ভারসাম্য বজায় রেখে সাময়িকভাবে চিকিৎসা করে। কিন্তু রোগের মূল কারণ নিয়ন্ত্রণ করতে না পারায় রোগের স্থায়ী নিরাময় হয় না। এছাড়া এগুলির অতিরিক্ত ব্যবহারে নানারকম পার্শ্বক্রিয়া দেখা যায়। যেমন – অ্যালুমিনিয়াম হাইড্রক্সাইডের অ্যালুমিনিয়াম আয়ন কিডনির ক্ষতি করে, স্মৃতিশক্তি হ্রাস করে। আবার ম্যাগনেশিয়াম হাইড্রক্সাইডের অতিরিক্ত ব্যবহারে পেটের অসুখ হতে পারে।
অতিরিক্ত পরিমাণে বাইকার্বনেট জাতীয় অ্যান্টাসিড গ্রহণের কুফল কী?
অথবা, অ্যান্টাসিড হিসেবে NaHCO3 -এর দুটি পার্শ্বপ্রতিক্রিয়া উল্লেখ করো।
অতিরিক্ত পরিমাণে বাইকার্বনেট জাতীয় অ্যান্টাসিড ব্যবহারের কুফল –
- অতিরিক্ত পরিমাণে বাইকার্বনেট জাতীয় অ্যান্টাসিড গ্রহণ করলে পাকস্থলীর অভ্যন্তরে pH বৃদ্ধি পেয়ে ক্ষারীয় হয়ে যেতে পারে। এই বর্ধিত pH নিয়ন্ত্রণ করার জন্য অতিরিক্ত অ্যাসিড (HCI) ক্ষরিত হতে পারে।
- বাইকার্বনেট জাতীয় অ্যান্টাসিডের অতিরিক্ত ব্যবহারে অ্যালক্যালোসিস রোগ হতে পারে। এটি শরীরে অম্ল-ক্ষারের ভারসাম্য নষ্ট করে।
- এই প্রকার অ্যান্টাসিড বিয়োজিত হয়ে পাকস্থলীতে CO2 গ্যাস উৎপন্ন করে এবং নালী ঘা -এর (ulcer) সম্ভাবনা বাড়িয়ে দেয়। ফলে স্ফীত উদর, অস্বাচ্ছন্দ্য, ঢেঁকুর তোলা প্রভৃতি দৈহিক সমস্যার সৃষ্টি হতে পারে।
- এটি ব্যবহারের ফলে শরীরে Na+ আয়নের গাঢ়ত্ব বৃদ্ধি পেয়ে হৃদযন্ত্র সংক্রান্ত রোগ, উচ্চ রক্তচাপজনিত শারীরিক সমস্যা দেখা দিতে পারে।
অ্যান্টাসিড হিসেবে অ্যালুমিনিয়াম হাইড্রক্সাইডের কার্যকারিতা ও পার্শ্বপ্রতিক্রিয়া আলোচনা করো।
অ্যালুমিনিয়াম হাইড্রক্সাইডের কার্যকারিতা ও পার্শ্বপ্রতিক্রিয়া –
অ্যালুমিনিয়াম হাইড্রক্সাইডের কার্যকারিতা – অ্যালুমিনিয়াম হাইড্রক্সাইড একটি কার্যকরী অ্যান্টাসিড। পেপটিক আলসার, বদহজম প্রভৃতি লিভারজনিত রোগে প্রচুর অ্যাসিড উৎপন্ন হয়। একে হাইপার অ্যাসিডিটি বলে। এর ফলে পাকস্থলীতে প্রয়োজনাতিরিক্ত অ্যাসিড উৎপন্ন হলে বুক, পেট ও গলা জ্বালা করে, পেটে যন্ত্রণা হয় ও টক ঢেঁকুর ওঠে। এইসব রোগের ক্ষেত্রে Al(OH)3 অত্যন্ত কার্যকরী। এটি ধীর গতিতে পাকস্থলীতে উৎপন্ন HCl -কে প্রশমিত করে।
অ্যালুমিনিয়াম হাইড্রক্সাইডের পার্শ্বপ্রতিক্রিয়া (Side effects) –
- অ্যালুমিনিয়াম হাইড্রক্সাইডের দীর্ঘদিন ব্যবহারের ফলে কোষ্ঠকাঠিন্য ও বমি বমিভাব দেখা দিতে পারে।
- এটি অস্ত্রে ফসফেট শোষণে বাধা দেয়। ফলে রক্তে ফসফেটের মাত্রা কমে গিয়ে হাইপোফসফেটেমিয়া হওয়ার সম্ভাবনা থাকে।
- অ্যালুমিনিয়াম আয়ন কিডনির ক্ষতি করে এবং অনেক সময় মানুষের স্মৃতিশক্তি হ্রাস করে।
- এছাড়া এর প্রভাবে অস্টিওম্যালেশিয়া হতে পারে।
- এর ব্যবহারে মূত্রের মাধ্যমে Cu -এর রেচন বৃদ্ধি পায়। ফলে রেনাল রিকেট্স রোগ সৃষ্টি হয়।
লবণের সংজ্ঞা দাও।
লবণ (Salt) – অ্যাসিডের প্রতিস্থাপনীয় হাইড্রোজেন পরমাণু ধাতু বা অন্য কোনো ধনাত্মক তড়িদ্গ্রস্ত মূলক দ্বারা আংশিক বা সম্পূর্ণরূপে প্রতিস্থাপিত হয়ে যে যৌগ উৎপন্ন করে, তাকে লবণ বলে। যেমন – HCl -এর সঙ্গে NaOH -এর বিক্রিয়ায় HCl -এর ‘H’ পরমাণু Na ধাতু দ্বারা প্রতিস্থাপিত হয়ে NaCl লবণ উৎপন্ন করে।
HCl + NaOH = NaCl + H2O
লবণ কত প্রকার ও কী কী?
লবণ ছয় প্রকার। যথা –
- অ্যাসিড লবণ,
- প্রশম লবণ,
- ক্ষারীয় লবণ,
- যুগ্ম লবণ,
- মিশ্র লবণ,
- জটিল লবণ।
উদাহরণসহ প্রত্যেক প্রকার লবণের সংজ্ঞা দাও।
বিভিন্ন প্রকার লবণের সংজ্ঞা এবং উদাহরণ –
অ্যাসিড লবণ/বাই লবণ (Acid Salt) – অ্যাসিডের প্রতিস্থাপনীয় হাইড্রোজেন পরমাণু কোনো ধাতু দ্বারা আংশিকভাবে প্রতিস্থাপিত হয়ে যে লবণ উৎপন্ন করে, তাকে অ্যাসিড লবণ বা বাইলবণ বলে। যেমন – সোডিয়াম বাইকার্বনেট (NaHCO3), ডাইসোডিয়াম হাইড্রোজেন ফসফেট (Na2HPO4), পটাশিয়াম বাইকার্বনেট (KHCO3)।
প্রশম লবণ (Normal Salt) – কোনো অ্যাসিডের প্রতিস্থাপনযোগ্য সবকটি হাইড্রোজেন পরমাণু সম্পূর্ণভাবে কোনো ধাতু দ্বারা প্রতিস্থাপিত হয়ে যে লবণ উৎপন্ন করে, তাকে প্রশম লবণ বলে। যেমন – সোডিয়াম সালফেট (Na2SO4), পটাশিয়াম সালফেট (K2SO4) ইত্যাদি।
ক্ষারীয় লবণ (Basic Salt) – কোনো ক্ষারে উপস্থিত OH- আয়ন কোনো অ্যানায়ন দ্বারা আংশিকভাবে প্রতিস্থাপিত হয়ে যে লবণ উৎপন্ন করে, তাকে ক্ষারীয় লবণ বলে। যেমন – বেসিক কপার ক্লোরাইড [Cu(OH)Cl], বেসিক লেড কার্বনেট [PbCO3⋅Pb(OH)2], বেসিক কপার কার্বনেট [CuCO3⋅Cu(OH)2]।
যুগ্ম লবণ (Double Salt) – দুই বা তার বেশি সংখ্যক স্থায়ী যৌগ পরস্পর যুক্ত হয়ে যে লবণ উৎপন্ন করে, যার শুধুমাত্র কঠিন অবস্থায় অস্তিত্ব থাকে, কিন্তু জলীয় দ্রবণে বিয়োজিত হয়ে উপাদান আয়ন উৎপন্ন করে, তাকে যুগ্ম লবণ বলে। যেমন – পটাশ অ্যালাম [K2SO4⋅Al2(SO4)3⋅24H2O], মোর লবণ [FeSO4⋅(NH4)2SO4⋅6H2O]।
\(FeSO_4⋅{\left(NH_4\right)}_2SO_4⋅6H_2O\rightarrow Fe^{2+}+2NH_4^++2SO_4^{2-}\)
মিশ্র লবণ (Mixed Salt) – যে লবণে একাধিক অম্ল বা ক্ষারীয় মূলক থাকে, তাকে মিশ্র লবণ বলে। যেমন – পটাশিয়াম সোডিয়াম কার্বনেট (KNaCO3), ক্যালশিয়াম পটাশিয়াম ফসফেট (CaKPO4)।
জটিল লবণ (Complex Salt) – যে লবণে কেন্দ্রীয় ধাতব আয়নটি নির্দিষ্ট সংখ্যক প্রশম পরমাণু বা ক্যাটায়ন বা অ্যানায়নের সঙ্গে অসমযোজী বন্ধন দ্বারা যুক্ত থাকে, তাকে জটিল লবণ বলে। জটিল লবণের কঠিন অবস্থায় এবং জলীয় দ্রবণে উভয় অবস্থাতেই অস্তিত্ব থাকে। এটি জলীয় দ্রবণে বিয়োজিত হয়ে জটিল আয়ন উৎপন্ন করে। যেমন – K4[Fe(CN)6], K3[Fe(CN)6], K2[HgI4] ইত্যাদি।
কোনটি আম্লিক লবণ, ক্ষারীয় লবণ ও শমিত লবণ লেখো – NaHSO4, K2SO4, Pb(OH)Cl, KClO3, CaSO4, K2CO3, NH4Cl, Na2HPO4।
| আম্লিক লবণ | NaHSO4, Na2HPO4 |
| ক্ষারীয় লবণ | Pb(OH)Cl |
| শমিত লবণ | K2SO4, KClO3, CaSO4, K2CO3, NH4Cl |
শমিত লবণের জলীয় দ্রবণ সর্বদা শমিত হয় কি? উদাহরণসহ আলোচনা করো।
সাধারণত শমিত লবণের জলীয় দ্রবণ প্রশম হওয়াই স্বাভাবিক। কিন্তু সর্বদা তা হয় না। কোনো লবণের জলীয় দ্রবণ ক্ষারধর্মী, অ্যাসিডধর্মী না প্রশম হবে তা নির্ভর করে লবণটি যে অ্যাসিড ও ক্ষারকের সংযোগে গঠিত হয়েছে তাদের তীব্রতার ওপর।
শমিত লবণ সাধারণত তৈরি করা যেতে পারে, যথা – তীব্র অ্যাসিডের সঙ্গে তীব্র ক্ষারের বিক্রিয়ায় (KCl, Na2SO4 ইত্যাদি), তীব্র অ্যাসিডের সঙ্গে মৃদু ক্ষারের বিক্রিয়ায় [(NH4)2SO4, FeCl3 ইত্যাদি], মৃদু অ্যাসিডের সঙ্গে তীব্র ক্ষারের বিক্রিয়ায় [CH3COONa, Na2CO3 ইত্যাদি], মৃদু অ্যাসিডের সঙ্গে মৃদু ক্ষারের বিক্রিয়ায় [CH3COONH4, (NH4)2CO3 ইত্যাদি]। কঠিন অবস্থায় শমিত লবণের অ্যাসিড বা ক্ষার ধর্মের প্রদর্শন না ঘটলেও লবণের জলীয় দ্রবণের আর্দ্র বিশ্লেষণ ঘটে পুনরায় অ্যাসিড ও ক্ষার উৎপন্ন হয়।
লবণ + জল ⇌ অ্যাসিড + ক্ষার
এটি প্রশমন বিক্রিয়ার বিপরীতমুখী ক্রিয়া।
যদি লবণটি সমমাত্রার তীব্র অ্যাসিড ও তীব্র ক্ষারের সাহায্যে উৎপন্ন হয় বা সমমাত্রার মৃদু অ্যাসিড ও মৃদু ক্ষারের সাহায্যে উৎপন্ন হয়, তবে আর্দ্র বিশ্লেষণে এদের জলীয় দ্রবণ প্রশম হয়। যেমন – সোডিয়াম ক্লোরাইডের (NaCl) [তীব্র অ্যাসিড HCl ও তীব্র ক্ষার NaOH থেকে প্রাপ্ত লবণ] জলীয় দ্রবণ প্রশম হয়। আবার অ্যামোনিয়াম অ্যাসিটেটের (CH3COONH4) [মৃদু অ্যাসিড CH3COOH এবং মৃদু ক্ষার NH4OH থেকে প্রাপ্ত লবণ] জলীয় দ্রবণ আর্দ্র বিশ্লেষিত হওয়া সত্ত্বেও প্রশম হয়।
অপরপক্ষে, যদি শমিত লবণটি তীব্র অ্যাসিড ও মৃদু ক্ষার অথবা মৃদু অ্যাসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন হয়, তবে আর্দ্র বিশ্লেষণের ফলে এদের জলীয় দ্রবণ যথাক্রমে অ্যাসিড ও ক্ষার ধর্ম প্রদর্শন করে। যেমন – অ্যালুমিনিয়াম সালফেটের [Al2(SO4)3] [তীব্র অ্যাসিড H2SO4 ও মৃদু ক্ষারক Al(OH)3 থেকে প্রাপ্ত লবণ] জলীয় দ্রবণ অ্যাসিড ধর্ম প্রদর্শন করে। সোডিয়াম কার্বনেটের (Na2CO3) [মৃদু অ্যাসিড H2CO3 ও তীব্র ক্ষারক NaOH থেকে প্রাপ্ত লবণ] জলীয় দ্রবণ ক্ষারীয়।
বোধমূলক প্রশ্নোত্তর
অ্যাসিড মাত্রই হাইড্রোজেনঘটিত যৌগ, কিন্তু হাইড্রোজেনঘটিত যৌগ মাত্রই অ্যাসিড নয় – ব্যাখ্যা করো।
অ্যাসিড মাত্রই তাতে হাইড্রোজেন থাকবে। হাইড্রোজেন ঘটিত যৌগ যার H পরমাণু ধাতু দ্বারা প্রতিস্থাপিত হয়ে লবণ ও H2 গ্যাস উৎপন্ন করে, ক্ষার বা ক্ষারকের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে, যার জলীয় দ্রবণ নীল লিটমাসকে লাল করে, তাকে অ্যাসিড বলে।
কিন্তু NH3, CH4, চিনি ইত্যাদি যৌগ হাইড্রোজেনঘটিত যৌগ কিন্তু এদের H পরমাণু ধাতু দ্বারা প্রতিস্থাপিত হয়ে লবণ ও H2 উৎপন্ন করে না, ক্ষার বা ক্ষারকের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে না বা নীল লিটমাসকে লাল করে না। তাই এরা হাইড্রোজেনঘটিত যৌগ হলেও অ্যাসিড নয়।
সব ক্ষারই ক্ষারক, কিন্তু সব ক্ষারক ক্ষার নয় – ব্যাখ্যা করো।
ধাতব অক্সাইড বা হাইড্রক্সাইড যৌগগুলিকে ক্ষারক বলে। এই সব ক্ষারকের মধ্যে আবার যেগুলি জলে দ্রাব্য তাদের ক্ষার বলে। কাজেই যেসব ক্ষারক জলে দ্রবীভূত হয় না তারা ক্ষারক হলেও ক্ষার নয়। তাই বলা যায় “সব ক্ষারই ক্ষারক, কিন্তু সব ক্ষারক ক্ষার নয়”।
তোমাকে একটি টেস্টটিউবে জল ও অন্য একটিতে অ্যাসিড দেওয়া হল। তুমি কীভাবে শনাক্ত করবে কোনটিতে কী দ্রবণ আছে?
দুটি টেস্টটিউবে পৃথকভাবে নীল লিটমাস কাগজ যোগ করা হল। যে টেস্টটিউবের তরলের সংস্পর্শে এসে নীল লিটমাস কাগজ লাল হল না, সেটি হল জল। আবার যে টেস্টটিউবে নীল লিটমাস কাগজ যোগ করা হলে লাল হয়ে যায় সেটি হল অ্যাসিড।
অ্যাসিডের লঘু দ্রবণ তৈরির সময় জলের মধ্যে ফোঁটা ফোঁটা গাঢ় অ্যাসিড ঢালা উচিত কেন?
অথবা, গাঢ় অ্যাসিডকে লঘু করতে হলে জলের মধ্যে অ্যাসিড যোগ করা উচিত, কিন্তু গাঢ় অ্যাসিডের মধ্যে কখনোই জল যোগ করা উচিত নয় কেন?
অ্যাসিডের সঙ্গে জলের বিক্রিয়া একটি তাপমোচী বিক্রিয়া। গাঢ় অ্যাসিডে জল ঢালা হলে প্রচুর তাপ উৎপন্ন হয়। এই তাপে পাত্রের জল বাষ্পে পরিণত হয়। এই বাষ্পের সঙ্গে কিছু পরিমাণ অ্যাসিড মিশে থাকে যা চোখেমুখে লাগলে ক্ষতি হবার সম্ভাবনা থাকে। এছাড়া প্রচুর তাপে কাচপাত্র ফেটে দুর্ঘটনা ঘটারও সম্ভাবনা থাকে। তাই অ্যাসিডের লঘু দ্রবণ তৈরি করতে হলে জলে ফোঁটা ফোঁটা অ্যাসিড ঢালতে হয়।
\(H_2SO_4+2H_2O\rightarrow2H_3O^++SO_4^{2-}+\) তাপ
অ্যাসিডের জলীয় দ্রবণ তড়িৎ পরিবহণ করে কেন?
জলীয় দ্রবণে অ্যাসিড বিয়োজিত হয়ে H3O+ আয়ন উৎপন্ন করে।
HCl + H2O → H3O+ + Cl–
যখন কোনো অ্যাসিডের জলীয় দ্রবণের মধ্যে দিয়ে তড়িৎ প্রবাহ চালনা করা হয়, তখন জলযোজিত H+ আয়নগুলি (H3O+) ক্যাথোডে যায়। প্রতিটি H+ আয়ন ক্যাথোড থেকে একটি করে ইলেকট্রন সংগ্রহ করে H2 গ্যাসে পরিণত হয়। এইভাবে অ্যাসিডের জলীয় দ্রবণ তড়িৎ পরিবহণ করে।
HCl একটি তীব্র অ্যাসিড, কিন্তু CH3COOH ও H2CO3 মৃদু অ্যাসিড – কেন?
হাইড্রোক্লোরিক অ্যাসিড (HCl) জলীয় দ্রবণে বিয়োজিত হয় এবং এর বেশিরভাগ অণুই বিয়োজিত হয়ে আয়নে পরিণত হয়।
HCl + H2O ⇌ H3O++ Cl–
এই কারণে HCl তীব্র অ্যাসিড।
কিন্তু অ্যাসিটিক অ্যাসিড (CH3COOH) ও কার্বনিক অ্যসিড (H2CO3) উভয়েই জলীয় দ্রবণে বিয়োজিত হয়ে খুব কম সংখ্যক আয়ন উৎপন্ন করে, বেশিরভাগ অণুই অবিয়োজিত অবস্থায় থাকে। তাই এটি মৃদু অ্যাসিড।
\(CH_3COOH+H_2O\rightleftharpoons H_3O^++CH_3COO^-\)
\(H_2CO_3+H_2O\rightleftharpoons H_3O^++HCO_3^-\)
\(H_3CO_3^-+H_2O\rightleftharpoons H_3O^++CO_3^{2-}\)
শুদ্ধ HCl গ্যাস নীল লিটমাসের বর্ণ পরিবর্তন করতে পারে না কেন।
অথবা, HCl গ্যাস ও HCl -এর জলীয় দ্রবণের মধ্যে কোনটি অ্যাসিড ও কেন?
HCl একটি সমযোজী যৌগ। গ্যাসীয় অবস্থায় এটি বিয়োজিত হয়ে H+ আয়ন উৎপন্ন করতে পারে না, অবিয়োজিত অবস্থাতেই থাকে। তাই HCl গ্যাসকে অ্যাসিড বলা যায় না এবং এটি নীল লিটমাসের বর্ণও পরিবর্তন করতে পারে না।
কিন্তু জল একটি শক্তিশালী ধ্রুবীয় মাধ্যম হওয়ায় HCl জলীয় দ্রবণে দ্রবীভূত হয়ে H3O+ বা H+ ও Cl– আয়ন উৎপন্ন করে। ফলে HCl -এর জলীয় দ্রবণ আম্লিক হয় এবং এটি নীল লিটমাসকে লাল করে।
HCl + H2O ⇌ H3O+ + Cl–
H2S, HCN যৌগগুলিকে অ্যাসিড বলা যায় কি?
H2S, HCN -এরা হাইড্রাসিড। [H2S -হাইড্রোসালফিউরিক অ্যাসিড, HCN -হাইড্রোসায়ানিক অ্যাসিড]। H2S ও HCN -এর জলীয় দ্রবণ নীল লিটমাসকে লাল করে এবং ক্ষারের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে।
H2S + NaOH = NaHS (অ্যাসিড লবণ) + H2O
H2S + 2NaOH = Na2S (নর্মাল লবণ) + 2H2O
HCN + NaOH = NaCN (নর্মাল লবণ) + H2O
জলে মুক্ত H+ আয়ন পাওয়া যায় না কেন?
জলে মুক্ত H+ আয়ন পাওয়া যায় না কারণ – H+ আয়ন অত্যন্ত ক্ষুদ্র হওয়ায় এর আধান ঘনত্ব (Charge Density) অত্যন্ত বেশি। ফলে, H+ আয়নের স্থায়িত্ব অত্যন্ত কম। তাই জলীয় দ্রবণে H+ আয়ন মুক্ত অবস্থায় না থেকে জলের অণুর সঙ্গে যুক্ত হয়ে হাইড্রক্সোনিয়াম আয়ন (H3O+) গঠনের মাধ্যমে স্থায়িত্ব লাভ করে।
H+ + H2O → H2O+
গাঢ় H2SO4 অপেক্ষা লঘু H2SO4 বেশি তীব্র কেন?
কোনো দ্রবণে অ্যাসিডের তীব্রতার মাত্রা ওই দ্রবণে উপস্থিত H+ আয়নের সংখ্যার ওপর নির্ভরশীল। যে অ্যাসিড জলীয় দ্রবণে বিয়োজিত হয়ে যত বেশি সংখ্যক H+ আয়ন উৎপন্ন করে, সেই অ্যাসিড তত বেশি তীব্র হয়। আবার, যে অ্যাসিড জলীয় দ্রবণে বিয়োজিত হয়ে কম সংখ্যক H+ আয়ন উৎপন্ন করে, সেই অ্যাসিডের তীব্রতা কম। অ্যাসিডের বিয়োজন মাত্রা অ্যাসিডের গাঢ়ত্বের ওপর নির্ভর করে। যে অ্যাসিড যত বেশি লঘু তার বিয়োজন মাত্রা তত বেশি। এক্ষেত্রে গাঢ় H2SO4 -এর বিয়োজনে কম সংখ্যক H+ আয়ন উৎপন্ন হয়।
\(H_2SO_4\rightleftharpoons H^++HSO_4^-\\\)কিন্তু লঘু H2SO4 -এর বিয়োজন মাত্রা বেশি হওয়ায় এটি জলীয় দ্রবণে বেশি সংখ্যক H+ আয়ন উৎপন্ন করে।
\(H_2SO_4\rightleftharpoons2H^++SO_4^{2-}\\\)তাই গাঢ় H2SO4 অপেক্ষা লঘু H2SO4 বেশি তীব্র হয়।
সোডিয়াম বাইসালফেটের জলীয় দ্রবণকে অ্যাসিড বলা যায় না কেন?
সোডিয়াম বাইসালফেট (NaHSO4) হল একটি আম্লিক লবণের উদাহরণ। এটি জলীয় দ্রবণে আর্দ্র বিশ্লেষিত হয়ে তীব্র ক্ষার NaOH এবং তীব্র অ্যাসিড H2SO4 উৎপন্ন করে। দ্রবণে উপস্থিত তীব্র ক্ষার ও তীব্র অ্যাসিড পরস্পরকে সম্পূর্ণরূপে প্রশমিত করায় NaHSO4 -এর জলীয় দ্রবণ আম্লিক ধর্ম প্রদর্শন করে না।
NaHSO4 জলীয় দ্রবণে বিয়োজিত হয়ে H+ আয়ন উৎপন্ন করা সত্ত্বেও এটি অ্যাসিড নয় কেন?
NaHSO4 জলীয় দ্রবণে বিয়োজিত হয়ে H+ আয়ন উৎপন্ন করে।
\(NaHSO_4\rightleftharpoons Na^++H^++SO_4^{2-}\)
আরহেনিয়াসের তত্ত্বানুযায়ী, যে-সমস্ত যৌগ জলীয় দ্রবণে বিয়োজিত হয়ে ক্যাটায়নরূপে শুধুমাত্র H+ আয়ন দেয় তারাই অ্যাসিড। এক্ষেত্রে NaHSO4 জলীয় দ্রবণে ক্যাটায়ন হিসেবে H+ আয়ন উৎপন্ন করার সঙ্গে সঙ্গে Na+ আয়নও উৎপন্ন করে। সুতরাং, এটি অ্যাসিড নয়।
জলীয় H3PO3 দ্বি-ক্ষারীয় অ্যাসিড হলেও H3PO3 ত্রি-ক্ষারীয় অ্যাসিড কেন?
H3PO3 দ্বি-ক্ষারীয় অ্যাসিড, কারণ – ফসফরাসের অক্সি-অ্যাসিডে উপস্থিত সেই হাইড্রোজেনগুলি প্রতিস্থাপনযোগ্য যারা সরাসরি অক্সিজেনের সঙ্গে যুক্ত থাকে। যে H -পরমাণু সরাসরি ফসফরাসের সঙ্গে যুক্ত তারা প্রতিস্থাপনযোগ্য নয়। অ্যাসিডটির গঠন সংকেত থেকে দেখা যায় H3PO3 -এর প্রতিস্থাপনযোগ্য H -পরমাণুর সংখ্যা = 2। তাই এটি জলীয় দ্রবণে দ্বি-ক্ষারীয় অ্যাসিড।

H3PO4 ত্রি-ক্ষারীয় অ্যাসিড কারণ – এক্ষেত্রে তিনটি হাইড্রোজেনই সরাসরি অক্সিজেনের সঙ্গে যুক্ত থাকে। অ্যাসিডটির গঠন সংকেত থেকে দেখা যায়, H3PO4 -এর প্রতিস্থাপনযোগ্য H -পরমাণুর সংখ্যা = 3। তাই এটি জলীয় দ্রবণে ত্রি-ক্ষারীয় অ্যাসিড।
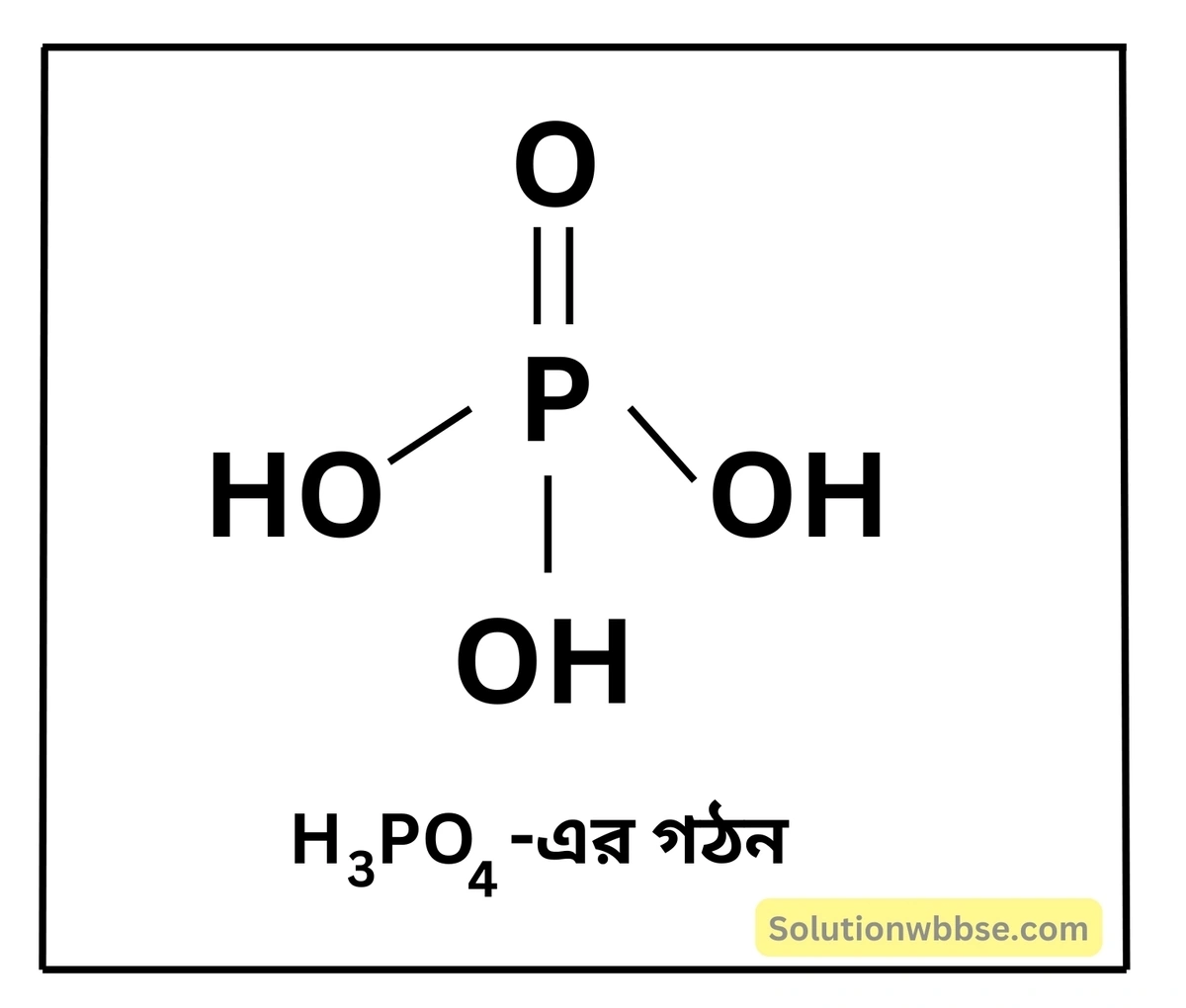
জলকে অ্যাসিড বলা যায় না কেন?
জলে হাইড্রোজেন উপস্থিত থাকলেও জলকে অ্যাসিড বলা যায় না কারণ –
- জল নীল লিটমাসকে লাল করতে পারে না ও স্বদে টক নয়।
- জলের হাইড্রোজেন পরমাণু তীব্র তড়িৎ-ধনাত্মক ধাতু (যেমন – Na, K, Ca প্রভৃতি) দ্বারা প্রতিস্থাপিত হলেও লবণ উৎপন্ন করে না; ক্ষার উৎপন্ন করে। যেমন – জলের সঙ্গে সোডিয়াম ধাতুর বিক্রিয়ায় জলের H -পরমাণু Na দ্বারা প্রতিস্থাপিত হয়ে সোডিয়াম হাইড্রক্সাইড ও হাইড্রোজেন উৎপন্ন করে। 2Na + 2H2O → 2NaOH + H↑।
- এছাড়া বিশুদ্ধ জলের pH -এর মান = 7। জল আম্লিক হলে, pH -এর মান 7 অপেক্ষা কম হত। প্রকৃতপক্ষে জল (H2O) একটি প্রশম অক্সাইড।
NaOH একটি ক্ষার হলেও Al(OH)3 ক্ষার নয় কেন?
NaOH একটি ক্ষার কারণ – এটি জলে দ্রবীভূত হয় এবং জলীয় দ্রবণে অ্যানায়নরূপে OH– আয়ন উৎপন্ন করে। অ্যাসিডের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করে।
NaOH ⇌ Na+ + OH–
NaOH + HCl → NaCl + H2O
AI(OH)3 জলীয় দ্রবণে অ্যানায়নরূপে OH– আয়ন উৎপন্ন করে। অ্যাসিডের সঙ্গে বিক্রিয়া করে লবণ ও জল উৎপন্ন করলেও সেটি জলে দ্রবীভূত হয় না। তাই এটি ক্ষার নয়, কিন্তু ক্ষারক।
Al(OH)3 ⇌ Al3+ + 3OH–
Al(OH)3 + 3HCl → AlCl3 + 3H2O
অ্যামোনিয়ার জলীয় দ্রবণ ক্ষারধর্মী কেন?
অ্যামোনিয়া জলে দ্রবীভূত হয়ে অ্যামোনিয়াম হাইড্রক্সাইড উৎপন্ন করে।
\(NH_3+H_2O\rightleftharpoons NH_4OH\)
অ্যামোনিয়াম হাইড্রক্সাইড জলীয় দ্রবণে বিয়োজিত হয়ে OH– আয়ন উৎপন্ন করে।
\(NH_4OH\rightleftharpoons NH_4^++OH^-\)
এই OH– আয়নের উপস্থিতির কারণে অ্যামোনিয়ার জলীয় দ্রবণ ক্ষারীয় হয়। এই কারণে অ্যামোনিয়ার জলীয় দ্রবণে লাল লিটমাস কাগজ দিলে নীল হয়ে যায় এবং অ্যাসিডের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে।
তোমাকে তিনটি বোতলে HCl, HNO3, H2SO4 দেওয়া হল। রাসায়নিক পরীক্ষার সাহায্যে তুমি প্রত্যেকটিকে কীভাবে শনাক্ত করবে? প্রয়োজনীয় সমীকরণগুলি লেখো।
একটি বোতলের তরল থেকে কিছু অংশ টেস্টটিউবে নিয়ে তাতে AgNO3 দ্রবণ যোগ করা হল। যদি সাদা দইয়ের মতো অধঃক্ষেপ উৎপন্ন হয় যা HNO3 -তে অদ্রাব্য কিন্তু অতিরিক্ত NH4OH -এ দ্রাব্য তবে বুঝতে হবে তরলটি HCl।
HCl + AgNO3 → AgCl↓ (দইয়ের ন্যায় সাদা অধঃক্ষেপ) + HNO3
AgCl + NH4OH = [Ag(NH3)2]Cl (দ্রাব্য জটিল যৌগ)
অপর একটি বোতলের থেকে কিছুটা তরল একটি টেস্টটিউবে নিয়ে তাতে বেরিয়াম ক্লোরাইড (BaCl2) দ্রবণ যোগ করা হল। যদি সাদা অধঃক্ষেপ উৎপন্ন হয় যা HNO3 বা HCl -এ অদ্রাব্য হয় তবে বুঝতে হবে তরলটি সালফিউরিক অ্যাসিড।
H2SO4 + BaCl2 = BaSO4↓ (সাদা অধঃক্ষেপ) + 2HCl
অপর একটি বোতলের থেকে কিছুটা তরল একটি টেস্টটিউবে নিয়ে তাতে সদ্য প্রস্তুত ফেরাস সালফেট দ্রবণ যোগ করা হল এবং টেস্টটিউবের গা বেয়ে ধীরে ধীরে গাঢ় H2SO4 ঢালা হল। যদি এক্ষেত্রে দুই তরলের সংযোগস্থলে বাদামি বলয় গঠিত হয় তবে বুঝতে হবে তরলটি নাইট্রিক অ্যাসিড।
6FeSO4 + 3H2SO4 + 2HNO3 = Fe2(SO4)3 + 2NO + 4H2O
FeSO4 + 6H2O = [Fe(H2O)6]SO4
[Fe(H2O)6]SO4 + NO = [Fe(H2O)5NO]SO4 + H2O
A, B, C তিনটি টেস্টটিউবে যথাক্রমে লিটমাস, ফেনলপ্থ্যালিন ও মিথাইল অরেঞ্জ আছে। এদের মধ্যে প্রত্যেকটিতে একটি করে পদার্থ যোগ করায় এদের বর্ণ প্রদত্ত চিত্রের মতো হয়। পদার্থগুলির প্রকৃতি নির্ণয় করো।

A টেস্টটিউবে লিটমাস আছে এবং ওই টেস্টটিউবে রাখা দ্রবণের বর্ণ নীল। লিটমাস ক্ষার দ্রবণে নীল বর্ণ ধারণ করে। অর্থাৎ, A টেস্টটিউবে যে পদার্থটি যোগ করায় দ্রবণের বর্ণ নীল হয়েছে সেই A পদার্থটি ক্ষারীয় প্রকৃতির।
B টেস্টটিউবে ফেনলপ্থ্যালিন আছে এবং ওই টেস্টটিউবে রাখা দ্রবণ বর্ণহীন। ফেনলপ্থ্যালিন অ্যাসিড দ্রবণে এবং প্রশম দ্রবণে বর্ণহীন হয়। অর্থাৎ, B টেস্টটিউবে যে পদার্থটি যোগ করায় দ্রবণটি বর্ণহীন হয় সেই পদার্থটি আম্লিক কিংবা প্রশম প্রকৃতির।
C টেস্টটিউবে মিথাইল অরেঞ্জ আছে এবং ওই টেস্টটিউবে রাখা দ্রবণের বর্ণ লাল। মিথাইল অরেঞ্জ অ্যাসিড দ্রবণে লাল বর্ণ ধারণ করে। অর্থাৎ, C টেস্টটিউবে যে পদার্থটি যোগ করায় দ্রবণের বর্ণ লাল হয়, সেই পদার্থটি আম্লিক প্রকৃতির।
সোডিয়াম কার্বনেটের জলীয় দ্রবণে একফোঁটা ফেনলপ্থ্যালিন যোগ করলে কী দেখা যাবে?
সোডিয়াম কার্বনেটের জলীয় দ্রবণে ক্ষারকীয় ধর্ম প্রকাশ পায়, কারণ – এটি একটি তীব্র ক্ষার ও মৃদু অ্যাসিডের লবণ।
তাই এই লবণের জলীয় দ্রবণে ফেনলপ্থ্যালিন তার ক্ষারীয় দ্রবণের বর্ণ প্রদর্শন করে। তাই দ্রবণের বর্ণ গোলাপি হয়।
বৃষ্টির জল মৃদু আম্লিক হয় কেন?
বৃষ্টির জল যখন বায়ুমণ্ডলের মধ্যে দিয়ে ভূপৃষ্ঠে পতিত হয়, তখন বায়ুমণ্ডলে উপস্থিত কার্বন ডাইঅক্সাইড (CO2), নাইট্রোজেন ডাইঅক্সাইড (NO2), সালফার ডাইঅক্সাইড (SO2) প্রভৃতি আম্লিক অক্সাইডগুলি বৃষ্টির জলের সঙ্গে মিশে যায় ও বিক্রিয়া করে বিভিন্ন অ্যাসিড উৎপন্ন করে। প্রধানত মৃদু অ্যাসিড কার্বনিক অ্যাসিডের উপস্থিতির জন্যই বৃষ্টির জল মৃদু আম্লিক হয়। H2SO4 এবং HNO3 খুব কম পরিমাণে বর্তমান থাকে।
CO2 + H2O → H2CO3 (কার্বনিক অ্যাসিড)
SO2 + H2O → H2SO3 (সালফিউরাস অ্যাসিড)
NO2 + H2O → HNO2 (নাইট্রাস অ্যাসিড) + HNO3 (নাইট্রিক অ্যসিড)
ক্যালশিয়াম অক্সাইডকে ক্ষারকীয় অক্সাইড বলে কেন?
ক্যালশিয়াম অক্সাইড (CaO) জলে দ্রবীভূত হয়ে ক্যালশিয়াম হাইড্রক্সাইড [Ca(OH)2] ক্ষার উৎপন্ন করে এবং আসিডের সঙ্গে বিক্রিয়ায় লবণ ও জল উৎপন্ন করে। তাই ক্যালশিয়াম অক্সাইডকে ক্ষারকীয় অক্সাইড বলা হয়।
CaO + H2O→ Ca(OH)2
CaO + H2SO4 → CaSO4 (ক্যালশিয়াম সালফেট লবণ) + H2O
অ্যাসিডকে ধাতব পাত্রে সংরক্ষণ করা হয় না কেন?
অ্যাসিডকে ধাতব পাত্রে সংরক্ষণ করা হয় না কারণ – সক্রিয়তা শ্রেণিতে হাইড্রোজেনের উপরে থাকা ধাতুগুলি অ্যাসিডের সঙ্গে বিক্রিয়ায় লবণ ও হাইড্রোজেন গ্যাস উৎপন্ন করে। ফলে, ধাতব পাত্র ক্ষয় পেতে থাকে এবং অ্যাসিডের কার্যকারিতা বিনষ্ট হয়।
যেমন – লোহার তৈরি পাত্রে H2SO4 অ্যাসিড রাখলে Fe লঘু H2SO4 -এর সঙ্গে বিক্রিয়ায় FeSO4 ও H2 গ্যাস উৎপন্ন করে।
Fe + H2SO4 → FeSO4 + H2↑
কপার, লেড বা জিংক পাত্রে দই বা কাটা লেবু জাতীয় ফল রাখা উচিত নয় কেন?
দই ও টক লেবু জাতীয় ফলে যথাক্রমে ল্যাকটিক অ্যাসিড ও সাইট্রিক অ্যাসিড নামক জৈব অ্যাসিড বর্তমান। এই জৈব অ্যাসিডগুলি ধীরে ধীরে কপার, লেড বা জিংকের সঙ্গে বিক্রিয়া করে বিষাক্ত লবণ উৎপন্ন করে। ফলে, খাবার দূষিত হয়ে যায়।
তাই কপার, লেড বা জিংক পাত্রে দই বা কাটা লেবু জাতীয় ফল রাখা উচিত নয়।
সোডিয়াম হাইড্রক্সাইড একটি ক্ষার কিন্তু ClOH একটি অ্যাসিড কেন?
সোডিয়াম হাইড্রক্সাইড (NaOH) জলে দ্রবীভূত হয় এবং জলীয় দ্রবণে বিয়োজিত হয়ে Na+ ও OH– আয়ন উৎপন্ন করে।
NaOH ⇌ Na+ + OH–
তাই NaOH একটি ক্ষার।
কিন্তু ClOH জলীয় দ্রবণে বিয়োজিত হয়ে H+ ও OCl– আয়ন উৎপন্ন করে এবং জলের সঙ্গে যুক্ত হয়ে হাইড্রক্সোনিয়াম আয়ন (H3O+) উৎপন্ন করে। তাই এটি একটি অ্যাসিড।
HOCl ⇌ H+ + OCl–
HOCl + H2O ⇌ H3O+ + OCl–
গাঢ় HNO3 পূর্ণ কাচের বোতল সূর্যালোকে রেখে দিলে হলুদ বর্ণ ধারণ করে কেন?
HNO3 তীব্র জারক অ্যাসিড হওয়ায় গাঢ় HNO3 পূর্ণ বোতলকে সূর্যালোকে অনেকক্ষণ রেখে দিলে এটি বিয়োজিত হয়ে বাদামি বর্ণের নাইট্রোজেন ডাইঅক্সাইড (NO2) গ্যাস উৎপন্ন করে। উৎপন্ন NO2 গ্যাস নাইট্রিক অ্যাসিডের সঙ্গে মিশে অ্যাসিডের বর্ণ হলুদ করে।
CO2 -এর জলীয় দ্রবণ আম্লিক, ক্ষারীয় না প্রশম? কীভাবে দেখাবে?
CO2 -এর জলীয় দ্রবণ আম্লিক, কারণ – CO2 জলে দ্রবীভূত হয়ে কার্বনিক অ্যাসিড (H2CO3) উৎপন্ন করে।
CO2 + H2O = H2CO3
CO2 -এর জলীয় দ্রবণে নীল লিটমাস কাগজ দিলে লাল হয়ে যায়। এর থেকে প্রমাণিত হয় যে, CO2 -এর জলীয় দ্রবণ আম্লিক।
A, B, C, D, E পাঁচটি দ্রবণের pH যথাক্রমে 4, 1, 11, 7 এবং 9 – (1) উপরের 5টি দ্রবণের মধ্যে (a) কোনটি প্রশম, (b) কোনটি তীব্র ক্ষারীয়, (c) কোনটি তীব্র আম্লিক, (d) কোনটি মৃদু আম্লিক, এবং (e) কোনটি মৃদু ক্ষারীয়? (2) উপরের দ্রবণগুলিকে H+ আয়নের গাঢ়ত্বের উর্ধ্বক্রমে সাজাও।
1. যে দ্রবণের pH -এর মান যত বেশি, সেই দ্রবণ তত কম আম্লিক এবং যে দ্রবণের pH -এর মান যত কম সেই দ্রবণ তত বেশি আম্লিক। আবার, যে দ্রবণের pH -এর মান যত বেশি, সেই দ্রবণ তত বেশি ক্ষারীয়, যে দ্রবণের pH -এর মান যত কম সেই দ্রবণ তত কম ক্ষারীয়।
| দ্রবণ | pH | প্রকৃতি |
| D | 7 | প্রশম |
| C | 11 | তীব্র ক্ষারীয় |
| B | 1 | তীব্র আম্লিক |
| A | 4 | মৃদু আম্লিক |
| E | 9 | মৃদু ক্ষারীয় |
2. যে দ্রবণের pH -এর মান যত কম সেই দ্রবণের H+ আয়নের গাঢ়ত্ব তত বেশি এবং যে দ্রবণের pH -এর মান যত বেশি সেই দ্রবণের H+ আয়নের গাঢ়ত্ব তত কম।
\(\underset{\left(pH=11\right)}C<\underset{\left(pH=9\right)}E<\underset{\left(pH=7\right)}D<\underset{\left(pH=4\right)}A<\underset{\left(pH=1\right)}B\\\)
তোমাকে ‘A’ এবং ‘B’ দুটি দ্রবণ দেওয়া হল। ‘A’ দ্রবণের pH = 6 এবং ‘B’ দ্রবণের pH = 8 হলে –
(i) কোন্ দ্রবণের H+ আয়নের গাঢ়ত্ব বেশি?
(ii) কোন্ দ্রবণটি আম্লিক এবং কোন্ দ্রবণটি ক্ষারীয়?
কোন্ দ্রবণের H+ আয়নের গাঢ়ত্ব বেশি?
আমরা জানি, কোনো দ্রবণের pH -এর মান ওই দ্রবণের হাইড্রোজেন আয়নের গাঢ়ত্বের সঙ্গে ব্যস্তানুপাতে পরিবর্তিত হয়। যে দ্রবণের pH -এর মান যত বেশি, সেই দ্রবণের H+ আয়নের গাঢ়ত্ব তত কম। এক্ষেত্রে, A দ্রবণের pH = 6 এবং B দ্রবণের pH = 8। যেহেতু, A দ্রবণের pH -এর মান B দ্রবণের pH -এর মান অপেক্ষা কম, তাই A দ্রবণে H+ আয়নের গাঢ়ত্ব, B দ্রবণের তুলনায় বেশি।
কোন্ দ্রবণটি আম্লিক এবং কোন্ দ্রবণটি ক্ষারীয়?
pH স্কেল অনুযায়ী আমরা জানি, অ্যাসিড দ্রবণের ক্ষেত্রে pH < 7 এবং ক্ষারীয় দ্রবণের ক্ষেত্রে pH > 7। সুতরাং, A দ্রবণ আম্লিক এবং B দ্রবণ ক্ষারীয়।
কার্বন ডাইঅক্সাইডকে কেন কার্বনিক অ্যাসিডের নিরুদক বলা হয়?
কোনো অ্যাসিডের নিরুদক বলতে, সেই পদার্থটিকে বোঝায় যার সঙ্গে জল মেশালে সংশ্লিষ্ট অ্যাসিডটি উৎপন্ন হয়। কার্বন ডাইঅক্সাইড জলে দ্রবীভূত হয়ে কার্বনিক অ্যাসিড উৎপন্ন করে।
এই কারণে CO2 -কে কার্বনিক অ্যাসিডের নিরুদক বলা হয়।
সাধারণত গ্যাসীয় অক্সাইডগুলি জলে দ্রবীভূত হলে অম্লত্ব বৃদ্ধি পায় কেন?
সাধারণত গ্যাসীয় অক্সাইডগুলি জলে দ্রবীভূত হলে অ্যাসিড উৎপন্ন করে, ফলে, অম্লত্ব বৃদ্ধি পায়।
ধাতব অক্সাইড হলেও ক্রোমিয়াম ট্রাইঅক্সাইডকে আম্লিক অক্সাইড বলা হয় কেন?
সাধারণত ধাতব অক্সাইডগুলি জলীয় দ্রবণে ক্ষারীয় ধর্ম প্রদর্শন করে। কিন্তু ক্রোমিয়াম অক্সাইড জলের সঙ্গে যুক্ত হয়ে ক্রোমিক অ্যাসিড উৎপন্ন করে।
তাই ধাতব অক্সাইড হলেও ক্রোমিয়াম ট্রাইঅক্সাইডকে আম্লিক অক্সাইড বলা হয়।
Mn2O7 অম্লধর্মী অক্সাইড কেন?
Mn2O7 ধাতব অক্সাইড হওয়া সত্ত্বেও এটি অম্লধর্মী অক্সাইড কারণ – এটি জলের সঙ্গে বিক্রিয়া করে পারম্যাঙ্গানিক অ্যাসিড (HMnO4) উৎপন্ন করে এবং ক্ষারের সঙ্গে বিক্রিয়া করে পারম্যাঙ্গানেট লবণ ও জল উৎপন্ন করে।
HCl এবং HNO3 সর্বদা শমিত লবণ উৎপন্ন করে, কিন্তু H2SO4 অ্যাসিড লবণ উৎপন্ন করে ব্যাখ্যা করো।
অ্যাসিডের অণুতে প্রতিস্থাপনযোগ্য হাইড্রোজেন পরমাণু ধাতু দ্বারা সম্পূর্ণরূপে প্রতিস্থাপিত হলে শমিত লবণ উৎপন্ন হয় এবং আংশিকরূপে প্রতিস্থাপিত হলে অ্যাসিড লবণ উৎপন্ন হয়। HCl এবং HNO3 এক-ক্ষারীয় অ্যাসিড অর্থাৎ, এদের অণুতে একটি মাত্র প্রতিস্থাপনযোগ্য হাইড্রোজেন পরমাণু বর্তমান। তাই HCl এবং HNO3 -এর 1টি H -পরমাণু ধাতু দ্বারা সম্পূর্ণরূপে প্রতিস্থাপিত হয়ে সর্বদা শমিত লবণ উৎপন্ন করে। এক্ষেত্রে অ্যাসিড লবণ গঠনের কোনো সুযোগ নেই।
H2SO4 দ্বি-ক্ষারীয় অ্যাসিড অর্থাৎ, 1টি অণুতে 2টি প্রতিস্থাপনযোগ্য H -পরমাণু বর্তমান। এক্ষেত্রে যদি 1টি H -পরমাণু ধাতু দ্বারা প্রতিস্থাপিত হয় তবে অ্যাসিড লবণ উৎপন্ন হয়। কিন্তু যদি 2টি H -পরমাণু ধাতু দ্বারা প্রতিস্থাপিত হয় তবে শমিত লবণ উৎপন্ন হয়। অর্থাৎ, H2SO4 শমিত লবণ এবং অ্যাসিড লবণ উভয় প্রকার লবণ গঠনে সক্ষম।
সোডিয়াম কার্বনেট একটি নর্মাল লবণ, কিন্তু এর জলীয় দ্রবণ ক্ষারীয় কেন?
অথবা, Na2CO3 -এর জলীয় দ্রবণ ক্ষারীয় কেন?
সোডিয়াম কার্বনেটের জলীয় দ্রবণের আর্দ্র বিশ্লেষণের ফলে কার্বনিক অ্যাসিড ও সোডিয়াম হাইড্রক্সাইড উৎপন্ন হয়।
Na2CO3 + H2O = 2Na+ + 2OH + H2CO3
কার্বনিক অ্যাসিড (H2CO3) একটি মৃদু অ্যাসিড। তাই এর বেশিরভাগ অণু আয়নিত না হয়ে অবিয়োজিত অবস্থায় থাকে। তাই দ্রবণে H+ আয়ন খুব কম থাকে। কিন্তু এর আর্দ্র বিশ্লেষণে উৎপন্ন NaOH একটি তীব্র ক্ষার। তাই এর সবকটি অণু বিয়োজিত হয়ে Na+ ও OH– আয়ন উৎপন্ন করে। তাই দ্রবণে OH– আয়নের গাঢ়ত্ব বেশি থাকে। এই কারণে Na2CO3 -এর জলীয় দ্রবণ ক্ষারীয় হয়।
জিংক পাত্রে NaOH -এর দ্রবণ রাখা যায় না কেন?
জিংক পাত্রে NaOH -এর দ্রবণ রাখা যায় না, কারণ জিংক NaOH -এর সঙ্গে বিক্রিয়া করে সোডিয়াম জিংকেট লবণ (Na2ZnO2) এবং হাইড্রোজেন গ্যাস (H2) উৎপন্ন করে।
Zn + 2NaOH = Na2ZnO2 + H2↑
ফলে, Zn -এর পাত্রটি ধীরে ধীরে ক্ষয়প্রাপ্ত হয় এবং NaOH দ্রবণটি নিঃশেষিত হয়ে যায়।
পরীক্ষাগারের কাঠের তাকে যেখানে গাঢ় H2SO4 -এর বোতল রাখা হয়, সেই জায়গাটা কিছুদিন পর কালো হয়ে যায় কেন?
গাঢ় H2SO4 একটি জলাকর্ষী পদার্থ। তাই এর নিরুদন ধর্ম আছে। এটি কাঠে উপস্থিত সেলুলোজের নিরুদন ঘটিয়ে কালো কার্বনে পরিণত করে। তাই গাঢ় H2SO4 -এর বোতলের তলদেশের কাঠ কালো হয়ে যায়।
গাঢ় সালফিউরিক অ্যাসিডের সংস্পর্শে এলে ত্বক কালো হয়ে যায় কেন?
গাঢ় সালফিউরিক অ্যাসিড তীব্র জলাকর্ষী পদার্থ এবং তীব্র জারক পদার্থ। মানুষের ত্বকের সংস্পর্শে এই অ্যাসিড এলে তা দেহ থেকে জলীয় অংশ শোষণ করে নেয়। ফলে, ত্বক কালো হয়ে যায়।
ক্ষারীয় মাধ্যমের ঘনত্বের ওপর ফেনলপ্থ্যালিনের বর্ণের পরিবর্তন নির্ভর করে ব্যাখ্যা করো।
জলীয় দ্রবণে ক্ষার মাত্রই OH– আয়ন দেয়। দ্রবণে ক্ষারত্বের তীব্রতা দ্রবণে উপস্থিত OH– আয়নের গাঢ়ত্বের ওপর নির্ভর করে। দ্রবণের pH -এর মান 7 থেকে বাড়তে বাড়তে 14 -এর অভিমুখে গেলে দ্রবণের OH– আয়নের গাঢ়ত্ব বাড়তে থাকে এবং সঙ্গে সঙ্গে দ্রবণের ক্ষারকত্বও বাড়তে থাকে। আবার pH -এর মানের পরিবর্তন হলে নির্দেশকের বর্ণের পরিবর্তন ঘটবে। ফেনলপ্থ্যালিনের pH বিস্তার 8.3 – 10 অর্থাৎ, দ্রবণের pH < 8.3 হলে ফেনলপ্থ্যালিনের উপস্থিতিতে দ্রবণের বর্ণ বর্ণহীন হয় এবং দ্রবণের pH > 10 হলে ফেনলপ্থ্যালিনের উপস্থিতিতে দ্রবণের বর্ণ গোলাপি হয়। সুতরাং, ক্ষারীয় মাধ্যমের ঘনত্ব তথা দ্রবণের pH -এর ওপর নির্ভর করে ফেনলপ্থ্যালিন নির্দেশকের বর্ণের পরিবর্তন ঘটে।
Na2CO3 -এর জলীয় দ্রবণে 1 ফোঁটা মিথাইল অরেঞ্জ যোগ করলে কী পরিবর্তন লক্ষ করবে? একটি স্ট্র দিয়ে ক্রমাগত ফুঁ দিলে কী পরিবর্তন লক্ষ করবে? যুক্তিসহ লেখো।
সোডিয়াম কার্বনেট (Na2CO3) একটি তীব্র ক্ষার ও মৃদু অ্যাসিডের লবণ। তাই এর জলীয় দ্রবণে ক্ষার ধর্ম প্রকাশ পায়। এই জলীয় দ্রবণে 1 ফোঁটা মিথাইল অরেঞ্জ যোগ করলে দ্রবণের বর্ণ হলুদ হয়ে যায়। কারণ – ক্ষার দ্রবণে মিথাইল অরেঞ্জ হলুদ বর্ণ প্রদর্শন করে।

এই দ্রবণে স্ট্র দিয়ে ক্রমাগত ফুঁ দিলে ফুঁ -এর বাতাসের মধ্যের CO2 ক্রমাগত দ্রবণে যুক্ত হয়ে কার্বনিক অ্যাসিড উৎপন্ন করে। ক্রমাগত ফুঁ দিলে কার্বনিক অ্যাসিডের পরিমাণ বাড়তে থাকে যা দ্রবণে উপস্থিত ক্ষারকে একসময় প্রশমিত করে দেয়। ফলে দ্রবণের বর্ণ কমলা হয়ে যায়। কারণ – মিথাইল অরেঞ্জ প্রশম দ্রবণে কমলা বর্ণ দেখায়। এইভাবে ক্রমাগত আরো ফুঁ দিলে একসময় অ্যাসিডের মাত্রা বেড়ে যাবে তখন মিথাইল অরেঞ্জ দ্রবণে লাল বর্ণ প্রদর্শন করবে।
একটি অজৈব অ্যাসিড (A) -এর মধ্যে বেরিয়াম ক্লোরাইড দ্রবণ যোগ করলে একটি সাদা অধঃক্ষেপ (B) উৎপন্ন হয়, যা HNO3 তে অদ্রাব্য। (A) ও (B) কে শনাক্ত করো। স্বপক্ষে রাসায়নিক বিক্রিয়া দাও।
বেরিয়াম ক্লোরাইড দ্রবণের সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়ায় বেরিয়াম সালফেটের (BaSO4) সাদা অধঃক্ষেপ উৎপন্ন হয়। এই অধঃক্ষেপ HCl ও HNO3 -তে অদ্রাব্য। সুতরাং, অজৈব অ্যাসিডটি (A) হল সালফিউরিক অ্যাসিড ও সাদা অধঃক্ষেপটি (B) হল বেরিয়াম সালফেট, যা HNO3 -তে অদ্রাব্য।
Pt-ধাতু কীভাবে অম্লরাজে দ্রবীভূত হয়?
অথবা, অম্লরাজে সোনা দ্রবীভূত হয় কেন?
অম্লরাজ হল এক আয়তন ঘন নাইট্রিক অ্যাসিড ও তিন আয়তন ঘন হাইড্রোক্লোরিক অ্যাসিডের মিশ্রণ। এই দুটি অ্যাসিডের পারস্পরিক বিক্রিয়ায় নাইট্রোসিল ক্লোরাইড (NOCl), জল ও জায়মান ক্লোরিন উৎপন্ন হয়। এই জায়মান ক্লোরিন সোনা ও প্ল্যাটিনামের সঙ্গে বিক্রিয়া করে ধাতুর দ্রাব্য ক্লোরাইড লবণ গঠন করে।
\(HNO_3+3HCl=2\left[Cl\right]+NOCl+2H_2O\\\)সালফিউরিক অ্যাসিডকে ‘Oil of vitriol’ বলে কেন?
মধ্যযুগে ইউরোপীয় রসায়নবিদরা ফেরাস সালফেট থেকে (FeSO4, 7H2O) সালফিউরিক অ্যাসিড তৈরি করতেন। ফেরাস সালফেটের অপর নাম গ্রিন ভিট্রিয়ল। ফেরাস সালফেটের কেলাস দেখতে স্বচ্ছ সবুজ কাচের মতো এবং এর থেকে উৎপন্ন H2SO4 দেখতে তেলের মতো। তাই ভিট্রিয়ল থেকে প্রাপ্ত তেলের মতো H2SO4 -এর নাম হয় অয়েল অব ভিট্রিয়ল (Oil of vitriol)।
10-9 (M) HCl -এর জলীয় দ্রবণের pH = 7 অপেক্ষা বেশি না কম?
HCl -এর গাঢ়ত্ব = 10-9 (M)
∴ প্রদত্ত দ্রবণে H+ আয়নের গাঢ়ত্ব 10-9 (M)
সুতরাং, প্রদত্ত দ্রবণের pH = -log [H+]
= -log [10-9]
= -(-9)
= 9
তাহলে, প্রদত্ত দ্রবণের pH -এর মান 9 হওয়া উচিত অর্থাৎ, দ্রবণটি ক্ষারকীয় হবে কিন্তু দ্রবণটি আম্লিক (HCl যুক্ত)। তাই এই ক্ষেত্রে দ্রবণে উপস্থিত জলের বিয়োজনে উৎপন্ন আয়নের গাঢ়ত্বও ধরতে হবে। ধরি, এই গাঢ়ত্ব = x(M) তাহলে OH– আয়নের গাঢ়ত্বও x(M) হবে।
∴ (10-9 + x)⋅10-14 [জলের আয়নীয় গুণফল]
∴ x = 99.5 × 10-9
∴ [H+] = 10-9 + 99.5 × 10-9 তাহলে pH = 6.997
∴ প্রকৃত দ্রবণের pH হবে 7 -এর কম।
HNO3 -এর জারণ ধর্ম থাকলেও বিজারণ ধর্ম নেই কেন?
নাইট্রোজেনঘটিত কোনো যৌগে নাইট্রোজেনের সর্বোচ্চ ও সর্বনিম্ন জারণ সংখ্যা যথাক্রমে +5 ও -3 হতে পারে।
HNO3 -তে নাইট্রোজেনের জারণ সংখ্যা +5। এটিই নাইট্রোজেন যৌগে সর্বোচ্চ জারণ সংখ্যা। বিভিন্ন বিক্রিয়ায় নাইট্রোজেনের জারণ সংখ্যা হ্রাস পেতে পারে (যেমন – +4, +3, +2, +1, 0, -1, -2, -3)। অর্থাৎ, এটি বিজারিত হতে পারে।
\(\overset{+5}{HNO_3}\rightarrow\overset{+4}{NO_2}\rightarrow\overset{+3}{HNO_2}\rightarrow\overset{+2}{NO}\rightarrow\overset{+1}{N_2O}\rightarrow\overset0{N_2}\\\)তাই HNO3 -এর নাইট্রোজেন পরমাণু ইলেকট্রন বর্জন করে উচ্চ জারণস্তরে জারিত হয়ে অন্যকে বিজারিত করতে পারে না অর্থাৎ, বিজারণ ক্ষমতা নেই। এই জন্য HNO3 -এর কেবলমাত্র জারণ ধর্ম আছে, বিজারণ ধর্ম নেই।
বিলীয়মান রং প্রস্তুতিতে NH4OH-এর পরিবর্তে KOH দিলে কী ঘটবে?
বিলীয়মান রং প্রস্তুতিতে NH4OH -এর বদলে KOH ব্যবহার করলে লালচে-গোলাপি রংটি স্থায়ীভাবে থেকে যায় কারণ – NH4OH থেকে NH3 উবে যাওয়ায় দ্রবণের ক্ষার ধর্ম লোপ পায়। তাই কিছুক্ষণ পর জামাকাপড়ের বিলীয়মান রঙের লালচে-গোলাপি বর্ণ অদৃশ্য হয়। কিন্তু KOH উদবায়ী নয়, ফলে, ফেনলপ্থ্যালিন যুক্ত KOH জামাকাপড়ে দিলে রংটি স্থায়ী হয়ে যাবে।
তেঁতুল, আমড়া ও লেবুগাছের তলায় সেইসব গাছের চারা ছাড়া অন্য কোনো গাছের চারা সহজে জন্মায় না, কেন? তার জন্য তুমি কী করবে?
তেতুঁল, আমড়া বা লেবু গাছ হল – টক জাতীয় ফলের গাছ। এদের ফলে ও পাতায় জৈব অ্যাসিড বর্তমান। দীর্ঘদিন ধরে এই গাছগুলির পাতা ও ফল গাছের তলায় পড়ে এবং মাটির সঙ্গে মিশ্রিত হয়। ফলে, মাটি আম্লিক হয়ে পড়ে এবং মাটির pH বেশ কমে যায়। এছাড়া মাটিতে পচনশীল পদার্থের পরিমাণও বৃদ্ধি পায়। তাই এই গাছগুলির তলায় সাধারণত অন্য কোনো গাছের চারা জন্মায় না। কিন্তু আবার আমড়া, তেঁতুল বা লেবু গাছ যেহেতু আম্লিক জৈব পদার্থযুক্ত মৃত্তিকাতে ভালো হয়, তাই এই চারা গাছগুলির ওই স্থানে জন্মাতে কোনো বাধা থাকে না।
এই সমস্যা সমাধানের জন্য লেবু, আমড়া বা তেতুঁল গাছের তলার মাটিতে নির্দিষ্ট সময় অন্তর মাটি কুপিয়ে চুন মিশিয়ে রৌদ্রে উন্মুক্ত করে রাখতে হবে, এতে মাটির গুণমান বৃদ্ধি পায়, pH বাড়ে ও পচনশীল জৈব পদার্থের পরিমাণও কমে।
মাটিতে সার হিসেবে অতিরিক্ত (NH4)2SO4 ব্যবহার করা উচিত নয় কেন?
অ্যামোনিয়াম সালফেট [(NH4)2SO4] সার হিসেবে অতিরিক্ত ব্যবহার করলে আর্দ্র বিশ্লেষিত হয়ে H2SO4 উৎপন্ন করবে। ফলে, মাটির অম্লত্ব বৃদ্ধি পায়।
(NH4)2SO4 + 2H2O ⇌ 2NH4OH + H2SO4
আবার (NH4)2SO4 -এর বিয়োজনে উৎপন্ন \(NH_4^+\) আয়ন মাটির মধ্যে বিভিন্ন জৈবিক ক্রিয়ার ফলে \(NO_3^-\) আয়ন উৎপন্ন করে যা পরে HNO3 -তে পরিবর্তিত হয়।
অর্থাৎ, ক্রমাগত জমিতে (NH4)2SO4 সার ব্যবহার করতে থাকলে জমিতে H2SO4 ও HNO3 -এর পরিমাণ বাড়তে থাকে, ফলে pH হ্রাস পায় এবং মাটির উৎপাদন ক্ষমতা হ্রাস পায়।
চামড়ায় অ্যাসিড পড়লে তীব্র ক্ষার যোগ করতে হয় না কেন?
চামড়ায় অ্যাসিড পড়লে ত্বকের সেই অংশ প্রচুর পরিমাণ জল দিয়ে বেশ কিছুক্ষণ ধরে বারবার ধুতে হয় এবং প্রয়োজনে ক্ষতস্থানে NaHCO3 -এর লঘু দ্রবণ (1%) লাগানো হয়। কিন্তু কখনোই তীব্র ক্ষারের দ্রবণ যোগ করতে নেই। কারণ – তীব্র ক্ষারের সঙ্গে অ্যাসিডের প্রশমন বিক্রিয়ায় যে তাপের সৃষ্টি হয়, তাতে ক্ষতস্থান পুড়ে যাওয়ার সম্ভাবনা থাকে। ফলে, চামড়া আরো ক্ষতিগ্রস্ত হয়।
বলয় পরীক্ষায় বলয় উৎপন্ন হওয়ার পর টেস্টটিউবটিকে ঝাঁকালে বলয়টি অদৃশ্য হয়ে যায় কেন?
বলয় পরীক্ষায় বলয় উৎপন্ন হওয়ায় পর টেস্টটিউবটিকে ঝাঁকালে বলয়টি অদৃশ্য হয়ে যায়, কারণ – বলয় গঠনকারী বাদামি বর্ণের জটিল যৌগটি [Fe(H2O)5NO]SO4 অস্থায়ী প্রকৃতির। তাই বলয় উৎপন্ন হওয়ার পর টেস্টটিউবটিকে ঝাঁকালে গাঢ় H2SO4 জলের সঙ্গে মিশে দ্রবণের তাপমাত্রা বৃদ্ধি করে। ফলে, উচ্চ উষ্ণতায় অস্থায়ী জটিল যৌগটি বিয়োজিত হয়ে নাইট্রিক অক্সাইড (NO) গ্যাস মুক্ত করে যা বুদ্বুদ আকারে বেরিয়ে আসে এবং বাদামি বলয়টি অদৃশ্য হয়ে যায়।
নাইট্রিক অ্যাসিড শনাক্তকরণের বলয় পরীক্ষায় ফেরাস সালফেটের সদ্য প্রস্তুত দ্রবণ নেওয়া হয় কেন?
নাইট্রিক অ্যাসিড শনাক্তকরণের বলয় পরীক্ষায় নাইট্রিক অ্যাসিড ফেরাস সালফেট দ্বারা বিজারিত হয়ে যে নাইট্রিক অক্সাইড (NO) উৎপন্ন করে তা ফেরাস সালফেটের সঙ্গে বিক্রিয়া করে বাদামি বর্ণের বলয় গঠন করে।
6FeSO4 + 3H2SO4 + 2HNO3 = 3Fe2(SO4)3 + 2NO + 4H2O
FeSO4 + 6H2O = [Fe(H2O)6]SO4
এই পরীক্ষায় সদ্য প্রস্তুত ফেরাস সালফেট দ্রবণ ব্যবহার না করলে, ফেরাস সালফেট (FeSO4) বাতাসের O2 দ্বারা ফেরিক সালফেটে [Fe2(SO4)3] জারিত হয়। ফলে বলয় পরীক্ষায় এটি বিজারক দ্রব্য হিসেবে কাজ করতে না পারায় NO উৎপন্ন হবে না, অতঃপর বাদামি বলয় গঠিত হবে না।
খাদ্য খাওয়ার পর নিয়মিত দাঁত পরিষ্কার করা উচিত কেন?
অথবা, নিম্ন pH মাত্রায় দাঁতের ক্ষয় হয় কেন?
খাদ্য খাওয়ার পর যদি মুখের মধ্যে দাঁতের ফাঁকে খাবারের (বিশেষত মিষ্টি জাতীয়) অবশিষ্টাংশ থেকে যায়, তবে তা ব্যাকটেরিয়া দ্বারা বিয়োজিত হয়ে ল্যাকটিক অ্যাসিড উৎপন্ন করে। আমাদের দাঁত (এনামেল) ক্যালশিয়াম ফসফেট ঘটিত যৌগ দিয়ে গঠিত। এই অ্যাসিড সৃষ্টির মাত্রা অধিকতর হলে মুখগহ্বরের লালারসের pH -এর মান ক্রমশ কমতে কমতে 5.5 হয়ে যায়। ফলে, দাঁতের সাদা এনামেল, ক্যালশিয়াম ফসফেট ক্ষয় পায়।
এজন্য খাবার পরেই ‘পেস্ট’ দিয়ে ভালো করে দাঁত ব্রাশ করা উচিত। টুথপেস্টের pH -এর মান 7 -এর বেশি, এটি ক্ষারীয়। ফলে মুখে সৃষ্ট অ্যাসিডকে অনেকটাই প্রশমিত করে এবং দাঁতের ক্ষয় রোধ করতে পারে।
মৎস্য চাষে পুকুর বা জলাশয়ের জলে চুন ব্যবহার করা হয় কেন?
মৎস্য চাষের জন্য ব্যবহৃত পুকুর, জলাশয়ের জলের pH নিয়ন্ত্রণ করা অত্যন্ত জরুরি। জলজ প্রাণীরা (যেমন মাছ) pH -মানের সংকীর্ণ ব্যাপ্তির মধ্যে জীবনধারণ করে। অ্যাসিড বৃষ্টির দরুন বৃষ্টির জলের pH -এর মান প্রায় 5.6 -এর নীচে নেমে যায়। ওই জল পুকুর বা জলাশয়ে মিশলে জলের অম্লত্বও বৃদ্ধি পায়। ফলে মাছ উৎপাদন ব্যাহত হয় এবং কখনো কখনো এরা মৃত্যুমুখে পতিত হয়।

তাই মৎস্য চাষিরা পুকুর বা জলাশয়ের জলের অম্লত্ব কমানোর জন্য জলে ক্ষার জাতীয় পদার্থ যেমন – চুন মিশিয়ে থাকেন যাতে জলে উপস্থিত অতিরিক্ত অ্যাসিড ক্ষার দ্বারা প্রশমিত হয়ে মাছেদের জীবন রক্ষা পায়।
অ্যাসপিরিন জাতীয় ওষুধ খেলে অ্যান্টাসিড খাওয়া উচিত কেন?
অ্যাসপিরিন হল অ্যাসিটাইল স্যালিসাইলিক অ্যাসিড। এর সংকেত C6H4(COOH)(OCOCH3)। অ্যাসপিরিন খেলে তা পাকস্থলীতে আর্দ্রবিশ্লিষ্ট হয়ে স্যালিসাইলিক অ্যাসিড ও অ্যাসিটিক অ্যাসিড উৎপন্ন করে। এগুলি পাকস্থলীর কোশপ্রাচীরে শোষিত হয়ে ক্ষতের সৃষ্টি করে এবং রক্তক্ষরণ ঘটায়। তাই অ্যাসপিরিন খেলে তার সঙ্গে অ্যান্টাসিড খাওয়া উচিত কারণ – অ্যান্টাসিড পাকস্থলীতে উৎপন্ন এইসব অ্যাসিডকে প্রশমিত করে।
ডাক্তারেরা অ্যান্টাসিড-অ্যাসিলক, প্যান-40 ইত্যাদি ঔষধগুলি খাবার খাওয়ার আগে খেতে বলেন কেন?
অ্যাসিলক, প্যান-40 ইত্যাদি ঔষধগুলি উন্নত মানের অ্যান্টাসিড। এরা আমাদের পাকস্থলী থেকে নিঃসৃত অতিরিক্ত অ্যাসিডকে সরাসরি প্রশমিত করে না। এই ঔষধগুলি খালি পেটে খেলে এরা প্রোটন পাম্প ইনহিবিটর (PPI) হিসেবে কাজ করে এবং পাকস্থলী থেকে হাইড্রোক্লোরিক অ্যাসিড নিঃসরণ হওয়াকে নিয়ন্ত্রণ করে। ফলে, অম্বল বা অ্যাসিডিটি হয় না। তাই ডাক্তারেরা এই ঔষধগুলি খাওয়ার আগে খেতে বলেন।
পার্থক্যধর্মী প্রশ্নোত্তর
অ্যাসিড (Acid) ও ক্ষারের (Base) মধ্যে তুলনা করো।
অ্যাসিড (Acid) ও ক্ষারের (Base) মধ্যে তুলনাগুলি হল –
সাদৃশ্য –
- দ্রাব্যতা – অ্যাসিড ও ক্ষার উভয়েই জলে দ্রবীভূত হয়।
- তড়িৎ পরিবাহিতা – অ্যাসিড ও ক্ষার উভয়েইর জলীয় দ্রবণ তড়িতের সুপরিবাহী।
- ক্ষতিকর প্রভাব – গাঢ় অ্যাসিড ও ক্ষার উভয়েই চামড়ার সংস্পর্শে এলে ক্ষতের সৃষ্টি হয়।
বৈসাদৃশ্য –
| বিষয় | অ্যাসিড (Acid) | ক্ষার (Base) |
| স্বাদ | অ্যাসিডের স্বাদ টক। | ক্ষারের স্বাদ কষাটে। |
| লিটমাসের বর্ণ পরিবর্তন | অ্যাসিডের জলীয় দ্রবণ নীল লিটমাসকে লাল করে। | ক্ষারের জলীয় দ্রবণ লাল লিটমাসকে নীল করে। |
| জলীয় দ্রবণের প্রকৃতি | অ্যাসিডের জলীয় দ্রবণ পিচ্ছিল নয়। | ক্ষারের জলীয় দ্রবণ পিচ্ছিল হয়। |
| পরমাণু বা মূলকের উপস্থিতি | অ্যাসিডের অণুতে প্রতিস্থাপনযোগ্য হাইড্রোজেন পরমাণু থাকে। | ক্ষারের অণুতে প্রতিস্থাপনযোগ্য হাইড্রক্সিল মূলক থাকে। |
| আয়নের প্রকৃতি | অ্যাসিড জলীয় দ্রবণে বিয়োজিত হয়ে H+ আয়ন উৎপন্ন করে। | ক্ষার জলীয় দ্রবণে বিয়োজিত হয়ে হাইড্রক্সিল আয়ন (OH–)উৎপন্ন করে। |
| কার্বনেট লবণের সঙ্গে বিক্রিয়া | অ্যাসিড ধাতব কার্বনেট লবণের সঙ্গে বিক্রিয়া করে CO2 গ্যাস উৎপন্ন করে। ধাতব কার্বনেট + অ্যাসিড → ধাতব ক্লোরাইড + CO2↑ + H2O | ক্ষার CO2 গ্যাস শোষণ করে ধাতব কার্বনেট উৎপন্ন করে। ক্ষার + CO2 → ধাতব কার্বনেট + H2O |
হাইড্রোজেন ক্লোরাইড ও হাইড্রোক্লোরিক অ্যাসিডের মধ্যে পার্থক্য লেখো।
হাইড্রোজেন ক্লোরাইড ও হাইড্রোক্লোরিক অ্যাসিডের মধ্যে পার্থক্যগুলি হল –
| বিষয় | হাইড্রোজেন ক্লোরাইড | হাইড্রোক্লোরিক অ্যাসিড |
| অবস্থা | হাইড্রোজেন ক্লোরাইড গ্যাসীয় পদার্থ। | হাইড্রোক্লোরিক অ্যাসিড হল হাইড্রোজেন ক্লোরাইড গ্যাসের জলীয় দ্রবণ। সুতরাং, এটি তরল। |
| আয়নন ও তড়িৎ পরিবহণ | হাইড্রোজেন ক্লোরাইডে গ্যাস আয়নিত হয় না, তাই এটি তড়িৎ পরিবহণ করে না। | হাইড্রোক্লোরিক অ্যাসিড জলীয় দ্রবণে H3O+ এবং Cl– আয়নে বিয়োজিত হয়,তাই এটি তড়িৎ পরিবহণেসক্ষম। |
| লিটমাসের ওপর ক্রিয় | হাইড্রোজেন ক্লোরাইড গ্যাস শুষ্ক নীল লিটমাসকে লাল বর্ণে পরিণত করতে পারে না। | হাইড্রোক্লোরিক অ্যাসিড শুষ্ক নীল লিটমাসকে লাল বর্ণে পরিণত করতে সক্ষম। |
সাধারণ নির্দেশক (Indicator) ও সর্বজনীন নির্দেশক (Universal Indicator) -এর মধ্যে পার্থক্য লেখো।
সাধারণ নির্দেশক (Indicator) ও সর্বজনীন নির্দেশক (Universal Indicator) -এর মধ্যে পার্থক্যগুলি হল –
| বিষয় | সাধারণ নির্দেশক (Indicator) | সর্বজনীন নির্দেশক (Universal indicator) |
| কার্য | কোনো দ্রবণ আম্লিক না ক্ষারীয় তা নির্দেশ করে। | কোনো আম্লিক বা ক্ষারীয় দ্রবণের pH নির্দেশ করে। |
| দ্রবণের শক্তিমাত্রা নির্ণয় | এর দ্বারা কোনো আম্লিক বা ক্ষারীয় দ্রবণের শক্তিমাত্রা নির্ণয় করা যায় না। | এর দ্বারা কোনো আম্লিক বা ক্ষারীয় দ্রবণের শক্তিমাত্রা নির্ণয় করা যায়। |
নৈর্ব্যক্তিক প্রশ্নোত্তর
সঠিক উত্তরটি নির্বাচন করো
কোনটি খনিজ অ্যাসিড? –
- সাইট্রিক অ্যাসিড
- অ্যাসিটিক অ্যাসিড
- ফসফরিক অ্যাসিড
- অক্সালিক অ্যাসিড
উত্তর – 3. ফসফরিক অ্যাসিড
অ্যাসিড জলীয় দ্রবণে উৎপন্ন করে –
- \(OH^-\) আয়ন
- \(H^+\) আয়ন
- \(Cl^-\) আয়ন
- \(SO_4^{2-}\) আয়ন
উত্তর – 2. \(H^+\) আয়ন
ত্রি-ক্ষারীয় অ্যাসিড কোনটি? –
- H3PO3
- H3PO4
- H3PO2
- CH3COOH
উত্তর – 2. H3PO4
একটি দ্বি-ক্ষারীয় অ্যাসিড হল –
- HCl
- H2SO4
- HNO3
- H2PO4
উত্তর – 2. H2SO4
কোন্ মৌলটি সব অ্যাসিডেই থাকে? –
- Cl
- N
- O
- H
উত্তর – 4. H
অ্যাসিড ও ক্ষার উভয়ের সঙ্গে বিক্রিয়া করে H2 গ্যাস উৎপন্ন করে এমন একটি ধাতু হল –
- কপার
- জিংক
- ম্যাগনেশিয়াম
- আয়রন
উত্তর – 2. জিংক
জলীয় দ্রবণে ক্ষার কোন্ আয়নটি উৎপন্ন করে? –
- H+ আয়ন
- Cl– আয়ন
- OH– আয়ন
- Na+ আয়ন
উত্তর – 3. OH– আয়ন
আরহেনিয়াসের অ্যাসিড ক্ষারক তত্ত্বের সীমাবদ্ধতা হল –
- এটি জৈব দ্রাবকে দ্রাব্য
- এটি অজৈব দ্রাবকে দ্রাব্য
- এটিতে দ্রাবক হিসেবে জলের উপস্থিতি আবশ্যক
- দ্রাবকের প্রয়োজন নেই
উত্তর – 3. এটিতে দ্রাবক হিসেবে জলের উপস্থিতি আবশ্যক
রসায়নের রাজা বলা হয় –
- NaOH -কে
- HNO3 -কে
- HCl -কে
- H2SO4 -কে
উত্তর – 4. H2SO4 -কে
একটি জলাকর্ষী অ্যাসিড হল –
- HNO3
- HCl
- H2SO4
- CH3COOH
উত্তর – 3. H2SO4
H2SO4 -কে শনাক্তকরণের জন্য ব্যবহৃত হয় –
- BaSO4
- BaCl2
- Ba(OH)2
- BaCO3
উত্তর – 2. BaCl2
কোন্ ধাতুটি অতি লঘু HNO3 -এর বিক্রিয়ায় গ্যাস উৎপন্ন করে? –
- Fe
- Al
- Ca
- Mg
উত্তর – 4. Mg
লঘু হাইড্রোক্লোরিক অ্যাসিড দ্রবণের সঙ্গে বিক্রিয়ায় H2 উৎপন্ন করতে পারে না –
- Fe
- Zn
- Cu
- Mg
উত্তর – 3. Cu
Zn + অতি লঘু ও শীতল HNO3 → Zn(NO3)2 + X + H2O, এখানে ‘X’ হল –
- N2O
- NO
- NO2
- NH4NO3
উত্তর – 4. NH4NO3
আপেলে যে অ্যাসিড পাওয়া যায় –
- সাইট্রিক অ্যাসিড
- টারটারিক অ্যাসিড
- ম্যালিক অ্যাসিড
- মিউরিয়েটিক অ্যাসিড
উত্তর – 3. ম্যালিক অ্যাসিড
অ্যাসিডকে লঘু করার সময় –
- জলে ধীরে ধীরে ঘন অ্যাসিড মেশানো উচিত
- ঘন অ্যাসিডের মধ্যে ধীরে ধীরে জল মেশানো উচিত
- জল ও ঘন অ্যাসিড 1 : 1 অনুপাতে দ্রুত মেশানো উচিত
- জল ও ঘন অ্যাসিড সমান পরিমাণ নিয়ে আস্তে আস্তে মেশানো উচিত
উত্তর – 1. জলে ধীরে ধীরে ঘন অ্যাসিড মেশানো উচিত
একটি সমযোজী যৌগ যার জলীয় দ্রবণ ক্ষারধর্মী সেটি হল –
- CH4
- CCl4
- NH3
- HCl
উত্তর – 3. NH3
কোন্ দ্রবণে NH4Cl অ্যাসিড ধর্ম প্রকাশ করে? –
- তরল NH3
- জল
- বেঞ্জিন
- CCl
উত্তর – 2. জল
Zn -এর সঙ্গে সালফিউরিক অ্যাসিডের বিক্রিয়ায় উৎপন্ন হয় –
- H2
- CO2
- SO2
- NO2
উত্তর – 1. H2
যে অ্যাসিডটি সামুদ্রিক লবণ থেকে তৈরি করা যায় সেটি হল –
- মিউরিয়েটিক অ্যাসিড
- নাইট্রিক অ্যাসিড
- সালফিউরিক অ্যাসিড
- অ্যাকোয়া রিজিয়া
উত্তর – 1. মিউরিয়েটিক অ্যাসিড
বলয় পরীক্ষায় যে যৌগটি উৎপন্ন হয় সেটি হল –
- [Fe(H2O)5(NO2)]SO4
- [Fe(H2O)5(NO)(SO4)]
- [Fe(H2O)5NO](SO4)2
- [Fe(H2O)5NO]SO4
উত্তর – 4. [Fe(H2O)5NO]SO4
কোনটি ক্ষারীয়? –
- লস্যি
- খাবার সোডার দ্রবণ
- ফুচকার জল
- ভিনিগার
উত্তর – 2. খাবার সোডার দ্রবণ
বিলীয়মান রং হল –
- NaOH + ফেনলপ্থ্যালিন
- NH4OH + মিথাইল অরেঞ্জ
- NaOH + মিথাইল অরেঞ্জ
- NH4OH + ফেনলপ্থ্যালিন
উত্তর – 4. NH4OH + ফেনলপ্থ্যালিন
একটি লবণের জলীয় দ্রবণ নিয়ে বলয় পরীক্ষা করা হল এবং বাদামি বলয় দেখা গেল। এই পরীক্ষা থেকে প্রদত্ত লবণে যে আয়নটির অস্তিত্ব প্রমাণিত হয়, তা হল –
- কার্বনেট
- সালফেট
- নাইট্রেট
- ক্লোরাইড
উত্তর – 3. নাইট্রেট
বলয় পরীক্ষার সাহায্যে শনাক্ত করা হয় –
- HCl -কে
- H2SO4 -কে
- NaOH -কে
- HNO3 -কে
উত্তর – 4. HNO3 -কে
সোনার দোকানের কাজে ব্যবহৃত অ্যাসিডটি হল –
- মিউরিয়েটিক অ্যাসিড
- নাইট্রিক অ্যাসিড
- সালফিউরিক অ্যাসিড
- ভিনিগার
উত্তর – 2. নাইট্রিক অ্যাসিড
যে গাঢ় অ্যাসিডের উপরিতল থেকে বাদামি বর্ণের ধোঁয়া নির্গত হয় –
- HNO3
- H2CO3
- H2SO4
- HCl
উত্তর – 1. HNO3
পিকরিক অ্যাসিড প্রস্তুতিতে কোন্ অ্যাসিড ব্যবহার করা হয়? –
- H2SO4
- HCl
- HNO3
- CH3COOH
উত্তর – 3. HNO3
লিটমাসের অ্যাসিড দ্রবণে বর্ণ –
- নীল
- লাল
- হলুদ
- বেগুনি
উত্তর – 2. লাল
নাইট্রোগ্লিসারিন তৈরিতে ব্যবহার করা হয় –
- HNO3
- HCl
- H2SO4
- NaOH
উত্তর – 1. HNO3
ক্ষারীয় দ্রবণে যে নির্দেশক নীল বর্ণ ধারণ করে সেটি হল –
- মিথাইল অরেঞ্জ
- মিথাইল রেড
- ফেনলপ্থ্যালিন
- লিটমাস
উত্তর – 4. লিটমাস
TiO2 উৎপাদনে ব্যবহৃত হয় –
- H2SO4
- HCl
- HNO3
- H2PO4
উত্তর – 1. H2SO4
\(NO_3^-\) মূলকের বলয় পরীক্ষায় উৎপন্ন বাদামি যৌগতে থাকে –
- NO2
- NO
- N2O
- N2O3
উত্তর – 2. NO
কোন্ দ্রবণটির pH সর্বাধিক? –
- 1 mol⋅L-1 HCl
- 0.01 mol⋅L-1 HCl
- 0.001 mol⋅L-1 HCl
- 0.1 mol⋅L-1 HCl
উত্তর – 3. 0.001 mol⋅L-1 HCl
নিউট্রাল pH -এর মান হল –
- 8
- 7
- 10
- 9
উত্তর – 2. 7
pH পেপারের ওপর একটি তরলের ফোঁটা ফেলায় পেপারটিতে লাল রঙের বৃত্তাকার অংশ দেখা গেল। তরলটি হবে –
- H2O
- HCl
- NaOH
- CH3COOH
উত্তর – 2. HCl
SO2 -এর জলীয় দ্রবণ –
- ক্ষারীয়
- প্রশম
- আম্লিক
- কোনোটিই নয়
উত্তর – 3. আম্লিক
প্রদত্ত কোন্ ধাতুটি লঘু নাইট্রিক অ্যাসিডের সঙ্গে বিক্রিয়ায় হাইড্রোজেন গ্যাস উৎপন্ন করে? –
- জিংক
- ম্যাগনেশিয়াম
- ক্যালশিয়াম
- কপার
উত্তর – 3. ক্যালশিয়াম
একটি ফলের রসে pH পেপার ডোবাতে সেটি লাল রং ধারণ করল তাহলে রসটির pH হল –
- < 3
- > 8
- 7
- 6.5375
উত্তর – 1. < 3
তেঁতুল জলে মিথাইল অরেঞ্জ যোগ করলে দ্রবণের বর্ণ হবে –
- কমলা
- হলুদ
- গোলাপি
- লাল
উত্তর – 4. লাল
একটি দ্রবণের pH = 2 হলে দ্রবণটি –
- আম্লিক হবে
- ক্ষারীয় হবে
- প্রশম হবে
- উভধর্মী হবে
উত্তর – 1. আম্লিক হবে
বিশুদ্ধ জলের pH –
- 5.7
- 6.8
- 7.0
- 7.8
উত্তর – 3. 7.0
ক্ষারীয় দ্রবণের pH হল –
- 7
- 0
- 3.5
- 7.9
উত্তর – 4. 7.9
বিশুদ্ধ জলে অ্যাসিড যোগ করলে জলে pH -এর মাত্রা –
- বাড়বে
- কমবে
- একই থাকবে
- শূন্য হবে
উত্তর – 2. কমবে
কোন্ দ্রবণটির pH সর্বোচ্চ? –
- 2 mol⋅L-1 দ্রবণ
- 0.2 mol⋅L-1 দ্রবণ
- 0.02 mol⋅L-1 দ্রবণ
- 0.002 mol⋅L-1 দ্রবণ
উত্তর – 4. 0.002 mol⋅L-1 দ্রবণ
একটি আম্লিক দ্রবণের pH হল –
- 5.4
- 7.0
- 8.2
- 13.4
উত্তর – 1. 5.4
অম্লবৃষ্টির ফলে কৃষিজমির pH –
- বৃদ্ধি পায়
- হ্রাস পায়
- অপরিবর্তিত থাকে
- কোথাও বৃদ্ধি পায় আবার কোথাও হ্রাস পায়
উত্তর – 2. হ্রাস পায়
প্রশম দ্রবণে লিটমাসের বর্ণ হবে –
- বেগুনি
- লাল
- কমলা
- হলুদ
উত্তর – 1. বেগুনি
প্রদত্ত কোনটি শমিত লবণের উদাহরণ নয়? –
- খাবার সোডা
- কাপড় কাচার সোডা
- তুঁতে
- গ্লবার লবণ
উত্তর – 1. খাবার সোডা
pH স্কেল হয় –
- (0 – 10)
- (0 – 14)
- (0 – 12)
- (0 – 16)
উত্তর – 2. (0 – 14)
টম্যাটো রসের pH -এর মান –
- 4.5
- 10
- 24 – 3.4
- 8.5
উত্তর – 1. 4.5
যে-সমস্ত টুথপেস্টগুলি সাধারণত ব্যবহৃত হয়, তাদের প্রকৃতি –
- আম্লিক
- ক্ষারীয়
- প্রশম
- উভধর্মী
উত্তর – 2. ক্ষারীয়
একটি দ্রবণে মিথাইল অরেঞ্জ যোগ করলে হলুদ বর্ণ ধারণ করে। দ্রবণটির pH হবে –
- 7
- 4
- >7
- <7
উত্তর – 3. >7
তীব্র অ্যাসিড ও মৃদু ক্ষারের প্রশমনে ব্যবহার করা যায় যে নির্দেশক –
- মিথাইল অরেঞ্জ
- লিটমাস
- ফেনলপ্থ্যালিন
- যে-কোনো নির্দেশক
উত্তর – 1. মিথাইল অরেঞ্জ
মৃদু অ্যাসিড ও তীব্র ক্ষারের প্রশমনে ব্যবহৃত নির্দেশক –
- মিথাইল অরেঞ্জ
- লিটমাস
- ফেনলপ্থ্যালিন
- যে-কোনো নির্দেশক
উত্তর – 3. ফেনলপ্থ্যালিন
তীব্র অ্যাসিড ও তীব্র ক্ষারের প্রশমনে নির্দেশক হিসেবে ব্যবহার করা যাবে
- মিথাইল অরেঞ্জ
- মিথাইল রেড
- ফেনলপ্থ্যালিন
- যে-কোনো নির্দেশক
উত্তর – 4. যে-কোনো নির্দেশক
প্রদত্ত কোনটি উভধর্মী অক্সাইডের উদাহরণ? –
- পোড়চুন
- কার্বন ডাইঅক্সাইড
- অ্যালুমিনা
- সালফার
উত্তর – 3. অ্যালুমিনা
প্রদত্ত যৌগগুলির মধ্যে উভধর্মী অক্সাইড হল –
- CaO
- CaSO4
- Al2O3
- সবগুলিই
উত্তর – 3. Al2O3
A ও B দ্রবণের pH যথাক্রমে 2 ও 4 -এর অর্থ হল –
- A দ্রবণ B দ্রবণের তুলনায় দ্বিগুণ আম্লিক
- B দ্রবণ A দ্রবণের তুলনায় দ্বিগুণ আম্লিক
- B দ্রবণ A দ্রবণের তুলনায় 100 গুণ আম্লিক
- A দ্রবণ B দ্রবণের তুলনায় 100 গুণ আম্লিক
উত্তর – 4. A দ্রবণ B দ্রবণের তুলনায় 100 গুণ আম্লিক
মানুষের শরীরে রস্তের pH -এর মান হওয়া উচিত –
- 4
- 2.5
- 7.4
- 5.5
উত্তর – 3. 7.4
তাজমহলের বায়ুমণ্ডলীয় ক্ষতির কারণ মথুরা তৈল শোধনাগার থেকে নির্গত –
- CO2 গ্যাস
- CH4 গ্যাস
- CO গ্যাস
- SO2 গ্যাস
উত্তর – 4. SO2 গ্যাস
Na2 O2 হল একটি –
- ক্ষারীয় অক্সাইড
- প্রশম অক্সাইড
- উভধর্মী অক্সাইড
- পারক্সাইড
উত্তর – 4. পারক্সাইড
NaH2PO4 একটি হল –
- প্রশম লবণ
- আম্লিক লবণ
- ক্ষারীয় লবণ
- যুগ্ম লবণ
উত্তর – 2. আম্লিক লবণ
Na2HPO4 একটি –
- অ্যাসিড লবণ
- ক্ষারকীয় লবণ
- শমিত লবণ
- উভধর্মী লবণ
উত্তর – 3. শমিত লবণ
Na2HPO4 হল –
- প্রশম লবণ
- আম্লিক লবণ
- ক্ষারীয় লবণ
- যুগ্ম লবণ
উত্তর – 2. আম্লিক লবণ
আমাদের দেহের কঠিনতম পদার্থ হল –
- দাঁতের এনামেল
- হাড়
- চামড়া
- নখ
উত্তর – 1. দাঁতের এনামেল
অ্যান্টাসিডের মধ্যে থাকে –
- NaOH
- Ca(OH)2
- Mg(OH)2
- CaCO3
উত্তর – 3. Mg(OH)2
কোনটি ক্ষারকীয় লবণ? –
- Ca(HCO3)2
- BiOCl
- NaCl
- NaH2PO4
উত্তর – 2. BiOCl
একটি অ্যান্টাসিড হল –
- প্যারাসিটামল
- জেলুসিল
- অ্যাসপিরিন
- ভ্যাসোপ্রিন
উত্তর – 2. জেলুসিল
নীচের কোনটি বাইলবণ? –
- NaH2PO2
- Na2HPO4
- HCOONa
- Na3PO4
উত্তর – 2. Na2HPO4
অক্সি অ্যাসিড নয় –
- নাইট্রিক অ্যাসিড
- সালফিউরিক অ্যাসিড
- ফসফরিক অ্যাসিড
- হাইড্রোক্লোরিক অ্যাসিড
উত্তর – 4. হাইড্রোক্লোরিক অ্যাসিড
কোন দ্রবণটি নীল লিটমাসকে লাল বর্ণে পরিণত করে না। –
- লেবুর রস
- ভিনিগার
- সাবান জল
- বৃষ্টির জল
উত্তর – 3. সাবান জল
অ্যামোনিয়ার জলীয় দ্রবণ একটি –
- তীব্র ক্ষার
- তীব্র অ্যাসিড
- মৃদু ক্ষার
- মৃদু অ্যাসিড
উত্তর – 3. মৃদু ক্ষার
কোন অ্যাসিড বাইলবণ উৎপন্ন করে না –
- সালফিউরাস অ্যাসিড
- সালফিউরিক অ্যাসিড
- কার্বনিক অ্যাসিড
- অ্যাসিটিক অ্যাসিড
উত্তর – 4. অ্যাসিটিক অ্যাসিড
নর্মাল লবণ –
- Zn(NO3)2
- Ca(HCO3)2
- (NH4)2HPO4
- Cu(OH)Cl
উত্তর – 1. Zn(NO3)2
কোনটি অ্যাসিড লবণ নয় –
- NaHSO4
- HCOONa
- NaHCO3
- NH4H2PO4
উত্তর – 2. HCOONa
NaCl ফেনলপ্থ্যালিনের জলীয় দ্রবণে যোগ করলে দ্রবণের বর্ণ –
- গোলাপি হয়
- বেগুনি হয়
- হলুদ হয়
- বর্ণহীন হয়
উত্তর – 4. বর্ণহীন হয়
গাঢ় ও উত্তপ্ত নাইট্রিক অ্যাসিড ও তামার বিক্রিয়ায় নাইট্রোজেনের যে অক্সাইড উৎপন্ন হয় তা হল –
- N2O5
- N2O
- NO2
- NO
উত্তর – 3. NO2
জল একটি –
- আম্লিক অক্সাইড
- ক্ষারকীয় অক্সাইড
- প্রশম অক্সাইড
- উভধর্মী অক্সাইড
উত্তর – 3. প্রশম অক্সাইড
অ্যাসিডিটিজনিত সমস্যার ক্ষেত্রে রোগীদের যে ঔষধ দেওয়া হয় তা হল –
- অ্যান্টিবায়োটিক
- অ্যানালজেসিক
- অ্যান্টাসিড
- অ্যান্টিসেপটিক
উত্তর – 3. অ্যান্টাসিড
pH সবচেয়ে কম –
- NaHCO3
- HCl
- KOH
- Na2CO3
উত্তর – 2. HCl
কোনো স্থানে অ্যাসিড বার্ন হলে সেই স্থানে লাগানো উচিত –
- লেবুর রস
- সোডিয়াম হাইড্রক্সাইড
- অ্যাসিটিক অ্যাসিড
- সোডিয়াম বাইকার্বনেট
উত্তর – 4. সোডিয়াম বাইকার্বনেট
যেটি মৃদু অ্যাসিড সেটি হল –
- HCl
- HBr
- CH3COOH
- HNO3
উত্তর – 3. CH3COOH
শূন্যস্থান পূরণ করো
Na2SO3 -এর কেলাস সামান্য উত্তপ্ত করলে ___ দ্রবণ উৎপন্ন হয়।
উত্তর – Na2SO3 -এর কেলাস সামান্য উত্তপ্ত করলে ক্ষারীয় দ্রবণ উৎপন্ন হয়।
দাঁতের এনামেল ___ দ্বারা গঠিত।
উত্তর – দাঁতের এনামেল ক্যালশিয়াম ফসফেট দ্বারা গঠিত।
ক্যালশিয়াম হাইড্রক্সাইডের অম্লগ্রাহিতা ___।
উত্তর – ক্যালশিয়াম হাইড্রক্সাইডের অম্লগ্রাহিতা 2।
সোডিয়াম হাইড্রক্সাইডের জলীয় দ্রবণে একফোঁটা ফেনলপ্থ্যালিন যোগ করলে দ্রবণের বর্ণ ___ হয়।
উত্তর – সোডিয়াম হাইড্রক্সাইডের জলীয় দ্রবণে একফোঁটা ফেনলপ্থ্যালিন যোগ করলে দ্রবণের বর্ণ গোলাপি হয়।
Na2CO3 একটি ___ লবণ হলেও এর জলীয় দ্রবণ ___।
উত্তর – Na2CO3 একটি শমিত লবণ হলেও এর জলীয় দ্রবণ ক্ষারীয়।
___ প্রোটন গ্রাহক বলে।
উত্তর – ক্ষারককে প্রোটন গ্রাহক বলে।
___ -একটি মিশ্র অক্সাইড।
উত্তর – Fe3O4 -একটি মিশ্র অক্সাইড।
হাইড্রোজেন সালফাইডের জলীয় দ্রবণ ___ অ্যাসিডধর্মী।
উত্তর – হাইড্রোজেন সালফাইডের জলীয় দ্রবণ মৃদু অ্যাসিডধর্মী।
pH = 13 -এর একটি জলীয় দ্রবণে pH কাগজ ডোবালে তা ___ বর্ণ ধারণ করে।
উত্তর – pH = 13 -এর একটি জলীয় দ্রবণে pH কাগজ ডোবালে তা বেগুনি বর্ণ ধারণ করে।
উষ্ণতা বৃদ্ধিতে দ্রবণের pH ___ পায়।
উত্তর – উষ্ণতা বৃদ্ধিতে দ্রবণের pH হ্রাস পায়।
ঠিক বা ভুল নির্বাচন করো
হাইড্রোজেনঘটিত যৌগ মাত্রই অ্যাসিড।
উত্তর – ভুল।
সঠিক উত্তর – নাও হতে পারে।
কোনো অ্যাসিডের প্রতিস্থাপনযোগ্য হাইড্রোজেনের সংখ্যা তার অম্লগ্রাহিতা নির্ধারণ করে।
উত্তর – ভুল।
সঠিক উত্তর – ক্ষারগ্রাহিতা।
অক্সালিক অ্যাসিড একটি দ্বি-ক্ষারীয় অ্যাসিড।
উত্তর – ঠিক।
অ্যাসিটিক অ্যাসিড একটি তীব্র অ্যাসিড।
উত্তর – ভুল।
সঠিক উত্তর – মৃদু অ্যাসিড।
যে দ্রবণে মিথাইল অরেঞ্জের রং হলুদ তার pH > 7।
উত্তর – ঠিক।
সকল ক্ষারকে ক্ষারক বলা যেতে পারে।
উত্তর – ঠিক।
চুন জলে নীল লিটমাস লাল হয়।
উত্তর – ভুল।
সঠিক উত্তর – লাল লিটমাস নীল হয়।
ম্যাগনেশিয়ামের সঙ্গে শীতল ও অতি লঘু HNO3 -এর বিক্রিয়ায় H3 উৎপন্ন হয়।
উত্তর – ঠিক।
এক-ক্ষারীয় অ্যাসিড বাইলবণ তৈরি করতে পারে না।
উত্তর – ঠিক।
NaHSO4 -এর জলীয় দ্রবণ আম্লিক।
উত্তর – ভুল।
সঠিক উত্তর – প্রশম।
ম্যাগনেশিয়াম হাইড্রক্সাইড একটি ক্ষার।
উত্তর – ভুল।
সঠিক উত্তর – ক্ষারক।
প্রশম দ্রবণে pH কাগজ সবুজ বর্ণ ধারণ করে।
উত্তর – ঠিক।
যে দ্রবণের pH -এর মান যত বেশি সেই দ্রবণ তত বেশি আম্লিক।
উত্তর – ভুল।
সঠিক উত্তর – কম আম্লিক।
অ্যান্টাসিড প্রশম পদার্থ।
উত্তর – ভুল।
সঠিক উত্তর – ক্ষারীয় পদার্থ।
জলের pH -এর মান 7 -এর কম।
উত্তর – ভুল।
সঠিক উত্তর – 7-এর সমান।
উত্তপ্ত Cu -এর উপর দিয়ে HNO3 বাষ্প চালনা করে NO2 গ্যাস নির্গত হয়।
উত্তর – ভুল।
সঠিক উত্তর – N2 গ্যাস নির্গত হয়।
তামা ও নাইট্রিক অ্যাসিডের বিক্রিয়ায় নাইট্রেট আয়নের জারণ ঘটে।
উত্তর – ঠিক।
লঘু জলীয় দ্রবণে সালফিউরিক অ্যাসিড পূর্ণ মাত্রায় বিয়োজিত হয়।
উত্তর – ঠিক।
দু-একটি শব্দে উত্তর দাও
HCl জারক না বিজারক অ্যাসিড?
HCl বিজারক অ্যাসিড।
দইতে কোন্ অ্যাসিড থাকে?
দইতে ল্যাকটিক অ্যাসিড থাকে।
একটি হাইড্রোজেনবিহীন অ্যাসিডের নাম লেখো।
একটি হাইড্রোজেনবিহীন অ্যাসিডের নাম হল বোরন ট্রাইফ্লুওরাইড (BF3)।
একটি জৈব দ্বি-ক্ষারীয় অ্যাসিডের নাম লেখো।
একটি জৈব দ্বি-ক্ষারীয় অ্যাসিডের নাম হল অক্সালিক অ্যাসিড \(\left(\underset{\underset{COOH}╵}COOH\right)\)।
কঠিন অবস্থায় পাওয়া যায় এমন দুটি অ্যাসিডের নাম লেখো।
কঠিন অবস্থায় পাওয়া যায় এমন দুটি অ্যাসিডের নাম হল টারটারিক অ্যাসিড ও অক্সালিক অ্যাসিড।
হাইপোফসফরাস অ্যাসিডের ক্ষারগ্রাহিতা কত?
হাইপোফসফরাস অ্যাসিডের ক্ষারগ্রাহিতা 1।
মানুষের পাকস্থলীতে কী অ্যাসিড থাকে?
মানুষের পাকস্থলীতে হাইড্রোক্লোরিক অ্যাসিড থাকে।
দৈনন্দিন জীবনে ব্যবহৃত হয় এমন দুটি ক্ষারের নাম লেখো।
দৈনন্দিন জীবনে ব্যবহৃত হয় এমন দুটি ক্ষারের নাম হল কাপড় কাচার সোডা (Na2CO3) ও বেকিং সোডা (NaHCO3)।
MgO ও Na2O -এর মধ্যে কোনটি ক্ষার ও কোনটি ক্ষারক?
MgO ও Na2O -এর মধ্যে MgO ক্ষারক ও Na2O ক্ষার।
NaCl -এর জলীয় দ্রবণ কী প্রকৃতির?
NaCl -এর জলীয় দ্রবণ প্রশম প্রকৃতির।
সাবান জল আম্লিক না ক্ষারীয়?
সাবান জল ক্ষারীয়।
একটি লুইস ক্ষারের নাম লেখো।
একটি লুইস ক্ষারের নাম হল অ্যামোনিয়া (NH3)।
Ca(OH)2 -এর অম্লগ্রাহিতা কত?
Ca(OH)2 -এর অম্লগ্রাহিতা 2।
রঞ্জন শিল্পে কোন্ অ্যাসিডের ব্যবহার হয়?
রঞ্জন শিল্পে হাইড্রোক্লোরিক অ্যাসিড ও নাইট্রিক অ্যাসিডের ব্যবহার হয়।
TNT নামক বিস্ফোরক প্রস্তুতিতে কোন্ অ্যাসিড ব্যবহৃত হয়?
TNT নামক বিস্ফোরক প্রস্তুতিতে নাইট্রিক অ্যাসিড ব্যবহৃত হয়।
সুপার ফসফেট অব লাইম তৈরিতে কোন্ অ্যাসিড লাগে?
সুপার ফসফেট অব লাইম তৈরিতে সালফিউরিক অ্যাসিড লাগে।
AgNO3 দ্রবণের সঙ্গে বিক্রিয়ায় অধঃক্ষেপ দেয় কোন্ অজৈব অ্যাসিড?
AgNO3 দ্রবণের সঙ্গে বিক্রিয়ায় অধঃক্ষেপ দেয় হাইড্রোক্লোরিক অজৈব অ্যাসিড।
সোনাকে খাদমুক্ত করতে কোন্ অ্যাসিড ব্যবহার করা হয়?
সোনাকে খাদমুক্ত করতে নাইট্রিক অ্যাসিড ব্যবহার করা হয়।
তামাকে গাঢ় H2SO4 সহযোগে ফোটালে যে বায়ুদূষক গ্যাসটি উৎপন্ন হয় তার নাম কী?
তামাকে গাঢ় H2SO4 সহযোগে ফোটালে যে বায়ুদূষক গ্যাসটি উৎপন্ন হয় তার নাম সালফার ডাইঅক্সাইড (SO2)।
পাতিলেবুর রসের pH কত?
পাতিলেবুর রসের আনুমানিক pH 2.5।
দুটি প্রাকৃতিক নির্দেশকের নাম লেখো।
দুটি প্রাকৃতিক নির্দেশকের নাম হল জবাফুলের পাপড়ির রস ও বিটের রস।
একটি দ্রবণের pH -এর মান 4। ওই দ্রবণে H+ -এর গাঢ়ত্ব কত?
একটি দ্রবণের pH -এর মান 4। ওই দ্রবণে H+ -এর গাঢ়ত্ব 10-4 মোল/লিটার।
মাটির pH -এর হ্রাস ঘটায় এমন একটি অজৈব সারের নাম লেখো।
মাটির pH -এর হ্রাস ঘটায় এমন একটি অজৈব সারের নাম হল অ্যামোনিয়াম সালফেট [(NH4)2SO4]।
pH স্কেলের প্রবর্তন করেন কোন্ বিজ্ঞানী?
pH স্কেলের প্রবর্তন করেন বিজ্ঞানী সোরেনসেন।
লালারসের pH -এর মান কত হলে দাঁতের এনামেল ক্ষতিগ্রস্ত হয়?
লালারসের pH -এর মান 5.5-এর নীচে হলে দাঁতের এনামেল ক্ষতিগ্রস্ত হয়।
রুজ -এর রাসায়নিক নাম ও সংকেত লেখো।
রুজ -এর রাসায়নিক নাম ও সংকেত হল ফেরিক অক্সাইড (Fe2O3)।
একটি পারক্সাইডের নাম ও সংকেত লেখো।
একটি পারক্সাইডের নাম ও সংকেত হল সোডিয়াম পারক্সাইড (Na2O2)।
ধাতব অক্সাইড বা হাইড্রক্সাইড নয় অথচ যৌগটি ক্ষারক – এরূপ একটি উদাহরণ দাও।
ধাতব অক্সাইড বা হাইড্রক্সাইড নয় অথচ যৌগটি ক্ষারক – এরূপ একটি উদাহরণ হল মিথাইল অ্যামিন (CH3NH2)।
X ও Y দুটি দ্রবণের pH -এর মান যথাক্রমে 3 এবং 9। এদের মধ্যে কোন্ দ্রবণটি লাল লিটমাসকে নীল করে?
X ও Y দুটি দ্রবণের pH -এর মান যথাক্রমে 3 এবং 9। এদের মধ্যে Y দ্রবণ (pH = 9) দ্রবণটি লাল লিটমাসকে নীল করে।
A ও B দুটি অ্যাসিডের pH যথাক্রমে 1 ও 5। কোনটি তীব্র অ্যাসিড?
A ও B দুটি অ্যাসিডের pH যথাক্রমে 1 ও 5। – A তীব্র অ্যাসিড।
CrO3 কী ধরনের অক্সাইড?
CrO3 আম্লিক ধরনের অক্সাইড।
এমন একটি অক্সাইডের নাম লেখো যা জলের সঙ্গে বিক্রিয়ায় অক্সিজেন উৎপন্ন করে।
এমন একটি অক্সাইডের নাম হল পটাশিয়াম সুপার অক্সাইড (KO2), যা জলের সঙ্গে বিক্রিয়ায় অক্সিজেন উৎপন্ন করে।
কোন্ লবণটির অস্তিত্ব নেই – Na3PO3 না Na3PO4?
Na3PO4 লবণটির অস্তিত্ব নেই।
বৃষ্টির জলে পাওয়া যায় এমন একটি অ্যাসিডের নাম লেখো।
বৃষ্টির জলে পাওয়া যায় এমন একটি অ্যাসিডের নাম হল কার্বনিক অ্যাসিড (H2CO3)।
দুটি অ্যাসিড লবণের নাম লেখো।
দুটি অ্যাসিড লবণের নাম হল সোডিয়াম বাইকার্বনেট (NaHCO3) ও পটাশিয়াম বাইসালফেট (KHSO4)।
একটি অ্যাসিড লবণের সংকেত লেখো।
একটি অ্যাসিড লবণের সংকেত হল সোডিয়াম বাইকার্বনেট (NaHCO3)।
এমন একটি অ্যান্টাসিডের উদাহরণ দাও যা কোষ্ঠকাঠিন্য সৃষ্টি করে।
এমন একটি অ্যান্টাসিডের উদাহরণ হল অ্যালুমিনিয়াম হাইড্রক্সাইড [Al(OH)3], যা কোষ্ঠকাঠিন্য সৃষ্টি করে।
যে বর্ণহীন জলীয় দ্রবণের pH 10 সেটিতে এক ফোঁটা মিথাইল অরেঞ্জ দ্রবণ দিলে কী রং দেখাবে?
যে বর্ণহীন জলীয় দ্রবণের pH 10 সেটিতে এক ফোঁটা মিথাইল অরেঞ্জ দ্রবণ দিলে হলুদ রং দেখাবে।
অ্যাসিড বৃষ্টির জন্য প্রধানত কোন্ কোন্ অ্যাসিড দায়ী?
অ্যাসিড বৃষ্টির জন্য প্রধানত H2SO4 ও HNO3 অ্যাসিড দায়ী।
দুধে যে অ্যাসিড থাকে, তা কী নামে পরিচিত এবং এর কী ব্যবহার রয়েছে?
দুধের মধ্যেও অ্যাসিড থাকে। দুধে যে অ্যাসিড থাকে তাকে বলে ল্যাকটিক অ্যাসিড। এই অ্যাসিডকে ব্যবহার করেই দুধ দই -এ পরিণত হয়। ‘Lactic’ শব্দটির উৎপত্তি ‘Lac’ শব্দ থেকে।
নরম পানীয়তে কোন অ্যাসিড থাকে এবং এটি অতিরিক্ত পরিমাণে গ্রহণের ফলে কী ধরনের ক্ষতিকর প্রভাব দেখা দিতে পারে?
নরম পানীয়গুলিতে থাকে কার্বনিক অ্যাসিড। আমেরিকা মহাদেশে প্রায় 12% এইরকম নরম পানীয় প্রাতরাশের সময় খাওয়া হয়, যা অত্যন্ত ক্ষতিকর এবং উদ্বেগজনক।
ক্যান্ডি লজেন্সে কোন অ্যাসিড ব্যবহৃত হয় এবং এর প্রধান কাজ কী?
ছোটোদের ক্যান্ডি লজেন্সে সাইট্রিক অ্যাসিড আছে। লজেন্সের গন্ধ বাড়ানোই এর প্রধান কাজ। যদিও এর ব্যবহারের ঊর্ধ্বসীমা 0.5% বেঁধে দেওয়া হয়ে থাকে।
আমাদের পাকস্থলীতে কোন অ্যাসিড থাকে এবং এর pH মান কত?
আমাদের পাকস্থলীতে যে HCl থাকে তা অত্যন্ত তীব্র। এর pH মান 1 এবং 2 -এর মাঝখানে।
বামদিকের সঙ্গে ডানদিক মিল করো
নীচের বামদিকের সঙ্গে ডানদিক মিলিয়ে লেখো।
| বামদিক | ডানদিক | উত্তর |
| 1. হাইড্রাসিড | a. কস্টিক পটাশ | 1. → b. |
| 2. জৈব অ্যাসিড | b. হাইড্রোব্রোমিক অ্যাসিড | 2. → g. |
| 3. অক্সি অ্যাসিড | c. ফসফরিক অ্যাসিড | 3. → d. |
| 4. ত্রি-ক্ষারীয় অ্যাসিড | d. নাইট্রিক অ্যাসিড | 4. → c. |
| 5. মৃদু ক্ষার | e. ম্যাগনেশিয়াম হাইড্রক্সাইড | 5. → f. |
| 6. তীব্র ক্ষার | f. অ্যামোনিয়াম হাইড্রক্সাইড | 6. → a. |
| 7. দ্বি-আম্লিক ক্ষারক | g. ফরমিক অ্যাসিড | 7. → e. |
নীচের বামদিকের সঙ্গে ডানদিক মিলিয়ে লেখো।
| বামদিক | ডানদিক | উত্তর |
| 1. অ্যামোনিয়াম নাইট্রেট সার উৎপাদনে ব্যবহৃত হয়। | a. সালফিউরিক অ্যাসিড | 1. → b. |
| 2. স্টার্চ থেকে গ্লুকোজ প্রস্তুতিতে ব্যবহৃত হয়। | b. নাইট্রিক অ্যাসিড | 2. → d. |
| 3. নাইট্রিক অ্যাসিড প্রস্তুতিতে ব্যবহৃত হয়। | c. সোডিয়াম হাইড্রক্সাইড | 3. → a. |
| 4. কৃত্রিম রেশম উৎপাদনে ব্যবহৃত হয়। | d. হাইড্রোক্লোরিক অ্যাসিড | 4. → c. |
For High-Types
HCl, HNO3 জলীয় দ্রবণে অ্যাসিড ধর্ম প্রদর্শন করে কিন্তু C2H5OH করে না কেন?
HCl, HNO3 জলীয় দ্রবণে বিয়োজিত হয়ে H3O+ আয়ন উৎপন্ন করে। এই আয়নের উপস্থিতির ফলে দ্রবণটি আম্লিক হয়।
\(HCl+H_2O\rightarrow H_3O^++Cl^-\)
\(HNO_3+H_2O\rightarrow H_3O^++NO_3^-\)
কিন্তু অ্যালকোহল (C2H5OH) সমযোজী যৌগ, তাই এরা জলীয় দ্রবণে আয়নিত হয় না এবং H3O+ আয়ন দেয় না। এ কারণে C2H5OH অ্যাসিড ধর্ম প্রদর্শন করে না।
লিটমাসের দ্বারা অ্যাসিড শনাক্তকরণ পরীক্ষায় জলের ভূমিকা কী?
জলের অনুপস্থিতিতে অ্যাসিড আয়নিত হতে পারে না। ফলে, জলের অনুপস্থিতিতে নীল লিটমাস অ্যাসিডের বর্ণ পরিবর্তন করতে পারে না। জলের উপস্থিতিতে অ্যাসিড আয়নিত হয়ে H3O+ আয়ন দেয়। এই আয়নের উপস্থিতির জন্য লিটমাসের বর্ণ পরিবর্তন হয়। ফলে, অ্যাসিড শনাক্ত করা যায়।
মৌমাছি কামড়ালে বেকিং সোডা ঘষতে বলা হয় কেন?
মৌমাছি শরীরের যেখানে হুল ফোঁটায় সেখানে ত্বকের মধ্যে দিয়ে একটি আম্লিক তরল শরীরে প্রবেশ করিয়ে দেয় ফলে প্রবল জ্বালা ও চুলকানির সৃষ্টি হয়। এই অ্যাসিডকে প্রশমিত করার জন্য ক্ষার জাতীয় পদার্থ যেমন বেকিং সোডা বা চুন ঘষা হয়, যা ওই আম্লিক তরলকে প্রশমিত করে ত্বককে আরাম দেয়।
হঠাৎ করে বোলতা কামড়ালে কী করা উচিত?
বোলতা হুল ফোঁটানোর সময় শরীরের মধ্যে একটি ক্ষারজাতীয় পদার্থ প্রবেশ করিয়ে দেয় যা তীব্র জ্বালার অনুভূতি সৃষ্টি করে। এতে সামান্য অ্যাসিডিক কোনো পদার্থ যেমন ভিনিগার ইত্যাদি ঘষে দিলে তা ক্ষারের ক্রিয়াকে প্রশমিত করে এবং ত্বককে আরাম প্রদান করে।
Class 9 Physical Science – Notes for All Chapters
| Chapter Name | Tropics |
|---|---|
| পরিমাপ | পরিমাপ ও একক বিভিন্ন মাপের একক মাত্রা পরিমাপ |
| বল ও গতি | স্থিতি ও গতি গতির সমীকরণ নিউটনের প্রথম গতিসূত্র নিউটনের দ্বিতীয় গতি সূত্র নিউটনের তৃতীয় গতিসূত্র বিভিন্ন ধরনের বল রৈখিক ভরবেগ রৈখিক ভরবেগ সংরক্ষণ |
| পদার্থ : গঠন ও ধর্ম | তরল ও বায়ুর চাপ আর্কিমিডিসের নীতি পৃষ্ঠটান সান্দ্রতা বার্নোলির নীতি স্থিতিস্থাপকতা |
| পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ | পরমাণুর গঠন মোলের ধারণা দ্রবণ অ্যাসিড, ক্ষার, লবণ মিশ্রণের উপাদানের পৃথকীকরণ জল |
| শক্তির ক্রিয়া , কার্য, ক্ষমতা | শক্তির ক্রিয়া , কার্য, ক্ষমতা |
| তাপ | ক্যালোরিমিতি কার্য ও তাপের তুল্যতা লীনতাপ সম্পৃক্ত ও অসম্পৃক্ত বাষ্প জলের ব্যতিক্রান্ত প্রসারণ |
| শব্দ | শব্দের উৎস : কম্পন শব্দের বিস্তার : তরঙ্গ শব্দের কয়েকটি ধর্ম শব্দের বৈশিষ্ট্য মানুষের কান ও শব্দ শোনার কৌশল শব্দদূষণ |
আজকের আর্টিকেলে আমরা নবম শ্রেণির ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “অ্যাসিড, ক্ষার, লবণ” থেকে পরীক্ষায় আসা গুরুত্বপূর্ণ প্রশ্ন ও উত্তরগুলো আলোচনা করেছি। এই প্রশ্নোত্তরগুলো নবম শ্রেণির বার্ষিক পরীক্ষা, এমনকি চাকরি বা যেকোনো প্রতিযোগিতামূলক পরীক্ষার জন্যও উপযোগী। কারণ, এই অধ্যায়ের প্রশ্ন প্রায়ই বিভিন্ন পরীক্ষায় কমন আসে।
আশা করি, এই আর্টিকেলটি আপনাদের পরীক্ষার প্রস্তুতিতে কিছুটা হলেও সাহায্য করবে। যদি কোনো প্রশ্ন, মতামত বা সাহায্যের প্রয়োজন হয়, নিচে কমেন্ট করে জানাতে পারেন কিংবা টেলিগ্রামে যোগাযোগ করুন—আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত।
ধন্যবাদ সবাইকে।






Leave a Comment