আজকের আর্টিকেলে আমরা নবম শ্রেণীর ভৌতবিজ্ঞান বইয়ের ষষ্ট অধ্যায় “তাপ” এর “ক্যালোরিমিতি” থেকে সহজ ও সংক্ষিপ্ত প্রশ্ন-উত্তর শেয়ার করবো। এই প্রশ্নগুলো নবম শ্রেণির ইউনিট টেস্ট থেকে বার্ষিক পরীক্ষা এর জন্য যেমন গুরুত্বপূর্ণ, তেমনি চাকরি বা বিভিন্ন প্রতিযোগিতার পরীক্ষাতেও কাজে লাগবে। এই অধ্যায় থেকে স্কুল পরীক্ষা থেকে শুরু করে চাকরির পরীক্ষায় প্রায়ই প্রশ্ন আসে, তাই এই প্রশ্নোত্তরগুলো সবাইকে সাহায্য করবে। প্রতিটি প্রশ্নের উত্তর সহজ ভাষায় লেখা হয়েছে, যাতে সবাই বুঝতে পারেন। পড়ার শেষে এই অধ্যায়ের মুখ্য বিষয়গুলো আপনার আয়ত্তে চলে আসবে এবং যেকোনো পরীক্ষায় আত্মবিশ্বাসের সঙ্গে লিখতে পারবেন।

জ্ঞানমূলক প্রশ্নোত্তর
তাপ কী? তাপ কী জাতীয় রাশি?
তাপ (Heat) –
তাপ হল একপ্রকার শক্তি, যা গ্রহণ করলে বস্তু উত্তপ্ত হয়ে ওঠে এবং বর্জন করলে বস্তু ঠান্ডা হয়।
তাপের শুধু মান আছে কিন্তু অভিমুখ নেই, তাই তাপ একটি স্কেলার রাশি।
পদার্থের অভ্যন্তরীণ শক্তি বলতে কী বোঝায়? তাপ ও অভ্যন্তরীণ শক্তির সম্পর্ক কী?
তাপ সম্পর্কে আধুনিক ধারণা –
যে-কোনো পদার্থের অণুগুলির মোট স্থিতিশক্তি ও গতিশক্তি ছাড়াও সংশ্লিষ্ট পদার্থ বা বস্তুসংস্থার মধ্যে যে বিশেষ প্রকার শক্তি সঞ্চিত থাকে, তাকে বলা হয় অভ্যন্তরীণ শক্তি। অভ্যন্তরীণ শক্তির যে অংশ কোনো বস্তু থেকে পরিবেশ বা দুটি ভিন্ন বস্তুর মধ্যে একটি থেকে অন্যটিতে স্থানান্তরিত হয়ে উষ্ণতার মানের সমতা প্রতিষ্ঠা করে, তাকেই তাপ বলে। শক্তি যতক্ষণ প্রবাহিত হয়, ততক্ষণই তাপ শব্দটি অর্থপূর্ণ থাকে।
বস্তুতে তাপ প্রয়োগের ফলাফলগুলি কী কী?
কোনো বস্তুতে তাপ প্রয়োগ করলে তার ফলাফলগুলি হয় নিম্নরূপ –
- অবস্থার পরিবর্তন – সাধারণত তাপপ্রয়োগে কঠিন পদার্থ তরলে এবং তরল পদার্থ বাষ্পে পরিণত হয়। আর তাপ বর্জনে বাষ্প তরলে এবং তরল কঠিনে পরিণত হয়।
- ব্যতিক্রম – কর্পূর, ন্যাপথলিন প্রভৃতি কঠিন পদার্থে তাপ প্রয়োগ করলে এগুলি সরাসরি বাষ্পে পরিণত হয়।
- উষ্ণতার পরিবর্তন – পদার্থের অবস্থার পরিবর্তন না হলে, তাপ দিলে উষ্ণতা বাড়ে এবং তাপ বের করে নিলে উষ্ণতা কমে।
- আয়তনের পরিবর্তন – তাপ দিলে সাধারণত বস্তুর আয়তন বাড়ে এবং তাপ বের করে নিলে বস্তুর আয়তন কমে।
- ব্যতিক্রম – বরফ, ঢালাই লোহা, পিতল, বিসমাথ প্রভৃতিতে তাপ দিলে আয়তনে কমে।
- রাসায়নিক পরিবর্তন – তাপ প্রয়োগের ফলে অনেক ক্ষেত্রে পদার্থের রাসায়নিক পরিবর্তন ঘটে। যেমন – কয়লাকে উত্তপ্ত করলে এটি বাতাসের অক্সিজেনের সঙ্গে যুক্ত হয়ে কার্বন ডাইঅক্সাইড গ্যাস উৎপন্ন করে।
- বৈদ্যুতিক শক্তির সৃষ্টি – বিসমাথ ও অ্যান্টিমনির দুটি পাতের প্রান্ত দুটিকে জোড়া লাগিয়ে একপ্রান্তকে গরম ও অন্যপ্রান্ত ঠান্ডা করলে এর মধ্যে দিয়ে তড়িৎপ্রবাহ হয়।
- বৈদ্যুতিক ও চৌম্বক ধর্মের পরিবর্তন – তাপপ্রয়োগে সাধারণত ধাতব পদার্থের রোধ বাড়ে (ব্যতিক্রম – কার্বনের রোধ উষ্ণতা বৃদ্ধিতে কমে)। চুম্বককে উত্তপ্ত করলে একটি নির্দিষ্ট উষ্ণতায় ওর চৌম্বকধর্ম লোপ পায়।
- আলোক শক্তির সৃষ্টি – বৈদ্যুতিক বাল্বে তড়িৎপ্রবাহ চালনা করলে বাল্বের তার খুব উত্তপ্ত হয়ে আলো উৎপন্ন করে।
- দহন ও প্রাণনাশ – কাঠ, কাগজ, কেরোসিন প্রভৃতি পদার্থে তাপ দিলে সেগুলি জ্বলে ওঠে। আর অতিরিক্ত তাপে সমস্ত জীবজগতের (উদ্ভিদ, প্রাণী) বিনাশ হয়।
CGS ও SI -তে বিনোদের তাপের একক লেখো। তাপের মাত্রা লেখো।
CGS পদ্ধতিতে তাপের একক ক্যালোরি (calorie) এবং SI -তে তাপের একক জুল (joule)।
তাপের মাত্রীয় সংকেত = [ML2T-2] (তাপ একপ্রকার শক্তি বলে, তাপের মাত্রীয় সংকেত ও শক্তির মাত্রীয় সংকেত একই হয়)।
1 ক্যালোরি বলতে কী বোঝায়? 1 ক্যালোরি = কত জুল?
1 গ্রাম বিশুদ্ধ জলের উষ্ণতা 1°C বৃদ্ধি করতে যে পরিমাণ তাপ লাগে, তাকে 1 ক্যালোরি বলে।
1 ক্যালোরি = 4.2 জুল।
1 ক্যালোরি (15° ক্যালোরি) বলতে কী বোঝায়? বিশুদ্ধ জলের উষ্ণতা বৃদ্ধির সাথে ক্যালোরির সংজ্ঞার সম্পর্কটি ব্যাখ্যা করো।
এক গ্রাম বিশুদ্ধ জলের উষ্ণতা 0°C থেকে 1°C বাড়াতে বা 1°C থেকে 2°C পর্যন্ত বাড়াতে বা 50°C থেকে 51°C পর্যন্ত বাড়াতে যে তাপ লাগে তা সমমানের নয়। অর্থাৎ, প্রতি ক্ষেত্রেই জলের উষ্ণতা 1°C বাড়ানো হলেও তাপের পরিমাণ আলাদা হয়। তাই 1 গ্রাম বিশুদ্ধ জলের উষ্ণতা 0°C থেকে 100°C পর্যন্ত বাড়াতে যে পরিমাণ তাপ লাগে তাকে 100 দিয়ে ভাগ করে গড় ক্যালোরি নির্ণয় করা হয়। এই মান 1 গ্রাম বিশুদ্ধ জলের উষ্ণতা 14.5°C থেকে 15.5°C পর্যন্ত বাড়াতে যে পরিমাণ তাপ লাগে তার প্রায় সমান।
তাই 1 ক্যালোরির সংজ্ঞায় জলের উষ্ণতা বৃদ্ধির পাল্লা ধরা হয় 14.5°C থেকে 15.5°C। একে অনেক সময় 15° calorie (15 ডিগ্রি ক্যালোরি) নামেও উল্লেখ করা হয়।
তাপ কয়প্রকার ও কী কী? তাদের সংজ্ঞা দাও।
তাপের প্রকারভেদ –
তাপ মূলত তিন প্রকার –
- বোধগম্য তাপ,
- লীনতাপ ও
- বিকীর্ণ তাপ।
বোধগম্য তাপ (Sensible heat) –
অবস্থার পরিবর্তন না ঘটিয়ে, কোনো বস্তুর ওপর যে তাপ প্রয়োগ করলে বস্তুটির তাপমাত্রা বেড়ে যায়, সেই তাপকে বোধগম্য তাপ বলে। থার্মোমিটারের সাহায্যে তাপমাত্রার এই পরিবর্তন বোঝা যায়। ক্যালোরিমিটারের সাহায্যে এই তাপ পরিমাপ করা হয়।
লীনতাপ (Latent heat) –
উষ্ণতার পরিবর্তন না ঘটিয়ে শুধুমাত্র অবস্থার পরিবর্তন করার জন্য একক ভরের কোনো পদার্থে যে তাপ প্রয়োগ বা নিষ্কাশন করতে হয়, তাকে লীনতাপ বলে। লীনতাপ ক্যালোরিমিটারের সাহায্যে মাপা যায় না।
বিকীর্ণ তাপ (Radient heat) –
যে তাপ জড় মাধ্যম ছাড়া অথবা জড় মাধ্যম থাকলেও তাকে উত্তপ্ত না করে এক স্থান থেকে অন্য স্থানে সঞ্চালিত হয়, তাকে বিকীর্ণ তাপ বলে। সূর্য থেকে পৃথিবীতে এই বিকীর্ণ তাপই আসে। এই তাপ ক্যালোরিমিটারের সাহায্যে মাপা যায় না।
উষ্ণতা বা তাপমাত্রা কাকে বলে?
উষ্ণতা (Temperature) –
উষ্ণতা হল বস্তুর এমন একটি তাপীয় অবস্থা যা স্থির করে দেয় কোনো বস্তুর সঙ্গে তাপীয় সংযোগে রাখা অন্য বস্তুকে ওই বস্তুটি তাপ দেবে, না অন্য বস্তু থেকে তাপ গ্রহণ করবে।
বিকল্প সংজ্ঞা –
তাপীয় সংযোগে রাখা দুই বা ততোধিক বস্তুর মধ্যে তাপ বিনিময় ঘটার সময় তাপ প্রবাহের অভিমুখ যে রাশি দ্বারা নিয়ন্ত্রিত ও নির্ধারিত হয়, তাকেই উষ্ণতা বলে।
তাপের প্রকৃতি সম্পর্কিত মতবাদগুলির সংক্ষিপ্ত পরিচয় দাও।
তাপের স্বরূপ বা প্রকৃতি সম্পর্কে পরিচিত প্রধান দুটি মতবাদ হল –
- ক্যালোরিক তত্ত্ব,
- গতীয় তত্ত্ব।
ক্যালোরিক তত্ত্ব –
এই ধারণা অনুসারে ক্যালোরিক নামে পরিচিত একপ্রকার সূক্ষ্ম, ভরহীন, অদৃশ্য কণা গ্রহণে বস্তু উত্তপ্ত ও এই কণা বর্জন করে বস্তু শীতল অবস্থায় আসে। অষ্টাদশ শতাব্দীর শেষভাগে কাউন্ট রামফোর্ড ও পরবর্তীকালে বিজ্ঞানী জুল, হামফ্রে ডেভি প্রমুখের কাজের সূত্রে এই ধারণা ভুল হিসেবে প্রমাণিত হয়।
গতীয় তত্ত্ব –
এই মতবাদের মূল বক্তব্য অণুর গতিশক্তিই তাপশক্তি। বিজ্ঞানী হামফ্রে ডেভি ও জুল এই তত্ত্বের প্রবক্তা। পরবর্তীকালে ম্যাক্সওয়েল, বোলজম্যান, ক্রনিগ, পেনী প্রমুখের গবেষণায় তত্ত্বটি সমৃদ্ধ হয় ও তাপের প্রকৃতি সম্পর্কিত আধুনিক মতবাদ হিসেবে স্বীকৃতি পায়।
তাপগতিবিদ্যার শূন্যতম সূত্র থেকে উষ্ণতার ধারণা কীভাবে পাওয়া যায়? তাপীয় সাম্যাবস্থা বলতে কী বোঝায় এবং উষ্ণতার সাথে অণুর গড় গতিশক্তির সম্পর্ক পদার্থের গতীয় তত্ত্ব অনুযায়ী ব্যাখ্যা কর।
তাপগতিবিদ্যার শূন্যতম সূত্র (Zeroth law of Thermodynamics) থেকে উষ্ণতার ধারণা পাওয়া যায়। দুটি বস্তুকে তাপীয় সংযোগে আনা হলে বস্তু দুটি তাপ বিনিময় করে একটি চূড়ান্ত অবস্থা লাভ করে, যে অবস্থায় তাদের মধ্যে আর তাপীয় আদানপ্রদান সম্ভব নয়। এই অবস্থাকে বলা হয় তাপীয় সাম্যাবস্থা (Thermal equilibrium)। দেখা যায়, যে-কোনো তাপীয় সংস্থার ক্ষেত্রেই উষ্ণতার মান সমান হলে বস্তুসংস্থা দুটি তাপীয় সাম্য লাভ করে। সুতরাং, এই দৃষ্টিকোণ থেকে বলা যায় তাপীয় সাম্যে থাকা দুই বা ততোধিক বস্তুর ক্ষেত্রে যে প্রাকৃতিক রাশির মান সমান থাকে, তাকেই উষ্ণতা বলে।
পদার্থের গতীয় তত্ত্ব অনুযায়ী, উষ্ণতা হল এমন একপ্রকার রাশি, যার মান পদার্থের অণুগুলির গড় গতিশক্তির ওপর নির্ভরশীল। সুতরাং, অণুর গতিশক্তি বৃদ্ধি পেলে উষ্ণতা বাড়ে।
আপেক্ষিক তাপ কাকে বলে? এর CGS ও SI একক লেখো।
আপেক্ষিক তাপ (Specific heat) – কোনো পদার্থের একক ভরের উষ্ণতা এক ডিগ্রি বৃদ্ধি করতে যে তাপের প্রয়োজন হয়, তাকে ওই পদার্থের আপেক্ষিক তাপ বলে।
CGS পদ্ধতিতে আপেক্ষিক তাপের একক – ক্যালোরি/গ্রাম ডিগ্রি সেলসিয়াস।
SI -তে আপেক্ষিক তাপের – একক-জুল/কেজি কেলভিন।
পদার্থের আপেক্ষিক তাপ কীসের উপর নির্ভর করে? ভৌত অবস্থার পরিবর্তনে এর মান পরিবর্তিত হয় কেন? উদাহরণ দিয়ে বুঝিয়ে দিন। অ্যামোনিয়া ও জলের আপেক্ষিক তাপ সম্পর্কে আলোচনা করুন।
আপেক্ষিক তাপ যেহেতু পদার্থের উপাদানের ধর্ম, তাই বিভিন্ন পদার্থের ক্ষেত্রে এর মান ভিন্ন হয়। ভৌত অবস্থা পৃথক হলেও এর মান আলাদা হতে পারে। যেমন – বরফ ও জল উভয়ের সংকেত H2O হলেও তাদের আপেক্ষিক তাপ যথাক্রমে 2100 J⋅kg-1⋅K-1 এবং 4200 J⋅kg-1 ⋅K-1 । কঠিন, তরল ও গ্যাসীয় সবরকম পদার্থের মধ্যে অ্যামোনিয়ার (NH3) আপেক্ষিক তাপ সর্বোচ্চ হয়। কঠিন ও তরলের মধ্যে তুলনা করলে জলের আপেক্ষিক তাপ সর্বাধিক। সাধারণভাবে, কঠিনের আপেক্ষিক তাপের মান তরলের তুলনায় কম হয়।
কোনো বস্তু দ্বারা গৃহীত বা বর্জিত তাপ কোন্ কোন্ বিষয়ের ওপর নির্ভর করে? এর গাণিতিক রাশিমালা নির্ণয় করো।
কোনো বস্তু দ্বারা গৃহীত বা বর্জিত তাপ নিম্নলিখিত তিনটি বিষয়ের ওপর নির্ভর করে –
- ভর – একই উপাদানে তৈরি কোনো বস্তুর একই পরিমাণ উষ্ণতা বৃদ্ধি বা হ্রাসের জন্য গৃহীত বা বর্জিত তাপ বস্তুটির ভরের সমানুপাতিক। অর্থাৎ, ভর বেশি হলে কোনো বস্তুর একই পরিমাণ উষ্ণতা বাড়াতে বেশি তাপ লাগবে এবং ভর কম হলে একই পরিমাণ উষ্ণতা বাড়াতে কম তাপ লাগবে।
- উষ্ণতা পার্থক্য – একই উপাদানে তৈরি কোনো বস্তুর ভর নির্দিষ্ট হলে বস্তুটির দ্বারা গৃহীত বা বর্জিত তাপ তার উষ্ণতা বৃদ্ধি বা হ্রাসের সমানুপাতিক। অর্থাৎ, নির্দিষ্ট পরিমাণ বস্তুর বেশি উষ্ণতা বাড়াতে বেশি তাপ লাগবে ও কম উষ্ণতা বাড়াতে কম তাপ লাগবে।
- উপাদান – কোনো বস্তু দ্বারা গৃহীত বা বর্জিত তাপ তার উপাদানের ওপর নির্ভর করে। যেহেতু, উপাদান আলাদা হলে আপেক্ষিক তাপের মানও পরিবর্তিত হয়, তাই কোনো বস্তু দ্বারা গৃহীত বা বর্জিত তাপের পরিমাণ বস্তুটির আপেক্ষিক তাপের সমানুপাতিক। অর্থাৎ, আপেক্ষিক তাপ বেশি হলে একই পরিমাণ উষ্ণতা বাড়াতে বেশি তাপ লাগবে ও আপেক্ষিক তাপ কম হলে কম তাপ লাগবে।
গাণিতিক রাশিমালা –
মনে করি, m ভরের কোনো বস্তুর উষ্ণতা θ° বৃদ্ধি করা হল। এখন বস্তুটির আপেক্ষিক তাপ হলে, আপেক্ষিক তাপের সংজ্ঞা অনুযায়ী – একক ভরের বস্তুর উষ্ণতা 1° বৃদ্ধি করতে প্রয়োজনীয় তাপ = s একক।
∴ m ভরের বস্তুর উষ্ণতা 1° বৃদ্ধি করতে প্রয়োজনীয় তাপ = ms একক।
∴ m ভরের বস্তুর উষ্ণতা θ° বৃদ্ধি করতে প্রয়োজনীয় তাপ = msθ একক।
একইভাবে, m ভরের বস্তুর উষ্ণতা θ° কমাতে প্রয়োজনীয় তাপ msθ একক।
∴ বস্তুটি যদি H পরিমাণ তাপ গ্রহণ বা বর্জন করে, তবে H = msθ।
কোনো বস্তু কর্তৃক গৃহীত বা বর্জিত তাপের গাণিতিক রাশিমালাটি হল – গৃহীত বা বর্জিত তাপ = বস্তুর ভর × বস্তুর আপেক্ষিক তাপ × উষ্ণতা বৃদ্ধি বা হ্রাস
বা, H = msθ
ক্যালোরিমিতি কাকে বলে? ক্যালোরিমিতির মূলনীতিটি বিবৃত করো। এই নীতি প্রযোজ্য হওয়ার শর্তগুলি উল্লেখ করো।
ক্যালোরিমিতি –
পদার্থবিজ্ঞানের যে শাখায় তাপশক্তির পরিমাপ বিষয়ে আলোচনা করা হয়, তাকে ক্যালোরিমিতি বলা হয়। তাপীয় আদানপ্রদানকালে বস্তু দ্বারা গৃহীত বা বর্জিত তাপের পরিমাণ এবং তার ফলে বস্তুর উষ্ণতা বৃদ্ধি বা হ্রাস, তাপীয় সাম্যে দুটি বা ততোধিক বস্তু দ্বারা গঠিত সংস্থার চূড়ান্ত উষ্ণতার মান নির্ণয় ইত্যাদি হল এই শাখার আলোচনার বিষয়বস্তু।
ক্যালোরিমিতির মূলনীতি –
ভিন্ন উষ্ণতায় থাকা দুটি বস্তুকে তাপীয় সংযোগে আনা হলে উষ্ণতর বস্তু তাপ বর্জন করে শীতল হয় এবং শীতলতর বস্তু ওই তাপ গ্রহণ করে উত্তপ্ত হয়। তাপের এই গ্রহণ ও বর্জন চলতে থাকে যতক্ষণ না দুটি বস্তু সমান উষ্ণতায় আসে, অর্থাৎ, তাপীয় সাম্য প্রতিষ্ঠিত হয়।
তাপীয় সাম্যে উষ্ণতর বস্তু কর্তৃক বর্জিত তাপ = শীতলতর বস্তু কর্তৃক গৃহীত তাপ-এই সমতাসূচক বিবৃতিটিকেই ক্যালোরিমিতির মূলনীতি বলে অভিহিত করা হয়।
ক্যালোরিমিতির ব্যাখ্যা –
ধরা যাক, m1 ও m2 ভরের বস্তু দুটির উপাদানের আপেক্ষিক তাপ যথাক্রমে s1 ও s2 এবং প্রাথমিক উষ্ণতা যথাক্রমে θ1 ও θ2 (θ1 > θ2)। প্রত্যক্ষ বা পরোক্ষ তাপীয় সংযোগে আনা হলে ও প্রথম বস্তু তাপ বর্জন করে, যা গ্রহণের ফলে দ্বিতীয় বস্তুর উষ্ণতা বৃদ্ধি পায়। তাপীয় সাম্যে সংস্থার চূড়ান্ত উষ্ণতা θ (θ2 < θ < θ1) হলে, ক্যালোরিমিতির মূলনীতি অনুসারে, প্রথম বস্তু কর্তৃক বর্জিত তাপ = দ্বিতীয় বস্তু কর্তৃক গৃহীত তাপ।
অর্থাৎ, m1s1(θ1 – θ2) = m2s2(θ1 – θ2)।
ক্যালোরিমিতির মূলনীতি প্রযোজ্য হওয়ার শর্ত –
- তাপীয় আদানপ্রদান শুধুমাত্র সংযোগে থাকা বস্তুগুলির মধ্যেই সীমাবদ্ধ থাকবে। অর্থাৎ, পারিপার্শ্বিক বা পরিবেশের সঙ্গে বিকিরণ বা অন্য পদ্ধতিতে কোনোভাবেই তাপের বিনিময় যেন না হয়।
- বস্তুগুলির মধ্যে কোনোরকম রাসায়নিক বিক্রিয়া যেন না হয় বা একটি তরল হলে তাতে যেন অন্য বস্তুগুলি দ্রাব্য না হয়। কারণ উভয়ক্ষেত্রেই অতিরিক্ত কিছু পরিমাণ তাপের উদ্ভব বা শোষণ হয়, যা এক্ষেত্রে বিবেচনাযোগ্য নয়।
- তাপ সঞ্চালনের সময় তাপশক্তির অন্য কোনো শক্তিতে রূপান্তর যেন না ঘটে।
ক্যালোরিমিতির মূলনীতিটি শক্তি সংরক্ষণ সূত্রের সাথে কীভাবে সম্পর্কিত? বহু বস্তুর তাপ বিনিময়ে এই নীতির গাণিতিক সমীকরণটি লিখুন ও প্রতিটি চলরাশির অর্থ ব্যাখ্যা করুন।
ক্যালোরিমিতির মূলনীতিটি প্রকৃতপক্ষে নতুন কোনো নীতি নয়, বরং তাপীয় সংস্থায় শক্তি সংরক্ষণ সূত্রেরই বিকল্পরূপ মাত্র। সংস্থায় দুটির পরিবর্তে অনেকগুলি বস্তু থাকলে, ক্যালোরিমিতির মূলনীতির গাণিতিক চেহারাটি হয় – m1s1 (θ1 – θ2) + m2s2 (θ2 – θ) + m3s3 (θ3 – θ) + …. + mnsn (θn – θ) = 0, যেখানে θ হল সংস্থার সাম্য উষ্ণতা।
ক্যালোরিমিতিক তরল কী?
ক্যালোরিমিতিক তরল (Calorimetric liquid) –
ক্যালোরিমিতিতে বস্তু বা বস্তুসংস্থার চূড়ান্ত উষ্ণতা বা আনুষঙ্গিক অন্যান্য পরিমাপের ক্ষেত্রে যে তরল ব্যবহার করা হয়, তাকেই ক্যালোরিমিতিক তরল বলা হয়।
ক্যালোরিমিটার কী? এটি কীভাবে ব্যবহার করা হয়? ক্যালোরিমিটার থেকে তাপক্ষয় রোধ করার জন্য কী কী ব্যবস্থা নেওয়া হয়?
ক্যালোরিমিটার (Calorimeter) –
ক্যালোরিমিতি সম্পর্কিত বেশিরভাগ পরীক্ষায় আংশিক তরলপূর্ণ যে তামার তৈরি চোঙাকৃতি পাত্র ব্যবহৃত হয়, তাকে ক্যালোরিমিটার বলে।
ক্যালোরিমিটারের ব্যবহার –
তাম্রনির্মিত একটি আলোড়ক (Stirrer) S -এর সাহায্যে ক্যালোরিমিতিক তরলকে ভালোভাবে নাড়ানো হয় এবং একটি থার্মোমিটার T -এর সাহায্যে আলোড়িত তরলসহ ক্যালোরিমিটারে রাখা যে-কোনো উষ্ণ বস্তুর উষ্ণতা পরিমাপ করা হয়। কোনো উত্তপ্ত বস্তুকে ক্যালোরিমিটারে ফেলা হলে ওই বস্তু ও ক্যালোরিমিটার বা ক্যালোরিমিতিক তরলের মধ্যে তাপ বিনিময় ঘটে। এই বিনিময়ের দ্বারা তাপীয় সাম্য প্রতিষ্ঠিত হলে, ওই অবস্থায় গৃহীত তাপ = বর্জিত তাপ সম্পর্ক ব্যবহার করে প্রয়োজনীয় গণনাগুলি করা হয়।
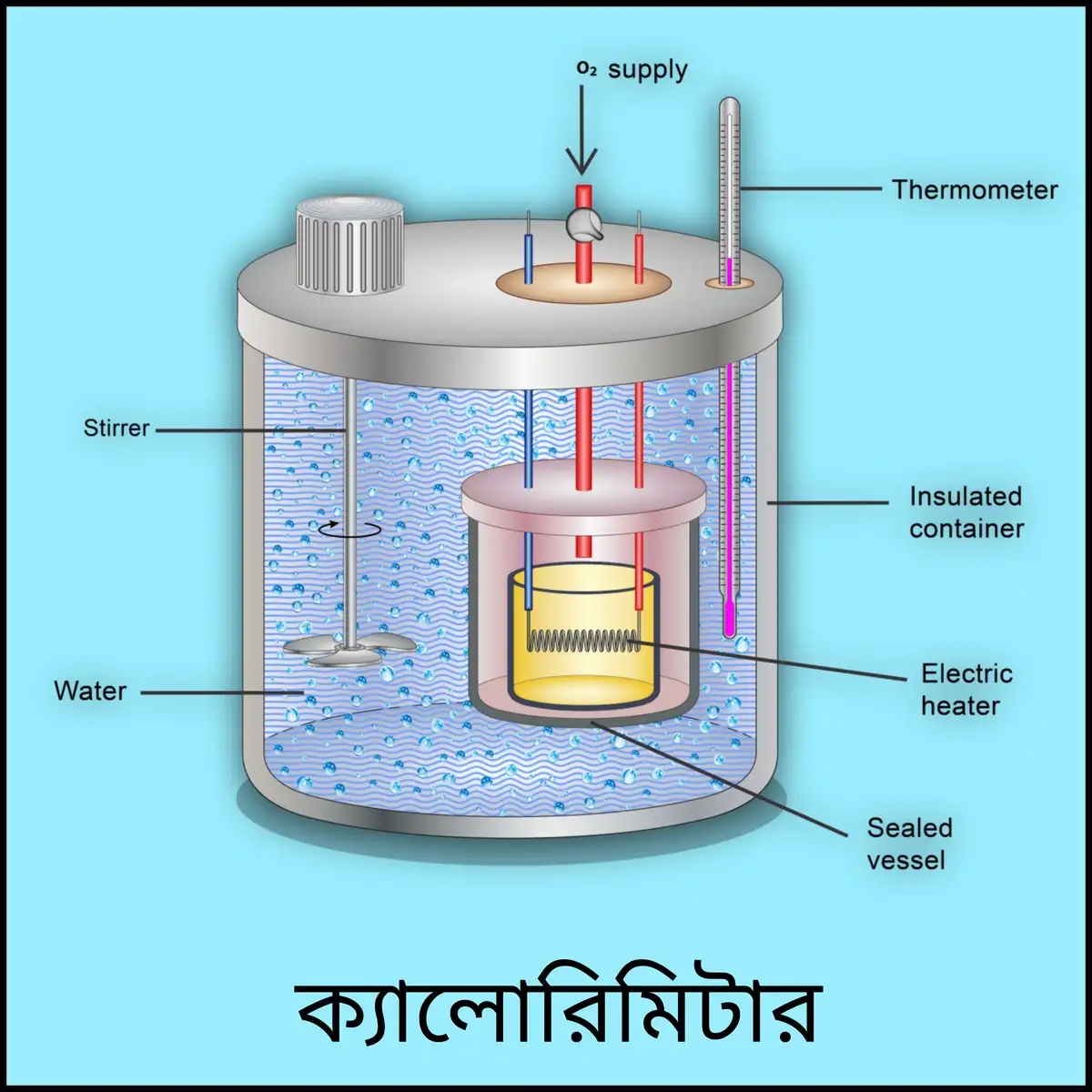
ক্যালোরিমিটার থেকে তাপক্ষয় রোধ করার জন্য প্রদত্ত ব্যবস্থাগুলি নেওয়া হয় –
- ক্যালোরিমিটারকে কর্ক, কাঠ, কার্ডবোর্ড ইত্যাদি কুপরিবাহী পদার্থের আবরণের মধ্যে বসানো হয় ও ক্যালোরিমিটারের মুখে একটি কুপরিবাহী পদার্থের তৈরি ঢাকনা রাখা হয়। এতে পরিবহণ পদ্ধতিতে তাপক্ষয় অনেক কম হয়।
- পরিচলন পদ্ধতিতে তাপক্ষয় রোধ করার জন্য ক্যালোরিমিটারকে একটি আবদ্ধ পাত্রের মধ্যে রাখা হয়। পাত্র ও ক্যালোরিমিটারের মাঝে তুলো, পশম ইত্যাদি কুপরিবাহী পদার্থ রাখা হয়।
- ক্যালোরিমিটারের বাইরের তলটি খুব ভালোভাবে পালিশ করা থাকে অথবা, নিকেলের চকচকে প্রলেপ দেওয়া থাকে। ফলে, বিকিরণ পদ্ধতিতে তাপক্ষয় কম হয়।
তাপীয় সাম্যাবস্থা বলতে কী বোঝায়? এই অবস্থায় থাকা বস্তুগুলির তাপমাত্রা কী হবে?
তাপীয় সাম্যাবস্থা (Thermal equilibrium) –
যে শর্তে বা অবস্থায় তাপীয় সংযোগে থাকা দুই বা ততোধিক বস্তুর মধ্যে তাপীয় আদানপ্রদান বন্ধ হয়, তাকেই তাপীয় সাম্যাবস্থা বলে।
এই অবস্থায় তাপীয় সংস্থার অন্তর্গত সকল বস্তুর উষ্ণতা সমান হয়ে থাকে।
গাণিতিক দৃষ্টিভঙ্গি থেকে আপেক্ষিক তাপের ধারণা ব্যাখ্যা করো।
তাপগ্রহণের ফলে, পদার্থের অবস্থার পরিবর্তন যদি না হয় তবে বলা যায় যে, বস্তু দ্বারা গৃহীত তাপ, Q ∝ পদার্থের ভর (m) [যখন উন্নতা বৃদ্ধি নির্দিষ্ট] এবং Q ∝ পদার্থের উষ্ণতা বৃদ্ধি (θ2 – θ1) বা Δt।
[যখন ভর নির্দিষ্ট, θ1 → প্রাথমিক উষ্ণতা θ2 → চূড়ান্ত উষ্ণতা]
∴ Q ∝ mΔθ [যখন m ও Δθ উভয়ই পরিবর্তনশীল]
বা, \(\frac Q{m\Delta\theta}\) = ধ্রুবক (s)
সমানুপাতিক ধ্রুবক s -কে পদার্থের আপেক্ষিক তাপ (Specific heat বা specific heat capacity) বলে চিহ্নিত করা হয়, যা পদার্থের একটি বিশেষ ধর্ম এবং যার মান সংশ্লিষ্ট পদার্থের উপাদানের তাপ গ্রহণ বা বর্জন ক্ষমতার ওপর নির্ভরশীল।
তাপগ্রাহিতা ও জলসম কাকে বলে? CGS পদ্ধতি ও SI -তে এদের এককগুলি লেখোে।
তাপগ্রাহিতা (Thermal capacity) –
কোনো বস্তুর উষ্ণতা 1° বৃদ্ধি করতে যে পরিমাণ তাপ লাগে, তাকে ওই বস্তুর তাপগ্রাহিতা বলে।
বস্তুর তাপগ্রাহিতা = বস্তুর ভর × আপেক্ষিক তাপ।
CGS পদ্ধতিতে তাপগ্রাহিতার একক ক্যালোরি/°C।
SI-তে তাপগ্রাহিতার একক জুল/K।
জলসম (Water equivalent) –
কোনো বস্তুর উষ্ণতা 1° বৃদ্ধির জন্য প্রয়োজনীয় তাপ যে পরিমাণ জলের উষ্ণতা 1° বৃদ্ধি করতে পারে, সেই পরিমাণ জলকে ওই বস্তুর জলসম বলে।
CGS পদ্ধতিতে জলসম = বস্তুর ভর × আপেক্ষিক তাপ।
SI -তে জলসম -এর রাশিমালা = \(\frac{ms}{4200}\)
CGS পদ্ধতিতে জলসমের একক গ্রাম।
SI -তে জলসমের একক কিলোগ্রাম।
বোধমূলক প্রশ্নোত্তর
তাপকে একপ্রকার শক্তি বলা হয় কেন যুক্তিসহ বুঝিয়ে লেখো।
তাপকে একপ্রকার শক্তি বলা হয়, কারণ –
- অন্যান্য শক্তির মতো তাপও ভরহীন, আয়তনহীন, অদৃশ্য কিন্তু ইন্দ্রিয়গ্রাহ্য।
- তাপের কার্য করার সামর্থ্য আছে, তাপশক্তি বাষ্পীয় ইঞ্জিনে কার্য করে।
- তাপ থেকে আমরা অন্য যে-কোনো প্রকারের শক্তি পেতে পারি। যেমন – প্ল্যাটিনাম তারকে উত্তপ্ত করলে তা থেকে আলো ছড়ায় অর্থাৎ, তাপ থেকে আলোকশক্তি পাওয়া যায়।
- আবার অন্যান্য শক্তি থেকেও তাপ পাওয়া যায়। যেমন – বৈদ্যুতিক হিটারে তড়িৎশক্তি থেকে তাপ পাওয়া যায়। সুতরাং, এর থেকে বোঝা যাচ্ছে, তাপ সৃষ্টি করতে গেলে কোনো না কোনো শক্তির প্রয়োজন হয়। আর শক্তিকে একরূপ থেকে অন্যরূপে পরিবর্তন করা যায়। এই কারণে তাপকে একপ্রকার শক্তি বলা হয়।
দুটি বস্তুর তাপমাত্রা সমান হলেও তাদের মোট তাপ-শক্তির পরিমাণ কি সর্বদা সমান হবে?
কোনো বস্তুর মোট তাপশক্তির পরিমাণ নিম্নলিখিত তিনটি রাশির ওপর নির্ভর করে –
- বস্তুর ভর (m),
- উপাদানের আপেক্ষিক তাপ (s) ও
- বস্তুর উষ্ণতা।
বস্তুর ভর (m) ও আপেক্ষিক তাপ (s) -এর গুণফলকে বলা হয় তাপ ধারকত্ব (ms) (Heat capacity)। সুতরাং, বলা যায়, কোনো বস্তুর মোট তাপশক্তির পরিমাণ নির্ভর করে বস্তুরটি তাপ ধারকত্ব (ms) ও বস্তুর উষ্ণতার গুণফলের ওপর। ফলে, দুটি বস্তুর উষ্ণতা সমান হলেও যদি তাপ ধারকত্ব ভিন্ন হয় তাহলে ওই বস্তু দুটির তাপশক্তির পরিমাণ ভিন্ন হবে।
ক্যালোরিমিতিক তরল হিসেবে জল ব্যবহার করা যায় কি?
জল সহজলভ্য, বিশুদ্ধ অবস্থায় সহজেই সংগ্রহযোগ্য বলে ক্যালোরিমিতির অনেক পরীক্ষাতেই জল ব্যবহার করা হয়। কিন্তু সূক্ষ্ম পরিমাপের ক্ষেত্রে জল আদৌ নির্ভরযোগ্য নয়। কারণ –
- জলের আপেক্ষিক তাপ অন্যান্য সমস্ত তরল বা কঠিনের তুলনায় বেশি। তাই নির্দিষ্ট পরিমাণ তাপ গ্রহণে জলের উষ্ণতা বৃদ্ধি তুলনামূলকভাবে অনেক কম হয়। ফলে, পরিমাপে শতকরা ত্রুটির সম্ভাবনা বাড়ে।
- বিশুদ্ধ জলের স্ফুটনাঙ্ক মাত্র 100°C হওয়ায় উচ্চ উষ্ণতাযুক্ত কোনো বস্তুকে জলের সংস্পর্শে আনলে জল বাষ্পীভূত হওয়ার সম্ভাবনা থাকে।
- জল রাসায়নিকভাবে খুব সক্রিয়।
- জল তাপের কুপরিবাহী। তাই এর ব্যবহারে পরিমাপের সুবেদিতা হ্রাস পায়।
ক্যালোরিমিতিক তরল হিসেবে অ্যানিলিন ব্যবহারের কারণ কী? এর প্রয়োজনীয় বৈশিষ্ট্যগুলি আলোচনা করুন।
ভালো ক্যালোরিমিতিক তরলের প্রয়োজনীয় বৈশিষ্ট্যগুলি হল – নিম্ন আপেক্ষিক তাপ, রাসায়নিক নিষ্ক্রিয়তা, উচ্চ স্ফুটনাঙ্ক, অনুদ্বায়ীতা ইত্যাদি। তরলটি কম সান্দ্রতাসম্পন্ন হওয়াও আবশ্যক যাতে ক্যালোরিমিটারের গায়ে সেটি আটকে না থাকে। এই ধর্মগুলি প্রায় সবই অ্যানিলিনে উপস্থিত বলে ক্যালোরিমিতিক তরল হিসেবে সাধারণত অ্যানিলিন ব্যবহৃত হয়।
ক্যালোরিমিটার সাধারণত তামার তৈরি হয় কেন?
ক্যালোরিমিটারের উপাদান হিসেবে সাধারণত তামা হয়। এর কারণ –
- তামা তাপের সুপরিবাহী, তাই ক্যালোরিমিতিক তরলের সঙ্গে এটি দ্রুত সাম্যে আসে।
- তামার আপেক্ষিক তাপ কম বলে পাত্র অল্প তাপ শোষণ করে যথেষ্ট উষ্ণতা বৃদ্ধি ঘটায়। ফলে নির্ণীত পাঠ সুবেদী হয়।
- তামা ভঙ্গুর হয় না বলে ক্যালোরিমিটার ভেঙে যাওয়ার সম্ভাবনাও কম থাকে।
ক্যালোরিমিটারে জল নিয়ে তার মধ্যে নুন ফেলা হল – ঘটনাটির ক্ষেত্রে ক্যালোরিমিটারের নীতি প্রযোজ্য হবে কি? যুক্তি দাও।
ক্যালোরিমিটারে জল নিয়ে তার মধ্যে নুন ফেললে ক্যালোরিমিটারের নীতি প্রযোজ্য হবে না, কারণ – নুন জলে দ্রবীভূত হয়।
ক্যালোরিমিটারে জল নিয়ে তার মধ্যে সোডিয়াম ধাতু ফেলা হল – ঘটনাটির ক্ষেত্রে ক্যালোরিমিটারের নীতি প্রযোজ্য হবে কি? যুক্তি দাও।
ক্যালোরিমিটারে জল নিয়ে তার মধ্যে সোডিয়াম ধাতু ফেললে ক্যালোরিমিটারের নীতি প্রযোজ্য হবে না। কারণ – সোডিয়াম ধাতু জলের সঙ্গে বিক্রিয়া করে।
ক্যালোরিমিটার খোলা অবস্থায় রাখা হল – ঘটনাটির ক্ষেত্রে ক্যালোরিমিটারের নীতি প্রযোজ্য হবে কি? যুক্তি দাও।
ক্যালোরিমিটার খোলা অবস্থায় রাখলে পরিবেশের সঙ্গে তাপের আদানপ্রদান হবে। তাই ক্যালোরিমিতির মূলনীতি প্রযোজ্য হবে না।
100°C উষ্ণতার 1 kg লোহা সম উষ্ণতার 1 kg তামা অপেক্ষা বেশি বরফ গলাতে পারে কেন?
তামা অপেক্ষা লোহার উপাদানের আপেক্ষিক তাপ বেশি হওয়ায় 100°C উষ্ণতার 1 কিগ্রা তামার তুলনায় সম ভর ও সম উষ্ণতার লোহা বেশি পরিমাণ তাপ বর্জন করতে সক্ষম হয়। সুতরাং, অবস্থান্তরের সময় বরফ একই ভর ও উষ্ণতার তামা অপেক্ষা লোহা থেকে বেশি পরিমাণ তাপ গ্রহণ করে থাকে। তাই, তামা অপেক্ষা লোহা বেশি পরিমাণ বরফ গলাতে সক্ষম হয়।
শীতপ্রধান দেশে ঘর গরম রাখার জন্য ঘরের মধ্যে গরম জলের পাইপ লাগানো হয় কেন?
জলের আপেক্ষিক তাপের মান বেশি বলে জলের মধ্যে বেশি তাপ সঞ্চিত থাকে। তাই গরম জলের পাইপ থেকে ঠান্ডা ঘরে তাপ সঞ্চালিত হয়ে ঘরকে গরম করে। সে কারণে শীতপ্রধান দেশে ঘরের মধ্যে গরম জলের পাইপ লাগানো হয়।
সেঁক দেওয়ার জন্য জল সবচেয়ে উপযোগী তরল কেন?
জলের আপেক্ষিক তাপ বেশি হওয়ায় একই উষ্ণতা বৃদ্ধিতে অন্য তরলের তুলনায় জল বেশি পরিমাণ তাপ গ্রহণ করে, এমনকি তা বর্জিত হতেও বেশি সময় লাগে। ফলে অনেকক্ষণ সময় ধরে তাপ ধরে রাখতে পারে। তাই সেঁক দেবার বোতল বা ব্যাগে গরম তরল হিসেবে গরম জল ব্যবহার করলে দীর্ঘক্ষণ ধরে তার সাহায্যে সেঁক দেওয়া যায়।
যখন একটি উত্তপ্ত বস্তু অপর একটি শীতল বস্তুকে উত্তপ্ত করে তাদের উষ্ণতা পরিবর্তন কি সমান হয়?
একটি উত্তপ্ত বস্তু অপর একটি শীতল বস্তুকে উত্তপ্ত করলে তাদের উষ্ণতা পরিবর্তন একই হয় না। ক্যালোরিমিতির মূলনীতি অনুসারে, গৃহীত তাপ \(H_1\) = বর্জিত তাপ \(H_2\)
বা, \(m_1s_1\theta_1=m_2s_2\theta_2\)
∴ \(\frac{\theta_1}{\theta_2}=\frac{m_2s_2}{m_1s_1}\)
সুতরাং, বস্তু দুটির ভর ও আপেক্ষিক তাপ আলাদা হওয়ায় উভয়ের উষ্ণতা বৃদ্ধি ও হ্রাস সম পরিমাণে হবে না। তবে দুটি বস্তুর তাপগ্রাহিতা (\(ms\)) সমান হলে \(\theta_1=\theta_2\) হয়। সেক্ষেত্রে বস্তু দুটির উষ্ণতা পরিবর্তন সমপরিমাণে হবে।
জল অপেক্ষা দুধ তাড়াতাড়ি ফোটে কেন?
\(m\) ভরের একটি বস্তুর উষ্ণতা \(\Delta t^\circ C\) বৃদ্ধি করতে প্রয়োজনীয় তাপ, \(Q=ms\Delta t\), যেখানে \(s\) হল বস্তুটির আপেক্ষিক তাপ। অতএব উষ্ণতার বৃদ্ধি \(\Delta t=\frac1{ms}\) বা, \(\Delta t\propto\frac1s\), যখন \(Q\) ও \(m\) ধ্রুবক থাকে। সুতরাং, একই ভরের দুটি বস্তুতে একই পরিমাণ তাপ দিলে যে বস্তুর আপেক্ষিক তাপ কম, সেই বস্তু তাড়াতাড়ি গরম হবে।
এখন জল অপেক্ষা দুধের আপেক্ষিক তাপ কম। তাই সম ভরের জল ও দুধ নিয়ে একই হারে তাপ দিলে দুধের আপেক্ষিক তাপ কম বলে দুধের উষ্ণতা বৃদ্ধির হার বেশি হয়। তাই জল অপেক্ষা দুধ তাড়াতাড়ি ফোটে।
সমভরের দুটি ভিন্ন ধাতব বস্তুতে সমপরিমাণ তাপ দেওয়া হল। দেখাও যে, উষ্ণতা বৃদ্ধি সমান হবে না।
ধরা যাক, বস্তুদুটির ভর = \(m\) এবং প্রযুক্ত তাপ = \(H\)
প্রথম বস্তুর আপেক্ষিক তাপ = \(s_1\) ও উষ্ণতা বৃদ্ধি = \(\theta_1\)
এবং দ্বিতীয় বস্তুর আপেক্ষিক তাপ = \(s_2\) ও উষ্ণতা বৃদ্ধি = \(\theta_2\)
∴ প্রথম বস্তুর ক্ষেত্রে, \(H=ms_1\theta_1\)
দ্বিতীয় বস্তুর ক্ষেত্রে, \(H=ms_2\theta_2\)
অতএব, \(ms_1\theta_1=ms_2\theta_2\)
বা, \(\frac{\theta_1}{\theta_2}=\frac{s_2}{s_1}\) [∵ \(s_1\neq s_2;\;\theta_1\neq\theta_2\)]
অর্থাৎ, সমভরের দুটি ভিন্ন ধাতব বস্তুতে সমপরিমাণ তাপ দেওয়া হলে উষ্ণতা বৃদ্ধি সমান হবে না।
একটি সোনার পাতকে কেটে দু-টুকরো করা হল। টুকরো দুটির আপেক্ষিক তাপের মানের কি কোনো পরিবর্তন হবে?
একক ভরের কোনো পদার্থের একক উন্নতা বৃদ্ধি করতে যে তাপশক্তির প্রয়োজন হয়, সেটিই হল ওই পদার্থের আপেক্ষিক তাপ। আপেক্ষিক তাপ কেবলমাত্র পদার্থের প্রকৃতির ওপর নির্ভর করে, পদার্থের পরিমাণ বা ভরের ওপর নির্ভর করে না। অর্থাৎ, 10 g ও 5 g সোনার আপেক্ষিক তাপ একই হবে। তাই একটি সোনার পাতকে কেটে দু-টুকরো করা হলে টুকরো দুটির আপেক্ষিক তাপের মানের কোনো পরিবর্তন হবে না।
তামার আপেক্ষিক তাপ 0.09 – বলতে কী বোঝায়?
তামার আপেক্ষিক তাপ 0.09 বলতে বোঝায় যে, 1 গ্রাম ভরের বিশুদ্ধ তামার তাপমাত্রা 1°C বৃদ্ধি করতে 0.09 ক্যালোরি তাপের প্রয়োজন।
লোহার আপেক্ষিক তাপ 462 জুল-কেজি/কেলভিন – বলতে কী বোঝায়?
লোহার আপেক্ষিক তাপ 462 J⋅kg/K বলতে বোঝায় যে, 1 কেজি লোহার উষ্ণতা 1 কেলভিন বৃদ্ধি করতে 462 জুল তাপের প্রয়োজন।
জলের আপেক্ষিক তাপ বেশি হওয়ার সুবিধা কী কী?
জলের আপেক্ষিক তাপের মান অন্যান্য কঠিন বা তরল পদার্থের আপেক্ষিক তাপের তুলনায় অনেক বেশি। জলের আপেক্ষিক তাপ উচ্চ হওয়ার ফলে নিম্নলিখিত সুবিধাগুলি পাওয়া যায়
- সেঁক দেওয়ার কাজে গরম জল ব্যবহার করা হয়।
- স্টিম ইঞ্জিন বা পেট্রোল ইঞ্জিনকে শীতল রাখার জন্য গাড়ির রেডিয়েটরে শীতলকারক হিসেবে জল ব্যবহার করা হয়।
- জলের উচ্চ আপেক্ষিক তাপের জন্য সমুদ্র তীরবর্তী অঞ্চলের জলবায়ু নাতিশীতোষ্ণ ও আরামদায়ক হয়।
- সমুদ্রবায়ু ও স্থলবায়ুর উৎপত্তির জন্য জলের উচ্চ আপেক্ষিক তাপ দায়ী।
- জ্বর অবস্থায় জলের সাহায্যে শরীরের উষ্ণতা নিয়ন্ত্রণ করা যায়।
- শীতপ্রধান দেশে ঘরবাড়ি গরম রাখতে পাইপের মধ্যে দিয়ে গরম জলের প্রবাহ চালনা করা হয়।
পার্থক্যধর্মী প্রাশ্নাত্তর
তাপ (Heat) ও উষ্ণতা (Temperature) -এর মধ্যে পার্থক্য লেখো।
তাপ (Heat) ও উষ্ণতা (Temperature) -এর মধ্যে পার্থক্যগুলি হল –
| বিষয় | তাপ (Heat) | উষ্ণতা (Temperature) |
| বৈশিষ্ট্য | তাপ একপ্রকার শক্তি। | উষ্ণতা হল বস্তুটির তাপীয় অবস্থা। |
| কার্যকারণ সম্পর্ক | কোনো পদার্থে তাপ দিলে উষ্ণতা বাড়ে। অর্থাৎ,তাপ হল উষ্ণতার কারণ। | উষ্ণতা হল তাপের ফল। |
| তাপপ্রবাহে ভূমিকা | এক বস্তু থেকে অন্য বস্তুতে তাপের প্রবাহ বস্তুর মধ্যেকার মোট তাপের ওপর নির্ভর করে না। | বেশি উষ্ণ বস্তু থেকে কম উষ্ণ বস্তুতে তাপ সঞ্চালিত হয়। |
| পরিমাপক ব্যবস্থা | গৃহীত বা বর্জিত তাপ মাপা হয় ক্যালোরিমিটারের সাহায্যে। | উষ্ণতা মাপা হয় থার্মোমিটারের সাহায্যে। |
| একক | CGS পদ্ধতিতে ও SI -তে তাপের একক যথাক্রমে ক্যালোরি ও জুল। | CGS পদ্ধতিতে ও SI -তে উষ্ণতার একক যথাক্রমে ডিগ্রী সেলসিয়াস ও কেলভিন। |
| সমতুল্যতার ধারণা | কোনো বস্তুর মধ্যস্থ তাপকে কোনো পাত্রে রাখা জলের পরিমাণের সঙ্গে তুলনা করা হয়। | বস্তুর উষ্ণতাকে কোনো পাত্রে রাখা জলের উচ্চতার সঙ্গে তুলনা করা হয়। |
| পারস্পরিক সম্পর্ক | দুটি বস্তুর উষ্ণতা সমান হলেও তাদের মোট তাপের পরিমাণ ভিন্ন হতে পারে। | দুটি বস্তুর মধ্যে তাপের পরিমাণ এক হলেও তাদের উষ্ণতা আলাদা হতে পারে। |
তাপগ্রাহিতা (Thermal capacity) ও জলসম (Water equivalent) -এর মধ্যে পার্থক্য লেখো।
তাপগ্রাহিতা (Thermal capacity) ও জলসম (Water equivalent) -এর মধ্যে পার্থক্যগুলি হল –
| বিষয় | তাপগ্রাহিতা (Thermal capacity) | জলসম (Water equivalent) |
| পরিমেয় রাশি | তাপগ্রাহিতা বলতে কিছু পরিমাণ তাপকে বোঝায়। | জলসম বলতে কিছু পরিমাণ জলের ভরকে বোঝায়। |
| সংজ্ঞা | কোনো বস্তুর উষ্ণতা 1° বৃদ্ধি করতে যে পরিমাণ তাপ লাগে, সেই পরিমাণ তাপকে ওই বস্তুর তাপগ্রাহিতা বলে। | কোনো বস্তুর উষ্ণতা 1° বৃদ্ধির জন্য প্রয়োজনীয় তাপ, যে পরিমাণ ভরের জলের উষ্ণতা 1° বৃদ্ধি করতে পারে, সেই পরিমাণ জলের ভরকে ওই বস্তুর জলসম বলে। |
| CGS পদ্ধতি ও SI -তে একক | CGS পদ্ধতিতে ও SI -তে তাপগ্রাহিতার একক হল যথাক্রমে ক্যালোরি/ডিগ্রি সেলসিয়াস ও জুল/কেলভিন। | CGS পদ্ধতিতে ও SI -তে জলসমের একক হল যথাক্রমে গ্রাম ও কিলোগ্রাম। |
| গাণিতিক রাশিমালা | m ভরবিশিষ্ট কোনো বস্তুর উপাদানের আপেক্ষিক তাপ s হলে SI -তে বস্তুটির তাপগ্রাহিতা = ms J/K। | m ভরবিশিষ্ট কোনো বস্তুর উপাদানের আপেক্ষিক তাপ s হলে SI -তে বস্তুটির জলসম = \(\frac{ms}{4200}kg\)। |
গাণিতিক প্রশ্নাবলি
প্রয়োজনীয় সূত্রাবলি
বস্তু কর্তৃক গৃহীত বা বর্জিত তাপ (H) = বস্তুর ভর (m) × আপেক্ষিক তাপ (s) × উষ্ণতা বৃদ্ধি বা হ্রাস ( θ) অর্থাৎ, H = ms( θ2 – θ1)।
ক্যালোরিমিতির মূলনীতি, মোট গৃহীত তাপ = মোট বর্জিত তাপ।
তাপগ্রাহিতা = ms cal/°C বা, J/K।
জলসম = ms kg বা, g।
3 kg ভরের একটি তামার পাতের উষ্ণতা 10°C বাড়াতে কত তাপ লাগবে? (তামার আপেক্ষিক তাপ 0.09 cal/g°C)।
প্রয়োজনীয় তাপ, H = ms θ
এখানে m = 3 kg, m = 3000 g, s = 0.09, 0 = 10°C
∴ H = 3000 × 0.09 × 10 =
বা, H = 2700 cal
∴ তামার পাতের উষ্ণতা 10°C বাড়াতে 2700 cal তাপ লাগবে।
60 g ভরের একখণ্ড লোহার তাপমাত্রা 200°C থেকে 100°C -এ কমালে কত তাপ বর্জিত হবে? (লোহার আপেক্ষিক তাপ = 0.12)
এখানে m = 60 g, s = 0.12,
θ = θ2 – θ1
বা, θ = (200° – 100°)
বা, θ = 100°C
∴ লোহা কর্তৃক বর্জিত তাপ H = msθ
বা, H = 60 × 0.12 × 100
বা, H = 720 cal
∴ 720 cal তাপ বর্জিত হবে।
100 g ভরের একটি লোহার টুকরোর তাপমাত্রা 200°C। এতে 1000 cal তাপ দেওয়া হলে এর অন্তিম তাপমাত্রা কত হবে? লোহার আপেক্ষিক তাপ = 0.11 cal/g °C।
ধরি, লোহার অন্তিম তাপমাত্রা = θ2
আমরা জানি, H = ms(θ2 – θ1)
এখানে m = 100 g, s = 0.11, H = 1000 cal, θ1 = 200°C, θ2 =?
∴ 1000 = 100 × 0.11 × (θ2 – 200)
বা, θ2 – 200 = \(\frac{1000}{100\times0.11}\)
বা, θ2 – 200 = \(\frac{1000}{11}\)
বা, θ2 – 200 = 90.91
বা, θ2 = 200 + 90.91
বা, θ2 = 290.91°C
∴ অন্তিম তাপমাত্রা 290.91°C হবে।
10 g ভরের কোনো বস্তুর তাপমাত্রা 25°C থেকে বাড়িয়ে 35°C করতে 12 cal তাপের প্রয়োজন হয়। বস্তুটির উপাদানের আপেক্ষিক তাপ নির্ণয় করো।
এখানে m = 10 g, θ = (35 – 25)°C = 10°C, H = 12 cal
আমরা জানি, H = msθ
∴ 12 = 10 × s × 10
বা, s = \(\frac{12}{100}\)
বা, s = 0.12 cal/g °C
∴ বস্তুটির উপাদানের আপেক্ষিক তাপ 0.12 cal/g °C।
সমান ভরের দুটি আপেক্ষিক তাপ যথাক্রমে s1 ও s2 (s2 < s1)। বস্তু দুটিকে সমপরিমাণ তাপ দিলে কোনটির উষ্ণতা বৃদ্ধি বেশি হবে; গণিতের সাহায্যে প্রমাণ করো।
ধরা যাক, সমান ভরের দুটি বস্তুর প্রতিটির ভর = m
বস্তুদুটির উপাদানের আপেক্ষিক তাপ যথাক্রমে s1 ও s2
বস্তুদুটিকে সমপরিমাণ তাপ H দিলে ধরা যাক বস্তুদুটির উষ্ণতা বৃদ্ধি হয় যথাক্রমে θ1 ও θ2।
∴ H = ms1θ1 এবং H = ms2θ2
∴ ms1θ1 = ms2θ2
বা, s1θ1 = s2θ2
বা, \(\frac{\theta_1}{\theta_2}=\frac{s_2}{s_1}<1\) [∵ s2 < s1]
∴ θ1 < θ2
∴ বস্তুদুটিকে সমপরিমাণ তাপ দিলে যার আপেক্ষিক তাপ কম তার উষ্ণতা বৃদ্ধি বেশি হবে।
100°C উষ্ণতার 40 g লোহাকে 21°C উষ্ণতার 100 g জলে ডুবিয়ে রাখার মিশ্রণের শেষ উষ্ণতা 25°C হল। লোহার আপেক্ষিক তাপ কত?
ধরা যাক, লোহার আপেক্ষিক তাপ = s cal/g °C
এক্ষেত্রে মিশ্রণের শেষ উষ্ণতা = 25°C
∴ লোহা কর্তৃক বর্জিত তাপ = লোহার ভর × লোহার আপেক্ষিক তাপ × উষ্ণতা হ্রাস
= 40 × s × (100 – 25) cal
= 40 × s × 75 cal
এবং জল কর্তৃক গৃহীত তাপ
= জলের ভর × জলের আপেক্ষিক তাপ × উষ্ণতা বৃদ্ধি
= 100 × 1 × (25 – 21) cal
= 100 × 4 cal
= 400 cal
ক্যালোরিমিতির মূলনীতি অনুযায়ী, গৃহীত তাপ = বর্জিত তাপ।
বা, 400 = 40 × s × 75
বা, s = \(\frac{400}{40\times75} \)
বা, s = 0.13
∴ লোহার আপেক্ষিক তাপ = 0.13 cal/g °C
সমভরের তিনটি তরল A, B ও C -এর উষ্ণতা যথাক্রমে 10°C, 30°C ও 40°C। A ও B কে মিশ্রিত করলে মিশ্রণের উষ্ণতা হয় 15°C, আবার B ও C -কে মিশ্রিত করলে মিশ্রণের উষ্ণতা হয় 34°C। তরল তিনটির আপেক্ষিক তাপের অনুপাত কত?
ধরা যাক, \(A,\;B\) ও \(C \) তরলের আপেক্ষিক তাপ যথাক্রমে \(s_A,\;s_B\) ও \(s_C\) এবং প্রত্যেকটি তরলের ভর হল \(m \) ।
\(A \) ও \( B\) -কে মিশ্রিত করলে মিশ্রণের উষ্ণতা হয় 15°C
∴ ক্যালোরিমিতির মূলনীতি অনুযায়ী,
\(A\) তরল দ্বারা গৃহীত তাপ = \(B\) তরল দ্বারা বর্জিত তাপ
∴ \(m\times s_A\times\left(15-10\right)=m\times s_B\times\left(30-15\right)\)
বা, \(5s_A=15s_B\) [∵ \(m\neq0\)]
বা, \(s_A=3s_B \)
বা, \(s_B=\frac{s_A}3\)
\(B\) ও \(C\) -কে মিশ্রিত করলে মিশ্রণের উষ্ণতা হয় 34°C
∴ ক্যালোরিমিতির মূলনীতি অনুযায়ী,
\(B\) তরল দ্বারা গৃহীত তাপ = \(C\) তরল দ্বারা বর্জিত তাপ
∴ \(m\times s_B\times\left(34-30\right)=m\times s_C\times\left(40-34\right)\)
বা, \(4s_B=6s_C\) [∵ \(m\neq0\)]
বা, \(2s_B=3s_C\)
বা, \(s_C=\frac23s_B\)
বা, \(s_C=\frac23\times\frac{s_A}3\)
বা, \(s_C=\frac{2s_A}9\)
∴ \(A,\;B \) ও \(C\) তরলের আপেক্ষিক তাপের অনুপাত হল –
\(s_A:s_B:s_C=s_A:\frac{s_A}3:\frac{2s_A}9\\\)বা, \(s_A:s_B:s_C=9:3:2\)
20°C উষ্ণতার কিছু পরিমাণ জলের সঙ্গে 100°C উষ্ণতার কত লিটার জল মেশালে মিশ্রণের উষ্ণতা হবে 40°C এবং আয়তন হবে 28 L?
যেহেতু মিশ্রণের আয়তন = 28 L
ধরা যাক, 20°C উষ্ণতার x L জলের সঙ্গে 100°C উষ্ণতার (28 – x)L জল মেশানো হয়েছে। মিশ্রণের চূড়ান্ত উষ্ণতা 40°C
এখন, x L জলের ভর = 1000x g এবং (28 – x)L জলের ভর = (28 – x) × 1000 g। জলের আপেক্ষিক তাপ = 1 cal/g °C
20°C উষ্ণতার জল দ্বারা গৃহীত তাপ,
H1 = (1000x) × 1 × (40 – 20) cal
বা, H1 = (1000x) × 20 cal
এবং 100°C উষ্ণতার জল দ্বারা বর্জিত তাপ,
H2 = (28 – x) × 1000 × 1 × (100 – 40)
বা, H2 = (28 – x) × 1000 × 60 cal
ক্যালোরিমিতির মূলনীতি অনুযায়ী, H1= H2
বা, (1000x) × 20 = (28 – x) × 1000 × 60
বা, x × 20 = (28 – x) × 60
বা, x = 3x(28 – x)
বা, x = 84 – 3x
বা, 4x = 84
বা, x = \(\frac{84}4\)
বা, x = 21
∴ 28 – x = 28 – 21 = 7
∴ 20°C উষ্ণতার 21 L জলের সঙ্গে 100°C উষ্ণতার 7 L জল মেশালে মিশ্রণের উষ্ণতা হবে 40°C এবং আয়তন হবে 28 L।
সমভরের তিনটি তরলের উষ্ণতা যথাক্রমে θ1, θ2 ও θ3 (θ1 > θ2 > θ3) এবং আপেক্ষিক তাপ যথাক্রমে s1, s2 ও s3। তরল তিনটিকে একসঙ্গে মিশ্রিত করলে মিশ্রণের চূড়ান্ত উষ্ণতা কত হবে?
ধরা যাক, প্রত্যেকটি তরলের ভর হল m এবং মিশ্রণের চূড়ান্ত উষ্ণতা হল ‘θ’।
∴ স্পষ্টতই এক্ষেত্রে, তিনটি তরলের মধ্যে একটি অথবা দুটি তরল তাপ বর্জন করে এবং যথাক্রমে দুটি বা একটি তরল সেই তাপ গ্রহণ করে। গৃহীত তাপ ধনাত্মক হলে বর্জিত তাপ ঋণাত্মক হবে। যেহেতু, মোট গৃহীত তাপ = মোট বর্জিত তাপ, সুতরাং তিনটি তরলের গৃহীত তাপ যোগ করলে ওই যোগফল শূন্য হবে।
প্রথম তরল দ্বারা গৃহীত তাপ H1 = ms1(θ – θ1)
দ্বিতীয় তরল দ্বারা গৃহীত তাপ H2 = ms2(θ – θ2)
তৃতীয় তরল দ্বারা গৃহীত তাপ H3 = ms3(θ – θ3)
∴ H1 + H2 + H3 = 0
বা, ms1(θ – θ1) + ms2(θ – θ2) + ms3(θ – θ3) = 0
বা, θ(S1 + S2 + S3) = s1θ1 + s2θ2 + s3θ3 [∵ m ≠ 0]
বা, \(\theta=\frac{s_1\theta_1+s_2\theta_2+s_3\theta_3}{s_1+s_2+s_3}\)
কোনো বস্তুর ভর ও আপেক্ষিক তাপ যথাক্রমে 100 গ্রাম এবং 0.09 cal/g°C। ওই বস্তুর তাপগ্রাহিতা ও জলসম নির্ণয় করো।
এখানে m = 100 g, s = 0.09 cal/g °C
তাপগ্রাহিতা = ms
= 100 × 0.09
= 9 cal/°C
জলসম = ms
= 100 × 0.09
= 9 g
Class 9 Physical Science – Notes for All Chapters
| Chapter Name | Tropics |
|---|---|
| পরিমাপ | পরিমাপ ও একক বিভিন্ন মাপের একক মাত্রা পরিমাপ |
| বল ও গতি | স্থিতি ও গতি গতির সমীকরণ নিউটনের প্রথম গতিসূত্র নিউটনের দ্বিতীয় গতি সূত্র নিউটনের তৃতীয় গতিসূত্র বিভিন্ন ধরনের বল রৈখিক ভরবেগ রৈখিক ভরবেগ সংরক্ষণ |
| পদার্থ : গঠন ও ধর্ম | তরল ও বায়ুর চাপ আর্কিমিডিসের নীতি পৃষ্ঠটান সান্দ্রতা বার্নোলির নীতি স্থিতিস্থাপকতা |
| পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ | পরমাণুর গঠন মোলের ধারণা দ্রবণ অ্যাসিড, ক্ষার, লবণ মিশ্রণের উপাদানের পৃথকীকরণ জল |
| শক্তির ক্রিয়া , কার্য, ক্ষমতা | শক্তির ক্রিয়া , কার্য, ক্ষমতা |
| তাপ | ক্যালোরিমিতি কার্য ও তাপের তুল্যতা লীনতাপ সম্পৃক্ত ও অসম্পৃক্ত বাষ্প জলের ব্যতিক্রান্ত প্রসারণ |
| শব্দ | শব্দের উৎস : কম্পন শব্দের বিস্তার : তরঙ্গ শব্দের কয়েকটি ধর্ম শব্দের বৈশিষ্ট্য মানুষের কান ও শব্দ শোনার কৌশল শব্দদূষণ |
আজকের আর্টিকেলে আমরা নবম শ্রেণির ভৌতবিজ্ঞান বইয়ের ষষ্ট অধ্যায় “তাপ” এর “ক্যালোরিমিতি” থেকে পরীক্ষায় আসা গুরুত্বপূর্ণ প্রশ্ন ও উত্তরগুলো আলোচনা করেছি। এই প্রশ্নোত্তরগুলো নবম শ্রেণির বার্ষিক পরীক্ষা, এমনকি চাকরি বা যেকোনো প্রতিযোগিতামূলক পরীক্ষার জন্যও উপযোগী। কারণ, এই অধ্যায়ের প্রশ্ন প্রায়ই বিভিন্ন পরীক্ষায় কমন আসে।
আশা করি, এই আর্টিকেলটি আপনাদের পরীক্ষার প্রস্তুতিতে কিছুটা হলেও সাহায্য করবে। যদি কোনো প্রশ্ন, মতামত বা সাহায্যের প্রয়োজন হয়, নিচে কমেন্ট করে জানাতে পারেন কিংবা টেলিগ্রামে যোগাযোগ করুন—আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত।
ধন্যবাদ সবাইকে।






Leave a Comment