আজকের আর্টিকেলে আমরা নবম শ্রেণীর ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “মোলের ধারণা” থেকে সহজ ও সংক্ষিপ্ত প্রশ্ন-উত্তর শেয়ার করবো। এই প্রশ্নগুলো নবম শ্রেণির ইউনিট টেস্ট থেকে বার্ষিক পরীক্ষা এর জন্য যেমন গুরুত্বপূর্ণ, তেমনি চাকরি বা বিভিন্ন প্রতিযোগিতার পরীক্ষাতেও কাজে লাগবে। এই অধ্যায় থেকে স্কুল পরীক্ষা থেকে শুরু করে চাকরির পরীক্ষায় প্রায়ই প্রশ্ন আসে, তাই এই প্রশ্নোত্তরগুলো সবাইকে সাহায্য করবে। প্রতিটি প্রশ্নের উত্তর সহজ ভাষায় লেখা হয়েছে, যাতে সবাই বুঝতে পারেন। পড়ার শেষে এই অধ্যায়ের মুখ্য বিষয়গুলো আপনার আয়ত্তে চলে আসবে এবং যেকোনো পরীক্ষায় আত্মবিশ্বাসের সঙ্গে লিখতে পারবেন।
জ্ঞানমূলক প্রশ্নোত্তর
অণুর সংজ্ঞা দাও। অণু কত প্রকার ও কী কী? উদাহরণসহ বিভিন্ন প্রকার অণুর সংজ্ঞা দাও।
অণু (Molecule) – মৌলিক বা যৌগিক পদার্থের যে ক্ষুদ্রতম কণার মধ্যে পদার্থের সকল ধর্ম বর্তমান এবং যা স্বাধীনভাবে থাকতে পারে, তাকে অণু বলা হয়।
অণু দুই প্রকার। যথা –
- মৌলিক অণু,
- যৌগিক অণু।
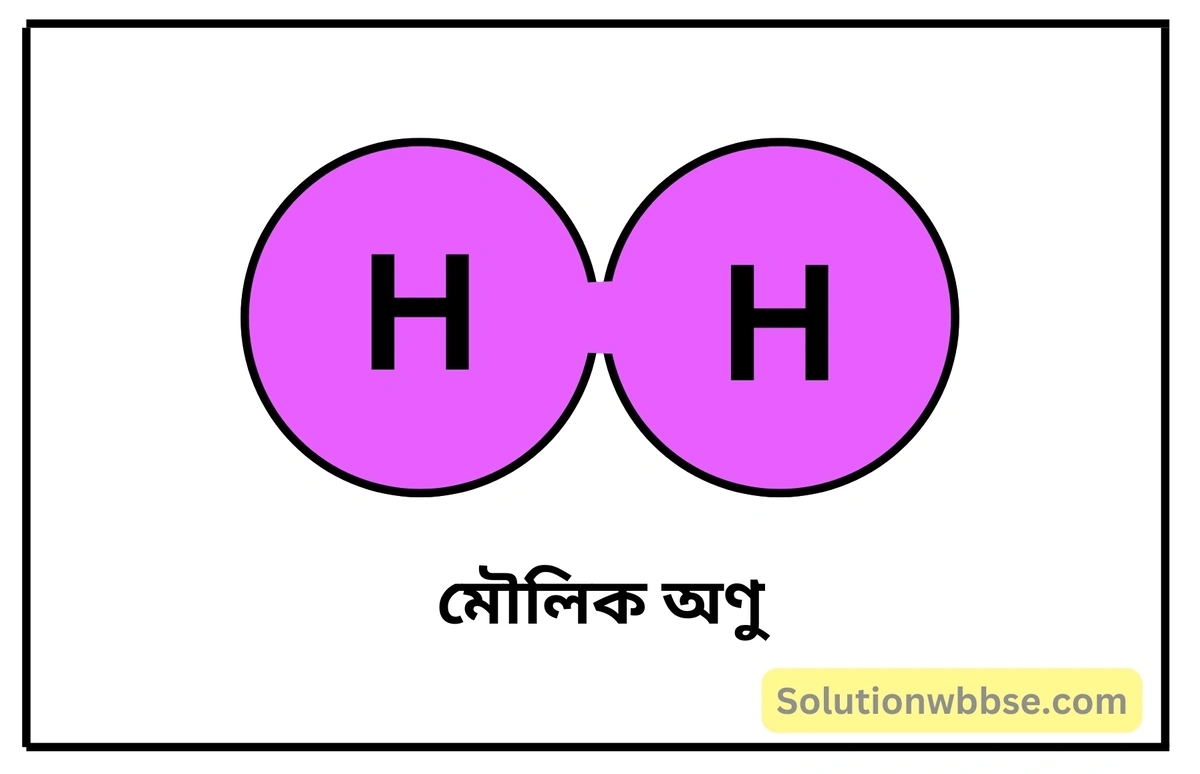
মৌলিক অণু (Elementary molecule) – যে অণু একই মৌলের এক বা একাধিক পরমাণু দ্বারা গঠিত হয়, তাকে মৌলিক অণু বলে। যেমন – হাইড্রোজেন অণু (H2), অক্সিজেন অণু (O2), নাইট্রোজেন অণু (N2) ইত্যাদি।
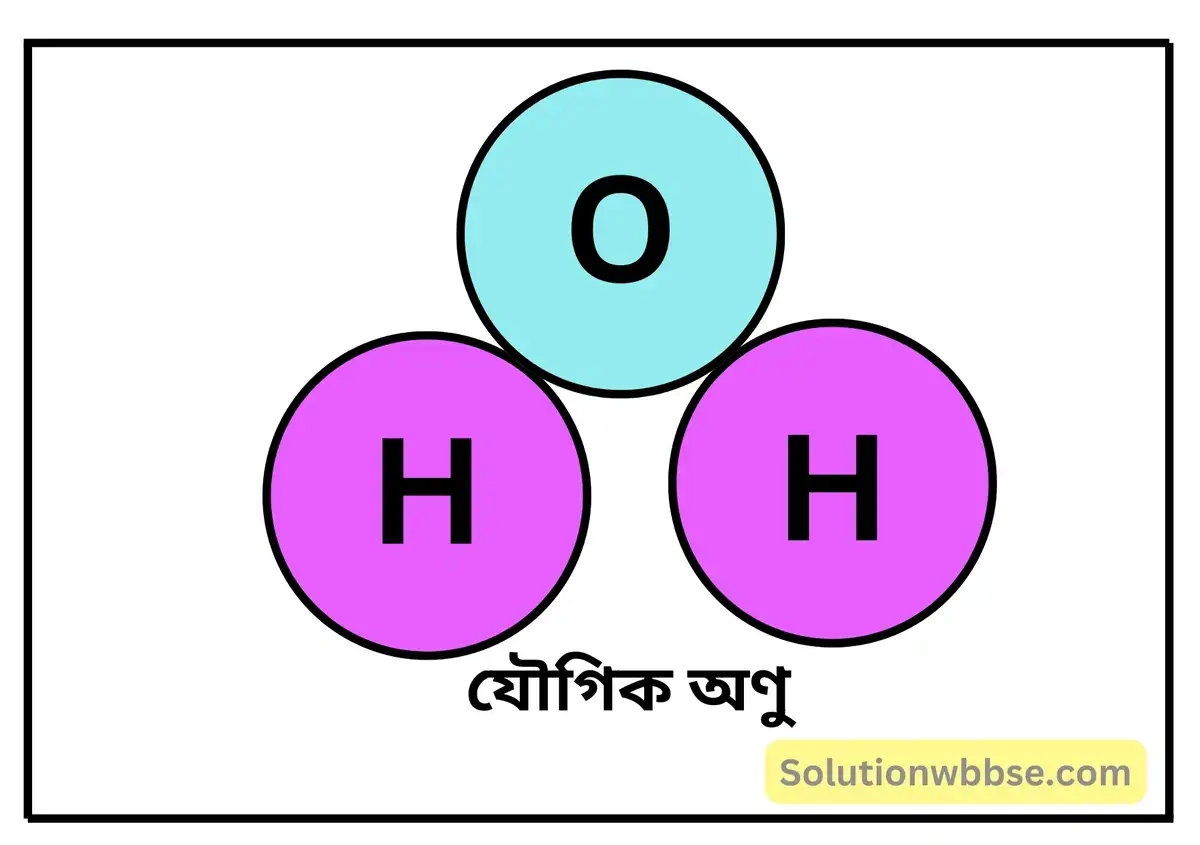
যৌগিক অণু (Compound molecule) – যে-সকল অণু বিভিন্ন মৌলের এক বা একাধিক পরমাণু দ্বারা গঠিত, তাদের যৌগিক অণু বলে। এই যৌগিক অণুতে বিভিন্ন মৌলের পরমাণুগুলি পূর্ণ সংখ্যার সরল অনুপাতে যুক্ত থাকে। যেমন – অ্যামোনিয়া (NH3), কার্বন ডাইঅক্সাইড (CO2), জল (H2O) ইত্যাদি।
অক্সিজেন, অ্যামোনিয়া, নাইট্রোজেন, সালফিউরিক অ্যাসিড, ফসফরাস, বেঞ্জিন, ক্লোরিন, হাইড্রোজেন – অণুগুলির মধ্যে কোনগুলি মৌলিক অণু এবং কোনগুলি যৌগিক অণু তা যুক্তিসহ লেখো।
| অণু | আণবিক সংকেত | অণুর প্রকৃতি | যুক্তি |
| অক্সিজেন | O2 | মৌলিক অণু | একই মৌলের পরমাণু দ্বারা তৈরি |
| অ্যামোনিয়া | NH3 | যৌগিক অণু | দুটি ভিন্ন মৌলের পরমাণু দ্বারা তৈরি |
| নাইট্রোজেন | N2 | মৌলিক অণু | একই মৌলের পরমাণু দ্বারা তৈরি |
| সালফিউরিক অ্যাসিড | H2SO4 | যৌগিক অণু | তিনটি ভিন্ন মৌলের পরমাণু দ্বারা তৈরি |
| ফসফরাস | P4 | মৌলিক অণু | একই মৌলের পরমাণু দ্বারা তৈরি |
| বেঞ্জিন | C6H6 | যৌগিক অণু | দুটি ভিন্ন মৌলের পরমাণু দ্বারা তৈরি |
| ক্লোরিন | Cl2 | মৌলিক অণু | একই মৌলের পরমাণু দ্বারা তৈরি |
| হাইড্রোজেন ক্লোরাইড | HCl | যৌগিক অণু | তিনটি ভিন্ন মৌলের পরমাণু দ্বারা তৈরি |
| নাইট্রিক অ্যাসিড | HNO3 | যৌগিক অণু | তিনটি ভিন্ন মৌলের পরমাণু দ্বারা তৈরি |
পারমাণবিকতা কাকে বলে?
পারমাণবিকতা (Atomicity) – যৌগিক পদার্থের একটি অণু যতগুলি পরমাণু দ্বারা গঠিত, সেই সংখ্যাকে ওই মৌলিক বা যৌগিক পদার্থের পারমাণবিকতা বলে। যেমন – হাইড্রোজেনের একটি অণু দুটি পরমাণু দ্বারা গঠিত। তাই এর পারমাণবিকতা 2। আবার একটি কার্বন ডাইঅক্সাইডের অণু তিনটি পরমাণু (1টি কার্বন ও 2টি অক্সিজেন) দ্বারা গঠিত। তাই এর পারমাণবিকতা 3।
অক্সিজেন, ফসফরাস, অসমিয়াম, সোডিয়াম, সালফার, বোরন, ক্লোরিন, ওজোন, পটাশিয়াম, হাইড্রোজেন – মৌলগুলির পারমাণবিকতা সারণির মাধ্যমে দেখাও।
| মৌলের নাম | চিহ্ন | পারমাণবিকতা | সংকেত |
| অক্সিজেন | O | 2 | O2 |
| ফসফরাস | P | 4 | P4 |
| অসমিয়াম | Os | 8 | Os8 |
| সোডিয়াম | Na | 1 | Na |
| সালফার | S | 8 | S8 |
| বোরন | B | 2 | B2 |
| ক্লোরিন | Cl | 2 | Cl2 |
| ওজোন | O | 3 | O3 |
| পটাশিয়াম | K | 1 | K |
| হাইড্রোজেন | H | 2 | H2 |
এক মোলের সংজ্ঞা দাও।
এক মোল – কোনো পদার্থের যে পরিমাণের মধ্যে পদার্থটির অ্যাভোগাড্রো সংখ্যক (6.022 × 1023) প্রাথমিক কণা যেমন – অণু, পরমাণু, আয়ন, মূলক, ইলেকট্রন ইত্যাদি বর্তমান থাকে, সেই পরিমাণ পদার্থকে ওই পদার্থের এক মোল বলে।
SI পদ্ধতিতে মোলের সংজ্ঞা লেখো।
SI পদ্ধতিতে মোলের সংজ্ঞা – কার্বন-12 আইসোটোপের 0.012 কিলোগ্রামের মধ্যে যত সংখ্যক কার্বন-12 পরমাণু উপস্থিত থাকে, কোনো পদার্থের যে পরিমাণের মধ্যে ঠিক তত সংখ্যক ওর প্রাথমিক কণা বর্তমান, সেই পরিমাণ পদার্থকে ওই পদার্থের এক মোল বলে।
1 মোল পরমাণুতে পরমাণু সংখ্যা → অ্যাভোগাড্রো সংখ্যা
1 মোল অণুতে অণু সংখ্যা → অ্যাভোগাড্রো সংখ্যা
1 মোল আয়নে আয়ন সংখ্যা → অ্যাভোগাড্রো সংখ্যা
মোল শব্দটির উৎপত্তি সম্পর্কে বিজ্ঞানী অস্তয়াল্ডের অবদান কী?
বিজ্ঞানী অস্তয়াল্ড সর্বপ্রথম ‘মোল’ শব্দটি ব্যবহার করেছিলেন। ল্যাটিন শব্দ ‘Moles’ -এর অর্থ ‘Heap’ বা ‘স্তূপ’ যার থেকে মোল’ কথাটির উৎপত্তি।
অ্যাভোগাড্রো সংখ্যার সংজ্ঞা দাও। অ্যাভোগা সংখ্যার আধুনিক সংজ্ঞা দাও। এর মান কত? একে কী দ্বারা প্রকাশ করা হয়?
অ্যাভোগাড্রো সংখ্যা (Avogadro Number) – কোনো পদার্থের এক মোলের মধ্যে উপস্থিত উপাদান কণিকার সংখ্যাকে অ্যাভোগাড্রো সংখ্যা বলা হয়।
আধুনিক সংজ্ঞা – কার্বনের 6C12 সমস্থানিকের 12 গ্রাম পরিমাণ ওজনে যত সংখ্যক কার্বন পরমাণু থাকে, সেই সংখ্যাকে বলা হয় অ্যাভোগাড্রো সংখ্যা (Avogadro Number)।
অ্যাভোগাড্রো সংখ্যার মান হল 6.022 × 1023।
অ্যাভোগাড্রো সংখ্যাকে NA অক্ষর দ্বারা প্রকাশ করা হয়।
ফরাসি পদার্থবিদ জিন ব্যাপটিস্ট পেরিন এবং আমেরিকান পদার্থবিদ রবার্ট মিলিকান অ্যাভোগাড্রো সংখ্যার নির্ণয়ে কীভাবে অবদান রেখেছিলেন?
ফরাসি পদার্থবিদ জিন ব্যাপটিস্ট পেরিন সর্বপ্রথম অ্যাভোগাড্রো সংখ্যাটি কল্পনা করেছিলেন। এরপর আমেরিকান পদার্থবিদ রবার্ট মিলিকান ইলেকট্রনের চার্জ নির্ণয়ের পরীক্ষার দ্বারা অ্যাভোগাড্রো সংখ্যাটি নির্ণয় করেন।
প্রথম কোন্ বিজ্ঞানী অ্যাভোগাড্রো সংখ্যার মান নির্ণয় করেন?
বিজ্ঞানী মিলিকান সর্বপ্রথম অ্যাভোগাড্রো সংখ্যার মান নির্ণয় করেন।
অ্যাভোগাড্রো ধ্রুবক কী? অ্যাভোগাড্রো ধ্রুবকের সঙ্গে অ্যাভোগাড্রো সংখ্যার সম্পর্ক কী?
অ্যাভোগাড্রো ধ্রুবক (Avogadro constant) – অ্যাভোগাড্রো সংখ্যাকে মোলসংখ্যা দ্বারা ভাগ করে যে রাশি পাওয়া যায়, তাকে অ্যাভোগাড্রো ধ্রুবক বলে।
অ্যাভোগাড্রো সংখ্যা ও ধ্রুবকের সম্পর্ক – সাধারণত কোনো পদার্থের 1 mol পরিমাণে উপস্থিত সংগঠক কণিকার (অণু/পরমাণু/আয়ন) সংখ্যাই হল অ্যাভোগাড্রো ধ্রুবক।
∴ \(N_A=6.022\times10^{23}\;mol^{-1}\)
বা, \(N_A=\frac{6.022\times10^{23}}{mol}\)
আবার, আমরা জানি, অ্যাভোগাড্রো সংখ্যা = \(6.022\times10^{23}\) একে সাধারণত ‘\(N\)‘ দিয়ে প্রকাশ করা হয়। তাহলে \(N_A=\frac{6.022\times10^{23}}{mol}=\frac N{mol}\)
বা, \(N_A=\frac{6.022\times10^{23}}{mol}\)
বা, \(N=N_A\times mol\)
∴ অ্যাভোগাড্রো সংখ্যা = অ্যাভোগাড্রো ধ্রুবক × মোলসংখ্যা।
1909 খ্রিস্টাব্দে কোন ফরাসি বিজ্ঞানী অ্যাভোগাড্রো সংখ্যার নাম অ্যাভোগাড্রো ধ্রুবক দেন?
1909 খ্রিস্টাব্দে ফরাসি বিজ্ঞানী পেরিন অ্যাভোগাড্রো সংখ্যার নাম দেন অ্যাভোগাড্রো ধ্রুবক।
অ্যাভোগাড্রো সংখ্যার গুরুত্ব বা প্রয়োজনীয়তা কী?
অথবা, বিজ্ঞানের বিভিন্ন শাখায় অ্যাভোগাড্রো সংখ্যার গুরুত্ব আলোচনা করো।
রসায়নবিদ্যায় অ্যাভোগাড্রো সংখ্যার গুরুত্ব –
- কোনো পদার্থের একটি অণু বা পরমাণুর প্রকৃত ভর নির্ণয় করার ক্ষেত্রে অ্যাভোগাড্রো সংখ্যার প্রয়োজন হয়।
- কোনো পদার্থের নির্দিষ্ট ভরে কতগুলি পরমাণু বা অণু আছে তা অ্যাভোগাড্রো সংখ্যার সাহায্যে নির্ণয় করা যায়।
- অ্যাভোগাড্রো সংখ্যার সাহায্যে মৌল বা যৌগের গ্রাম-পরমাণু, গ্রাম-অণু, পারমাণবিক ভর, আণবিক ভরের মান জানা যায়।
- STP -তে নির্দিষ্ট আয়তনের কোনো গ্যাসীয় পদার্থে উপস্থিত অণু বা পরমাণুর সংখ্যা জানা যায়।
- কোনো কঠিন ধাতুর ঘনত্ব ও গ্রাম-পারমাণবিক ভর জানা থাকলে মৌলটির পারমাণবিক ব্যাসার্ধের আসন্ন মান নির্ণয় করা যায়।
পদার্থবিদ্যায় অ্যাভোগাড্রো সংখ্যার গুরুত্ব –
- সর্বজনীন গ্যাস ধ্রুবক (R) এবং বোলজম্যান ধ্রুবক (KB) -এর মধ্যে সম্পর্ক স্থাপন করে অ্যাভোগাড্রো সংখ্যা।
- কোয়ান্টাম পদার্থবিদ্যা, পদার্থের কেলাস গঠন সংক্রান্ত পদার্থবিদ্যায় অ্যাভোগাড্রো সংখ্যার ধারণা খুবই গুরুত্বপূর্ণ।
- অ্যাভোগাড্রো সংখ্যার সাহায্যে একটি ইলেকট্রনের চার্জ ও 1 ফ্যারাডের মধ্যে সম্পর্ক স্থাপন করা যায়।
- অ্যাভোগাড্রো সংখ্যার সাহায্যে গ্যাসীয় পদার্থের আণবিক ভর নির্ণয় করে, তাকে 2 দিয়ে ভাগ করে গ্যাসীয় পদার্থের বাষ্প ঘনত্বের মান পাওয়া যায়।
জীববিদ্যায় অ্যাভোগাড্রো সংখ্যার গুরুত্ব –
- সালোক-সংশ্লেষের জন্য উদ্ভিদের অত্যন্ত প্রয়োজনীয় উপাদান ক্লোরোফিলে 2.68% ম্যাগনেশিয়াম ধাতু থাকে। 1 গ্রাম ক্লোরোফিলে কতগুলি ম্যাগনেশিয়াম পরমাণু উপস্থিত, তা অ্যাভোগাড্রো সংখ্যার সাহায্যে জানা যায়।
- DNA, RNA প্রভৃতি আণুবীক্ষণিক জৈব বস্তুর গঠন ও রাসায়নিক বিশ্লেষণে অ্যাভোগাড্রো সংখ্যার প্রয়োগ দেখা যায়।
- বেকারিতে কীভাবে পাঁউরুটি প্রস্তুত করা যায় তার ধারণা পাওয়া যায়।
অ্যাভোগাড্রো সংখ্যা আণুবীক্ষণিক ও দৃশ্যমান জগতের মধ্যে যোগসূত্র রচনা করে – ব্যাখ্যা করো।
আণুবীক্ষণিক জগতে উপস্থিত অণু, পরমাণু, আয়ন প্রভৃতি অতি ক্ষুদ্র কণিকা হওয়ায় এদের শক্তিশালী অণুবীক্ষণ যন্ত্রের সাহায্যে দেখা যায় না। এই ধরনের ক্ষুদ্র কণিকা যাদের চোখে দেখা যায় না, অ্যাভোগাড্রো সংখ্যার সাহায্যে নির্দিষ্ট পরিমাণ পদার্থে তাদের সংখ্যা নির্ভুলভাবে নির্ণয় করা যায়। কারণ – অ্যাভোগাড্রো সংখ্যক অর্থাৎ, 6.022 × 1023 সংখ্যক অণু বা পরমাণু যে পরিমাণ পদার্থে উপস্থিত তা আমরা খালি চোখে দেখতে পাই। যেমন – 1 চামচ জলকে আমরা চোখে দেখতে পাই। কিন্তু ওই পরিমাণ জলে কতগুলি জলের অণু উপস্থিত তা চোখে দেখা যায় না। 1 চামচ জল যদি 1 গ্রাম-অণু জল বা 1 মোল জল বা 18 গ্রাম জলের সমান হয়, তাহলে অ্যাভোগাড্রো সংখ্যার ধারণা অনুযায়ী আমরা বলতে পারি, 1 চামচ জলে অ্যাভোগাড্রো সংখ্যক বা 6.022 × 1023 সংখ্যক জলের অণু উপস্থিত। সুতরাং, অ্যাভোগাড্রো সংখ্যা আণুবীক্ষণিক জগতের অতিশয় ক্ষুদ্র কণিকা এবং তাদের পরিমাণের মধ্যে সম্পর্ক স্থাপন করে আমাদের কাছে বোধগম্য করে তোলে। স্পষ্টতই, অ্যাভোগাড্রো সংখ্যা আণুবীক্ষণিক ও দৃশ্যমান জগতের মধ্যে যোগসূত্র রচনা করে।
অ্যাভোগাড্রো সংখ্যার কয়েকটি প্রয়োগ লেখো।
অ্যাভোগাড্রো সংখ্যার প্রয়োগগুলি নিম্নরূপ –
- অ্যাভোগাড্রো সংখ্যার সাহায্যে অণুর প্রকৃত ভর নির্ণয় করা যায়।
- পরমাণুর প্রকৃত ভর নির্ণয় করা যায়।
- কোনো পদার্থের নির্দিষ্ট ভরে উপস্থিত অণুর সংখ্যা নির্ণয় করা যায়।
C-12 স্কেল অনুযায়ী পারমাণবিক ভরের সংজ্ঞা দাও।
C-12 স্কেলে পারমাণবিক ভর (Atomic Mass in Carbon Scale) – কোনো মৌলের একটি পরমাণু একটি 12C পরমাণুর প্রকৃত ভরের অংশের তুলনায় যত গুণ ভারী, সেই সংখ্যাকে ওই মৌলের পারমাণবিক ভর বলে।
অর্থাৎ, মৌলের পারমাণবিক ভর
=
=
দুটি ভরের অনুপাত হওয়ায়, এটি একটি এককবিহীন রাশি।
পারমাণবিক ভর একক কাকে বলে?
অথবা, সংহত পারমাণবিক ভর এককের সংজ্ঞা দাও। 1 amu -এর মান লেখো।
পারমাণবিক ভর একক (Atomic mass unit) – যে এককের মাধ্যমে কোনো মৌলের পরমাণুর প্রকৃত ভরকে প্রকাশ করা হয় এবং যার মান একটি 12C পরমাণুর প্রকৃত ভরের অংশের সমান, তাকে পারমাণবিক ভর একক বা সংহত পারমাণবিক ভর একক (Unified atomic mass unit) বলা হয়।
∴ 1 পারমাণবিক ভর একক (বা 1u) = \(\frac1{12}\) × 1 টি 12C পরমাণুর প্রকৃত ভর
= 1.6605 × 10-24 g
[amu atomic mass unit]
[u – unified atomic mass unit]
1 amu বা 1u = 1.6605 × 10-24 g।
মৌলের একটি পরমাণুর ভরের সঙ্গে amu -এর সম্পর্ক লেখো।
মৌলের একটি পরমাণুর প্রকৃত ভর = মৌলের পারমাণবিক ওজন × 1 amu বা বলা যায় মৌলের একটি পরমাণুর প্রকৃত ভর = (মৌলের পারমাণবিক ওজন × 1.6605 × 10-24) গ্রাম।
যেমন – একটি অক্সিজেন পরমাণুর প্রকৃত ভর
= অক্সিজেনের পারমাণবিক ওজন × 1.6605 × 10-24
= 16 × 1.6605 × 10-24 গ্রাম।
হাইড্রোজেন স্কেল ও 0-16 স্কেলের সাপেক্ষে পারমাণবিক ভরের সংজ্ঞা দাও।
হাইড্রোজেন স্কেলের সাপেক্ষে পারমাণবিক ভর (Atomic Mass in Hydrogen Scale) – কোনো মৌলের একটি পরমাণু একটি হাইড্রোজেন পরমাণুর তুলনায় যতগুণ ভারী, সেই সংখ্যাকে ওই মৌলের পারমাণবিক ভর বলে। অর্থাৎ, হাইড্রোজেনের সাপেক্ষে পারমাণবিক ভর
=
অক্সিজেন – 16 স্কেলের সাপেক্ষে পারমাণবিক ভর (Atomic Mass in Oxygen Scale) – কোনো মৌলের একটি পরমাণু একটি অক্সিজেন – 16 সমস্থানিকের পরমাণুর ওজনের \(\frac1{16}\) অংশের তুলনায় যতগুণ ভারী, সেই সংখ্যাকে ওই মৌলের পারমাণবিক ভর বলে।
কোন বিজ্ঞানী হাইড্রোজেন স্কেলের প্রবক্তা?
বিজ্ঞানী জন ডালটন হলেন হাইড্রোজেন স্কেলের প্রবক্তা।
পারমাণবিক ভর এককহীন রাশি কেন?
পারমাণবিক ভর প্রকৃতপক্ষে দুটি ভরের অনুপাত। এটি একটি তুলনামূলক সংখ্যা। তাই এটি একটি একক বিহীন রাশি।
1 amu = কত গ্রাম?
6.022 × 1023 সংখ্যক 12C পরমাণুর প্রকৃত ভর 12g
∴ 1টি সংখ্যক 12C পরমাণুর প্রকৃত ভর = \(\frac{12}{6.22\times10^{23}}\) g
1 amu \(=\frac1{12}\times\frac{12}{6.22\times10^{23}}=1.6605\times10^{-24}\) g
মৌলের পরমাণুর পারমাণবিক ভর আপেক্ষিক হয় কেন?
প্রকৃতিতে প্রায় সব মৌলই একাধিক আইসোটোপের মিশ্রণ রূপে বর্তমান। প্রকৃতিজাত কোনো নির্দিষ্ট মৌলে তার আইসোটোপগুলির প্রাচুর্যের অনুপাত মোটামুটি নির্দিষ্ট। মৌলের পারমাণবিক ভর নির্ণয়ের সময় প্রকৃতিতে উপস্থিত উক্ত মৌলের সব আইসোটোপের পারমাণবিক ভরের আনুপাতিক গড় নেওয়া হয়। যদিও বিভিন্ন আইসোটোপের পারমাণবিক ভর প্রায় পূর্ণসংখ্যা হয়, কিন্তু তা সত্ত্বেও তাদের প্রাচুর্য অনুযায়ী গড় নেওয়ার ফলে মৌলটির পারমাণবিক ভরের প্রাপ্ত মান পূর্ণসংখ্যা না হয়ে ভগ্নাংশে হয়। যেমন – প্রকৃতিতে হাইড্রোজেনের তিনটি আইসোটোপ বর্তমান প্রোটিয়াম (1H1), ডয়টেরিয়াম (1H2) এবং ট্রিটিয়াম (1H3)। প্রকৃতিতে আইসোটোপগুলির প্রাচুর্য যথাক্রমে 99%, 0.9% এবং 0.1%।
সুতরাং, হাইড্রোজেনের পারমাণবিক গুরুত্ব
= \(\frac{1\times99+2\times0.9+3\times0.1}{100}\)
= 1.011 (ভগ্নাংশ)
[মনে রাখা দরকার যে, মৌলের পারমাণবিক ভর বা পারমাণবিক গুরুত্ব বা পারমাণবিক ওজন একই অর্থ বহন করে।]
মৌলের পরমাণুর পারমাণবিক ভর আপেক্ষিক হয় কেন?
কোনো মৌলের একটি পরমাণুর ভর খুবই নগণ্য (10-24 – 10-27 g) হওয়ায় এটি নির্ণয় করা অত্যন্ত অসুবিধাজনক। এজন্য রসায়নবিদরা পরিমাপ ও গণনার সুবিধার্থে মৌলের একটি পরমাণুর ভর নির্ণয় করার জন্য বিশেষ কিছু মৌলকে প্রমাণ হিসেবে (যেমন – H1, O16, C12 ইত্যাদি পরমাণু) ধরে, উক্ত মৌলের ভরের সঙ্গে তুলনা করে পারমাণবিক ভর নির্ণয়ের ব্যবস্থা করেন। অর্থাৎ, কোনো মৌলের পারমাণবিক ভর, প্রমাণ মৌলের পরমাণুর ভরের সঙ্গে তুলনা করে নির্ণয় করা হয়।
একটি নাইট্রোজেন পরমাণুর প্রকৃত ভর নির্ণয় করো।
একটি নাইট্রোজেনের পরমাণুর প্রকৃত ভর
= নাইট্রোজেনের পারমাণবিক ভর × 1 u
= 14 × 1.6605 × 10-24 g
= 23.247 × 10-24 g
পারমাণবিক ভর এককের মান কীরূপে নির্ণয় করা যায়?
কোনো মৌলের পরমাণুর প্রকৃত ভরকে পারমাণবিক ভর এককে প্রকাশ করা হয়।
C-12 স্কেলে পারমাণবিক ভর এককের (amu) মান
= \(\frac1{12}\) × 1টি 12C পরমাণুর ভর
= \(\frac1{12}\times\frac{12}{6.022\times10^{23}}\) গ্রাম
= \(\frac1{6.022\times10^{23}}\) গ্রাম
= 1.6605 × 10-24 গ্রাম
∴ 1 amu (পারমাণবিক ভর একক) = 1.6605 × 10-24 গ্রাম।
ক্লোরিনের একটি আইসোটোপ একটি 12C আইসোটোপের \(\frac1{12}\) ভরের অংশ অপেক্ষা 35 গুণ ভারী। ক্লোরিনের আইসোটোপটির প্রকৃত ভর কত?
ক্লোরিনের আইসোটোপটি একটি 12C আইসোটোপের ভরের \(\frac1{12}\) অংশ অপেক্ষা 35 গুণ ভারী, সুতরাং ক্লোরিনের আইসোটোপটির পারমাণবিক ভর 35।
সুতরাং, ক্লোরিনের আইসোটোপটির প্রকৃত ভর
= ক্লোরিনের আইসোটোপটির ভর × 1 amu
= 35.5 × 1.6605 × 10-24 g
= 58.947 × 10-24 g
গ্রাম-পরমাণু কাকে বলে?
কোনো মৌলিক পদার্থের যে পরিমাণের মধ্যে 6.022 × 1023 সংখ্যক পরমাণু থাকে, গ্রামে প্রকাশিত সেই পরিমাণকে ওই পদার্থের এক গ্রাম-পরমাণু বলে।
যেমন 1 গ্রাম-পরমাণু অক্সিজেন = 16 গ্রাম অক্সিজেন = 6.022 × 1023 সংখ্যক অক্সিজেন।
গ্রাম-পারমাণবিক ভর বলতে কী বোঝায়?
গ্রাম-পারমাণবিক ভর (Gram Atomic Mass) – কোনো মৌলের পারমাণবিক ভরকে গ্রাম এককে প্রকাশ করলে যত গ্রাম হয়, তত গ্রাম ভরকে ওই মৌলের গ্রাম-পারমাণবিক ভর বলে। যেমন – নাইট্রোজেনের গ্রাম-পারমাণবিক ভর 14g। গ্রাম-পারমাণবিক ভরের একক হল গ্রাম।
মৌলের পারমাণবিক ভর ও গ্রাম-পারমাণবিক ভর লেখো?
| মৌলের নাম | পারমাণবিক ভর | গ্রাম-পারমাণবিক ভর |
| হাইড্রোজেন (H) | 1.008 | 1.008 g |
| কার্বন (C) | 12 | 12 g |
| নাইট্রোজেন (N) | 14 | 14 g |
| অক্সিজেন (O) | 16 | 16 g |
| সোডিয়াম (Na) | 23 | 23 g |
| ম্যাগনেশিয়াম (Mg) | 24 | 24 g |
| অ্যালুমিনিয়াম (Al) | 27 | 27 g |
| ফসফরাস (P) | 31 | 31 g |
| সালফার (S) | 32 | 32 g |
| ক্লোরিন (Cl) | 35.5 | 35.5 g |
| পটাশিয়াম (K) | 39 | 39 g |
| ক্যালশিয়াম (Ca) | 40 | 40 g |
| আয়রন (Fe) | 56 | 56 g |
| কপার (Cu) | 63.5 | 63.5 g |
| জিংক (Zn) | 65 | 65 g |
0.08 গ্রাম-পরমাণু সোডিয়াম বলতে কী বোঝায়?
সোডিয়ামের গ্রাম-পারমাণবিক ওজন = 23 g
সুতরাং, 1 গ্রাম-পরমাণু সোডিয়াম = 23 g
∴ 0.08 গ্রাম-পরমাণু সোডিয়াম = 23 × 0.08 g
= 1.84 g।
2.1 গ্রাম নাইট্রোজেনে গ্রাম-পরমাণুর সংখ্যা নির্ণয় করো।
1 গ্রাম-পরমাণু নাইট্রোজেন 14 গ্রাম
অর্থাৎ, 14 গ্রাম নাইট্রোজেন = 1 গ্রাম-পরমাণু
∴ 2.1 গ্রাম নাইট্রোজেন = \(\frac{2.1}{14}\)
= 0.15 গ্রাম-পরমাণু।
অক্সিজেন স্কেলে (16O) কোনো পদার্থের আণবিক গুরুত্বের সংজ্ঞা দাও।
অক্সিজেন স্কেলে পদার্থের আণবিক গুরুত্ব – কোনো মৌল বা যৌগের একটি অণু একটি অক্সিজেন পরমাণুর (16O) ওজনের \(\frac1{12}\) অংশের তুলনায় যত গুণ ভারী, সেই তুলনামূলক সংখ্যাকে ওই মৌল বা যৌগের আণবিক গুরুত্ব বলে।
কার্বন স্কেলে (12C) কোনো পদার্থের আণবিক গুরুত্বের সংজ্ঞা দাও।
কার্বন স্কেলে পদার্থের আণবিক গুরুত্ব – কোনো মৌল বা যৌগের একটি অণু একটি কার্বন – 12 (C12) পরমাণুর ওজনের \(\frac1{12}\) অংশের চেয়ে যত গুণ ভারী সেই তুলনামূলক সংখ্যাকে ওই মৌল বা যৌগের আণবিক গুরুত্ব বলে।
অ্যামোনিয়ার আণবিক ভর 17 বলতে কী বোঝায়?
অ্যামোনিয়ার আণবিক ভর 17 বলতে বোঝায় অ্যামোনিয়ার একটি অণু 1টি 12C পরমাণুর ওজনের \(\frac1{12}\) অংশের তুলনায় 17 গুণ ভারী।
মৌলের আণবিক গুরুত্ব ও পারমাণবিক গুরুত্বের মধ্যে কী সম্পর্ক? কোনো মৌলের পারমাণবিক ভর ও আণবিক ভর একই হতে পারে কি? যুক্তি দাও।
কোনো মৌলের পারমাণবিক গুরুত্বকে ওই মৌলের পারমাণবিকতা দিয়ে গুণ করলে ওই মৌলের আণবিক গুরুত্ব পাওয়া যায়।
মৌলের আণবিক গুরুত্ব = মৌলের পারমাণবিক গুরুত্ব × পারমাণবিকতা।
যদি মৌলের পারমাণবিকতা = 1 হয় তখন,
আণবিক গুরুত্ব = পারমাণবিক গুরুত্ব হবে।
অর্থাৎ, যারা এক-পরমাণুক তাদের ক্ষেত্রে আণবিক গুরুত্ব এবং পারমাণবিক গুরুত্ব সমান হবে। যেমন – হিলিয়াম, সোডিয়াম, ক্যালশিয়াম ইত্যাদি।
গ্রাম-অণু বা গ্রাম-মোল বলতে কী বোঝায়?
গ্রাম-অণু বা গ্রাম-মোল (Gram-Molecule) – মৌলিক বা যৌগিক পদার্থের আণবিক ভরকে গ্রাম এককে প্রকাশ করলে যত গ্রাম হয়, তত গ্রাম ভরের পদার্থকে ওই পদার্থের এক গ্রাম-অণু বা এক গ্রাম-মোল বলে। যেমন – এক গ্রাম-অণু নাইট্রোজেন ও অ্যামোনিয়া বলতে যথাক্রমে 28 গ্রাম নাইট্রোজেন ও 17 গ্রাম অ্যামোনিয়াকে বোঝায়।
গ্রাম-আণবিক ভর কাকে বলে?
গ্রাম-আণবিক ভর – কোনো মৌলিক বা যৌগিক পদার্থের আণবিক ভরকে গ্রাম এককে প্রকাশ করলে যত গ্রাম হয়, তত গ্রাম ভরের পদার্থকে ওই পদার্থের গ্রাম-আণবিক ভর বলে। যেমন – কার্বন ডাইঅক্সাইডের আণবিক ভর = 44, কার্বন ডাইঅক্সাইডের গ্রাম-আণবিক ভর = 44 গ্রাম।
3 গ্রাম-অণু CO2 বলতে কী পরিমাণ CO2 বোঝায়?
1 গ্রাম-অণু CO2 = 44 গ্রাম CO2
3 গ্রাম-অণু CO2 = 44 × 3 গ্রাম CO2 = 132 গ্রাম CO2।
NTP -তে কোনো গ্যাসের মধ্যে 1 গ্রাম-অণুতে উপস্থিত অণুর সংখ্যা কত?
NTP -তে কোনো গ্যাসের এক গ্রাম-অণুতে উপস্থিত অণুর সংখ্যা = 6.022 × 1023।
দেখাও যে, ভিন্ন আণবিক ভরবিশিষ্ট দুটি পদার্থের সমভরে অণুসংখ্যার অনুপাত ওদের আণবিক ভরের বিপরীত অনুপাতের সমান হয়।
ধরি, A ও B পদার্থ দুটির আণবিক ভর যথাক্রমে MA ও MB এবং পদার্থদ্বয়ের ভর = W গ্রাম।
আমরা জানি, 1 গ্রাম-অণু যে-কোনো পদার্থে অণুর সংখ্যা = 6.022 × 1023
অর্থাৎ, A পদার্থের MA গ্রাম পরিমাণে অণুর সংখ্যা = 6.022 × 1023
অর্থাৎ, A পদার্থের W গ্রাম পরিমাণে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times W}{M_A}\)
অনুরূপে, B পদার্থের W গ্রাম পরিমাণে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times W}{M_B}\)
অতএব, সমভরের পদার্থদ্বয়ের (A ও B) অণু সংখ্যার অনুপাত = \(\frac{6.022\times10^{23}\times W}{M_A}:\frac{6.022\times10^{23}\times W}{M_B}\)
= \(\frac1{M_A}:\frac1{M_B}\)
= \(M_B:M_A\)
সুতরাং, ভিন্ন আণবিক ভরবিশিষ্ট কিন্তু সমভরের দুটি পদার্থের অণুসংখ্যার অনুপাত তাদের আণবিক ভরের বিপরীত অনুপাতের সমান।
আপেক্ষিক পারমাণবিক ভর নির্ণয়ে হাইড্রোজেনের পরিবর্তে 12C -কে বর্তমানে প্রামাণ্য মৌল হিসেবে ধরার কারণ কী?
বিজ্ঞানী নীর (Nier) এবং ওলানডু (Olandu) 1957 সালে আপেক্ষিক পারমাণবিক ভর নির্ণয়ের C-12 স্কেলটি প্রবর্তন করেন, যা 1961 সালে IUPAC দ্বারা স্বীকৃত হয়। এই স্কেল অনুযায়ী,
বর্তমানে মৌলের আপেক্ষিক পারমাণবিক ভর নির্ণয়ে হাইড্রোজেনের পরিবর্তে C-12 স্কেলকে বেশি প্রাধান্য দেওয়া হয়।
কারণ –
- কার্বনের 12C আইসোটোপের পারমাণবিক ভর (12.00) পূর্ণসংখ্যায় হওয়ায় অন্যান্য মৌলের পারমাণবিক ভর গণনায় সুবিধা হয়।
- কার্বন প্রকৃতিতে সহজলভ্য এবং সংরক্ষণযোগ্য এবং
- ভর-বর্ণালি (Mass spectroscopy) বিশ্লেষণের কাজে কার্বন ব্যবহার করা হয়।
সোডিয়ামের পারমাণবিক গুরুত্ব 23 – কথাটির অর্থ কী?
সোডিয়ামের পারমাণবিক গুরুত্ব 23 কথাটির অর্থ – সোডিয়ামের একটি পরমাণু একটি 12C আইসোটোপের প্রকৃত ভরের \(\frac1{12}\) অংশের তুলনায় 23 গুণ ভারী।’
= \(\frac{23\;amu}{12\;amu}\times12=23\)
= \(23\)
∴ সোডিয়ামের পারমাণবিক গুরুত্ব = \(23\)।
মোলার আয়তন বা গ্রাম-আণবিক আয়তনের সংজ্ঞা দাও। NTP-তে মোলার আয়তনের মান কত? এর মান কীসের ওপর নির্ভর করে।
মোলার আয়তন (Molar volume) – প্রমাণ চাপ ও উষ্ণতায় এক গ্রাম-অণু পরিমাণ যে-কোনো গ্যাস যে পরিমাণ আয়তন দখল করে, তাকে ওই গ্যাসের মোলার আয়তন বা গ্রাম-আণবিক আয়তন (Gram molecular volume) বলে।
NTP বা প্রমাণ চাপ ও উষ্ণতায় গ্রাম-আণবিক আয়তন বা মোলার আয়তনের মান 22.4 L বা 22400 cc।
মোলার আয়তনের মান গ্যাসের চাপ ও উষ্ণতার ওপর নির্ভর করে।
মোল ধারণার উপযোগিতা লেখো।
মোল ধারণার উপযোগিতা-
- মোলসংখ্যার দ্বারা বিভিন্ন রাসায়নিক বিক্রিয়া প্রকাশ করা এবং রাসায়নিক গণনার কাজ সহজে করা যায়।
- কোনো পদার্থে উপস্থিত অণু, পরমাণু বা আয়নের সংখ্যা জানা যায়।
- দ্রবণে দ্রাবের কণার সংখ্যা বা দ্রবণের গাঢ়ত্ব প্রকাশে ব্যবহার করা হয়।
- পদার্থের পরিমাণ তথা গ্যাসের আয়তন মোলসংখ্যা থেকে জানা যায়।
NTP -তে 2 g H2 14 g N2, 32g O2 -এর আয়তন কি সমান হবে? যুক্তি দাও।
NTP -তে 2 g H2, 14 g N2, 32 g O2 -এর আয়তন সমান হবে না।
আমরা জানি, NTP -তে কোনো গ্যাসের এক গ্রাম-অণু অর্থাৎ, গ্রাম আণবিক গুরুত্বের সমান ওজনের আয়তন 22.4 L
এখন, 2 g H2 = 1 গ্রাম-অণু H2, অর্থাৎ, 1 মোল H2
∴ 1 মোল H2 -এর আয়তন = 22.4 L
N2 -এর আণবিক গুরুত্ব = 28 g N2 = 1 মোল N2
∴ 14g N2 = \(\frac12\) মোল N2
NTP -তে 28 g N2 -এর আয়তন = 22.4 L
∴ 14 g N2 -এর আয়তন = \(\frac{22.4\times14}{28}=11.2\)
অক্সিজেনের আণবিক গুরুত্ব = 32 g
∴ 32 g O2 = 1 মোল O2
∴ 1 মোল O2 -এর আয়তন = 22.4 L
সুতরাং, 2 g H2 এবং 32 g O2 -এর আয়তন (22.4 L) সমান হবে এবং 14 g N2 -এর আয়তন (11.2 L) আলাদা হবে।
STP -তে কোনো গ্যাসীয় পদার্থের মোলার আয়তনের সঙ্গে ওই পদার্থটির গ্রাম-আণবিক ভর বা গ্রাম-অণুর সম্পর্ক কী?
STP -তে 1 মোল অণুর আয়তন STP -তে মোলার আয়তন = 22.4 L
কোনো মৌলিক বা যৌগিক পদার্থের 1 মোল-অণু বলতে ওই মৌলিক বা যৌগিক পদার্থের 6.022 × 1023 সংখ্যক অণুকে বোঝায়। আবার, কোনো মৌলিক বা যৌগিক পদার্থের 6.022 × 1023 সংখ্যক অণুর ভর = ওই মৌলিক বা যৌগিক পদার্থের গ্রাম-আণবিক ভর বা 1 গ্রাম-অণু। সুতরাং কোনো মৌলিক বা যৌগিক পদার্থের 1 মোল-অণু = ওই মৌলিক বা যৌগিক পদার্থের 1 গ্রাম-অণু।
উপরের আলোচনা থেকে এই সিদ্ধান্তে উপনীত হওয়া যায় যে, STP -তে যে-কোনো গ্যাসের 1 গ্রাম-অণু পরিমাণ 22.4 L আয়তন দখল করে। যেমন – এক গ্রাম-অণু N2 = 28 g, এক গ্রাম-অণু হাইড্রোজেন = 2 g, এক গ্রাম-অণু CO2 = 44 গ্রাম। STP -তে 28 g N2 বা 2g H2 বা 44 g CO2 গ্যাস 22.4 L আয়তন দখল করে।
56 g N2 ও 44 g CO2 গ্যাসের মধ্যে কোনটি এক্ষেত্রে বেশি আয়তন দখল করে?
56 g N2 = \(\frac{56}{28}\) = 2 mol N2 (N2 -এর আণবিক গুরুত্ব = 28)
44 g CO2 = \(\frac{44}{44}\) = 1 mol CO2 (CO2 -এর আণবিক গুরুত্ব = 44)। STP -তে 1 মোল যে-কোনো মৌলিক বা যৌগিক গ্যাসীয় পদার্থের আয়তন সর্বদা 22.4 L হয়।
সুতরাং, STP -তে 56 g N2 (বা 2 mol N2) 22.4 × 2 = 44.8 L আয়তন দখল করে এবং STP -তে 44 g CO2 (বা 1 mol CO2) 22.4 L আয়তন দখল করে।
অর্থাৎ, একই চাপ ও উষ্ণতায় 56 g N2 সর্বদা 44 g CO2 অপেক্ষা বেশি আয়তন দখল করে।
গ্যাসের মোলার আয়তন ও প্রমাণ মোলার আয়তনের সম্পর্ক কী?
নির্দিষ্ট চাপ ও উষ্ণতায় 1 মোল যে-কোনো মৌলিক বা যৌগিক গ্যাসীয় পদার্থের আয়তনকে ওই গ্যাসের মোলার আয়তন বলে। যেমন – চাপ ও উষ্ণতার ওপর নির্ভর করে 1 মোল CO2 গ্যাসের আয়তন 22.4 L -এর কম বা বেশি হতে পারে।
আবার, প্রমাণ চাপ ও উষ্ণতায় অর্থাৎ, STP -তে 1 মোল গ্যাসীয় পদার্থের আয়তনকে প্রমাণ মোলার আয়তন বলে। প্রমাণ চাপ ও উষ্ণতায় (STP -তে) যে-কোনো মৌলিক বা যৌগিক গ্যাসের মোলার আয়তনের মান সবর্দা 22.4 L. হয়।
যেমন – 1 মোল CO2 গ্যাসের প্রমাণ মোলার আয়তন 22.4 L
বিভিন্ন গ্যাসের গ্রাম আণবিক ভর, মোল সংখ্যা ও STP -তে আয়তন লেখ।
| গ্যাস | গ্রাম-আণবিক ভর | মোল | অণু সংখ্যা | STP -তে আয়তন |
| হাইড্রোজেন (H2) | 2 × 1 = 2 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| নাইট্রোজেন (N2) | 2 × 14 = 28 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| অক্সিজেন (O2) | 2 × 16 =32 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| ক্লোরিন (CI2) | 2 × 35.5 = 71 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| অ্যামোনিয়া (NH3) | 14 + (1 × 3) = 17 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| মিথেন (CH4) | 12 + (1 × 4) = 16 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| কার্বন ডাইঅক্সাইড (CO2) | 12 + (16 × 2) = 44 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| সালফার ডাইঅক্সাইড (SO2) | 32 + (16 × 2) = 64 g | 1 | 6.022 × 1023 | 22.4 লিটার |
| নাইট্রোজেন ডাইঅক্সাইড (NO2) | 14 + (16 × 2) = 46 g | 1 | 6.022 × 1023 | 22.4 লিটার |
মোলার ভর কাকে বলে? ভর, মোলার ভর ও মোলসংখ্যা কীভাবে পরস্পরের সঙ্গে সম্পর্কিত?
মোলার ভর (Molar Mass) – কোনো পদার্থের 1 মোলের অর্থাৎ, অ্যাভোগাড্রো সংখ্যক উপাদান কণিকার (অণু, পরমাণু বা আয়ন) ভরকে মোলার ভর বলা হয়। যেমন – কার্বন ডাইঅক্সাইডের গ্রাম-আণবিক ভর = 44 g অর্থাৎ CO2 -এর মোলার ভর = 44 g⋅mol-1। আবার সোডিয়ামের গ্রাম-পারমাণবিক ভর = 23 g অর্থাৎ, সোডিয়ামের মোলার ভর = 23 g⋅mol-1।
যেমন – 64 g অক্সিজেনের মোলসংখ্যা = \(\frac{64\;g}{32\;g}=2\;g\)।
[অক্সিজেনের গ্রাম-আণবিক ভর বা মোলার ভর = 32 g]।
কোন্ ক্ষেত্রে মোলার ভর, গ্রাম-পারমাণবিক ভরের সমান হবে? একটি উদাহরণ দিয়ে বোঝাও।
যে-কোনো পদার্থের 1 মোল অর্থাৎ 6.022 × 1023 সংখ্যক উপাদান কণা অণু, পরমাণু বা আয়ন ইত্যাদির ভরকে ওই পদার্থের মোলার ভর বলে।
যেসব পদার্থ প্রকৃতিতে পারমাণবিক অবস্থায় মুক্তভাবে অবস্থান করে (যেমন He, Ne, Ar, Kr, Xe, Rn প্রভৃতি নিষ্ক্রিয় গ্যাসসমূহ বা Na, K প্রভৃতি ধাতব মৌল) তাদের ক্ষেত্রে মোলার ভরের মান, গ্রাম-পারমাণবিক ভরের মানের সমান হয়।
যেমন – হিলিয়ামের মোলার ভর = 4 g = গ্রাম-পারমাণবিক ভর (He -এর পারমাণবিক ভর = 4)
আবার, সোডিয়ামের মোলার ভর = 23 g = গ্রাম-পারমাণবিক ভর (Na -এর পারমাণবিক ভর = 23)
[যেসব পদার্থের পারমাণবিকতা 1, তাদের ক্ষেত্রে মোলার ভর = গ্রাম-পারমাণবিক ভর]
H, N ও O -এর পারমাণবিক ভর যথাক্রমে 1u, 14u ও 16u হলে HNO3 -এর মোলার ভর কত?
HNO3 -এর মোলার ভর = 1u + 14u + (3 × 16) u = 63 u।
সংকেত ভর বা সংকেত ওজন বলতে কী বোঝায়?
সংকেত ভর (Formula weight) – কোনো আয়নীয় যৌগ যে সংকেত দ্বারা প্রকাশিত হয় সেই সংকেতে উপস্থিত পরমাণুসমূহের পারমাণবিক ভরের সমষ্টিকে পদার্থটির সংকেত ভর বলা হয়। যেমন – সোডিয়াম ক্লোরাইডের (NaCl) সংকেত ভর = 23 + 35.5 = 58.5।
আণবিক ভর ও সংকেত ভর সর্বদা সমার্থক নয় – ব্যাখ্যা করো।
মৌল বা যৌগের আণবিক সংকেত থেকে আণবিক ভর নির্ণয় করা হয়। তাই অনেক সময় সংকেত ভরকে আণবিক ভরও বলা হয়। কিন্তু এই দুটি শব্দ সবসময় সমার্থক হয় না।
যেসব পদার্থের অণুর প্রকৃত অস্তিত্ব আছে তাদের ক্ষেত্রে আণবিক ভর ও সংকেত ভর শব্দ দুটি সমার্থক। কিন্তু আয়নীয় যৌগ, যাদের অণুর কোনো অস্তিত্ব নেই তাদের ক্ষেত্রে শুধুমাত্র সংকেত ভর কথাটি প্রযোজ্য। সুতরাং, আয়নীয় যৌগের ক্ষেত্রে সংকেত ভর ও আণবিক ভর শব্দ দুটি সমার্থক নয়।
যেমন – গ্লুকোজের অণুর পৃথক অস্তিত্ব আছে, তাই এক্ষেত্রে আণবিক ভর ও সংকেত ভর 180। কিন্তু NaCl যৌগের অণুর প্রকৃত অস্তিত্ব না থাকায়, NaCl -এর আণবিক ভর 58.5 -এর পরিবর্তে NaCl -এর সংকেত ভর (23 + 35.5) = 58.5 ব্যবহৃত হয়।
আয়নীয় যৌগের ক্ষেত্রে আণবিক ভর ও সংকেত ভরের মধ্যে কোনটি ব্যবহার করা হয়? উদাহরণসহ ব্যাখ্যা করো।
সাধারণত ধাতু ও অধাতুর সমন্বয়ে আয়নীয় যৌগ গঠিত হয়। আয়নীয় যৌগে উপস্থিত ক্যাটায়ন ও অ্যানায়নগুলি পরস্পরের সঙ্গে স্থির তড়িৎ আকর্ষণ বল দ্বারা যুক্ত হয়ে বৃহদাকার কেলাস গঠন করে। এই প্রকার যৌগে অণুর কোনো পৃথক অস্তিত্ব থাকে না, শুধুমাত্র বিপরীত আধানযুক্ত আয়নের সমষ্টি মাত্র। তাই আয়নীয় যৌগের ক্ষেত্রে আণবিক ভরের পরিবর্তে সংকেত ভর ব্যবহার করা হয়।
আয়নীয় যৌগের সংকেত এককের অন্তর্ভুক্ত পরমাণুগুলির পারমাণবিক ভরের যোগফলই হল ওই যৌগের সংকেত ভর।
যেমন – আয়নীয় যৌগ NaCl -এর সংকেত ভর
= Na -এর পারমাণবিক গুরুত্ব + Cl -এর পারমাণবিক গুরুত্ব
= 23 + 35.5
= 58.5
CaCl2 -এর সংকেত ভর –
Ca -এর পারমাণবিক গুরুত্ব + 2 × Cl -এর পারমাণবিক গুরুত্ব
= 40 + (2 × 35.5)
= 40 + 71
= 111
সোডিয়াম ক্লোরাইডের আণবিক ওজন 58.5 উক্তিটির যথার্থতা বিচার করো।
আয়নীয় যৌগের ক্ষেত্রে প্রকৃত অণুর কোনো অস্তিত্ব না থাকায় আণবিক ভরের পরিবর্তে সংকেত ভর পদটি ব্যবহার করা হয়, যেহেতু NaCl একটি আয়নীয় যৌগ (Na+ এবং Cl– আয়ন দ্বারা গঠিত)।
কারণ – সোডিয়াম ক্লোরাইডের কেলাসে Na+ আয়ন এবং Cl– আয়ন ঘনকের আকারে সংঘবদ্ধ অবস্থায় থাকে। একটি Na+ আয়নকে ঘিরে 6টি Cl– আয়ন এবং একটি Cl– আয়নকে ঘিরে 6টি Na+ আয়ন থাকে। তাই NaCl -এর ক্ষেত্রে আণবিক ওজনের পরিবর্তে সংকেত ওজন শব্দটি যথোপযুক্ত। সুতরাং, সোডিয়াম ক্লোরাইডের আণবিক ওজন 58.5 না বলে, বলা উচিত সোডিয়াম ক্লোরাইডের সংকেত ওজন 58.5।
H2SO4 -এর সংকেত ভর গণনা করো। [পারমাণবিক ভর – H = 1u, O = 16u, S = 32u ]
H2SO4 -এর সংকেত ভর
= (2 × 1) u + 32 u + (4 × 16) u
= 98 u
NaNO3 -এর সংকেত ভর গণনা করো। [পারমাণবিক ভর – N = 14 u, O = 16 u, Na = 23 u]
NaNO3 -এর সংকেত ভর
= 23 u + 14 u + (3 × 16) u
= 85 u
বোধমূলক প্রাশ্নাত্তর
একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসে সমসংখ্যক অণু বর্তমান – বক্তব্যটি থেকে কি আমরা বলতে পারি প্রত্যেক অণুর আয়তন সমান?
একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসে সমসংখ্যক অণু বর্তমান থাকলেও প্রত্যেক অণুর আয়তন সমান হবে না। অণুর আয়তন বলতে এদের মোট আয়তন এবং গ্যাসের আয়তন বলতে গ্যাসের অণুগুলি যে আয়তন অধিকার করে সঞ্চরণশীল সেই আয়তনকে বোঝায়। বিভিন্ন গ্যাসের যে যে আয়তনে সমান সংখ্যক অণু থাকে, সেই সেই আয়তন সমান হয়। বিভিন্ন গ্যাসের অণুগুলির আয়তন বিভিন্ন হয়।
একই চাপ ও উষ্ণতায় 3 লিটার কার্বন ডাইঅক্সাইড, 4 লিটার ক্লোরিন, 6 লিটার হাইড্রোজেন, 5 লিটার নাইট্রোজেন এবং 2 লিটার সালফার ডাইঅক্সাইড গ্যাস সংগ্রহ করা হয়েছে। উপরের গ্যাসগুলির মধ্যে – (1) কোন্ গ্যাসটির মধ্যে সবচেয়ে বেশি সংখ্যক অণু আছে? (2) কোন্ গ্যাসটির মধ্যে সবচেয়ে কম সংখ্যক অণু আছে?
অ্যাভোগাড্রো সূত্রানুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসের মধ্যে সমান সংখ্যক অণু বর্তমান। অর্থাৎ, একই চাপ ও উষ্ণতায় কোনো গ্যাসের আয়তন হ্রাস পেলে তার মধ্যে উপস্থিত অণুসংখ্যা হ্রাস পাবে। সুতরাং, প্রদত্ত গ্যাসগুলির মধ্যে যে গ্যাসের আয়তন যত বেশি তার মধ্যে উপস্থিত অণুসংখ্যাও তত বেশি এবং যে গ্যাসের আয়তন যত কম তার মধ্যে উপস্থিত অণুসংখ্যাও তত কম হবে।
- 6 লিটার হাইড্রোজেন গ্যাসে অণুর সংখ্যা সর্বাধিক।
- 2 লিটার সালফার ডাইঅক্সাইড গ্যাসে অণুর সংখ্যা সর্বনিম্ন।
দুটি অনুরূপ জারে একই চাপ ও উষ্ণতায় CO2 এবং NO গ্যাস আছে। কোন্ জারে বেশি সংখ্যক অক্সিজেন পরমাণু আছে এবং কেন?
যেহেতু দুটি অনুরূপ জারে একই চাপ ও উষ্ণতায় CO2 এবং NO গ্যাস আছে। সুতরাং, গ্যাস দুটির আয়তন সমান। অ্যাভোগাড্রো সূত্রানুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসে সমান সংখ্যক অণু বর্তমান। অর্থাৎ, জার দুটিতে CO2 এবং NO গ্যাসের অণুর সংখ্যা সমান। কিন্তু CO2 -এর একটি অণুতে 2টি অক্সিজেন পরমাণু এবং NO -এর একটি অণুতে একটি অক্সিজেন পরমাণু আছে। তাই যে জারটিতে CO2 রয়েছে সেটিতে অক্সিজেন পরমাণুর সংখ্যা বেশি থাকবে।
একই চাপ ও উষ্ণতায় V লিটার হাইড্রোজেন গ্যাসে যত সংখ্যক অণু বর্তমান V লিটার নাইট্রোজেন গ্যাসেও তত সংখ্যক অণু বর্তমান; কিন্তু এর থেকে V লিটার কার্বন ডাইঅক্সাইডে উপস্থিত অণুর সংখ্যা বলা যায় না কারণ কার্বন ডাইঅক্সাইড হাইড্রোজেন বা নাইট্রোজেনের মতো মৌলিক গ্যাস নয় – বক্তব্যটি কি সঠিক? যুক্তি দাও।
বক্তব্যটি সঠিক নয় কারণ – অ্যাভোগাড্রো সূত্রানুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসের মধ্যে সমান সংখ্যক অণু বর্তমান। এই সূত্র মৌলিক ও যৌগিক উভয় প্রকার গ্যাসের ক্ষেত্রে প্রযোজ্য। সুতরাং, একই চাপ ও উষ্ণতায় V লিটার মৌলিক গ্যাস অর্থাৎ, হাইড্রোজেন বা নাইট্রোজেনে যত সংখ্যক অণু বর্তমান, ওই চাপ ও উষ্ণতায় V লিটার কার্বন ডাইঅক্সাইডের মতো যৌগিক V গ্যাসেও তত সংখ্যক অণু বর্তমান থাকবে।
25°C উষ্ণতায় 1 বায়ুমণ্ডলীয় চাপে 10 লিটার অক্সিজেন এবং 10 লিটার নাইট্রোজেন গ্যাসে অণুসংখ্যার অনুপাত নির্ণয়া করো। এক্ষেত্রে কোন্ সূত্রটি প্রয়োগ করা হয়েছে?
ধরি, 25°C উষ্ণতায় 1 বায়ুমণ্ডলীয় চাপে 10 লিটার অক্সিজেন গ্যাসে অণুসংখ্যা = x।
অ্যাভোগাড্রো সূত্রানুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসে সমান সংখ্যক অণু বর্তমান। সুতরাং, 25°C উষ্ণতায় 1 বায়ুমণ্ডলীয় চাপে 10 লিটার নাইট্রোজেন গ্যাসে অণুসংখ্যা হবে x।
∴
∴ 10 লিটার অক্সিজেনে অণুসংখ্যা : 10 লিটার নাইট্রোজেনে অণুসংখ্যা = 1 : 1।
এক্ষেত্রে, অ্যাভোগাড্রো সূত্রটি প্রয়োগ করা হয়েছে।
1 মোল N2 এবং 1 মোল N কি একই পরিমাণ নির্দেশ করে? যুক্তি দাও।
নাইট্রোজেনের আণবিক সংকেত হল N2 এবং পারমাণবিক সংকেত হল N। 1 মোল N2 বলতে 28 g নাইট্রোজেন বোঝায়, যার মধ্যে 6.022 × 1023 সংখ্যক নাইট্রোজেন অণু বর্তমান। 1 মোল N বলতে 14 g নাইট্রোজেন বোঝায়, যার মধ্যে 6.022 × 1023 সংখ্যক নাইট্রোজেন পরমাণু বর্তমান। সুতরাং, 1 মোল N2 এবং 1 মোল N একই পরিমাণ নির্দেশ করে না।
1 মোল মানুষ – কথাটি কি বিজ্ঞানসম্মত?
অথবা, ‘1 মোল পেনসিল’ ও ‘1 মোল মানুষ’ – এই দুইয়ের মধ্যে কোনটি বিজ্ঞানসম্মত নয়?
কোনো মৌলিক বা যৌগিক পদার্থের অ্যাভোগাড্রো সংখ্যক (6.022 × 1023) উপাদান কণিকাকে (অণু, পরমাণু বা আয়ন) 1 মোল বলে।
মোল দ্বারা নির্দেশিত প্রাথমিক বস্তুকণাগুলি অবশ্যই অভিন্ন হওয়া বাঞ্ছনীয়। পেনসিল যেহেতু কৃত্রিমভাবে উৎপাদিত হয় সুতরাং, সেগুলি বৈশিষ্ট্যগতভাবে অভিন্ন হওয়া সম্ভব। অর্থাৎ, ‘1 মোল পেনসিল’ কথাটি বিজ্ঞানসম্মত বলে ভাবা যায়।
কিন্তু দুজন মানুষ (যদি তারা যমজও হয়) কখনোই সব বিষয়ে অভিন্ন হতে পারে না (যেমন – দুজন মানুষের হাতের ছাপ কখনোই একই রকম হয় না), তাই ‘1 মোল মানুষ’ ধারণাটি বৈজ্ঞানিক যুক্তির বিচারে গ্রহণযোগ্য নয়।
2 মোল নক্ষত্র ও 1 মোল বালুকণার মধ্যে কোনটি সংখ্যায় বেশি? কোনটির ভরই বা বেশি?
2 মোল নক্ষত্র = 2 × 6.022 × 1023 সংখ্যক নক্ষত্র = 12.046 × 1023 সংখ্যক নক্ষত্র ও 1 মোল বালুকণা = 6.022 × 1023 সংখ্যক বালুকণা।
∴ 2 মোল নক্ষত্রের সংখ্যা বেশি।
যেহেতু, নক্ষত্রের সংখ্যা বালুকণার সংখ্যার থেকে অনেক বেশি। অতএব, নক্ষত্রের ভর বেশি।
6.022 × 1023 সংখ্যক জলের অণু ও জলীয় বাষ্পের অণুর ভর একই না ভিন্ন হবে?
জলের অণু ও জলীয় বাষ্পের অণু উভয় ক্ষেত্রেই আণবিক গুরুত্ব = 18। আবার, যে-কোনো পদার্থের সমপরিমাণে 6.022 × 1023 সংখ্যক অণু থাকে। তাই বলা যায়, উভয় ক্ষেত্রেই ভর একই হবে।
কোনো মৌলের একটি পরমাণুর ওজন এবং পারমাণবিক ওজন কি একই?
মৌলের একটি পরমাণুর ওজন ও পারমাণবিক ওজন এক নয়, এদের মধ্যে পার্থক্য আছে। কারণ –
- মৌলের একটি পরমাণুর ওজন বলতে তার প্রকৃত ওজনকে বোঝায়। কিন্তু, মৌলের পারমাণবিক ওজন বলতে মৌলটির একটি পরমাণুর ওজন একটি হাইড্রোজেন পরমাণুর ওজনের বা একটি কার্বন পরমাণুর ওজনের \(\frac1{12}\) অংশের তুলনায় যত গুণ ভারী তা বোঝায়।
- মৌলের একটি পরমাণুর ওজনকে গ্রামে প্রকাশ করা যায় অর্থাৎ, এর একক আছে। পারমাণবিক ওজন দুটি ওজনের অনুপাত হওয়ায় এটি এককবিহীন। উদাহরণ – একটি হাইড্রোজেন পরমাণুর প্রকৃত ভর = 1.67 × 10-24 g, কিন্তু হাইড্রোজেনের পারমাণবিক ভর 1.008 বা 1 ধরা হয়।
একটি মৌলের আণবিক ওজন M এবং মৌলটির পারমাণবিক ওজন A। ওই মৌলের 1টি পরমাণু ও 1টি অণুর ওজন গ্রামে প্রকাশ করো।
মৌলটির পারমাণবিক ওজন = A। সুতরাং, 1 গ্রাম-পরমাণু মৌলের ওজন = A গ্রাম। 1 গ্রাম-পরমাণু মৌলে পরমাণুর সংখ্যা = N = অ্যাভোগাড্রো সংখ্যা। সুতরাং, 1টি পরমাণুর ওজন = \(\frac AN\) গ্রাম।
∵ মৌলটির আণবিক ওজন = M। সুতরাং, 1 গ্রাম-অণু মৌলের ওজন = M গ্রাম, 1 গ্রাম-অণু মৌলে অণুসংখ্যা = আভোগাত্রো সংখ্যা। অতএব, এটি অণুর ওজন = \(\frac MN\) গ্রাম।
STP -তে n সংখ্যক N2 অণু যদি V L আয়তন অধিকার করে, তবে STP -তে \(\frac n2\) সংখ্যক CO2 অণু কত আয়তন অধিকার করবে?
অ্যাভোগাড্রো প্রকল্পের বিপরীত বক্তব্য অর্থাৎ, সম উষ্ণতা ও চাপে দুটি গ্যাসের সমসংখ্যক অণুর আয়তন সমান।
STP -তে n সংখ্যক N2 অণুর আয়তন = V লিটার,
STP -তে n সংখ্যক CO2 অণুর আয়তন = V লিটার,
STP -তে \(\frac n2\) সংখ্যক CO2 অণুর আয়তন = \(\frac V2\) লিটার।
∴ STP -তে \(\frac n2\) সংখ্যক CO2 অণু \(\frac V2\) লিটার আয়তন অধিকার করবে।
STP এবং NTP এর মধ্যে প্রধান তাপমাত্রা ও চাপের পার্থক্য কী?
STP (Standard Temperature and Pressure) -তে প্রমাণ উষ্ণতা = 273.15K (0°C/32°F) এবং পরম চাপ = 100 kPa (1 bar) = 0.987 atm (প্রমাণ বায়ুমণ্ডলীয় চাপ)। NTP (Normal Temperature and Pressure) -তে প্রমাণ উষ্ণতা 293.15K (20°C/68°F) এবং পরম চাপ = 101.325 kPa = 1 atm।
[এক্ষেত্রে 1 atm = 1.013 bar = 76 cm পারদস্তম্ভের চাপ]
গ্রাফাইটের 0.1 গ্রামে যতগুলি কার্বন পরমাণু আছে সমপরিমাণ হিরেতে কি ততগুলিই কার্বন পরমাণু থাকবে?
গ্রাফাইট ও হিরে উভয়েই একই মৌল কার্বনের রূপভেদ। একই মৌলের একাধিক রূপভেদের সমপরিমাণে সমান সংখ্যক উপাদান কণা উপস্থিত থাকে।
কাজেই সমপরিমাণ উভয় রূপভেদে সমসংখ্যক কার্বন পরমাণু উপস্থিত থাকবে। সুতরাং, গ্রাফাইটের 0.1 গ্রামে যতগুলি কার্বন পরমাণু আছে সমপরিমাণ হিরেতেও ততগুলিই কার্বন পরমাণু থাকবে। [0.1 g গ্রাফাইটে C পরমাণু = 0.1 g হিরেতে C পরমাণু]
মোল শব্দটি ব্যবহার করার সময় পদার্থের উপাদান কণিকার উল্লেখ করা অবশ্যই প্রয়োজন কেন?
মোল শব্দটি ব্যবহার করার সময় পদার্থ গঠনকারী উপাদান কণাটির নাম উল্লেখ করা বিশেষ প্রয়োজন কারণ – পদার্থের পরিমাণ ওই কণার প্রকৃতির ওপর একান্তভাবে নির্ভরশীল।
কোনো পদার্থের মধ্যে একাধিক ভিন্ন উপাদান কণিকা থাকতে পারে এবং পদার্থের পরিমাণ ভিন্ন উপাদান কণিকার সাপেক্ষে ভিন্ন হবে। যেমন – 1 মোল নাইট্রোজেন বললে নাইট্রোজেনের পরিমাণ সম্পর্কে স্পষ্ট ধারণা পাওয়া যায় না কারণ – এটি 1 মোল নাইট্রোজেন অণু ও 1 মোল নাইট্রোজেন পরমাণু উভয়কেই নির্দেশ করে।
1 mol নাইট্রোজেন অণু (N2) এবং 1 mol নাইট্রোজেন পরমাণু উভয়েরই উপাদান কণা সংখ্যা একই 6.022 × 1023টি। কিন্তু পদার্থের পরিমাণ আলাদা হয়, যেমন – 1 mol N2 অণুর ভর = 28 g, আবার 1 mol N পরমাণুর ভর 14 g।
অর্থাৎ, 1 মোল নাইট্রোজেন অণু এবং 1 মোল নাইট্রোজেন পরমাণু পৃথক পরিমাণ পদার্থকে নির্দেশ করে। এছাড়া 1 মোল নাইট্রোজেন অণুতে উপস্থিত পরমাণু সংখ্যা 1 মোল নাইট্রোজেন পরমাণুতে উপস্থিত পরমাণু সংখ্যার দ্বিগুণ। সুতরাং, কণার প্রকৃতির ওপর মোলের প্রকৃত পরিমাণ নির্ভর করে, তাই মোলের ব্যবহারে কণার উল্লেখ না করলে ‘মোল’ শব্দটি অর্থহীন হয়ে যাবে এবং রাসায়নিক গণনার ক্ষেত্রে বিভ্রান্তির সৃষ্টি হবে।
মোল কথার অর্থ কী?
মোল একটি ল্যাটিন শব্দ, যার অর্থ রাশি বা গুচ্ছ।
4 × 1020 সংখ্যক SO2 ও CO2 -এর মধ্যে কোনটি বেশি ভারী ও কেন?
কোনো পদার্থের 1 গ্রাম-অণু পরিমাণে অ্যাভোগাড্রো সংখ্যক (6.022 × 1023) অণু বর্তমান থাকে।
অর্থাৎ, 6.022 × 1023 সংখ্যক অণুর ওজন = গ্রাম-আণবিক ওজন।
SO2 -এর আণবিক গুরুত্ব = 32 + (2 × 16)
= 32 + 32
= 64
∴ 4 × 1020 সংখ্যক SO2 অণুর ওজন
= \(\frac{64\times4\times10^{20}}{6.022\times10^{23}}\)
= 0.0425 g
আবার, CO2 -এর আণবিক গুরুত্ব = 12 + (2 × 16)
= 12 + 32
= 44
∴ 4 × 1020 সংখ্যক CO2 অণুর ওজন
= \(\frac{44\times4\times10^{20}}{6.022\times10^{23}}\)
= 0.0292 g
∴ 4 × 1020 সংখ্যক SO2 অণু সমসংখ্যক CO2 অণু অপেক্ষা বেশি ভারী।
NTP -তে 22.4 লিটার অ্যামোনিয়া ও 22.4 লিটার CO2 -এর মধ্যে – (1) অণুর সংখ্যা সমান হবে না পৃথক হবে? (2) পরমাণুর সংখ্যা সমান হবে না পৃথক হবে?
প্রথম,
NTP -তে গ্যাসের মোলার আয়তন 22.4 লিটার।
∴ 22.4 লিটার আয়তনের NH3 -তে অণুর সংখ্যা = 6.022 × 1023 এবং 22.4 লিটার CO2 -তে অণুর সংখ্যা = 6.022 × 1023। অ্যাভোগাড্রো সূত্রানুযায়ী, উভয়ক্ষেত্রে অণুর সংখ্যা সমান হবে।
দ্বিতীয়,
একটি NH3 অণুতে পরমাণুর সংখ্যা = (1 + 3) = 4টি।
∴ 6.022 × 1023 সংখ্যক NH3 অণুতে পরমাণুর সংখ্যা
= 4 × 6.022 × 1023
= 24.088 × 1023টি।
একটি CO2 অণুতে পরমাণু সংখ্যা = (1 + 2) = 3টি।
∴ 6.022 × 1023 সংখ্যক CO2 অণুতে পরমাণুর সংখ্যা
= 3 × 6.022 × 1023
= 18.066 × 1023 টি।
সুতরাং, পরমাণুর সংখ্যা পৃথক হবে।
100°C উষ্ণতায় এবং 500 mm Hg চাপে এক মোল গ্যাসের মধ্যে অণুর সংখ্যা অ্যাভোগাড্রো সংখ্যার সমান না এটি অপেক্ষা বেশি বা কম?
এক মোল পরিমাণ যে-কোনো পদার্থে সর্বদাই অ্যাভোগাড্রো সংখ্যক অণু উপস্থিত থাকে। পদার্থটি যে অবস্থাতেই থাকুক না কেন অণু সংখ্যার কোনো পরিবর্তন ঘটে না। তাই 100°C উষ্ণতায় এবং 500 mm Hg চাপে এক মোল গ্যাসের মধ্যে অণুর সংখ্যা অ্যাভোগাড্রো সংখ্যার সমান হবে।
দুটি অনুরূপ গ্যাসজারে একই উষ্ণতা ও চাপে 44 g CO2 এবং 30 g NO গ্যাস আছে। গ্যাসজার দুটির মধ্যে গ্যাস অণুর সংখ্যার অনুপাত নির্ণয় করো।
44 g CO2 = 1 গ্রাম-অণু CO2 এবং 30 g NO = 1 গ্রাম-অণু NO।
আমরা জানি, 1 গ্রাম-অণু যে-কোনো গ্যাসের মধ্যে অণুর সংখ্যা 6.022 × 1023।
তাই 44 g CO2 গ্যাসে 6.022 × 1023 সংখ্যক CO2 অণু এবং 30 g NO গ্যাসে 6.022 × 1023 সংখ্যক NO অণু বর্তমান। সুতরাং, গ্যাসজার দুটিতে গ্যাস অণু সংখ্যার অনুপাত হবে 1 : 1।
18 g জলে যদি অণুর সংখ্যা n হয়, তবে 100 g CaCO3 -তে অণুর সংখ্যা এবং 44 g CO2 -তে অণুর সংখ্যা কত হতে পারে? এই সংখ্যার মান কত?
18 g জল (H2O) = 1 গ্রাম-অণু জল [∵ H2O -এর আণবিক ভর = 18]
100 g CaCO3 = 1 গ্রাম-অণু CaCO3 [∵ CaCO3 -এর আণবিক ভর = 100]
44 g CO2 = 1 গ্রাম-অণু CO2 [∵ CO2 -এর আণবিক ভর = 44]
আমরা জানি, এক গ্রাম-অণু সব পদার্থের মধ্যে অণুর সংখ্যা সমান।
যেহেতু, 18 g জলে অণুর সংখ্যা = n
তাই 100 g CaCO3 -তে অণুর সংখ্যা = n এবং
44 g CO2 -তে অণুর সংখ্যা = n
n হল অ্যাভোগাড্রো সংখ্যা অর্থাৎ, n = 6.022 × 1023।
মোলার আয়তনের সংজ্ঞা দেবার সময় পদার্থের উপাদান কণিকার উল্লেখ করা অবশ্যই প্রয়োজন কেন?
মোলার আয়তনের মান গ্যাসীয় পদার্থের প্রকৃতির ওপর নির্ভর করে না, কিন্তু গ্যাসের উষ্ণতা ও চাপের ওপর নির্ভরশীল।
(যখন উষ্ণতা স্থির)
আবার, আয়তন ∝ উষ্ণতা (যখন চাপ স্থির)
যেহেতু উষ্ণতা ও চাপের পরিবর্তনের ফলে গ্যাসীয় পদার্থের আয়তন পরিবর্তন হয়, তাই মোলার আয়তনের সংজ্ঞায় উষ্ণতা ও চাপের মান নির্দিষ্ট রাখা হয়। যেমন – প্রমাণ উষ্ণতা (0°C) ও প্রমাণ চাপে (76 cm পারদস্তম্ভের চাপ) 1 মোল যে-কোনো গ্যাসের আয়তন 22.4 L হয়।
স্থির চাপে উষ্ণতার পরিবর্তনে নির্দিষ্ট ভরের গ্যাসের আয়তন কীরূপে পরিবর্তিত হয়?
চার্লসের সূত্রানুযায়ী, স্থির চাপে নির্দিষ্ট ভরের গ্যাসের আয়তন গ্যাসটির পরম উষ্ণতার সমানুপাতিক হয়। স্থির চাপে কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন = V এবং পরম উষ্ণতা = T হলে –
সূত্রানুযায়ী,
V ∝ T, যখন চাপ স্থির
বা, V = KT [K = ধ্রুবক]
অর্থাৎ, স্থির চাপে নির্দিষ্ট ভরের গ্যাসের আয়তন গ্যাসের উষ্ণতা বৃদ্ধির সঙ্গে সঙ্গে বাড়তে থাকে। অপরপক্ষে, স্থির চাপে নির্দিষ্ট ভরের গ্যাসের আয়তন গ্যাসের উষ্ণতা কমার সঙ্গে সঙ্গে কমতে থাকে।
রাসায়নিক গণনার সময় পরমাণুর প্রকৃত ভর ব্যবহার না করে পারমাণবিক ভর ব্যবহার করা হয় কেন?
পরমাণু অত্যন্ত ক্ষুদ্র। এর ছোটো আকৃতির জন্য শক্তিশালী অণুবীক্ষণ যন্ত্রের সাহায্যেও একে দেখা যায় না এবং তুলাদণ্ডের সাহায্যে সরাসরি এর ভরও মাপা যায় না। পরমাণুর প্রকৃত ভর খুবই কম হওয়ায় রাসায়নিক গণনার ক্ষেত্রে এর ব্যবহার অসুবিধাজনক। ব্যাবহারিক ক্ষেত্রে সুবিধার জন্য একটি পরমাণুর প্রকৃত ভরের পরিবর্তে একটি মৌলের ভরকে প্রমাণ ধরে তার সাপেক্ষে বিভিন্ন মৌলের আপেক্ষিক বা তুলনামূলক ভরকে প্রকাশ করা হয়। এই আপেক্ষিক ভরকেই পারমাণবিক ভর বলা হয়। তাই ক্ষুদ্র ভগ্নাংশের প্রকৃত ওজন ব্যবহারের চেয়ে পারমাণবিক ভর ব্যবহার করা অধিক যুক্তিযুক্ত।
উষ্ণতা ও চাপের পরিবর্তনে কোনো গ্যাসের পরম ঘনত্ব কি প্রভাবিত হয়? – তোমার উত্তরের স্বপক্ষে যুক্তি দাও।
নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন চাপ ও উষ্ণতা দ্বারা প্রভাবিত হয়। তাই পরম ঘনত্ব চাপ ও উষ্ণতার ওপর নির্ভর করে। গ্যাসের আয়তনের সঙ্গে পরম ঘনত্বের ব্যস্তানুপাতিক সম্পর্ক। অর্থাৎ, চাপ ও উষ্ণতার পরিবর্তনে যদি কোনো গ্যাসের আয়তন বাড়ে তবে পরম ঘনত্ব হ্রাস পায়। আবার চাপ ও উষ্ণতার পরিবর্তনে গ্যাসের আয়তন হ্রাস পেলে পরম ঘনত্বের মান বৃদ্ধি পায়।
অ্যাভোগাড্রো ধ্রুবককে ‘সর্বজনীন ধ্রুবক’ বলা যায় কি – তোমার উত্তরের স্বপক্ষে যুক্তি দাও।
অ্যাভোগাড্রো ধ্রুবককে সর্বজনীন ধ্রুবক বলা যায়। এর কারণগুলি হল যে –
- কোনো মৌলিক বা যৌগিক পদার্থের 1 গ্রাম-অণুতে বা 1 গ্রাম-পরমাণুতে অ্যাভোগাড্রো সংখ্যক অণু বা পরমাণু থাকে।
- যে-কোনো গ্যাসের 22.4 লিটার আয়তনে অ্যাভোগাড্রো সংখ্যাক অণু থাকে।
- যে-কোনো এক গ্রাম-আয়নে অ্যাভোগাড্রো সংখ্যক আয়ন থাকে।
- উপরের সবকটি ক্ষেত্রেই অ্যাভোগাড্রো সংখ্যার মান স্থির (6.022 × 1023)। তাই এটি একটি সর্বজনীন ধ্রুবক।
একই চাপ ও উষ্ণতায় A গ্যাসের V আয়তন B গ্যাসের 2V আয়তনের সঙ্গে বিক্রিয়া করে। A গ্যাসের অণুর সংখ্যা n1 ও গ্যাসের অণুর সংখ্যা n2 হলে \(\frac1{n_1}:\frac1{n_2}\) = কত?
আমরা জানি, অ্যাভোগাড্রো প্রকল্প অনুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসের মধ্যে সমসংখ্যক অণু বর্তমান।
এখন, এ গ্যাসের আয়তনে অণুর সংখ্যা = n1, হলে
B গ্যাসের 2V আয়তনে অণুর সংখ্যা = 2n1 হবে।
∴ n1 : n2
= n1 : 2n1
= 1 : 2
এখন, \(\frac1{n_1}:\frac1{n_2}\)
= \(\frac11:\frac12\)
= 2 : 1
A ও B দুটি মৌলের একটি পরমাণুর প্রকৃত ভর a1 ও a2 হলে মৌল দুটির পারমাণবিক ভরের অনুপাত কত হবে?
ধরি, Aও B মৌল দুটির পারমাণবিক ভর যথাক্রমে XA ও XB
এখন, আমরা জানি,
মৌলের পারমাণবিক ভর × 1 amu = মৌলের 1টি পরমাণুর প্রকৃত ভর।
∴ A মৌলের ক্ষেত্রে, XA × 1 amu = a1 ___(1)
B মৌলের ক্ষেত্রে, XB × 1 amu = a2 ___(2)
এখন, (i) ÷ (ii) করে পাই,
\(\frac{X_A\times1\;amu}{X_B\times1\;amu}=\frac{a_1}{a_2}\\\)বা, \(\frac{X_A}{X_B}=\frac{a_1}{a_2}\)
বা, \(X_A:X_B=a_1:a_2\)
সুতরাং, মৌল দুটির পারমাণবিক ভরের অনুপাত হবে a1 : a2।
একই চাপ ও উষ্ণতায় তিনটি পৃথক গ্যাসের অণু সংখ্যার অনুপাত 1 : 2 : 3 হলে তাদের আয়তনের অনুপাত কী হবে বলে তোমার মনে হয়? (ধরো একই চাপ ও উষ্ণতায় গ্যাসের আয়তন ও অণু সংখ্যার সম্পর্কটি হল V ∝ n)
প্রশ্নানুসারে, একই চাপ ও উষ্ণতায় গ্যাসের আয়তন ও অণু সংখ্যার সম্পর্ক হল V ∝ n।
বা, V = kn [যেখানে k ধ্রুবক]
এখন ধরি, একই চাপ ও উষ্ণতায় গ্যাস তিনটির আয়তন যথাক্রমে V1, V2 ও V3 এবং অণুর সংখ্যা যথাক্রমে n1, n2 ও n3।
প্রশ্নানুসারে, n1 : n2 : n3 = 1 : 2 : 3
∴ \(\frac{V_1}{V_2}=\frac{kn_1}{kn_2}=\frac12\)
আবার, \(\frac{V_1}{V_3}=\frac{kn_1}{kn_3}=\frac13\)
∴ \(V_1:V_2:V_3=1:2:3\)
X ও Y দুটি পদার্থের আণবিক ভর যথাক্রমে Mx ও My। পদার্থ দুটির A গ্রামে অণু সংখ্যার অনুপাত কত হবে?
আমরা জানি, অ্যাভোগাড্রো প্রকল্প অনুযায়ী কোনো পদার্থের 1 গ্রাম-অণুতে অণুর সংখ্যা = 6.022 × 1023
এখন, X পদার্থের Mx গ্রাম = 1 গ্রাম-অণু X পদার্থ
Y পদার্থের My গ্রাম = 1 গ্রাম-অণু Y পদার্থ
∴ X পদার্থের,
Mx গ্রামে অণুর সংখ্যা = 6.022 × 1023
∴ A গ্রামে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times A}{M_x}\)
এবং, Y পদার্থের,
My গ্রামে অণুর সংখ্যা = 6.022 × 1023
∴ A গ্রামে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times A}{M_y}\)
সুতরাং, অণু সংখ্যার অনুপাত
= \(\frac{6.022\times10^{23}\times A}{M_x}:\frac{6.022\times10^{23}\times A}{M_y}\)
= \(\frac1{M_x}:\frac1{M_y}\)
= \(M_y:M_x\)
একটি যৌগের 1 গ্রাম-অণুতে অণুর সংখ্যা m এবং একটি মৌলের \(\frac12\) গ্রাম-অণুতে অণুর সংখ্যা n হলে m : n কত হবে?
আমরা জানি, কোনো পদার্থের 1 গ্রাম-অণুতে অণুর সংখ্যা = 6.022 × 1023
অতএব, m = 6.022 × 1023
আবার, 1 গ্রাম-অণুতে অণুর সংখ্যা = 6.022 × 1023
\(\frac12\) গ্রাম-অণুতে অণুর সংখ্যা = \(6.022\times10^{23}\times\frac12\)
= \(\frac{6.022\times10^{23}}2\)
∴ \(n=\frac{6.022\times10^{23}}2\)
∴ \(m:n=6.022\times10^{23}:\frac{6.022\times10^{23}}2\)
= \(2:1\)
একটি গ্যাসীয় পদার্থের বাষ্পমনত্ব D -এর অংশ \(\frac14\) সেটির আণবিক গুরুত্ব M -এর কত অংশ?
D -এর অংশ অর্থাৎ,
আমরা জানি, M = 2D
বা, \(\frac M8=\frac{2D}8\)
বা, \(\frac M8=\frac D4\)
অর্থাৎ, গ্যাসীয় পদার্থের বাষ্পঘনত্ব D -এর \(\frac14\) অংশ = পদার্থের আণবিক গুরুত্ব M -এর \(\frac18\) অংশ।
একই চাপ ও উষ্ণতায় দুটি গ্যাসের আয়তন VA ও VB এবং অণুর সংখ্যা যথাক্রমে nA ও nB হলে \(V_A:V_{{}_B}=\frac1{n_A}:\frac1{n_B}\) বিবৃতিটি কি সঠিক? তোমার উত্তরের স্বপক্ষে যুক্তি দাও।
না, বিবৃতিটি সঠিক নয়।
কারণ – প্রশ্নানুসারে,
\(V_A:V_{{}_B}=\frac1{n_A}:\frac1{n_B}\\\)বা, VA : VB = nB : nA
কিন্তু অ্যাভোগাড্রো প্রকল্প অনুযায়ী,
\(\frac{V_A}{V_B}=\frac{n_A}{n_B}\) হয়
তাই বিবৃতিটি সঠিক নয়।
একই চাপ ও উষ্ণতায় দুটি গ্যাসকে 1 : 3 অণু সংখ্যার অনুপাতে বিক্রিয়া করালে তারা কোন্ আয়তনের অনুপাতে বিক্রিয়া করে?
ধরি, প্রথম গ্যাসের অণুর সংখ্যা = n
দ্বিতীয় গ্যাসের অণুর সংখ্যা = 3 n
এখন, অ্যাভোগাড্রো প্রকল্প অনুযায়ী, একই চাপ ও উষ্ণতায় গ্যাসের আয়তন তার অণু সংখ্যার সমানুপাতিক হয়।
∴ প্রথম গ্যাসের n সংখ্যক অণুর আয়তন V
দ্বিতীয় গ্যাসের 3n সংখ্যক অণুর আয়তন 3 V
∴ তাদের আয়তনের অনুপাত হবে = V : 3 V = 1 : 3
পার্থক্যধর্মী প্রশ্নোত্তর
আণবিক ভর (Molecular mass) ও সংকেত ভরের (Formula weight)মধ্যে পার্থক্য লেখো।
আণবিক ভর (Molecular mass) ও সংকেত ভরের (Formula weight)মধ্যে পার্থক্যগুলি হল –
| বিষয় | আণবিক ভর (Molecular mass) | সংকেত ভরের (Formula weight) |
| সংজ্ঞা | কোনো মৌলের বা যৌগের একটি অণুর ভর একটি 12C পরমাণুর ভরের \(\frac1{12}\) অংশের তুলনায় যত গুণ ভারী, সেই সংখ্যাকে ওই পদার্থের আণবিক ভর বলে। | সংকেত ভর বলতে কোনো আয়নীয় যৌগের সংকেতে উপস্থিত পরমাণুর পারমাণবিক ভরের যোগফলকে বোঝায়। |
| প্রযোজ্যতা | যেসব মৌলিক বা যৌগিক পদার্থের অণুর পৃথক অস্তিত্ব আছে, তাদের ক্ষেত্রে ‘আণবিক ভর’ কথাটি প্রযোজ্য। | যেসব যৌগের অণুর কোনো পৃথক অস্তিত্ব নেই (আয়নীয় যৌগ), তাদের ক্ষেত্রে ‘সংকেত ওজন’ কথাটি প্রযোজ্য। |
| নির্ণয় | অণুর মধ্যে উপস্থিত সংগঠক পরমাণুগুলির পারমাণবিক ভরের সমষ্টি থেকে নির্ণয় করা হয়। | কোনো যৌগিক অণুর সংকেত এককে উপস্থিত পরমাণুর (বা আয়ন) ভরের সমষ্টি থেকে নির্ণয় করা হয়। |
| উদাহরণ | যেসব অণুর প্রকৃত অস্তিত্ব আছে তাদের আণবিক ওজন ও সংকেত ওজন পদ দুটি সমার্থক। যেমন – CO2 -এর আণবিক ভর = 12 + (2 × 16) = 12 + 32 = 44। | আয়নীয় যৌগে অণুর অস্তিত্ব না থাকায়, আণবিক ওজন ও সংকেত ওজন পদ দুটি সমার্থক নয়। যেমন – NaCl -এর সংকেত ভর = (23 + 35.5) = 58.5। |
পরমাণুর প্রকৃত ভর ও পারমাণবিক ভরের মধ্যে পার্থক্য লেখো।
পরমাণুর প্রকৃত ভর ও পারমাণবিক ভরের মধ্যে পার্থক্যগুলি হল –
| বিষয় | পরমাণুর প্রকৃত ভর | পারমাণবিক ভর |
| সংজ্ঞা | পরমাণুর প্রকৃত ভর বলতে কোনো মৌলের একটি পরমাণুর মধ্যেকার সব কণাগুলির ভরের যোগফল বোঝায়। | মৌলের একটি পরমাণুর ভর একটি 12C পরমাণুর ভরের \(\frac1{12}\) অংশের তুলনায় যতগুণ, সেই সংখ্যাকে ওই মৌলের পারমাণবিক ভর বলে। |
| একক | পরমাণুর প্রকৃত ভরের একক আছে। যেমন – হাইড্রোজেন মৌলের একটি পরমাণুর প্রকৃত ওজন = 1.6735 × 10-24 g | পারমাণবিক ভরের কোনো একক নেই, কারণ – এটি দুটি ভরের অনুপাত। যেমন – H -এর পারমাণবিক ভর 1.0078। |
| রাসায়নিক গণনায় ব্যবহার | রাসায়নিক গণনার ক্ষেত্রে এই মান ব্যবহার করা অসুবিধাজনক। | রাসায়নিক গণনার ক্ষেত্রে এই মান ব্যবহার করা সুবিধাজনক। |
গাণিতিক প্রশ্নাবলি
প্রয়োজনীয় সূত্রাবলি
নিষ্ক্রিয় গ্যাস ব্যতীত অন্যান্য গ্যাসের অণুগুলি দ্বি-পরমাণুক।
NTP (Normal Temperature and Pressure) -তে যে-কোনো গ্যাসের মোলার আয়তন 22.4 লিটার।
পদার্থের আণবিক গুরুত্ব
মৌলিক পদার্থের আণবিক গুরুত্ব = মৌলের পারমাণবিক গুরুত্ব × মৌলের অণুর পারমাণবিকতা
যৌগিক পদার্থের আণবিক গুরত্ব = যৌগিক অণুর সংকেতে উপস্থিত বিভিন্ন পরমাণুগুলির পারমাণবিক গুরুত্বের সমষ্টি।
গ্যাসের আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব।
অ্যাভোগাড্রো প্রকল্প – একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসের মধ্যে সমান সংখ্যক অণু থাকে।
কোনো পদার্থের 1 মোলে উপস্থিত অণুর সংখ্যা 6.022 × 1023।
পরমাণুর প্রকৃত ভর = পারমাণবিক ওজন × 1 amu।
1 মোল কোনো পদার্থের আয়তন = 22.4 লিটার।
1 amu = 1.6605 × 10-24 গ্রাম।
1 মোল = পদার্থের আণবিক গুরুত্ব।
পরমাণু সংখ্যা = মোল সংখ্যা × অ্যাভোগাড্রো সংখ্যা।
NaNO3 পদার্থের আণবিক গুরুত্ব নির্ণয় করো। (প্রদত্ত Na = 23, N = 14, O = 16)
সোডিয়াম নাইট্রেটের (NaNO3) আণবিক গুরুত্ব –
NaNO3 = 23 + 14 + (3 × 16)
বা, NaNO3 = 23 + 14 + 48
বা, NaNO3 = 85
∴ NaNO3 -এর আণবিক ওজন 85 গ্রাম।
H2SO4 পদার্থের আণবিক গুরুত্ব নির্ণয় করো। (প্রদত্ত O = 16, S = 32, H = 1)
সালফিউরিক অ্যাসিডের (H2SO4) আণবিক গুরুত্ব
H2SO4 = (2 × 1) + 32 + (4 × 16)
বা, H2SO4 = 2 + 32 + 64
বা, H2SO4 = 98
∴ H2SO4 -এর আণবিক ওজন 98 গ্রাম।
Ca3(PO4)2 পদার্থের আণবিক গুরুত্ব নির্ণয় করো। (প্রদত্ত O = 16, Ca = 40, P = 31)
ক্যালশিয়াম ফসফেটের [Ca3(PO4)2] আণবিক গুরুত্ব –
Ca3(PO4)2 = 3 × 40 + {31 + (16 × 4)} × 2
বা, Ca3(PO4)2 = 120 + {31 + 64} × 2
বা, Ca3(PO4)2 = 120 + (95 × 2)
বা, Ca3(PO4)2 = 120 + 190
বা, Ca3(PO4)2 = 310
∴ Ca3(PO4)2 -এর আণবিক ওজন 310 গ্রাম।
ক্যালশিয়াম কার্বনেটের গ্রাম-আণবিক ওজন কত? (Ca = 40, C = 12, O = 16)
ক্যালশিয়াম কার্বনেটের আণবিক সংকেত = CaCO3
∴ ক্যালশিয়াম কার্বনেটের আণবিক গুরুত্ব বা আণবিক ওজন
= 40 + (1 × 12) + (16 × 3)
= 40 + 12 + 48
= 100
∴ ক্যালশিয়াম কার্বনেটের গ্রাম-আণবিক ওজন = 100 g।
কোনো গ্যাসের বাষ্পঘনত্ব 17 হলে ওই গ্যাসের আণবিক গুরুত্ব কত?
অ্যাভোগাড্রো সূত্রের অনুসিদ্ধান্ত থেকে আমরা জানি,
গ্যাসের আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব = 2 × 17 = 34
সুতরাং, গ্যাসটির আণবিক গুরুত্ব = 34
কোনো মৌলিক গ্যাসের বাষ্পঘনত্ব 62 এবং পারমাণবিক গুরুত্ব 31 হলে গ্যাসটির অণুর পারমাণবিকতা নির্ণয় করো।
গ্যাসটির আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব = 2 × 62 = 124
∴ মৌলিক গ্যাসটির পারমাণবিকতা 4।
11 g কার্বন ডাইঅক্সাইডে কতগুলি কার্বন ডাইঅক্সাইডের অণু বর্তমান?
কার্বন ডাইঅক্সাইডের আণবিক ওজন = 44
এক গ্রাম-অণু CO2 = 44 g
44 g CO2 -এ অণুর সংখ্যা = 6.022 × 1023
∴ 11 g CO2 -এ অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times11}{44}\)
= 1.505 × 1023
∴ 11 g কার্বন ডাইঅক্সাইডে অণুর সংখ্যা = 1.505 × 1023
4.5 গ্রাম জলে অণুর সংখ্যা কত?
জলের আণবিক গুরুত্ব = (2 × 1) + 16
= 2 + 16
= 18
∴ জলের গ্রাম-আণবিক ওজন = 18 g
18 g জলে অণুর সংখ্যা = 6.022 × 1023
1 g জলে অণুর সংখ্যা = \(\frac{6.022\times10^{23}}{18}\)
4.5 g জলে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times4.5}{18}\)
= 1.5055 × 1023
∴ 4.5 g জলে অণুর সংখ্যা= 1.5055 × 1023।
32 g অক্সিজেন ও 44 g কার্বন ডাইঅক্সাইডের প্রত্যেকটিতে অণুর সংখ্যা কত? [C = 12, O = 16]
অক্সিজেনের আণবিক ওজন = 32
∴ 1 গ্রাম-অণু অক্সিজেন = 32 g অক্সিজেন।
32 g অক্সিজেনে অণুর সংখ্যা = 6.022 × 1023
কার্বন ডাইঅক্সাইডের আণবিক ওজন = 44
∴ 1 গ্রাম-অণু কার্বন ডাইঅক্সাইড = 44 g কার্বন ডাইঅক্সাইড।
∴ 44 g কার্বন ডাইঅক্সাইডে অণুর সংখ্যা = 6.022 × 1023
9 g জলে উপস্থিত অণুর সংখ্যা n হলে 44 g কার্বন ডাইঅক্সাইডে উপস্থিত অণুর সংখ্যা কত হবে? [H = 1, C = 12, O = 16]
অ্যাভোগাড্রো প্রকল্প অনুসারে, আণবিক গুরুত্ব বা 1 মোল পরিমাণ সকল পদার্থে সমান সংখ্যক অণু থাকে।
জলের (H2O) আণবিক গুরুত্ব = (1 × 2) + 16 = 18
কার্বন ডাইঅক্সাইডের (CO2) আণবিক গুরুত্ব
=12 + (16 × 2)
= 12 + 32
= 44
∴ 18 g জলে অণুর সংখ্যা = 44 g কার্বন ডাইঅক্সাইডের অণুর সংখ্যা।
9 g জলে উপস্থিত অণুর সংখ্যা = n হলে,
18 g জলে উপস্থিত অণুর সংখ্যা = 2 n
∴ 44 g কার্বন ডাইঅক্সাইডে উপস্থিত অণুর সংখ্যা = 2 n
তোমাকে 18 g জল দেওয়া হল তা 120 কোটি ভারতবাসীর প্রত্যেককে সমানভাবে ভাগ করে দিতে বলা হল। তা হলে প্রত্যেক ভারতবাসীর দ্বারা প্রাপ্ত জলের অণুর সংখ্যা কত হবে?
18 g জলে উপস্থিত অণুর সংখ্যা = 6.022 × 1023
120 কোটি = 12 × 108 সংখ্যক ভারতবাসীর মধ্যে 6.022 × 1023 সংখ্যক জলের অণু সমানভাবে ভাগ করলে প্রত্যেক ভারতবাসী দ্বারা প্রাপ্ত জলের অণুর সংখ্যা
= \(\frac{6.022\times10^{23}}{12\times10^8}\)
= 5.018 × 1014
18 g জলে অণুর সংখ্যা n হলে, 100 g CaCO3 ও 44 g CO2 -এ অণুর সংখ্যা কত হবে? [Ca = 40, C = 12, O =16, H = 1]
1 গ্রাম-অণু সকল পদার্থে সমান সংখ্যক অণু থাকে। জলের (H2O) গ্রাম-আণবিক ভর
= (1 × 2) + 16
= 18 g
ক্যালশিয়াম কার্বনেটের (CaCO3) গ্রাম-আণবিক ভর
= 40 + 12 + (16 × 3)
= 100 g
কার্বন ডাইঅক্সাইডের (CO2) গ্রাম-আণবিক ভর
= 12 + (16 × 2)
= 44 g
18 g জলে অণুর সংখ্যা = 100 g CaCO3 -এ অণুর সংখ্যা = 44 g CO2 -এ অণুর সংখ্যা।
∴ 100 g CaCO3 ও 44 g CO2 -এ অণুর সংখ্যা n হবে।
96 g অক্সিজেনের মধ্যে যতগুলি অক্সিজেন অণু বর্তমান, সেই পরিমাণ অণু কত পরিমাণ নাইট্রোজেন গ্যাসের মধ্যে পাওয়া সম্ভব?
অক্সিজেনের আণবিক গুরুত্ব = 32
∴ 32 g অক্সিজেন = 1 গ্রাম-অণু বা 1 মোল O2
32 g অক্সিজেনে অণুর সংখ্যা = 6.022 × 1023
∴ 96 g অক্সিজেনে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times96}{32}\)
= 18.066 × 1023
এখন নাইট্রোজেনের আণবিক গুরুত্ব = 28
অর্থাৎ, 6.022 × 1023 সংখ্যক N2 অণুর ওজন = 28 g
18.066 × 1023 সংখ্যক N2 অণুর ওজন = \(\frac{28\times18.066\times10^{23}}{6.022\times10^{23}}\)
= 84 g
∴ 84 g নাইট্রোজেন গ্যাসের মধ্যে সমসংখ্যক N2 অণু বর্তমান।
বিকল্প পদ্ধতি,
96 g অক্সিজেন = \(\frac{96}{32}=3\) মোল অক্সিজেন।
1 মোল যে-কোনো পদার্থে অ্যাভোগাড্রো সংখ্যক অণু বর্তমান থাকে। সুতরাং, 3 মোল অক্সিজেনে যে সংখ্যক অণু উপস্থিত থাকে (3 N = 3 × 6.022 × 1023), সেই সংখ্যক অণু সমপরিমাণ নাইট্রোজেন গ্যাসে অর্থাৎ, 3 mol N2 গ্যাসে উপস্থিত থাকবে।
3 মোল N2 = 3 × 28 g = 84 g N2 (∵ N2 -এর আণবিক গুরুত্ব = 28) অতএব, 84 g N2 গ্যাসে সমসংখ্যক অণু বর্তমান থাকে।
STP -তে 2 গ্রাম হাইড্রোজেন গ্যাস এবং 2 গ্রাম অক্সিজেন গ্যাসের মধ্যে কোনটিতে অণুর সংখ্যা বেশি? এদের মধ্যে অণু সংখ্যার অনুপাত কত?
1 গ্রাম-অণু হাইড্রোজেন = 2 g হাইড্রোজেন।
সুতরাং, 2 g হাইড্রোজেন গ্যাসে অণুর সংখ্যা = 6.022 × 1023
1 গ্রাম-অণু অক্সিজেন = 32 g অক্সিজেন।
1 g অক্সিজেনে অণুর সংখ্যা = 6.022 × 1023
∴ 2 g অক্সিজেনে অণুর সংখ্যা = \(\frac{6.022\times10^{23}}{32}\)
32 g অক্সিজেনে অণুর সংখ্যা = \(\frac{6.022\times10^{23}}{32}\times2\)
= 3.764 × 1022
সুতরাং, 2 গ্রাম হাইড্রোজেন গ্যাসে অণুর সংখ্যা 2 g অক্সিজেন গ্যাসের অণুর সংখ্যা অপেক্ষা বেশি।
=
= \(\frac{6.022\times10^{23}}{\displaystyle\frac{6.022\times10^{23}\times2}{32}}\)
= \(\frac{6.022\times10^{23}}{6.022\times10^{23}}\times\frac{32}2\)
= \(\frac{16}1\)
= \(16:1\)
সুতরাং, হাইড্রোজেন এবং অক্সিজেন গ্যাসে অণুর সংখ্যার অনুপাত = 16 : 1।
0.09 গ্রাম জলে অক্সিজেন পরমাণু এবং হাইড্রোজেন পরমাণুর সংখ্যা কত?
উত্তর। জলের আণবিক ওজন = (1 × 2) + 16 = 18
18 g জলে অণুর সংখ্যা = 6.022 × 1023
∴ 0.09 g জলে অণুর সংখ্যা = \(\frac{6.022\times10^{23}}{18}\times0.09\)
= 3.011 × 1021
জলের 1টি অণুর মধ্যে অক্সিজেনের পরমাণুর সংখ্যা = 1
∴ 0.09 g জলে অক্সিজেন পরমাণুর সংখ্যা
= 1 × 3.011 × 1021
= 3.011 × 1021
জলের 1টি অণুর মধ্যে হাইড্রোজেনের পরমাণুর সংখ্যা = 2
∴ 0.09 g জলে হাইড্রোজেন পরমাণুর সংখ্যা
= 2 × 3.011 × 1021
= 6.022 × 1021
4.4 গ্রাম কার্বন ডাইঅক্সাইডে কার্বন পরমাণু ও অক্সিজেন পরমাণুর সংখ্যা নির্ণয় করো। [C = 12, O = 16]
কার্বন ডাইঅক্সাইডের আণবিক গুরুত্ব
= 12 + (2 × 16)
= 12 + 32
= 44
44 গ্রাম কার্বন ডাইঅক্সাইডে অণুর সংখ্যা = 6.022 × 1023
4.4 গ্রাম কার্বন ডাইঅক্সাইডে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times4.4}{44}\)
= 6.022 × 1022
1 অণু কার্বন ডাইঅক্সাইডে (CO2) C পরমাণুর সংখ্যা = 1
∴ 6.022 × 1022 সংখ্যক অণুতে C পরমাণুর সংখ্যা
= 1 × 6.022 × 1022
= 6.022 × 1022
1 অণু কার্বন ডাইঅক্সাইডে O পরমাণুর সংখ্যা = 2
∴ 6.022 × 1022 সংখ্যক অণুতে পরমাণুর সংখ্যা
= 2 × 6.022 × 1022
= 12.044 × 1022
24 g ফসফরাসে (P4) উপস্থিত পরমাণু ও অণুর সংখ্যা কত?
ফসফরাসের (P4) গ্রাম-আণবিক ভর = 31 × 4 g
= 124 g
∴ 124 g ফসফরাসে উপস্থিত অণুর সংখ্যা = 6.022 × 1023
যেহেতু 1টি ফসফরাস অণুতে (P4) 4টি ফসফরাস পরমাণু থাকে। অতএব, 124 g ফসফরাসে উপস্থিত পরমাণুর সংখ্যা
= 6.022 × 1023 × 4
= 24.088 × 1023
এক ফোঁটা জলের ভর 0.18 g হলে এতে উপস্থিত মোট পরমাণু সংখ্যা কত?
জলের আণবিক গুরুত্ব = (1 × 2) + 16 = 18
∵ 18 g জলে উপস্থিত অণুর সংখ্যা= 6.022 × 1023টি।
∴ 0.18 g জলে উপস্থিত অণুর সংখ্যা
= \(\frac{6.022\times10^{23}}{18}\times0.18\)
= 6.022 × 1021টি।
জলের 1টি অণুতে (2 + 1) = 3টি পরমাণু উপস্থিত থাকে।
সুতরাং, 0.18 g জলে (এক ফোঁটা জল) মোট পরমাণুর সংখ্যা = 3 × 6.022 × 1021
= 18.066 × 1021টি।
1 মিলি মোল জলে H2O অণু সংখ্যা গণনা করো।
1 মিলি মোল = 10-3 মোল।
1 মোল জলে উপস্থিত অণুর সংখ্যা = 6.022 × 1023
10-3 মোল জলে উপস্থিত অণুর সংখ্যা = 6.022 × 1023 × 10-3
= 6.022 × 1020
∴ 1 মিলি মোল জলে 6.022 × 1020 সংখ্যক জলের অণু উপস্থিত।
1 মিলি মোল জলে H পরমাণুর সংখ্যা গণনা করো।
1টি জলের অণুতে উপস্থিত H পরমাণুর সংখ্যা = 2টি।
6.022 × 1020 সংখ্যক জলের অণুতে উপস্থিত Η পরমাণুর সংখ্যা = 6.022 × 1020
= 12.044 × 1020
∴ 1 মিলি মোল জলে 12.044 × 1020 সংখ্যক H পরমাণু উপস্থিত।
1 মিলি মোল জলে O পরমাণুর সংখ্যা গণনা করো।
1টি জলের অণুতে উপস্থিত O পরমাণুর সংখ্যা = 1টি।
∴ 6.022 × 1020 সংখ্যক জলের অণুতে উপস্থিত O পরমাণু সংখ্যা = 6.022 × 1020
∴ 1 মিলি মোল জলে O পরমাণুর সংখ্যা 6.022 × 1020।
মোল -এর সঙ্গে বিভিন্ন উপসর্গ যোগ করে তৈরি হওয়া এককগুলোর মধ্যে 1 কিলো মোল কত মাইক্রো মোলের সমান?
মোল -এর সঙ্গে বিভিন্ন উপসর্গ যোগ করে বিভিন্ন ছোটো ও বড়ো মাপের একক তৈরি করা যায়। যেমন- মিলি মোল, কিলো মোল, মাইক্রো মোল, ন্যানো মোল।
1 মিলি মোল = 10-3 মোল।
1 কিলো মোল = 103 মোল।
1 মাইক্রো মোল = 10-6 মোল।
1 ন্যানো মোল = 10-9 মোল।
2 মোল N2 ও 2 মোল O2 -এর মধ্যে কার ওজন বেশি?
1 মোল N2 = (14 × 2) = 28 g N2
∴ 2 মোল N2 = (2 × 28) = 56 g N2
1 মোল O2 = (16 × 2) = 32 g O2
∴ 2 মোল O2 = (2 × 32) = 64 g O2
∴ 2 মোল O2 -এর ওজন বেশি।
42 g সুক্রোজ (C12H22O11) -কে 18 g জলে দ্রবীভূত করা হল। দ্রবণে উপস্থিত অক্সিজেন পরমাণুর সংখ্যা নির্ণয় করো।
সুক্রোজের (C12H22O11) গ্রাম-আণবিক ভর
= (12 × 12) + (1 × 22) + (11 × 16)
= 342 g
342 g সুক্রোজে উপস্থিত অণুর সংখ্যা = 6.022 × 1023
3.42 g সুক্লোজে উপস্থিত অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times3.42}{342}\)
= 6.022 × 1021
1টি সুক্রোজ অণুতে উপস্থিত অক্সিজেন পরমাণুর সংখ্যা = 11টি।
∴ 6.022 × 1021 সংখ্যক সুক্রোজ অণুতে উপস্থিত অক্সিজেন পরমাণুর সংখ্যা = 6.022 × 1021 × 11 = 66.242 × 1021
আবার, 18 g জলে অণুর সংখ্যা = 6.022 × 1023
1টি জলের অণুতে উপস্থিত অক্সিজেন পরমাণুর সংখ্যা = 1।
∴ 18 g জলে অক্সিজেন পরমাণুর সংখ্যা= 6.022 × 1023
∴ দ্রবণে উপস্থিত অক্সিজেন পরমাণুর সংখ্যা
= 66.242 × 1021 + 6.022 × 1023
= 0.66242 × 1023 + 6.022 × 1023
= 6.68442 × 1023
12 g অক্সিজেন গ্যাসের মোলসংখ্যা নির্ণয় করো।
অক্সিজেনের মোলার ভর = 32 গ্রাম।
32 গ্রাম অক্সিজেন গ্যাস = 1 মোল
12 গ্রাম অক্সিজেন গ্যাস \(\frac{12}{32}\) মোল = 0.375 মোল।
40 g জলের মোলসংখ্যা নির্ণয় করো।
জলের মোলার ভর = 18 গ্রাম।
∵ 18 গ্রাম জল = 1 মোল
∴ 40 গ্রাম জল = \(\frac{40}{18}\) মোল = 2.22 মোল।
17.6g CO2 -এর মোলসংখ্যা নির্ণয় করো।
CO2 -এর মোলার ভর = 44 গ্রাম।
∵ 44 গ্রাম CO2 = 1 মোল
∴ 17.6 গ্রাম CO2 = \(\frac{17.6}{44}\) মোল = 0.4 মোল।
12.044 × 1023 সংখ্যক হিলিয়াম পরমাণুর মোলসংখ্যা নির্ণয় করো।
6.022 × 1023 সংখ্যক হিলিয়াম পরমাণু = 1 মোল হিলিয়াম পরমাণু
12.044 × 1023 সংখ্যক হিলিয়াম পরমাণু = \(\frac{12.044\times10^{23}}{6.022\times10^{23}}=2\) মোল হিলিয়াম পরমাণু।
18.066 × 1023 সংখ্যক হিলিয়াম অণুর মোলসংখ্যা নির্ণয় করো।
হিলিয়ামের পারমাণবিকতা = 1 অর্থাৎ, হিলিয়ামের অণু ও পরমাণু সমার্থক।
∴ 6.022 × 1023 সংখ্যক হিলিয়াম অণু = 1 মোল হিলিয়াম অণু
18.066 × 1023 সংখ্যক হিলিয়াম অণু \(\frac{18.066\times10^{23}}{6.022\times10^{23}}=3\) মোল হিলিয়াম অণু।
24 g He -এর মোলসংখ্যা নির্ণয় করো।
হিলিয়ামের গ্রাম-আণবিক ভর = 4 g
4 g হিলিয়াম = 1 মোল হিলিয়াম
24 g হিলিয়াম = \(\frac{24}4\) মোল হিলিয়াম = 6 মোল হিলিয়াম।
24 g হিলিয়াম গ্যাসের মোলসংখ্যা = 6।
1000 g জলে মোলসংখ্যা নির্ণয় করো।
জলের মোলার ভর = 18 g
= \(\frac{1000}{18}\)
= 55.55
∴ 1000 g জলে মোলসংখ্যা 55.55।
1 মোল জলের ভর কত?
জলের (H2O) আণবিক ওজন = (2 × 1) + 16 = 18
অর্থাৎ, জলের গ্রাম-আণবিক ওজন = 18 g
1 গ্রাম-অণু জল = 1 মোল জল = 18 g
21 g নাইট্রিক অ্যাসিডে মূলকের সংখ্যা নির্ণয় করো।
\(HNO_3\rightleftharpoons H^++NO_3^-\\\)\(HNO_3\) -এর আণবিক গুরুত্ব = (1 + 14) + (3 × 16) = 63
1টি \(HNO_3\) বিয়োজিত হয়ে 1টি \(NO_3^-\) মূলক উৎপন্ন করে।
∴ 63 g নাইট্রিক অ্যাসিডে \(NO_3^-\) মূলকের সংখ্যা = 6.022 × 1023টি।
∴ 21 g নাইট্রিক অ্যাসিডে \(NO_3^-\) মূলকের সংখ্যা = \(\frac{6.022\times10^{23}}{63}\times21\) টি
= 2.007 × 1023টি।
∴ 21 g নাইট্রিক অ্যাসিডে \(NO_3^-\) মূলক আছে = 2.007 × 1023টি।
0.1 মোল ইক্ষু শর্করায় (C12H22O11) কতগুলি ইলেকট্রন বর্তমান? [C = 12, H = 1, O = 16]
ইক্ষু শর্করার (C12H22O11) আণবিক গুরুত্ব
= (12 × 12) + (1 × 22) + (11 × 16)
= 144 + 22 + 176
= 342
∴ ইক্ষু শর্করার গ্রাম-আণবিক ওজন = 342 g
1 মোল ইক্ষু শর্করা = 342 g
1 মোল ইক্ষু শর্করাতে অণুর সংখ্যা = 6.022 × 1023
∴ 0.1 মোল ইক্ষু শর্করাতে অণুর সংখ্যা = 6.022 × 1023 × 0.1 = 6.022 × 1022
1টি ইক্ষু শর্করার অণুতে মোট ইলেকট্রন সংখ্যা = (6 × 12 + 1 × 22 + 8 × 11) = 182টি।
∴ 6.022 × 1022টি ইক্ষু শর্করার অণুতে ইলেকট্রন সংখ্যা
= 6.022 × 1022 × 182
= 1096.18 × 1022
= 1.096 × 1025টি।
14.2 g সোডিয়াম সালফেট যৌগে সোডিয়াম আয়ন এবং সালফেট আয়নের সংখ্যা নির্ণয় করো। [Na = 23, S = 32, O = 16]
সোডিয়াম সালফেটের (Na2SO4) আণবিক ওজন
=(2 × 23) + (1 × 32) + (4 × 16)
= 142
142 g Na2SO4 = 1 মোল
14.2 g Na2SO4 = 0.1 মোল।
1 মোল Na2SO4 -এ অণুর সংখ্যা = 6.022 × 1023
0.1 মোল Na2SO4 -এ অণুর সংখ্যা = 6.022 × 1023 × 0.1
= 6.022 × 1022
Na2SO4 -এর আয়নায়ন ঘটে এভাবে –
\(Na_2SO_4\rightleftharpoons2Na^++SO_4^{2-}\\\)অর্থাৎ, 1টি Na2SO4 অণু বিয়োজিত হয়ে 2টি Na+ আয়ন এবং 1টি \(SO_4^{2-}\) আয়ন উৎপন্ন হয়।
∴ মোট Na+ আয়নের সংখ্যা = 2 × 6.022 × 1022
= 1.204 × 1023
মোট \(SO_4^{2-}\) আয়নের সংখ্যা = 1 × 6.022 × 1022
= 6.022 × 1022
1 মোল CaCl2 থেকে কত সংখ্যক Ca2+ ও Cl– আয়ন নির্গত হয়?
CaCl2 ⇌ Ca2+ + 2Cl
∴ 1 অণু CaCl2 থেকে 1টি Ca2+ আয়ন এবং 2টি Cl– আয়ন নির্গত হয়।
1 মোল CaCl2 থেকে 1 মোল Ca2+ এবং 2 মোল Cl– আয়ন নির্গত হয়।
1 মোল Ca2+ = 6.022 × 1023 সংখ্যক Ca2+ আয়ন এবং 2 মোল Cl– = 2 × 6.022 × 1023 সংখ্যক Cl– আয়ন
সুতরাং, 1 মোল CaCl2 থেকে 6.022 × 1023 সংখ্যক Ca2+ আয়ন এবং 12.044 × 1023 সংখ্যক Cl– আয়ন নির্গত হয়।
22 g CO2 থেকে 1020 সংখ্যক অণু অপসারণ করলে কতগুলি CO2 অণু পড়ে থাকবে?
CO2 -এর আণবিক ওজন
= 12 + (2 × 16)
= (12 + 32)
= 44
44 g CO2 -তে অণুর সংখ্যা = 6.022 × 1023
1 g CO2 -তে অণুর সংখ্যা = \(\frac{6.022\times10^{23}}{44}\)
22 g CO2 -তে অণুর সংখ্যা = \(\frac{6.022\times10^{23}\times22}{44}\)
= 3.011 × 1023
এর থেকে 1020 সংখ্যক CO2 অণু অপসারণ করলে অবশিষ্ট CO2 অণুর সংখ্যা = ( 3.011 × 1023 – 1020 )
= 1020 × (3011 – 1)
= 1020 × 3010
= 3.01 × 1023
180 L জলের মোলসংখ্যা নির্ণয় করো। [H = 1, O = 16]
180 L জলের ভর = আয়তন × ঘনত্ব
= 180000 mL × 1 g⋅mL-1 [জলের ঘনত্ব = 1 g/mL]
= 180000 g [180 L = 180000 mL]
জলের (H2O) আণবিক গুরুত্ব = 18
∴ জলের গ্রাম-আণবিক ভর = 18 g
∴ 180 L জলের মোলসংখ্যা = \(\frac{180000\;g}{18\;g}=10000\)
নাইট্রোজেনের পারমাণবিক ওজন 14.007 amu হলে নাইট্রোজেন পরমাণুর ভর কত গ্রাম?
নাইট্রোজেনের পারমাণবিক ওজন 14.007 amu
নাইট্রোজেন পরমাণুর ভর = পারমাণবিক ওজন × এক পারমাণবিক ভর একক
= 14.007 × 1.6605 × 10-24 g
= 2.3258 × 10-23 g
100 amu হিলিয়ামে পরমাণুর সংখ্যা নির্ণয় করো।
হিলিয়ামের পারমাণবিক ভর = 4 amu
100 amu হিলিয়ামে পরমাণুর সংখ্যা
=
= \(\frac{100\;amu}{4\;amu}\)
= \(25\)
22 g CO2 -এর NTP -তে আয়তন কত? [C = 12, O = 16]
CO2 -এর আণবিক ওজন = (12 + 16 × 2) = 44
NTP -তে 44 g CO2 -এর আয়তন = 22.4 লিটার
1 g CO2 -এর আয়তন = \(\frac{22.4}{44}\) লিটার
22 g CO2 -এর আয়তন = \(\frac{22.4}{44}\times22\) লিটার
= 11.2 লিটার।
সুতরাং, 22 গ্রাম CO2 -এর NTP -তে আয়তন 11.2 লিটার।
STP -তে 0.44 g একটি গ্যাসের আয়তন 224 cm3 গ্যাসটির আণবিক ভর কত?
224 cm3 গ্যাসের ভর = 0.44 g
224 cm3 গ্যাসের ভর = \(\frac{0.44}{224}\times22400\) g
= 44 g
∴ গ্যাসটির আণবিক ভর = 44।
NTP -তে 5 g একটি গ্যাসের 4 লিটার আয়তন দখল করে। গ্যাসটির আণবিক গুরুত্ব নির্ণয় করো।
গ্যাসের NTP -তে মোলার আয়তন হয় 22.4 লিটার
কোনো গ্যাসের 1 মোল = আণবিক গুরুত্ব।
4 L আয়তনের কোনো গ্যাসের ওজন = 5 g
∴ 1 L আয়তনের কোনো গ্যাসের ওজন = \(\frac54\) g
∴ 22.4 L আয়তনের কোনো গ্যাসের ওজন = \(\frac{5\times22.4}4\) g
সুতরাং, গ্যাসটির আণবিক গুরুত্ব = 28 g
প্রমাণ চাপ ও তাপমাত্রায় 2.24 L সালফার ডাইঅক্সাইড গ্যাসের ভর কত? [S = 32, O = 16]
সালফার ডাইঅক্সাইডের আণবিক ভর = 32 + (16 × 2) = 6
∴ 1 গ্রাম-অণু সালফার ডাইঅক্সাইড = 64 g সালফার ডাইঅক্সাইড।
প্রমাণ চাপ ও উষ্ণতায়,
22.4 L সালফার ডাইঅক্সাইড গ্যাসের ভর = 64 g
2.24 L সালফার ডাইঅক্সাইড গ্যাসের ভর = \(\frac{64}{22.4}\times2.24\) g = 6.4 g
সুতরাং, প্রমাণ চাপ ও তাপমাত্রায় 2.24 L সালফার ডাইঅক্সাইড গ্যাসের ভর 6.4 g
2.5 মোল ক্যালশিয়াম হাইড্রক্সাইডের (কলিচুনের) ওজন কত? [প্রদত্ত Ca = 40, O = 16, H = 1]
ক্যালশিয়াম হাইড্রক্সাইডের সংকেত Ca(OH)2।
ক্যালশিয়াম হাইড্রক্সাইডের আণবিক গুরুত্ব
= 40 + (16 + 1) × 2
= 40 + 34
= 74
∴ Ca(OH)2 -এর গ্রাম-আণবিক ওজন = 74 g
∴ 74 g Ca(OH)2 = 1 মোল Ca(OH)2
1 মোল Ca(OH)2 = 74 g
∴ 2.5 মোল Ca(OH)2 = (74 × 2.5) g = 185 g
সুতরাং, 2.5 মোল Ca(OH)2 -এর ওজন 185 g
STP -তে গ্যাসীয়, এমন একটি যৌগের 3.011 × 1022 সংখ্যক অণুর ভর 3.2 g হলে যৌগটির গ্রাম আণবিক গুরুত্ব নির্ণয় করো। STP -তে 3.2 g গ্যাসীয় যৌগটির আয়তন কত লিটার?
STP -তে,
3.011 × 1022 সংখ্যক অণুর ভর = 3.2 g
1 সংখ্যক অণুর ভর = \(\frac{3.2}{3.011\times10^{22}}\) g
∴ 6.022 × 1023 সংখ্যক অণুর ভর = \(\frac{3.2\times6.022\times10^{23}}{3.011\times10^{22}}\)
= 64 g
∴ যৌগটির গ্রাম-আণবিক গুরুত্ব 64
STP -তে, 64 g গ্যাসীয় যৌগটির আয়তন= 22.4 L
1 g গ্যাসীয় যৌগটির আয়তন = \(\frac{22.4}{64}\) L
∴ 32 g গ্যাসীয় যৌগটির আয়তন = \(\frac{22.4\times3.2}{64}\)
= 1.12 L
∴ STP -তে 3.2 g গ্যাসীয় যৌগটির আয়তন 11.2 L
STP -তে 3 মোল নাইট্রোজেনের আয়তন ও অণুর সংখ্যা নির্ণয় করো।
STP -তে 1 মোল নাইট্রোজেনের আয়তন = 22.4 L
∴ STP -তে 3 মোল নাইট্রোজেনের আয়তন = 22.4 × 3 L = 67.2 L
1 মোল নাইট্রোজেনে অণুর সংখ্যা = 6.022 × 1023
∴ 3 মোল নাইট্রোজেনে অণুর সংখ্যা = 6.022 × 1023 × 3
= 18.066 × 1023
একটি পাত্রে 7.2 × 1020 সংখ্যক সালফার ডাইঅক্সাইড (SO2) গ্যাসের অণু আছে। এর মোলসংখ্যা কত হবে?
সালফার ডাইঅক্সাইড (SO2) গ্যাসের গ্রাম-আণবিক ওজন
= 32 + (2 × 16)
= 32 + 32
= 64
∴ 64 g সালফার ডাইঅক্সাইড = 1 মোল SO2
6.022 × 1023 সংখ্যক SO2 অণু = 1 মোল SO2
∴ 7.2 × 1020 সংখ্যক SO2 অণু = \(\frac{7.2\times10^{20}}{6.022\times10^{23}}\) মোল SO2
= 1.195 × 10-3 মোল SO2
NTP -তে 5.6 L অ্যামোনিয়ার মধ্যে কটি অণু আছে?
NTP -তে,
22.4 L অ্যামোনিয়ার মধ্যে অ্যামোনিয়ার অণু সংখ্যা = 6.022 × 1023
∴ 5.6 L অ্যামোনিয়ার মধ্যে অ্যামোনিয়ার অণু সংখ্যা = \(\frac{6.022\times10^{23}}{22.4}\times5.6\)
= 1.5055 × 1023
NTP -তে 5.6 L অ্যামোনিয়ার মধ্যে কটি H -পরমাণু আছে?
1 অণু অ্যামোনিয়াতে (NH3) H -পরমাণুর সংখ্যা = 3
5.6 লিটার অ্যামোনিয়ার মধ্যে H -পরমাণুর সংখ্যা = 1.5055 × 1023 × 3
= 4.5165 × 1023
NTP -তে 5.6 L অ্যামোনিয়ার মধ্যে কটি N -পরমাণু আছে?
1 অণু অ্যামোনিয়াতে (NH3) N -পরমাণুর সংখ্যা = 1
5.6 লিটার অ্যামোনিয়ার মধ্যে N -পরমাণুর সংখ্যা = 1.5055 × 1023
জলের একটি অণুর ভর কত?
জলের (H2O) আণবিক ওজন = (1 × 2) + 16 = 18
∴ জলের গ্রাম-আণবিক ওজন = 18 g
18 g জলের মধ্যে অণুর সংখ্যা = 6.022 × 1023
6.022 × 1023 সংখ্যক জলের অণুর ওজন = 18 g
∴ 1টি জলের অণুর ওজন = \(\frac{18}{6.022\times10^{23}}\) g
= 2.989 × 10-23 g
C60H122 যৌগের একটি অণুর ওজন কত?
C60H122 -এর গ্রাম-আণবিক ওজন = (12 × 60) + (1 × 122) = 842 g
অর্থাৎ, 6.022 × 1023 সংখ্যক C60H122 অণুর ওজন = 842 g
∴ 1 টি সংখ্যক C60H122 অণুর ওজন = \(\frac{842}{6.022\times10^{23}}\) g
= 139.820 × 10-23 g
একটি হাইড্রোজেন অণুর ভর 1.675 × 10-24 g, 1 মোল হাইড্রোজেনের ভর কত?
1 মোল হাইড্রোজেনে অণুর সংখ্যা = 6.022 × 1023
1টি হাইড্রোজেন অণুর ভর = 1.675 × 10-24 g
6.022 × 1023টি হাইড্রোজেন অণুর ভর = 1.675 × 10-24 × 6.022 × 1023 g
= 1.008 g
সুতরাং, 1 মোল হাইড্রোজেনের ভর 1.008 g
16 g অক্সিজেনে 1 মোল অক্সিজেন পরমাণু থাকলে একটি অক্সিজেন পরমাণুর ভর নির্ণয় করো।
1 মোল অক্সিজেন পরমাণু = 6.022 × 1023টি পরমাণু।
6.022 × 1023টি অক্সিজেন পরমাণুর ভর = 16 g
∴ 1টি অক্সিজেন পরমাণুর ভর = \(\frac{16}{6.022\times10^{23}}\)
= 2.65 × 10-23 g
∴ 1টি অক্সিজেন পরমাণুর ভর 2.65 × 10-23 g
একটি গ্যাসের বাষ্পঘনত্ব 14 হলে তার আণবিক গুরুত্ব কত?
গ্যাসের আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব
= 2 × 14
= 28
একটি গ্যাসের বাষ্পঘনত্ব 14 হলে একটি অণুর ওজন কত?
আমরা জানি,
= \(\frac{28}{6.022\times10^{23}}\) g
= \(4.649\times10^{-23}\) g
64 g অক্সিজেনকে গ্রাম-অণুতে প্রকাশ করো।
অক্সিজেনের গ্রাম-আণবিক ভর = 32 g
32 g অক্সিজেন = 1 গ্রাম-অণু অক্সিজেন
বা, 64 g অক্সিজেন = \(\frac1{32}\times64\) গ্রাম-অণু অক্সিজেন
= 2 গ্রাম-অণু অক্সিজেন
∴ 64 g অক্সিজেন = 2 গ্রাম-অণু অক্সিজেন।
2.2 g কার্বন ডাইঅক্সাইডে গ্রাম-অণুতে প্রকাশ করো।
কার্বন ডাইঅক্সাইডের গ্রাম-আণবিক ভর = 44 g
44 g কার্বন ডাইঅক্সাইড = 1 গ্রাম-অণু কার্বন ডাইঅক্সাইড
2.2 g কার্বন ডাইঅক্সাইড = \(\frac1{44}\times2.2\) গ্রাম-অণু কার্বন ডাইঅক্সাইড
= 0.05 গ্রাম-অণু কার্বন ডাইঅক্সাইড
∴ 2.2 g কার্বন ডাইঅক্সাইড = 0.05 গ্রাম-অণু কার্বন ডাইঅক্সাইড।
0.5 গ্রাম-অণু সালফিউরিক অ্যাসিড বলতে কী বোঝায়?
সালফিউরিক অ্যাসিডের (H2SO4) আণবিক গুরুত্ব
= (2 × 1) + 32 + (4 × 16)
= 2 + 32 + 64
= 98
∴ অ্যাসিডের গ্রাম-আণবিক ওজন = 98 g
0.5 অ্যাসিডের গ্রাম-আণবিক ওজন = 98 × 0.5 = 49 g
0.5 গ্রাম-অণু সালফিউরিক অ্যাসিড বলতে 49 g সালফিউরিক অ্যাসিড বোঝায়।
9.6 g O2 প্রস্তুত করতে কত গ্রাম KClO3 -এর প্রয়োজন?
বিক্রিয়ার সমীকরণ – 2KClO3 = 2KCl + 3O2
2KClO3 = 2 (39 + 35.5 + 3 × 16) = 245 g,
3O2 = 3 (2 × 16) = 96 g
96 g O2 প্রস্তুত করতে 245 g KClO3 -এর প্রয়োজন হবে।
9.6 g O2 প্রস্তুত করতে 245 g KClO3 -এর প্রয়োজন হবে।
= 24.5 g KClO3 -এর প্রয়োজন।
H2O2 -এর বিয়োজনে জল ও অক্সিজেন গ্যাস উৎপন্ন হয়। 6.8 g H2O2 -এর সম্পূর্ণ বিয়োজনে যে পরিমাণ O2 গ্যাস উৎপন্ন হয়, তার ভর এবং STP -তে তার আয়তন নির্ণয় করো।
বিক্রিয়ার সমীকরণ – \(\underset{2\left(2+32\right)g=68g}{2H_2O_2}\rightarrow\underset{\left(2\times18\right)g=36g}{2H_2O}+O_2\)
68 g H2O2 -এর সম্পূর্ণ বিয়োজন O2 উৎপন্ন হয় = 32 g
∴ 6.8 g H2O2 -এর সম্পূর্ণ বিয়োজন O2 উৎপন্ন হয় = 3.2 g
আবার, 32 g অক্সিজেনের আয়তন = 22.4 L
∴ 3.2 g অক্সিজেনের আয়তন = 2.24 L
∴ উৎপন্ন O2 -এর ভর 3.2 g এবং
STP -তে এর আয়তন 2.24 L।
লোহিততপ্ত আয়রনের ওপর দিয়ে স্টিম চালনা করে 2 মোল হাইড্রোজেন উৎপন্ন করতে কী পরিমাণ আয়রনের প্রয়োজন হবে?
বিক্রিয়ার সমীকরণ – 3Fe + 4H2O = Fe3O4 + 4H2
3Fe = 3 × 56 = 168 g,
4H2 = 4 মোল H2
4 মোল হাইড্রোজেন উৎপন্ন হয় 168 g Fe থেকে
∴ 2 মোল হাইড্রোজেন উৎপন্ন হয় = \(\frac{168\times2}4=84\) g Fe থেকে
∴ 2 মোল হাইড্রোজেন উৎপন্ন করতে 84 g আয়রন প্রয়োজন।
অতিরিক্ত লঘু সালফিউরিক অ্যাসিডের সঙ্গে ফেরাস সালফাইডের বিক্রিয়ায় NTP -তে 11.2 L হাইড্রোজেন সালফাইড গ্যাস প্রস্তুত করতে কী পরিমাণ ফেরাস সালফাইড প্রয়োজন? (Fe = 56, S = 32)
বিক্রিয়ার সমীকরণ – FeS + H2SO4 = FeSO4 + H2S
FeS = 56 + 32 = 88 g,
H2S = 34 g = 1 মোল = NTP -তে 22.4 L
NTP -তে 22.4 L H2S পাওয়া যায় 88 g ফেরাস সালফাইড থেকে।
∴ NTP -তে 11.2 L H2S পাওয়া যায় = \(\frac{88\times11.2}{22.4}=44\) g ফেরাস সালফাইড থেকে।
∴ 11.2 L (NTP -তে) H2S প্রস্তুত করতে 44 g ফেরাস সালফাইড প্রয়োজন।
নৈর্ব্যক্তিক প্রশ্নোত্তর
সঠিক উত্তরটি নির্বাচন করো
সর্বপ্রথম অণুর ধারণা করেন –
- অ্যাভোগাড্রো
- ডালটন
- নিউটন
- আইনস্টাইন
উত্তর – 1. অ্যাভোগাড্রো
H = 1, O = 16 হলে 9 g জলে কত মোল জল উপস্থিত?
- 0.5
- 0.75
- 0.9
- 1
উত্তর – 1. 0.5
কোনো মৌলের একটি অণুতে উপস্থিত পরমাণু সংখ্যাকে বলে –
- পারমাণবিকতা
- আণবিকতা
- যোজ্যতা
- তড়িৎ-ঋণাত্মকতা
উত্তর – 1. পারমাণবিকতা
একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসের মধ্যে সমান সংখ্যক পরমাণু থাকে, এটি বলেন –
- অ্যাভোগাড্রো
- ডালটন
- ম্যাক্সওয়েল
- বার্জেলিয়াস
উত্তর – 4. বার্জেলিয়াস
প্রদত্ত কোনটি অর্থহীন? –
- 1 মোল ইলেকট্রন
- 1 মোল Na পরমাণু
- 1 মোল পটাশিয়াম আয়ন
- 1 মোল হাইড্রোজেন
উত্তর – 4. 1 মোল হাইড্রোজেন
কোন্ সংখ্যাকে আণুবীক্ষণিক ও দৃশ্যমান জগতের যোগসূত্র বলা হয়? –
- ভর সংখ্যা
- পারমাণবিক সংখ্যা
- অ্যাভোগাড্রো সংখ্যা
- ইলেকট্রন সংখ্যা
উত্তর – 3. অ্যাভোগাড্রো সংখ্যা
1 মোল অক্সিজেন পরমাণু বলতে বোঝায় –
- 6.022 × 1023 সংখ্যক অক্সিজেন অণু
- 2 × 6.022 × 1023 সংখ্যক অক্সিজেন পরমাণু
- ½ × 6.022 × 1023 সংখ্যক অক্সিজেন পরমাণু
- 6.022 × 1023 সংখ্যক অক্সিজেন পরমাণু
উত্তর – 2. 6.022 × 1023 সংখ্যক অক্সিজেন পরমাণু
34 g অ্যামোনিয়ার সমতুল্য মোল হল –
- 2 মোল
- 1 মোল
- 0.5 মোল
- 10 মোল
উত্তর – 1. 2 মোল
4.4 g CO2 -এ মোলসংখ্যা –
- 1.5 মোল
- 1 মোল
- 1.1 মোল
- 0.1 মোল
উত্তর – 4. 0.1 মোল
72 গ্রাম জল হল –
- 4 মোল
- 2 মোল
- 3 মোল
- 1 মোল
উত্তর – 1. 4 মোল
অ্যাভোগাড্রো সংখ্যা প্রযোজ্য –
- কেবল তরলে
- কেবল কঠিনে
- তরল ও গ্যাসে
- কঠিন, তরল ও গ্যাসের সবকটির জন্য
উত্তর – 4. কঠিন, তরল ও গ্যাসের সবকটির জন্য
100 গ্রাম জল কত মোল জল? –
- 5.56
- 55.6
- 18
- 91
উত্তর – 1. 5.56
একই চাপ ও উষ্ণতায় 10 L N2 এবং 10 L ‘X’ গ্যাসে সমসংখ্যক অণু থাকলে, ‘X’ গ্যাসটি হবে –
- H2
- NO
- CO2
- সবকটি
উত্তর – 4. সবকটি
অ্যাভোগাড্রো সংখ্যার মান নীচের কোনটির ওপর নির্ভর করে? –
- চাপ
- উষ্ণতা
- তড়িৎপ্রবাহ
- কোনোটির ওপর নয়
উত্তর – 4. কোনোটির ওপর নয়
22 গ্রাম CO2 -তে অণুর সংখ্যা –
- 6.022 × 1023
- 3.0115 × 1023
- 3.0115 × 1025
- 2.023 × 1023
উত্তর – 2. 3.0115 × 1023
অণুর সংখ্যা সর্বোচ্চ –
- 7 g N2 -এ
- 2 g H2 -এ
- 16 g O2 -এ
- 1 g H2 -এ
উত্তর – 2. 2 g H2
18 g জলে অণুর সংখ্যা n হলে 66 g CO2 -তে অণুর সংখ্যা হবে –
- 0.5 n
- 1.5 n
- n
- 2 n
উত্তর – 2. 1.5 n
36 g জলে অণুর সংখ্যা –
- 6.022 × 1023
- 12.044 × 1023
- 3.011 × 1023
- 9.0345 × 1023
উত্তর – 2. 12.044 × 1023
কোনটিতে অণুর সংখ্যা সর্বাধিক? –
- 0.5 mol SO2
- 0.5 mol Na
- 0.5 mol O2
- সবগুলিতেই
উত্তর – 4. সবগুলিতেই সমান
কোনটিতে পরমাণুর সংখ্যা সর্বাধিক? –
- 28 g N2
- 18 g H2O
- 17 g NH3
- 16 g CH4
উত্তর – 4. 16 g CH4
16 g সালফার ডাইঅক্সাইডে পরমাণুর সংখ্যা –
- 16 × 6.022 × 1023
- 0.25 × 6.022 × 1023
- 0.5 × 6.022 × 1023
- 0.75 × 6.022 × 1023
উত্তর – 4. 0.75 × 6.022 × 1023
1.71 গ্রাম চিনি চায়ে যোগ করলে ওই পরিমাণ চিনিতে কার্বন পরমাণুর সংখ্যা –
- 3.6 × 1022
- 7.2 × 1022
- 6.6 × 1022
- কোনোটিই নয়
উত্তর – 1. 3.6 × 1022
0.5 মোল পটাশিয়াম ফেরোসায়ানাইডে কার্বনের পরিমাণ –
- 1.5 mol
- 36 g
- 18 g
- 3.6 g
উত্তর – 2. 36 g
কার্বন মনোক্সাইডের 6.022 × 1024 সংখ্যক অণুর মধ্যে কত মোল অক্সিজেন পরমাণু আছে? –
- 10 মোল
- 5 মোল
- 1 মোল
- 0.5 মোল
উত্তর – 1. 10 মোল
1 কিলো মোল জলের মধ্যে ইলেকট্রন সংখ্যা –
- 6.022 × 1026
- 6.022 × 1027
- 6.022 × 1023
- 6.022 × 1020
উত্তর – 2. 6.022 × 1027
3.011 × 1023 সংখ্যক ইলেকট্রন কত মোল ইলেকট্রনের সমান? –
- 0.5 মোল
- 1 মোল
- 1.5 মোল
- 2 মোল
উত্তর – 1. 0.5 মোল
12 g কার্বনে অণুর সংখ্যা –
- 12
- 1200
- 6.022 × 1023
- 6.023 × 10-23
উত্তর – 3. 6.022 × 1023
2 mol জলে H -পরমাণুর সংখ্যা –
- NA
- 2NA
- \(\frac34\)NA
- 4NA
উত্তর – 4. 4NA
1 মোল NH3 ও 1 মোল CO2 -এর মধ্যে –
- NH3 -তে বেশি অণু থাকে
- CO2 -তে বেশি অণু থাকে
- উভয়ের মধ্যে সমসংখ্যক পরমাণু থাকে
- উভয়ের মধ্যেই সমসংখ্যক অণু থাকে
উত্তর – 4. উভয়ের মধ্যেই সমসংখ্যক অণু থাকে
1 গ্রাম জল = ___ সংখ্যক জলের অণু –
- \(\frac{N_A}{18}\\\)
- \(\frac{N_A}3\\\)
- \(\frac{N_A}{16}\\\)
- \(\frac{N_A}2\\\)
উত্তর – 1. \(\frac{N_A}{18}\)
STP -তে 11.2 L SO2 গ্যাসে মোট পরমাণু সংখ্যা –
- 4 NA
- 2 NA
- 1.5 NA
- NA
উত্তর – 3. 1.5 NA
12 গ্রাম-অণু কার্বনে X পরমাণু থাকলে 12 গ্রাম Mg -এ পরমাণু সংখ্যা –
- x
- \(\frac x2\)
- 2x
- 1.5x
উত্তর – 2. \(\frac x2\)
18 গ্রাম জলে অণুর সংখ্যা –
- 6.022 × 1023
- 0.622 × 1023
- 12.044 × 1023
- 18
উত্তর – 1. 6.022 × 1023
10 মোল চিনিতে উপস্থিত অণুর সংখ্যা হল –
- 6.022 × 1024
- 6.022 × 10-25
- 6.022 × 10-23
- 6.022 × 1023
উত্তর – 1. 6.022 × 1024
কোনটিতে ন্যূনতম সংখ্যক অণু বর্তমান? –
- 16 g CO
- 8 g O2
- 4 g N2
- 2 g H2
উত্তর – 3. 4 g N2
অ্যামোনিয়ার গ্রাম-আণবিক ওজন হল –
- 34 গ্রাম
- 17 গ্রাম
- 20 গ্রাম
- 2 গ্রাম
উত্তর – 2. 17 গ্রাম
অক্সিজেনের গ্রাম-পারমাণবিক ওজন হল –
- 16 গ্রাম
- 32 গ্রাম
- 8 গ্রাম
- 4 গ্রাম
উত্তর – 1. 16 গ্রাম
পারমাণবিক ভর এককের মান হল –
- 1.66 × 10-24 kg
- 1.66 × 10-24 g
- 1.66 × 10-27 g
- 1.66 × 10-25 g
উত্তর – 2. 1.66 × 10-24 g
1 ডালটন = ? –
- 1.6605 × 10-24 g
- 1.6725 × 10-24 g
- 1.675 × 10-24 g
- 9.11 × 10-28 g
উত্তর – 1. 1.6605 × 10-24 g
কোনটির গ্রাম-আণবিক ভর ও গ্রাম-পারমাণবিক ভর সমান? –
- সালফার
- নাইট্রোজেন
- জেনন
- ওজোন
উত্তর – 3. জেনন
2 গ্রাম-অণু নাইট্রোজেন বলতে বোঝায় –
- 2 গ্রাম নাইট্রোজেন
- 14 গ্রাম নাইট্রোজেন
- 28 গ্রাম নাইট্রোজেন
- 56 গ্রাম নাইট্রোজেন
উত্তর – 4. 56 গ্রাম নাইট্রোজেন
NTP -তে 0.25 mol HCl -এর আয়তন –
- 22.4 L
- 5.6 L
- 11.2 L
- 44.8 L
উত্তর – 2. 5.6 L
98 g H2SO4 (আণবিক ভর 98) থেকে কত মোল H+ পাওয়া যাবে? –
- 1 মোল
- 2 মোল
- ½ মোল
- কোনোটিই নয়
উত্তর – 2. 2 মোল
প্রমাণ চাপ ও উষ্ণতায় 1 g H2 গ্যাসের আয়তন হল –
- 5600 mL
- 22400 mL
- 11200 mL
- 2800 mL
উত্তর – 3. 11200 mL
0.1 মোল অক্সিজেনের STP -তে আয়তন হল –
- 11.2 L
- 22.4 L
- 44.8 L
- 2.24 L
উত্তর – 4. 2.24 L
STP -তে 2 g -অণু CO2 -এর আয়তন –
- 22.4 লিটার
- 44.8 লিটার
- 11.2 লিটার
- 2.24 লিটার
উত্তর – 2. 44.8 লিটার
amu এককের মান নির্ধারণের জন্য যে পরমাণুর ভরকে প্রমাণ হিসেবে ধরা হয় তা হল –
- \({}_6^{12}C\\\)
- \({}_6^{13}C\\\)
- \({}_6^{14}C\\\)
- \({}_6^{16}C\\\)
উত্তর – 1. \({}_6^{12}C\)
STP -তে কোনো গ্যাসের মোলার আয়তন –
- 1 L
- 111 L
- 22.4 L
- 56 L
উত্তর – 3. 22.4 L
STP -তে একটি গ্যাসের 22.4 L আয়তনের ভর 32 g। গ্যাসটির সংকেত –
- N2
- NO2
- NH3
- O2
উত্তর – 4. O2
STP -তে 22.4 লিটার আয়তনসম্পন্ন গ্যাসটি হল –
- 1 গ্রাম-অণু O2
- 1 গ্রাম-পরমাণু O
- 2 গ্রাম-অণু O2
- \(\frac12\) গ্রাম-অণু O2
উত্তর – 1. 1 গ্রাম-অণু O2
1 amu = কত গ্রাম? –
- 1.6605 × 10-24
- 6.023 × 1023
- 3.0115 × 1023
- 5.0235 × 10-20
উত্তর – 1. 1.6605 × 10-24
একটি O16 পরমাণুর পরম ভর –
- 16
- 16 g
- 16 amu
- 16 kg
উত্তর – 3. 16 amu
10 মোল অ্যামোনিয়ার ভর –
- 17 g
- 1.7 g
- 170 g
- 34 g
উত্তর – 3. 170 g
H3PO4 এর সংকেত ওজন হবে –
- 89
- 90
- 99
- 98
উত্তর – 4. 98
কোনো মৌলের 6.022 × 1020 সংখ্যক কণার ভর 0.012 g হলে, মৌলটির পারমাণবিক গুরুত্ব হবে –
- 11
- 12
- 13
- 14
উত্তর – 2. 12
সোডিয়াম ক্লোরাইডের সংকেত ওজন হল –
- 50.5
- 58.5
- 48.5
- 60.5
উত্তর – 2. 58.5
সালফারের পারমাণবিক গুরুত্ব 32 হলে, 2.5 গ্রাম-পরমাণু সালফারের ভর হবে –
- 60 g
- 80 g
- 16 g
- 90 g
উত্তর – 2. 80 g
হাইড্রোজেন স্কেলে সোডিয়ামের পারমাণবিক ভর 23, কার্বন স্কেলে ওই পারমাণবিক ভর –
- \(23\times12\\\)
- \(23\\\)
- \(23\times\frac1{12}\\\)
- \(12\times\frac1{23}\\\)
উত্তর – 2. \(23\)
গ্রাম-অণু ও গ্রাম-পরমাণুর মান একই যে মৌলের –
- অক্সিজেন
- হিলিয়াম
- হাইড্রোজেন
- ক্লোরিন
উত্তর – 2. হিলিয়াম
একটি N -পরমাণুর প্রকৃত ভর –
- 14 g
- 28 g
- 14 u
- 15
উত্তর – 3. 14 u
1 ডেসিমোল জলের ভর –
- 18 g
- 0.18 g
- 1.8 g
- 0.018 g
উত্তর – 3. 1.8 g
নাইট্রোজেনের বা অক্সিজেনের আণবিক ভর M এবং অ্যাভোগাড্রো সংখ্যা N হলে একটি নাইট্রোজেন M পরমাণুর প্রকৃত ভর –
- \(\frac M{2N}g\\\)
- \(\frac{2M}Ng\\\)
- \(\frac N{2M}g\\\)
- \(\frac{2N}Mg\\\)
উত্তর – 3. \(\frac N{2M}g\)
একটি কার্বন – 12 পরমাণুর তুলনায় একটি সালফার পরমাণু মোটামুটিভাবে কত গুণ ভারী? –
- \(32\\\)
- \(\frac83\\\)
- \(\frac{12}{32}\\\)
- \(\frac1{12}\\\)
উত্তর – 4. \(\frac1{12}\)
4 g ভরের একটি ত্রি-পরমাণুক গ্যাসের আয়তন NTP -তে 1.4 L। গ্যাসটির মোলার ভর –
- 32 g⋅mol-1
- 16 g⋅mol-1
- 64 g⋅mol-1
- 13.6 g⋅mol-1
উত্তর – 3. 64 g⋅mol-1
এক মিলিমোল NH3 -এর ভর –
- 17 g
- 0.17 g
- 0.017 g
- 34 g
উত্তর – 3. 0.017 g
সোডিয়াম ক্লোরাইডের আণবিক ভর 58.5, এই উক্তিটি ঠিক নয়, কারণ –
- এটি তেজস্ক্রিয় পদার্থ
- এটি কঠিন পদার্থ
- NaCl অণুর কোনো পৃথক অস্তিত্ব নেই
- কোনোটিই নয়
উত্তর – 3. NaCl অণুর কোনো পৃথক অস্তিত্ব নেই
এক মোল অক্সিজেন গ্যাস বললে প্রদত্ত কোন্ বক্তব্যটি ঠিক নয়? –
- 32 g অক্সিজেন
- অ্যাভোগাড্রো অক্সিজেন পরমাণু
- অ্যাভোগাড্রো সংখ্যক অক্সিজেন অণু
- STP -তে আয়তন 22.4 L
উত্তর – 3. অ্যাভোগাড্রো সংখ্যক অক্সিজেন পরমাণু
শূন্যস্থান পূরণ করো
নিষ্ক্রিয় গ্যাস ব্যতীত অন্য গ্যাসীয় মৌলের অণু ___।
উত্তর – নিষ্ক্রিয় গ্যাস ব্যতীত অন্য গ্যাসীয় মৌলের অণু দ্বি-পরমাণুক।
হাইড্রোজেনের পারমাণবিকতা ___।
উত্তর – হাইড্রোজেনের পারমাণবিকতা 2।
একটি ত্রি-পরমাণুক গ্যাস হল ___।
উত্তর – একটি ত্রি-পরমাণুক গ্যাস হল ওজোন (O3)।
অক্সিজেন গ্যাসের বাষ্পঘনত্ব হল ___।
উত্তর – অক্সিজেন গ্যাসের বাষ্পঘনত্ব হল 16 গ্রাম।
যৌগিক পদার্থের ক্ষুদ্রতম কণা হল ___।
উত্তর – যৌগিক পদার্থের ক্ষুদ্রতম কণা হল অণু।
নিষ্ক্রিয় গ্যাসগুলির ___ এক হওয়ায়, এদের অণু ও ___ সমার্থক।
উত্তর – নিষ্ক্রিয় গ্যাসগুলির পারমাণবিকতা এক হওয়ায়, এদের অণু ও পরমাণু সমার্থক।
অ্যাভোগাড্রো সংখ্যার মান নির্ণয় করেন ___।
উত্তর – অ্যাভোগাড্রো সংখ্যার মান নির্ণয় করেন মিলিকান।
গ্যাসের আণবিক গুরুত্ব বাষ্পীয় ঘনত্বের ___।
উত্তর – গ্যাসের আণবিক গুরুত্ব বাষ্পীয় ঘনত্বের দ্বিগুণ।
আণবিক গুরুত্বকে গ্রামে প্রকাশ করলে তাকে ___ বলে।
উত্তর – আণবিক গুরুত্বকে গ্রামে প্রকাশ করলে তাকে গ্রাম-আণবিক ওজন বলে।
1 মোল কোনো পদার্থে অণুর সংখ্যা ___।
উত্তর – 1 মোল কোনো পদার্থে অণুর সংখ্যা 6.022 × 1023।
NTP -তে 11.2 লিটার CO2 -তে অণুর সংখ্যা ___।
উত্তর – NTP -তে 11.2 লিটার CO2 -তে অণুর সংখ্যা 3.011 × 1023।
3 গ্রাম-অণু জল = ___ গ্রাম জল।
উত্তর – 3 গ্রাম-অণু জল = 54 গ্রাম জল।
0.1 মোল সুক্রোজের ভর ___। [C = 12, H = 1,0 = 16]
উত্তর – 0.1 মোল সুক্রোজের ভর 34.2 g। [C = 12, H = 1,0 = 16]
3.6 গ্রাম জলে ___ মোল জলের অণু আছে।
উত্তর – 3.6 গ্রাম জলে 0.2 মোল জলের অণু আছে।
সালফিউরিক অ্যাসিডের আণবিক ভর হল ___।
উত্তর – সালফিউরিক অ্যাসিডের আণবিক ভর হল 98।
AxByCz যৌগে A, B এবং C -এর পারমাণবিক ভর যথাক্রমে a, b এবং c হলে এই যৌগের আণবিক ভর ___।
উত্তর – AxByCz যৌগে A, B এবং C -এর পারমাণবিক ভর যথাক্রমে a, b এবং c হলে এই যৌগের আণবিক ভর ax + by + cz।
1 মোল নাইট্রোজেনের ভর ___।
উত্তর – 1 মোল নাইট্রোজেনের ভর 28 গ্রাম।
পারমাণবিক ভর এককের মান ___।
উত্তর – পারমাণবিক ভর এককের মান 1.6605 × 10-24।
NTP -তে 1 মোল গ্যাসের আয়তন ___।
উত্তর – NTP -তে 1 মোল গ্যাসের আয়তন 22.4 লিটার।
NTP -তে 32 গ্রাম SO2 -এর আয়তন ___।
উত্তর – NTP -তে 32 গ্রাম SO2 -এর আয়তন 11.2 লিটার।
অ্যাভোগাড্রো সংখ্যার মান ___।
উত্তর – অ্যাভোগাড্রো সংখ্যার মান 6.022 × 1023।
ঠিক বা ভুল নির্বাচন করো
অ্যাভোগাড্রো সূত্রানুযায়ী, একই চাপ ও উষ্ণতায় সমআয়তন সকল গ্যাসে সমান সংখ্যক পরমাণু বর্তমান।
উত্তর – ভুল।
সঠিক উত্তর – অণু।
গ্যাসের বাষ্পঘনত্ব = 2 × আণবিক গুরুত্ব।
উত্তর – ভুল।
সঠিক উত্তর – আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব।
\({}_6^{12}C\) পরমাণুর 12 গ্রামে অ্যাভোগাড্রো সংখ্যক কার্বন পরমাণু বর্তমান।
উত্তর – ঠিক।
35.5 গ্রাম ক্লোরিনে উপস্থিত অণুর সংখ্যা 6.022 × 1023।
উত্তর – ভুল।
সঠিক উত্তর – 3.0115 × 1023।
এক মোল ওজোন গ্যাসে অক্সিজেন পরমাণুর সংখ্যা 6.022 × 1023।
উত্তর – ভুল।
সঠিক উত্তর – অণুর সংখ্যা।
0.1 মোল CO2 -তে 0.1 মোল O2 উপস্থিত।
উত্তর – ঠিক।
1 মোল অ্যামোনিয়াতে মোট ও মোল পরমাণু আছে।
উত্তর – ভুল।
সঠিক উত্তর – 4 মোল।
STP -তে সমআয়তন সকল গ্যাসে সমসংখ্যক অণু থাকে।
উত্তর – ঠিক।
1 মোল নাইট্রোজেনে 2 গ্রাম-পরমাণু নাইট্রোজেন থাকে।
উত্তর – ঠিক।
1 গ্রাম জল অপেক্ষা 1 গ্রাম স্টিমে অণুর সংখ্যা বেশি।
উত্তর – ভুল।
সঠিক উত্তর – সমান।
STP -তে 1 গ্রাম হাইড্রোজেন 22.4 লিটার আয়তন দখল করে।
উত্তর – ভুল।
সঠিক উত্তর – 11.2 লিটার।
12C স্কেলে ক্লোরিনের পারমাণবিক গুরুত্ব 35.453 হলে একটি ক্লোরিন পরমাণুর ভর 35.453 U।
উত্তর – ঠিক।
জলের 1টি অণুর ভর \(\frac{18}Ng\)।
উত্তর – ঠিক।
সোডিয়াম ক্লোরাইডের আণবিক গুরুত্ব 58.44।
উত্তর – ঠিক।
দু-একটি শব্দে উত্তর দাও
পরমাণুবাদের জনক কাকে বলে?
বিজ্ঞানী জন ডালটন।
পারমাণবিকতা B এরূপ একটি মৌলের উদাহরণ দাও।
পারমাণবিকতা B এরূপ একটি মৌলের উদাহরণ হল সালফার।
নিষ্ক্রিয় গ্যাসগুলির পারমাণবিকতা কত?
নিষ্ক্রিয় গ্যাসগুলির পারমাণবিকতা 1
একটি গ্যাসীয় মৌলের নাম লেখো যার অণু ও পরমাণু সমার্থক।
একটি গ্যাসীয় মৌলের হল হিলিয়াম যার অণু ও পরমাণু সমার্থক।
মোল শব্দটি প্রথম কোন্ বিজ্ঞানী ব্যবহার করেছিলেন?
মোল শব্দটি প্রথম বিজ্ঞানী অসওয়াল্ড বিজ্ঞানী ব্যবহার করেছিলেন।
একটি নির্দিষ্ট চাপে ও নির্দিষ্ট উষ্ণতায় V আয়তন কার্বন ডাইঅক্সাইড গ্যাসে n সংখ্যক অণু থাকলে একই চাপ ও উষ্ণতায় V আয়তন অক্সিজেন গ্যাসে অণুর সংখ্যা কত?
একটি নির্দিষ্ট চাপে ও নির্দিষ্ট উষ্ণতায় V আয়তন কার্বন ডাইঅক্সাইড গ্যাসে n সংখ্যক অণু থাকলে একই চাপ ও উষ্ণতায় V আয়তন অক্সিজেন গ্যাসে অণুর সংখ্যা n।
SI -তে পদার্থের পরিমাণের একক কী?
SI -তে পদার্থের পরিমাণের একক হল মোল।
NaCl ও H2O -এর মধ্যে কোন্ যৌগের ক্ষেত্রে সংকেত ভরের ধারণা ব্যবহার করা উচিত?
NaCl যৌগের ক্ষেত্রে।
1 গ্রাম-অণু অক্সিজেন বলতে কী বোঝায়?
32 গ্রাম অক্সিজেন।
অক্সিজেনের একটি পরমাণুর ভর 16 amu হলে গ্যাসীয় অক্সিজেনের আণবিক গুরুত্ব কত?
অক্সিজেনের একটি পরমাণুর ভর 16 amu হলে গ্যাসীয় অক্সিজেনের আণবিক গুরুত্ব 32।
কার্বন স্কেলে পারমাণবিক ভর নির্ণয়ের সময় কার্বনের কোন্ আইসোটোপটিকে প্রামাণ্য ধরা হয়?
কার্বন স্কেলে পারমাণবিক ভর নির্ণয়ের সময় কার্বনের 12C আইসোটোপটিকে প্রামাণ্য ধরাহয়।
1 মিলি মোল H2 = কত গ্রাম H2?
1 মিলি মোল H2 = 2 × 10-3 গ্রাম H2।
1 মিলি মোল অ্যামোনিয়ার ভর কত?
1 মিলি মোল অ্যামোনিয়ার ভর 17 × 10-3 গ্রাম।
1.5 × 10-2 g জলে অণুর সংখ্যা 5 × 1020। জলের আণবিক ভর কত?
1.5 × 10-2 g জলে অণুর সংখ্যা 5 × 1020। জলের আণবিক ভর \(\frac{1.5\times10^{-2}\times6.022\times10^{23}}{5\times10^{20}}=18.066\)
9 g জলীয় বাষ্পের আয়তন STP -তে কত mL?
9 g জলীয় বাষ্পের আয়তন STP -তে কত 11200 mL।
নাইট্রিক অক্সাইডের এক গ্রাম-অণুর মান কত?
নাইট্রিক অক্সাইডের এক গ্রাম-অণুর মান 30 g।
1টি C-12 পরমাণুর ভরের \(\frac1{12}\) অংশ = কত?
1টি C-12 পরমাণুর ভরের \(\frac1{12}\) অংশ = 1.66 × 10-24 g।
3.4 g অ্যামোনিয়া গ্যাসের মধ্যে কতগুলি অণু আছে?
3.4 g অ্যামোনিয়া গ্যাসের মধ্যে 1.2044 × 1023 গুলি অণু আছে।
32 g কঠিন সালফারে S8 অণুর সংখ্যা কত?
32 g কঠিন সালফারে S8 অণুর সংখ্যা 7.53 × 1022।
28 g N2, 32 g O2, 18 g H2O ও 100 g CaCO3 -এর মধ্যে কোনটির অণুর সংখ্যা বেশি?
সব ক্ষেত্রেই অণুর সংখ্যা সমান [কারণ প্রত্যেকটি 1 মোল পদার্থ]
4.25 g NH3 -তে পরমাণুর সংখ্যা কত? [N = 14, H = 1]
4.25 g NH3 -তে পরমাণুর সংখ্যা 6.022 × 1023।
49 g H2SO4 -এ মোট পরমাণু সংখ্যার মান কত?
49 g H2SO4 -এ মোট পরমাণু সংখ্যার মান \(\frac{49}{98}\times6.022\times10^{23}\times7=21.077\times10^{23}\)।
11.5 g সোডিয়ামে পরমাণুর সংখ্যা কত?
11.5 g সোডিয়ামে পরমাণুর সংখ্যা 3.011 × 1023।
70 g নাইট্রোজেনে গ্রাম-পরমাণুর সংখ্যা কত?
70 g নাইট্রোজেনে গ্রাম-পরমাণুর সংখ্যা 5 গ্রাম-পরমাণু।
18 g H2O এবং 18 g CO2 -এর মধ্যে কোনটিতে পরমাণুর সংখ্যা বেশি?
18 g H2O -এ; [3 × 6.022 ×1023]
1 মোল অণু হাইড্রোজেনে ইলেকট্রনের সংখ্যা কত?
1 মোল অণু হাইড্রোজেনে ইলেকট্রনের সংখ্যা 2 × 6.022 × 1023।
1 মোল Na+ আয়নে Na+ আয়নের সংখ্যা কত?
1 মোল Na+ আয়নে Na+ আয়নের সংখ্যা 6.022 × 1023।
STP -তে V লিটার হাইড্রোজেন গ্যাসে অণুর সংখ্যা n হলে, STP -তে \(\frac V{10}\) লিটার CO2 গ্যাসে অণুর সংখ্যা কত হবে?
STP -তে V লিটার হাইড্রোজেন গ্যাসে অণুর সংখ্যা n হলে, STP -তে \(\frac V{10}\) লিটার CO2 গ্যাসে অণুর সংখ্যা \(\frac n{10}\) হবে।
12.044 × 1024 সংখ্যক ইলেকট্রন সমান কত মোল ইলেকট্রন?
12.044 × 1024 সংখ্যক ইলেকট্রন সমান 20 মোল ইলেকট্রন।
1 গ্রাম মোল H2O বলতে কত গ্রাম জল বোঝানো হয়েছে?
1 গ্রাম মোল H2O বলতে 18 গ্রাম জল বোঝানো হয়েছে।
0.1 মোল CaCO3 -কে HCl -এর সঙ্গে বিক্রিয়া ঘটালে NTP -তে কত আয়তনের CO2 উৎপন্ন হবে?
0.1 মোল CaCO3 -কে HCl -এর সঙ্গে বিক্রিয়া ঘটালে NTP -তে 2.24 L আয়তনের CO2 উৎপন্ন হবে।
3.5 g Cl2 -এর STP-তে আয়তন কত?
3.5 g Cl2 -এর STP-তে আয়তন \(\left(\frac{3.5}{71}\right)\times22.4=1.104\;L\)।
STP -তে 2.8 g নাইট্রোজেন গ্যাসের আয়তন কত?
STP -তে 2.8 g নাইট্রোজেন গ্যাসের আয়তন 2.24 L।
0.5 মোল অক্সিজেনের ভর কত?
0.5 মোল অক্সিজেনের ভর 16 g।
1 মোল সোডিয়াম (Na) ও 1 মোল অক্সিজেনের (O2) মধ্যে কোনটি ভারী?
1 মোল সোডিয়াম (Na) ও 1 মোল অক্সিজেনের (O2) মধ্যে 1 মোল অক্সিজেন ভারী।
একটি \({}_{92}^{235}U\) পরমাণুর ভর 235 u হলে kg এককে এর ভর কত?
একটি \({}_{92}^{235}U\) পরমাণুর ভর 235 u হলে kg এককে এর ভর 390.1 × 10-27 kg।
একটি অক্সিজেন পরমাণুর প্রকৃত ভর কত?
একটি অক্সিজেন পরমাণুর প্রকৃত ভর (16 × 1.6605 × 10-24) g = 26.568 × 10-24 g।
এক কেজি মোল কার্বন ডাইঅক্সাইডের ভর কত?
এক কেজি মোল কার্বন ডাইঅক্সাইডের ভর 44 kg।
ইথাইল অ্যালকোহলের পারমাণবিক গুরুত্ব কত?
ইথাইল অ্যালকোহলের পারমাণবিক গুরুত্ব 46।
SI এককে 1 মোল পরিমাণ কার্বন ডাইঅক্সাইডের ভর কত?
SI এককে 1 মোল পরিমাণ কার্বন ডাইঅক্সাইডের ভর 0.044 kg।
CO2 অণুতে কার্বনের শতকরা পরিমাণ কত?
CO2 অণুতে কার্বনের শতকরা পরিমাণ \(\frac{12}{44}\times100=27.27\%\)।
ছুঁচোর ইংরাজি নাম ‘Mole’ হওয়ায় একে রসায়নে ‘Mole animal’ হিসেবে ব্যবহার করা হয় এবং Mole Day-এর প্রতীক হিসেবে বেছে নেওয়া হয়েছে—এর কারণ ব্যাখ্যা করো।
ছুঁচোর ইংরাজি নাম ‘Mole’ হবার কারণে একে mole animal হিসেবে রসায়নের ক্ষেত্রেও ব্যবহার করা হয়। Mole day -এর প্রতীক হিসেবেও তাই ছুঁচোকেই বেছে নেওয়া হয়েছে।
কোয়ার্ক কী?
প্রোটন, নিউট্রন ও ইলেকট্রন কণা অসংখ্য ক্ষুদ্র ক্ষুদ্র কণার সমন্বয়ে গঠিত, যার নাম ‘কোয়ার্ক’।
অ্যামেদিও অ্যাভোগাড্রো তাঁর জীবদ্দশায় তাঁর আবিষ্কারগুলির জন্য কোনো পুরস্কার পাননি। এর প্রধান কারণ কী?
রসায়ন এবং পদার্থবিদ্যায় অ্যামেদিও অ্যাভোগাড্রোর অবদান অসীম। তবুও তাঁর জীবনকালে তিনি তাঁর আবিষ্কারগুলির জন্য কোনো পুরস্কার পাননি। কারণ – তাঁর আবিষ্কারগুলি সময়ের চেয়ে অনেকটাই এগিয়ে ছিল এবং সেগুলিকে গুরুত্বপূর্ণ বলে মনে করা হয়নি। মৃত্যুর পর তাঁকে সম্মান জানাতে একটি ইতালীয় স্ট্যাম্প বের করা হয়।
প্রতি বছর অক্টোবর মাসে কোন তারিখে এবং কখন থেকে কখন পর্যন্ত ‘Mole Day’ উদ্যাপন করা হয়, এবং এটি কীসের প্রতি শ্রদ্ধা জানাতে পালন করা হয়?
প্রতি বছর অক্টোবর মাসে 23 তারিখ 6:02 am থেকে 6:02 pm পর্যন্ত রসায়ন জগতে অ্যাভোগাড্রো সংখ্যা আবিষ্কারের প্রতি শ্রদ্ধা জানাতে ‘Mole Day’ উদ্যাপন করা হয়। সময় এবং তারিখটি অ্যাভোগাড্রো সংখ্যা থেকেই তৈরি। Maurice Oehler নামে একজন রসায়ন শিক্ষক এই দিনটি শুরু করেন।
বামদিকের সঙ্গে ডানদিক মিল করো
নীচের বামদিকের সঙ্গে ডানদিক মিলিয়ে লেখো।
| বামদিক | ডানদিক | উত্তর |
| 1. ওজোনের পারমাণবিকতা | a. 56 গ্রাম | 1 → e |
| 2. গ্যাসের আণবিক গুরুত্ব বাষ্পঘনত্বের | b. গাঢ়ত্ব 0.5 মোল⋅L-1 | 2 → d |
| 3. 2 মোল নাইট্রোজেনের ভর | c. STP -তে আয়তন 11.2 L | 3 → a |
| 4. 1000 mL দ্রবণে 0.5 মোল দ্রাব | d. দ্বিগুণ | 4 → b |
| 5. 0.5 মোল গ্যাস | e. 3 | 5 → c |
For High-Types
30°C উষ্ণতায় একটি গ্যাসের বাষ্পঘনত্ব 20। 45°C উষ্ণতায় গ্যাসটির বাষ্পঘনত্ব কত হবে?
কোনো গ্যাসের বাষ্পঘনত্ব বলতে সমচাপ ও উষ্ণতায় নির্দিষ্ট আয়তনের ওই গ্যাসের আয়তন, সমআয়তন হাইড্রোজেন অপেক্ষা যতগুণ ভারী সেই সংখ্যাকে বোঝায়। উষ্ণতা বাড়ালে সকল গ্যাসের আয়তন সমপরিমাণে বৃদ্ধি পায়। সুতরাং, 30°C উষ্ণতায় ও 45°C উষ্ণতায় ওই গ্যাসের বাষ্পঘনত্ব একই হবে।
সমআয়তনের x গ্যাস ও H2 গ্যাসের ভর যথাক্রমে 12.46 g এবং 0.89 g। x গ্যাসের আণবিক গুরুত্ব কত?
∴ গ্যাসটির বাষ্পঘনত্ব = \(\frac{12.46\;g}{0.089\;g}=14\)
গ্যাসটির আণবিক গুরুত্ব = 2 × বাষ্পঘনত্ব = 2 ×14 = 28
5 × 10-4 মোল \({}_6^{14}C\) -এ মোট কতগুলি নিউট্রন আছে?
\({}_6^{14}C\) -এর ইলেকট্রন সংখ্যা = 6টি, প্রোটন সংখ্যা = 6টি, নিউট্রন সংখ্যা = (14 – 6) = 8টি।
1 মোল \({}_6^{14}C\) -এ পরমাণু সংখ্যা = 6.022 × 1023
5 × 10-4 মোল \({}_6^{14}C\) -এ পরমাণু সংখ্যা = 6.022 × 1023 × 5 × 10-4
= 3.011 × 1020
1টি \({}_6^{14}C\) পরমাণুতে নিউট্রন সংখ্যা = 8টি।
3.011 × 1020 সংখ্যক \({}_6^{14}C\) পরমাণুতে নিউট্রন সংখ্যা
= 3.011 × 1020 × 8
= 24.088 × 1020
1 মোল ক্যালশিয়াম আয়নে কটি এবং কী কী উপাদান কণা বর্তমান?
ক্যালশিয়ামের পারমাণবিক সংখ্যা = 20 এবং ভরসংখ্যা = 40
∴ 1টি Ca2+ পরমাণুতে প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 20, নিউট্রন সংখ্যা = 20
একটি ক্যালশিয়াম আয়নে (Ca2+) ইলেকট্রন সংখ্যা = 20 – 2 = 18টি। কিন্তু প্রোটন ও নিউট্রন সংখ্যা সমান থাকে।
1 মোল Ca2+ আয়ন = 6.022 × 1023 টি Ca2+ আয়ন।
∴ 1 মোল Ca2+ আয়নে ইলেকট্রন সংখ্যা
= 18 × 6.022 × 1023
= 108.396 × 1023
প্রোটন সংখ্যা = 20 × 6.022 × 1023 = 120.44 × 1023
নিউট্রন সংখ্যা = 20 × 6.022 × 1023 = 120.44 × 1023
RMM বলতে কী বোঝায়?
RMM কথাটির অর্থ হল Relative Molecular Mass বা আপেক্ষিক আণবিক গুরুত্ব। কোনো পদার্থের একটি অণুর আকার এতই ক্ষুদ্র এবং এর ভর এতই নগণ্য যে, কোনো প্রামাণ্য মৌলের (H অথবা O অথবা C) একটি পরমাণুর সাপেক্ষে পদার্থের একটি-একটি অণুর তুলনামূলক ভর নেওয়া হয়। তাই আণবিক ভরকে ‘আপেক্ষিক’ বলা হয়।
RAM -এর অর্থ কী?
RAM -এর পুরো কথাটি হল Relative Atomic Mass বা আপেক্ষিক পারমাণবিক ভর।
C-12 স্কেলটি প্রবর্তনের ক্ষেত্রে \({}_6^{14}C\) আইসোটোপটিকে নির্বাচন করা হয় কেন?
C-12 স্কেলটি প্রবর্তনের ক্ষেত্রে \({}_6^{14}C\) আইসোটোপটিকে নির্বাচন করার কারণ –
- কার্বন সহজলভ্য।
- ভর-বর্ণালি বিশ্লেষণের কাজে উদ্বায়ী কার্বন যৌগ ব্যবহার করা যায়।
- কার্বনের একাধিক আইসোটোপ থাকলেও, 12C পরমাণুর আপেক্ষিক পারমাণবিক ভর (RAM) -কে পূর্ণসংখ্যা (12.000) ধরা হয়।
কোনো একটি জৈব যৌগের নমুনায় ভর হিসেবে 0.096% সালফার আছে। এই যৌগটির ন্যূনতম গ্রাম-আণবিক ভর কত হবে? (S = 32)
জৈব যৌগে ভর হিসেবে 0.096% সালফার আছে।
∴ 100 g জৈব যৌগের মধ্যে সালফার আছে = \(\frac{0.096\times100}{100}g=0.096\;g\)
জৈব যৌগের প্রতি অণুতে কমপক্ষে 1টি সালফার পরমাণু আছে।
∴ জৈব যৌগের গ্রাম-আণবিক ভরের মধ্যে কমপক্ষে 32 g সালফার থাকতে হবে।
0.096 g সালফার উপস্থিত আছে, 100 g জৈব যৌগের মধ্যে
32 g সালফার উপস্থিত আছে, \(\frac{100\times32}{0.096}g\) জৈব যৌগের মধ্যে
= 33333.33 g জৈব যৌগের মধ্যে
∴ জৈব যৌগটির ন্যূনতম গ্রাম-আণবিক ভর = 33333.33 g
একটি জৈব যৌগে ভর অনুপাতে 0.093% ফসফরাস আছে। যদি ওই যৌগটির একটি অণুতে একটিই ফসফরাস পরমাণু থাকে, তাহলে যৌগের মোলার ভর নির্ণয় করো। (তোমাকে দেওয়া আছে P = 31)
জৈব যৌগে ভর হিসেবে 0.093% ফসফরাস আছে।
∴ 100 g জৈব যৌগের মধ্যে ফসফরাস আছে \(\frac{0.093\times100}{100}g=0.093\;g\)
দেওয়া আছে, জৈব যৌগের একটি অণুতে, একটিই ফসফরাস পরমাণু থাকে। সুতরাং, জৈব যৌগের গ্রাম মোলার ভরের মধ্যে ফসফরাসের পরিমাণ = 31 g।
0.093 g ফসফরাস উপস্থিত আছে = 100 g যৌগের মধ্যে
∴ 31 g ফসফরাস উপস্থিত আছে = \(\frac{100\times31}{0.093}g\) যৌগের মধ্যে
= 33333.33 g জৈব যৌগের মধ্যে
∴ জৈব যৌগটির মোলার ভর = 33333.33 g/mol
একটি জৈব যৌগে ভর অনুপাতে 0.031% ফসফরাস আছে, যদি ওই যৌগের 1টি অণুতে একটি ফসফরাস পরমাণু থাকে তাহলে যৌগের মোলার ভর নির্ণয় করো। (দেওয়া আছে P = 31)। যৌগটির একটি অণুর আয়তন সম্পর্কে কী বলতে পারো?
জৈব যৌগে ভর অনুপাতে 0.031% ফসফরাস আছে।
100 g জৈব যৌগের মধ্যে ফসফরাস আছে = \(\frac{0.031\times100}{100}g=0.031\;g\)
দেওয়া আছে, জৈব যৌগের প্রতি অণুতে একটিই ফসফরাস পরমাণু আছে। সুতরাং, জৈব যৌগের গ্রাম মোলার ভরের মধ্যে ফসফরাস আছে = 31 g।
0.031 g ফসফরাস উপস্থিত আছে = 100 g জৈব যৌগের মধ্যে
∴ 31 g ফসফরাস উপস্থিত আছে = \(\frac{0.031\times100}{31}g\) জৈব যৌগের মধ্যে
= 105 g জৈব যৌগের মধ্যে
∴ যৌগের মোলার ভর = 105 g⋅mol-1
1 মোল যৌগের মধ্যে অণু আছে = 6.022 × 1023 সংখ্যক। যৌগটি গ্যাসীয় হলে, STP -তে 1 মোল যৌগের আয়তন = 22.4 L।
6.022 × 1023 সংখ্যক অণুর আয়তন = 22.4 L
∴ 1টি অণুর আয়তন = \(\frac{22.4}{6.022\times10^{23}}\) L
= 3.719 × 10-23 L
Class 9 Physical Science – Notes for All Chapters
| Chapter Name | Tropics |
|---|---|
| পরিমাপ | পরিমাপ ও একক বিভিন্ন মাপের একক মাত্রা পরিমাপ |
| বল ও গতি | স্থিতি ও গতি গতির সমীকরণ নিউটনের প্রথম গতিসূত্র নিউটনের দ্বিতীয় গতি সূত্র নিউটনের তৃতীয় গতিসূত্র বিভিন্ন ধরনের বল রৈখিক ভরবেগ রৈখিক ভরবেগ সংরক্ষণ |
| পদার্থ : গঠন ও ধর্ম | তরল ও বায়ুর চাপ আর্কিমিডিসের নীতি পৃষ্ঠটান সান্দ্রতা বার্নোলির নীতি স্থিতিস্থাপকতা |
| পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ | পরমাণুর গঠন মোলের ধারণা দ্রবণ অ্যাসিড, ক্ষার, লবণ মিশ্রণের উপাদানের পৃথকীকরণ জল |
| শক্তির ক্রিয়া , কার্য, ক্ষমতা | শক্তির ক্রিয়া , কার্য, ক্ষমতা |
| তাপ | ক্যালোরিমিতি কার্য ও তাপের তুল্যতা লীনতাপ সম্পৃক্ত ও অসম্পৃক্ত বাষ্প জলের ব্যতিক্রান্ত প্রসারণ |
| শব্দ | শব্দের উৎস : কম্পন শব্দের বিস্তার : তরঙ্গ শব্দের কয়েকটি ধর্ম শব্দের বৈশিষ্ট্য মানুষের কান ও শব্দ শোনার কৌশল শব্দদূষণ |
আজকের আর্টিকেলে আমরা নবম শ্রেণির ভৌতবিজ্ঞান বইয়ের চতুর্থ অধ্যায় “পদার্থ : পরমাণুর গঠন ও পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ” এর “মোলের ধারণা” থেকে পরীক্ষায় আসা গুরুত্বপূর্ণ প্রশ্ন ও উত্তরগুলো আলোচনা করেছি। এই প্রশ্নোত্তরগুলো নবম শ্রেণির বার্ষিক পরীক্ষা, এমনকি চাকরি বা যেকোনো প্রতিযোগিতামূলক পরীক্ষার জন্যও উপযোগী। কারণ, এই অধ্যায়ের প্রশ্ন প্রায়ই বিভিন্ন পরীক্ষায় কমন আসে।
আশা করি, এই আর্টিকেলটি আপনাদের পরীক্ষার প্রস্তুতিতে কিছুটা হলেও সাহায্য করবে। যদি কোনো প্রশ্ন, মতামত বা সাহায্যের প্রয়োজন হয়, নিচে কমেন্ট করে জানাতে পারেন কিংবা টেলিগ্রামে যোগাযোগ করুন—আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত।






Leave a Comment