আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ’ থেকে পর্যায়-সারণি এবং মৌলদের ধর্মের পর্যাবৃত্ততা এর সংক্ষিপ্ত প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও প্রতিযোগিতামূলক পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

পর্যায়-সারণি কাকে বলে?
পর্যায়-সূত্র অনুসারে, ক্রমবর্ধমান পারমাণবিক গুরুত্ব বা পারমাণবিক সংখ্যা অনুসারে মৌলগুলিকে নির্দিষ্ট রীতিতে অনুভূমিক ও উল্লম্ব পঙক্তিতে সাজিয়ে যে তালিকা গঠন করা হয়েছে, মৌলগুলির সেই তালিকাকেই পর্যায়-সারণি বলে।
পর্যায় ও শ্রেণি কাকে বলে?
শ্রেণি – মৌলসমূহকে ক্রমবর্ধমান পারমাণবিক ভর অনুযায়ী সাজিয়ে কয়েকটি অনুভূমিক সারিতে রাখার ফলে সমধর্মী মৌলগুলি এক-একটি উল্লম্ব সারিতে স্থান পায়। এই উল্লম্ব সারিগুলিকে শ্রেণি বা গ্রুপ বলে।
পর্যায় – মৌলসমূহকে ক্রমবর্ধমান পারমাণবিক ভর অনুযায়ী সাজিয়ে কয়েকটি অনুভূমিক সারিতে রাখা হয়। এই অনুভূমিক সারিগুলিকে পর্যায় বা পিরিয়ড বলে।
মেন্ডেলিফের পর্যায়-সারণিতে মৌলগুলিকে ক্রমবর্ধমান পারমাণবিক ভর অনুসারে সাজানো হলেও যে চারজোড়া মৌলের ক্ষেত্রে এই নীতি লঙ্ঘিত হয়েছে তাদের নাম লেখো।
চারজোড়া মৌল নিম্নরূপ –
| পর্যায়-সারণিতে আগে অবস্থান | পর্যায়-সারণিতে পরে অবস্থান |
| আর্গন (পা.ভর = 39.94) কোবাল্ট (পা.ভর = 58.94) টেলুরিয়াম (পা.ভর = 127.61) থোরিয়াম (পা.ভর = 232.12) | পটাশিয়াম (পা.ভর = 39.1) নিকেল (পা.ভর = 58.69) আয়োডিন (পা.ভর = 126.91) প্রোট্যাক্টিনিয়াম (পা.ভর = 231) |
A, B ও C মৌল তিনটি ডোবেরিনারের ত্রয়ী সূত্র মেনে চলে, A ও C -এর পরমাণবিক ভর 7 ও 39 হলে B -এর পারমাণবিক ভর নির্ণয় করো।
B -এর পারমাণবিক ভর
=
= \(\frac{7+39}2\)
= 23
দীর্ঘ পর্যায়-সারণিতে মৌলগুলিকে পারমাণবিক ভরের পরিবর্তে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজানো হয়েছে কেন?
1913-14 খ্রিস্টাব্দে ব্রিটিশ বিজ্ঞানী মোলে পরমাণুর X-রশ্মি বর্ণালির ওপর নানা পরীক্ষা-নিরীক্ষা করে প্রমাণ করেন পারমাণবিক ভর অপেক্ষা মৌলের পরমাণু-ক্রমাঙ্ক মৌলকে চিহ্নিত করার ক্ষেত্রে বেশি কার্যকরী এবং সিদ্ধান্ত করেন পরমাণু-ক্রমাঙ্কই মৌলের মূলগত ধর্মের নিয়ন্ত্রক। আবার, আইসোটোপ আবিস্কারের পর জানা যায় যে, একই মৌলের ভিন্ন পারমাণবিক ভরবিশিষ্ট পরমাণু থাকতে পারে। সুতরাং, এর দ্বারা প্রমাণিত হয় যে পারমাণবিক ভর মৌলের মূলগত ধর্মের নিয়ন্ত্রক নয়। এই কারণে দীর্ঘ পর্যায়-সারণিত মৌলগুলিকে পারমাণবিক ভরের পরিবর্তে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজানো হয়েছে।
আর্গনের পারমাণবিক গুরুত্ব (39.94) পটাশিয়ামের পারমাণবিক গুরুত্বের (39.1) তুলনায় বেশি হলেও মেন্ডেলিফ তাঁর পর্যায়-সারণিতে পটাশিয়ামের আগে আর্গনকে স্থান দিয়েছেন কেন?
মেন্ডেলিফের পর্যায়-সারণি গঠনের সময় মৌলগুলিকে ক্রমবর্ধমান পারমাণবিক গুরুত্ব অনুযায়ী সাজানোর নীতি গ্রহণ করা হলেও মেন্ডেলিফের মূল উদ্দেশ্য ছিল একই রকম ধর্মবিশিষ্ট মৌলগুলিকে একই শ্রেণিভুক্ত করা। তাই রাসায়নিক ধর্মের সাদৃশ্যের উপর অধিক গুরুত্ব আরোপ করতে গিয়ে আর্গনকে \( (Ar) \) পটাশিয়ামের \( (K) \) আগে স্থান দেওয়া হয়েছে।
মেন্ডেলিফের পর্যায়-সারণির ত্রুটিগুলি উল্লেখ করো।
মেন্ডেলিফের পর্যায়-সারণির ত্রুটিগুলি হল –
- মেন্ডেলিফের পর্যায়-সারণিতে কোনো কোনো ক্ষেত্রে উচ্চতর পারমাণবিক ভরবিশিষ্ট মৌলকে নিম্নতর পারমাণবিক ভরবিশিষ্ট মৌলের পূর্বে স্থান দিতে হয়েছে।
- মেন্ডেলিফের পর্যায়-সারণিতে হাইড্রোজেনের অবস্থান বিতর্কিত।
- মেন্ডেলিফের পর্যায়-সারণিতে সমধর্মী মৌলসমূহের ভিন্ন গ্রুপে এবং ভিন্নধর্মী মৌলসমূহের একই গ্রুপে স্থান দেওয়া হয়েছে।
- পারমাণবিক ভর ভিন্ন হওয়া সত্ত্বেও একটি মৌলের সমস্ত আইসোটোপ বা সমস্থানিকগুলিকে মেন্ডেলিফের পর্যায়-সারণিতে একই স্থানে রাখা হয়েছে।
দীর্ঘ পর্যায়-সারণি কাকে বলে?
আধুনিক পর্যায়-সূত্র অনুযায়ী, মেন্ডেলিফের পর্যায়-সারণির অনুসরণে মৌলের পরমাণুগুলির ইলেকট্রন-বিন্যাসের ভিত্তিতে নিলস বোর যে পর্যায়-সারণি প্রকাশ করেন তার সর্বাধুনিক সংস্করণই দীর্ঘ পর্যায়-সারণি বা বোর সারণি নামে পরিচিত।
পর্যায়-সারণির অতি হ্রস্ব পর্যায় কাকে বলে? অতি হ্রস্ব পর্যায়ের মৌলগুলি কোন্ কোন্ শ্রেণিতে আছে?
পর্যায়-সারণির প্রথম পর্যায়টিকে অতি হ্রস্ব পর্যায় বলে।
অতি হ্রস্ব পর্যায়ের দুটি মৌলের মধ্যে \( H, IA\) শ্রেণিতে (আধুনিক দীর্ঘ পর্যায়-সারণির 1 নং) এবং \( He \) শূন্য (আধুনিক দীর্ঘ পর্যায়-সারণির 18 নং) শ্রেণিতে অবস্থিত।
পর্যায়-সারণির প্রথম ও দ্বিতীয় হ্রস্ব পর্যায় কাকে বলে? এই পর্যায়গুলিতে মৌলের সংখ্যা কত?
পর্যায়-সারণির দ্বিতীয় ও তৃতীয় পর্যায়কে যথাক্রমে প্রথম ও দ্বিতীয় হ্রস্ব পর্যায় বলে।
প্রতিটি হ্রস্ব পর্যায়ে 8টি করে মৌল আছে।
পর্যায়-সারণির প্রথম ও দ্বিতীয় দীর্ঘ পর্যায় বলতে কী বোঝ? এই পর্যায়গুলিতে মৌলের সংখ্যা কত?
পর্যায়-সারণির চতুর্থ ও পঞ্চম পর্যায়কে যথাক্রমে প্রথম ও দ্বিতীয় দীর্ঘ পর্যায় বলে।
প্রতিটি দীর্ঘ পর্যায়ে 18টি করে মৌল আছে।
পর্যায়-সারণির অতি দীর্ঘ পর্যায় কাকে বলা হয়? এই পর্যায়ে মৌলের সংখ্যা কত?
পর্যায়-সারণির ষষ্ঠ পর্যায়টিকে অতি দীর্ঘ পর্যায় বলে।
অতি দীর্ঘ পর্যায়ে 32টি মৌল বর্তমান।
মেন্ডেলিফের সংশোধিত পর্যায়-সারণির বিভিন্ন পর্যায়ের নাম, পর্যায়স্থিত মোট মৌলের সংখ্যা, প্রতিটি পর্যায়ের প্রথম ও শেষ মৌলের নাম ও চিহ্ন –
| পর্যায় | পর্যায়ের নাম | মৌলের সংখ্যা | প্রথম ও শেষ মৌলের নাম | প্রথম ও শেষ মৌলের চিহ্ন |
| 1 | অতি হ্রস্ব পর্যায় (very short period) | 2 | হাইড্রোজেন ও হিলিয়াম | H ও He |
| 2 | প্রথম হ্রস্ব পর্যায় (first short period) | 8 | লিথিয়াম ও নিয়ন | Li ও Ne |
| 3 | দ্বিতীয় হ্রস্ব পর্যায় (second short period) | 8 | সোডিয়াম ও আর্গন | Na ও Ar |
| 4 | প্রথম দীর্ঘ পর্যায় (first long period) | 18 | পটাশিয়াম ও ক্রিপটন | K ও Kr |
| 5 | দ্বিতীয় দীর্ঘ পর্যায় (second long period) | 18 | রুবিডিয়াম ও জেনন | Rb ও Xe |
| 6 | অতি দীর্ঘ পর্যায় (very long period) | 32 | সিজিয়াম ও রেডন | Cs ও Rn |
| 7 | অসম্পূর্ণ পর্যায় (incomplete period) | 28 (সম্ভাব্য সংখ্যা 32) | ফ্রান্সিয়াম ও লরেন্সিয়াম | Fr ও Lr |
মেন্ডেলিফের পর্যায়-সারণির আধুনিক সংস্করণের সাথে দীর্ঘ পর্যায়-সারণির পার্থক্য লেখো।
মেন্ডেলিফের পর্যায়-সারণি ও দীর্ঘ পর্যায়-সারণির পার্থক্য নিম্নরূপ –
| মেন্ডেলিফের পর্যায়-সারণি | আধুনিক দীর্ঘ বা পর্যায়-সারণি |
| মেন্ডেলিফের পর্যায়-সারণির আধুনিক সংস্করণে মৌলগুলিকে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজানো হয়েছে। | আধুনিক দীর্ঘ পর্যায়-সারণিতে মৌলগুলিকে তাদের পরমাণুর ইলেকট্রন-বিন্যাসের ভিত্তিতে সাজানো হয়েছে। |
| মেন্ডেলিফের পর্যায়-সারণিতে 7টি পর্যায় ও 9টি শ্রেণি আছে এবং প্রথম থেকে সপ্তম শ্রেণির প্রতিটি A এবং B উপশ্রেণিতে বিভক্ত। | দীর্ঘ পর্যায়-সারণিতে 7টি পর্যায় ও 18টি শ্রেণি আছে এবং কোনো শ্রেণিই উপশ্রেণিতে বিভক্ত নয়। |
আদর্শ মৌল বলতে কী বোঝ?
দ্বিতীয় ও তৃতীয় পর্যায়ের মৌলগুলি প্রকৃতিতে প্রচুর পরিমাণে পাওয়া যায়। তাছাড়া, দ্বিতীয় পর্যায়ের যে-কোনো মৌলকে প্রথম মৌল ধরে অগ্রসর হলে এই মৌলটির সঙ্গে তৃতীয় পর্যায়ের নবম মৌলটির ধর্মের সাদৃশ্য পাওয়া যায় অর্থাৎ নিয়মিত ব্যবধানে ধর্মের পুনরাবৃত্তি ঘটে। তাই দ্বিতীয় এবং তৃতীয় পর্যায়ের মৌলগুলিকে আদর্শ মৌল বা স্বাভাবিক মৌল বা বিশিষ্ট মৌল (typical or representative elements) বলা হয়। [এছাড়া চতুর্থ পর্যায়ে K(19), Ca(20) এবং Ga(31) থেকে Kr(36) পর্যন্ত 8টি আদর্শ মৌল আছে। পঞ্চম পর্যায়ে Rb(37), Sr(38) এবং In(49) থেকে Xe(54) পর্যন্ত 8টি আদর্শ মৌল আছে। সপ্তম পর্যায়ে Fr(87) ও Ra(88) মৌল দুটি আদর্শ মৌল।]
ক্ষার ধাতু কোন্গুলি? এদের এরূপ নামকরণ করা হয়েছে কেন?
\( IA \) বা 1 নং শ্রেণির লিথিয়াম \( (Li) \), সোডিয়াম \( (Na) \), পটাশিয়াম \( (K) \), রুবিডিয়াম \( (Rb) \), সিজিয়াম \( (Cs) \) এবং ফ্রান্সিয়াম \( (Fr) \) -এই 6টি ধাতুকে ক্ষার ধাতু বলে।
এই ধাতুগুলির অক্সাইড, হাইড্রক্সাইড ও কার্বনেট যৌগগুলি তীব্র ক্ষারধর্মী হওয়ায় এদের ক্ষার ধাতু বলে।
ক্ষারীয় মৃত্তিকা ধাতু বলতে কী বোঝ?
\( IIA \) বা 2 নং শ্রেণির বেরিলিয়াম \( (Be) \), ম্যাগনেশিয়াম \( (Mg) \), ক্যালশিয়াম \( (Ca) \), স্ট্রনশিয়াম \( (Sr) \), বেরিয়াম \( (Ba) \) ও রেডিয়াম \( (Ra) \) -কে ক্ষারীয় মৃত্তিকা ধাতু বলে। ভূত্বকে প্রাপ্ত এই ধাতুগুলির অক্সাইড, হাইড্রক্সাইড ও কার্বনেট যৌগগুলি ক্ষারধর্মী হওয়ায় এরূপ নামকরণ করা হয়েছে।
হ্যালোজেন মৌল কোনগুলি? এদের এরূপ নামকরণের কারণ কী?
\( VIIIB \) বা 17 নং শ্রেণির ফ্লুরিন \( (F) \), ক্লোরিন \( (Cl) \), ব্রোমিন \( (Br) \), আয়োডিন \( (I) \) এবং অ্যাস্টাটিন \( (At) \) -এই পাঁচটি মৌলকে হ্যালোজেন মৌল বলে।
হ্যালোজেন কথার অর্থ হল সামুদ্রিক লবণ উৎপাদক। সামুদ্রিক লবণের (যেমন – \( NaCl) \) উপাদান হিসেবে এদের পাওয়া যায় বলে এরূপ নামকরণ করা হয়েছে।
নিষ্ক্রিয় মৌল (inert elements) কোনগুলি? এদের মধ্যে কোনটি রাসায়নিকভাবে সবচেয়ে সক্রিয়?
পর্যায়-সারণির শূন্য শ্রেণিতে (অর্থাৎ 18 নং শ্রেণিতে) অবস্থিত 6টি মৌল হিলিয়াম \( (He) \), নিয়ন \( (Ne) \), আর্গন \( (Ar) \), ক্রিপটন \( (Kr) \), জেনন \( (Xe) \) ও রেডন \( (Rn) \) -কে ‘নিষ্ক্রিয় মৌল’ বলা হয়।
এদের মধ্যে জেনন \( (Xe) \) রাসায়নিকভাবে সবচেয়ে সক্রিয়।
সন্ধিগত মৌল কাদের বলা হয়?
পর্যায়-সারণির চতুর্থ পর্যায়ের স্ক্যান্ডিয়াম \( \left(Sc\right) \) থেকে কপার \( \left({}_{29}Cu\right) \), পঞ্চম পর্যায়ের ইট্রিয়াম \( \left({}_{39}Y\right) \) থেকে সিলভার \( \left({}_{47}Ag\right) \) এবং ষষ্ঠ পর্যায়ের ল্যান্থানাম \( \left({}_{57}La\right) \) ও হ্যাফনিয়াম \( \left({}_{72}Hf\right) \) থেকে গোল্ড \( \left({}_{79}Au\right) \) পর্যন্ত মৌলগুলিকে ইলেকট্রন-বিন্যাসের বিশেষ বৈশিষ্ট্যের জন্য সন্ধিগত মৌল বলা হয়।
বিরল মৃত্তিকা মৌল কাকে বলে?
ষষ্ঠ পর্যায়ে ল্যান্থানামের \( \left(La\right) \) পরবর্তী 14টি মৌলের \( ({}_{58}Ce \) থেকে \( {}_{71}Lu) \) ভৌত ও রাসায়নিক ধর্মে সাদৃশ্য লক্ষ করা যায়। এই 14টি মৌলকে পর্যায়-সারণির তলদেশে একটি সম্পূর্ণ আলাদা অনুভূমিক সারিতে স্থান দেওয়া হয়েছে। এই 14টি মৌলকে একসাথে ল্যান্থানাইড মৌল বলা হয়। প্রকৃতিতে অত্যন্ত অল্প পরিমাণে পাওয়া যায় বলে এদের বিরল মৃত্তিকা মৌলও বলে।
সন্ধিগত মৌলের তিনটি বৈশিষ্ট্য লেখো।
সন্ধিগত মৌলগুলির ধর্ম স্বাভাবিক বা আদর্শ মৌলগুলির ধর্ম থেকে সম্পূর্ণ পৃথক। এদের কয়েকটি বৈশিষ্ট্য নিম্নরূপ –
- সন্ধিগত মৌলগুলি সকলেই ধাতু এবং এরা একাধিক যোজ্যতা প্রদর্শন করে।
- সন্ধিগত মৌলগুলি স্থায়ী জটিল যৌগ গঠন করতে পারে।
- সন্ধিগত মৌলগুলির দ্বারা গঠিত জটিল যৌগগুলি রঙিন হয়।
দীর্ঘ পর্যায়-সারণির 3 থেকে 12 পর্যন্ত গ্রুপগুলিতে স্থানপ্রাপ্ত মৌলগুলিকে সন্ধিগত মৌল বলে কেন?
3 থেকে 12 নং পর্যন্ত গ্রুপে স্থানপ্রাপ্ত মৌলগুলির ধর্ম, 1 ও 2 নং গ্রুপভুক্ত তড়িৎ ধনাত্মক মৌল ও 13 থেকে 18 নং গ্রুপভুক্ত প্রধানত তড়িৎ-ঋণাত্মক মৌলগুলির ধর্মের মাঝামাঝি অর্থাৎ এই মৌলগুলির মাধ্যমে অধিক তড়িৎ-ধনাত্মক মৌল থেকে তড়িৎ-ঋণাত্মক মৌলে উত্তরণ বা ট্রানজিশন ঘটে। তাই 3 থেকে 12 পর্যন্ত গ্রুপগুলিতে স্থানপ্রাপ্ত মৌলগুলিকে সন্ধিগত মৌল বলে।
মুদ্রা ধাতু (coinage metal) কাদের বলা হয়? এরা পর্যায়-সারণির কোথায় অবস্থিত?
কপার \( \left(Cu\right) \), সিলভার \( \left(Ag\right) \) এবং গোল্ড \( \left(Au\right) \) -এই তিনটি ধাতু প্রাচীনকাল থেকে মুদ্রা তৈরির কাজে ব্যবহৃত হয়ে আসছে। তাই এদের ‘মুদ্রা ধাতু’ বলে।
এরা পর্যায়-সারণির \( IB \) শ্রেণিতে (অথবা 11 নং) যথাক্রমে 4,5 ও 6 নং পর্যায়ে অবস্থিত।
অ্যাকটিনাইড মৌল (Actinides) কাকে বলে?
সপ্তম পর্যায়ের অ্যাকটিনিয়ামের \( \left({}_{89}Ac\right) \) পরে থোরিয়াম \( \left({}_{90}Th\right) \) থেকে লরেন্সিয়াম \( \left({}_{103}Lr\right) \) পর্যন্ত 14টি মৌলের ভৌত ও রাসায়নিক ধর্মে সাদৃশ্য রয়েছে। \( Ac \) -র পরবর্তী এই 14টি মৌল অ্যাকটিনাইড মৌল নামে পরিচিত। এদের পর্যায়-সারণির নীচে পৃথক একটি অনুভূমিক সারিতে স্থান দেওয়া হয়েছে।
আদর্শ ও সন্ধিগত মৌলের দুটি পার্থক্য লেখো।
আদর্শ ও সন্ধিগত মৌলের পার্থক্য নিম্নরূপ –
| আদর্শ মৌল | সন্ধিগত মৌল |
| আদর্শ মৌল ধাতু বা অধাতু হতে পারে। | সন্ধিগত মৌলগুলি সবই ধাতু। |
| আদর্শ মৌলগুলির সুনির্দিষ্ট যোজ্যতা থাকে। | সন্ধিগত মৌল এই শব্দটি যোজ্যতা থাকে। |
চতুর্থ পর্যায়ে মোট কয়টি সন্ধিগত মৌল আছে? এদের প্রথম ও শেষ মৌলের নাম কী?
চতুর্থ পর্যায়ে মোট 9টি সন্ধিগত মৌল আছে।
চতুর্থ পর্যায়ের প্রথম সন্ধিগত মৌল হল স্ক্যান্ডিয়াম \( \left(Sc\right) \) এবং শেষ সন্ধিগত মৌল হল কপার \( \left(Cu\right) \)।
সেতু মৌল কাদের বলা হয়? এরূপ নামকরণের কারণ কী?
শূন্য শ্রেণি বা 18 নং শ্রেণির নিষ্ক্রিয় মৌলসমূহ \( (He,\;Ne,\;Ar,\;Kr,\;Xe \) ও \( Rn) \) -কে সেতু মৌল বলা হয়।
এই মৌলগুলি \( VIIB \) (17 নং) শ্রেণির তীব্র তড়িৎ-ঋণাত্মক হ্যালোজেন মৌল ও পরবর্তী পর্যায়ের \( IA \) (1 নং) শ্রেণির তীব্র তড়িৎ-ধনাত্মক ক্ষার ধাতু মৌলগুলির মাঝে সেতু হিসেবে কাজ করে। তাই এদের সেতু মৌল বলে।
চ্যালকোজেন মৌল কাদের বলা হয়? এরূপ নামকরণের কারণ কী?
\( 16 \) নং শ্রেণির মৌলগুলি \( (O,\;S,\;Se,\;Te \) ও \( Po) \) -কে চ্যালকোজেন মৌল বলে।
চ্যালকোজেন কথাটির অর্থ হল ‘আকরিক উৎপাদক’। বেশিরভাগ ধাতুকে তার অক্সাইড বা সালফাইড আকরিক হিসেবে পাওয়া যায়। তাই এই শ্রেণির মৌলগুলির এরূপ নামকরণ হয়েছে।
নিকটোজেন মৌল কাদের বলা হয়? এরূপ নামকরণের কারণ কী?
\( 15 \) নং শ্রেণির মৌলগুলি \( (N,\;P,\;As,\;Sb \) ও \( Bi) \) -কে ‘নিকটোজেন মৌল’ বলা হয়।
নিকটোজেন কথাটির অর্থ হল ‘শ্বাসরোধকারী’। এই শ্রেণির প্রথম মৌল নাইট্রোজেন একটি শ্বাসরোধকারী গ্যাস। তাই এই শ্রেণির মৌলগুলির এরূপ নামকরণ হয়েছে।
ইউরেনিয়ামোত্তর মৌল কাকে বলে? এদের দুটি বৈশিষ্ট্য উল্লেখ করো।
ইউরেনিয়ামোত্তর মৌল – পর্যায়-সারণির সপ্তম পর্যায়ে অবস্থিত ইউরেনিয়াম \( \left({}_{92}U\right) \) পরবর্তী মৌলগুলিকে ইউরেনিয়ামোত্তর মৌল বলে।
বৈশিষ্ট্য –
- ইউরেনিয়ামোত্তর মৌলগুলি তেজস্ক্রিয় হয়।
- ইউরেনিয়ামোত্তর মৌলগুলির সবগুলিই কৃত্রিম উপায়ে তৈরি করা হয়।
হাইড্রোজেনকে ‘দুষ্ট মৌল’ (rogue element) বলা হয় কেন?
ক্রমবর্ধমান পারমাণবিক গুরুত্ব অনুসারে মৌলগুলিকে পর্যায়-সারণিতে সাজাতে গিয়ে মেন্ডেলিফ লক্ষ করেন যে, \( IA \) শ্রেণির ক্ষার ধাতুগুলির সঙ্গে হাইড্রোজেনের ধর্মের যেমন বেশ কিছু সাদৃশ্য আছে, তেমনই \( VIIB \) শ্রেণির হ্যালোজেন মৌলগুলির ধর্মের সঙ্গেও এর কিছু সাদৃশ্য আছে। তাই হাইড্রোজেনকে \( IA \) ও \( VIIB \) -উভয় শ্রেণিতেই স্থান দেওয়া যায়। পর্যায়-সারণিতে হাইড্রোজেনের সঠিক অবস্থান নির্ণয়ের ক্ষেত্রে মেন্ডেলিফ বেশ কিছু অসুবিধার সম্মুখীন হন বলে হাইড্রোজেনকে তিনি ‘দুষ্ট মৌল’ নামে অভিহিত করেন।
পারমাণবিক ব্যাসার্ধ বলতে কী বোঝায়? পারমাণবিক ব্যাসার্ধ কয় প্রকারের হয়?
পারমাণবিক ব্যাসার্ধ – পারমাণবিক ব্যাসার্ধ বলতে পরমাণুর নিউক্লিয়াস থেকে বহিস্তম ইলেকট্রন-কক্ষের দূরত্বকে বোঝায়।
পারমাণবিক ব্যাসার্ধ তিন প্রকারের –
- সমযোজী ব্যাসার্ধ,
- ধাতব ব্যাসার্ধ,
- ভ্যান ডার ওয়ালস্ ব্যাসার্ধ।
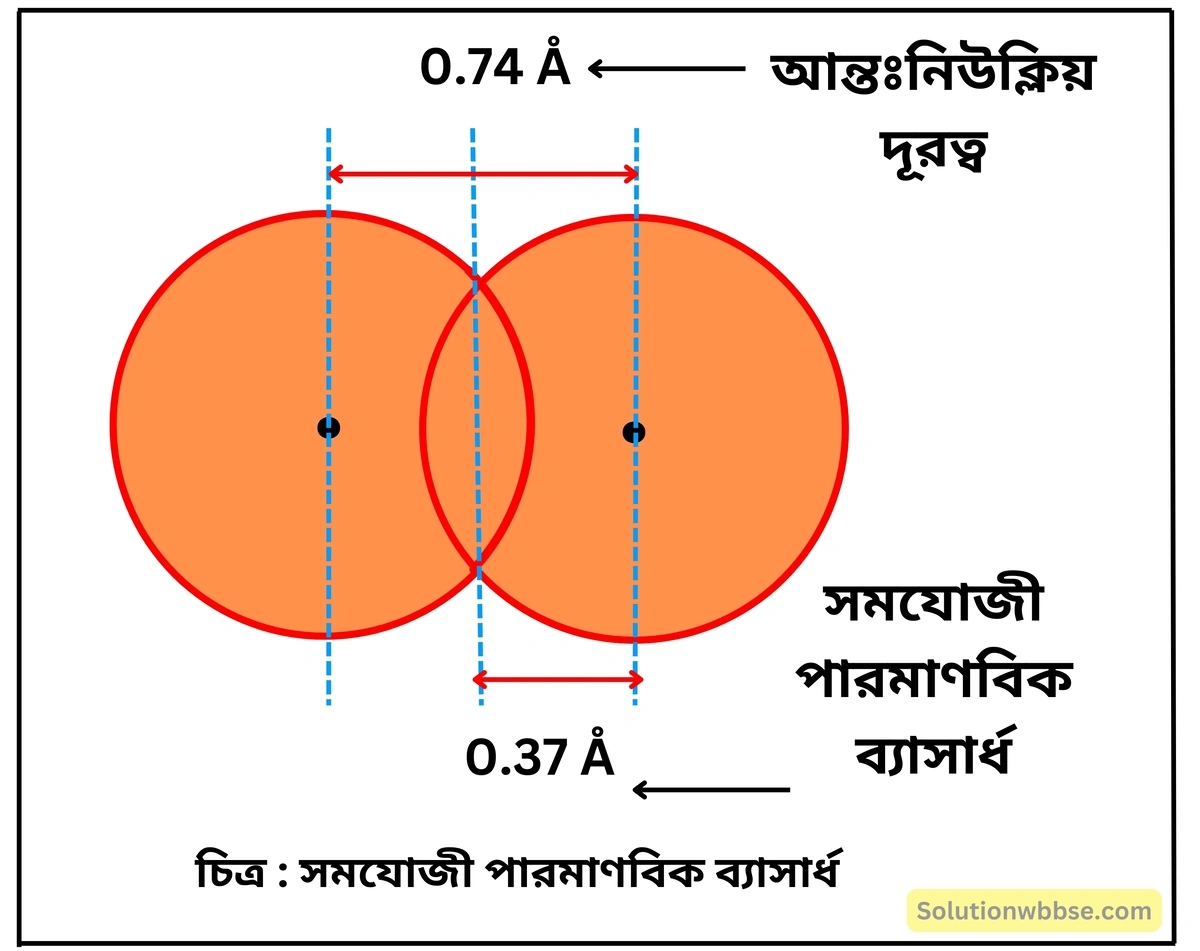
সমযোজী ব্যাসার্ধ কাকে বলে? হাইড্রোজেন অণুর পরমাণু দুটির আন্তঃনিউক্লিয় দূরত্ব 0.74Å হলে তার সমযোজী ব্যসার্ধ কত হবে?
সমযোজী ব্যাসার্ধ – একই মৌলের দুটি পরমাণু সমযোজী এক-বন্ধন দ্বারা পরস্পরের সাথে যুক্ত থাকলে তাদের নিউক্লিয়াস দুটির মধ্যবর্তী দূরত্বের অর্ধেককে সমযোজী ব্যাসার্ধ (covalent radius) বলে।
হাইড্রোজেন অণু মধ্যস্থ পরমাণু দুটির আন্তঃনিউক্লিয় দূরত্ব 0.74Å। সুতরাং, হাইড্রোজেনের সমযোজী পারমাণবিক ব্যাসার্ধ হবে = \(\frac{0.74}2Å\) = 0.37Å।
ধাতব ব্যাসার্ধ কাকে বলে? সমযোজী ব্যসার্ধ ও ধাতব ব্যাসার্ধের মধ্যে কোনটি বড়ো হয়?
ধাতব ব্যাসার্ধ – ধাতব কেলাসের মধ্যে পাশাপাশি অবস্থিত দুটি ধাতব পরমাণুর নিউক্লিয়াসের মধ্যবর্তী দূরত্বের অর্ধেককে ধাতব ব্যাসার্ধ বলে।
ধাতব ব্যাসার্ধ সর্বদা সমযোজী ব্যাসার্ধ অপেক্ষা বড়ো হয়।
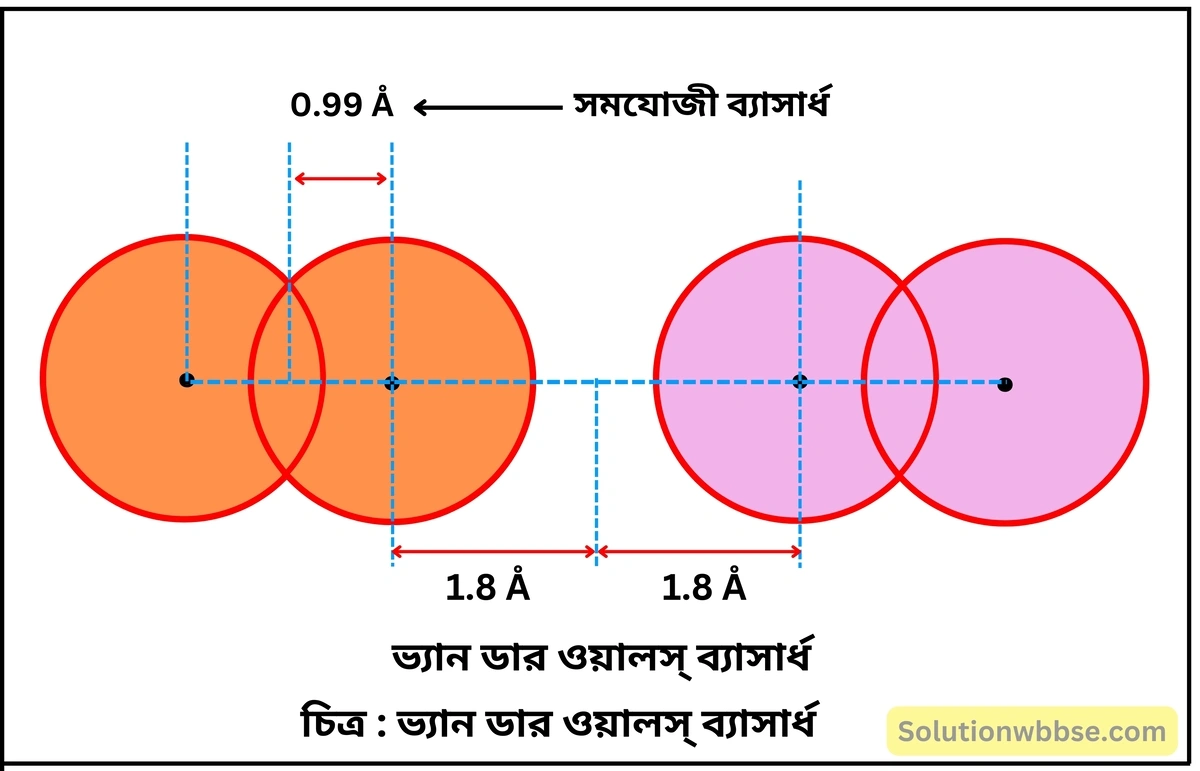
ভ্যান ডার ওয়ালস্ ব্যাসার্ধ কাকে বলে? ভ্যান ডার ওয়ালস্ ব্যাসার্ধ, ধাতব ব্যাসার্ধ ও সমযোজী ব্যাসার্ধকে মানের ক্রমানুসারে সাজাও।
কোনো মৌলের কঠিন অবস্থায় সবচেয়ে কাছাকাছি অবস্থিত দুটি পৃথক অণুর অন্তর্গত নিকটতম দুটি পরমাণুর নিউক্লিয়াস দুটির মধ্যবর্তী দূরত্বের অর্ধেককে ‘ভ্যান ডার ওয়ালস্ ব্যাসার্ধ’ (van dar waals radii) বলে।
তিন প্রকার পারমাণবিক ব্যাসার্ধের ক্রম – ভ্যান ডার ওয়ালস্ ব্যাসার্ধ > ধাতব ব্যাসার্ধ > সমযোজী ব্যাসার্ধ।
মৌলের প্রথম আয়নন শক্তি (first ionisation energy) কাকে বলে?
আয়নন শক্তি – সর্বনিম্ন শক্তিস্তরে (ground state) থাকা কোনো মৌলের একটি বিচ্ছিন্ন, গ্যাসীয় পরমাণু থেকে তার যোজ্যতা-কক্ষের সবচেয়ে দুর্বলভাবে আবদ্ধ ইলেকট্রনটিকে সম্পূর্ণভাবে অপসারিত করে পরমাণুটিকে গতিশক্তিহীন এক একক ধনাত্মক আধানবিশিষ্ট আয়নে পরিণত করার জন্য প্রয়োজনীয় ন্যূনতম শক্তিকে ওই মৌলের ‘প্রথম আয়নন শক্তি, (first ionisation energy) বলে।
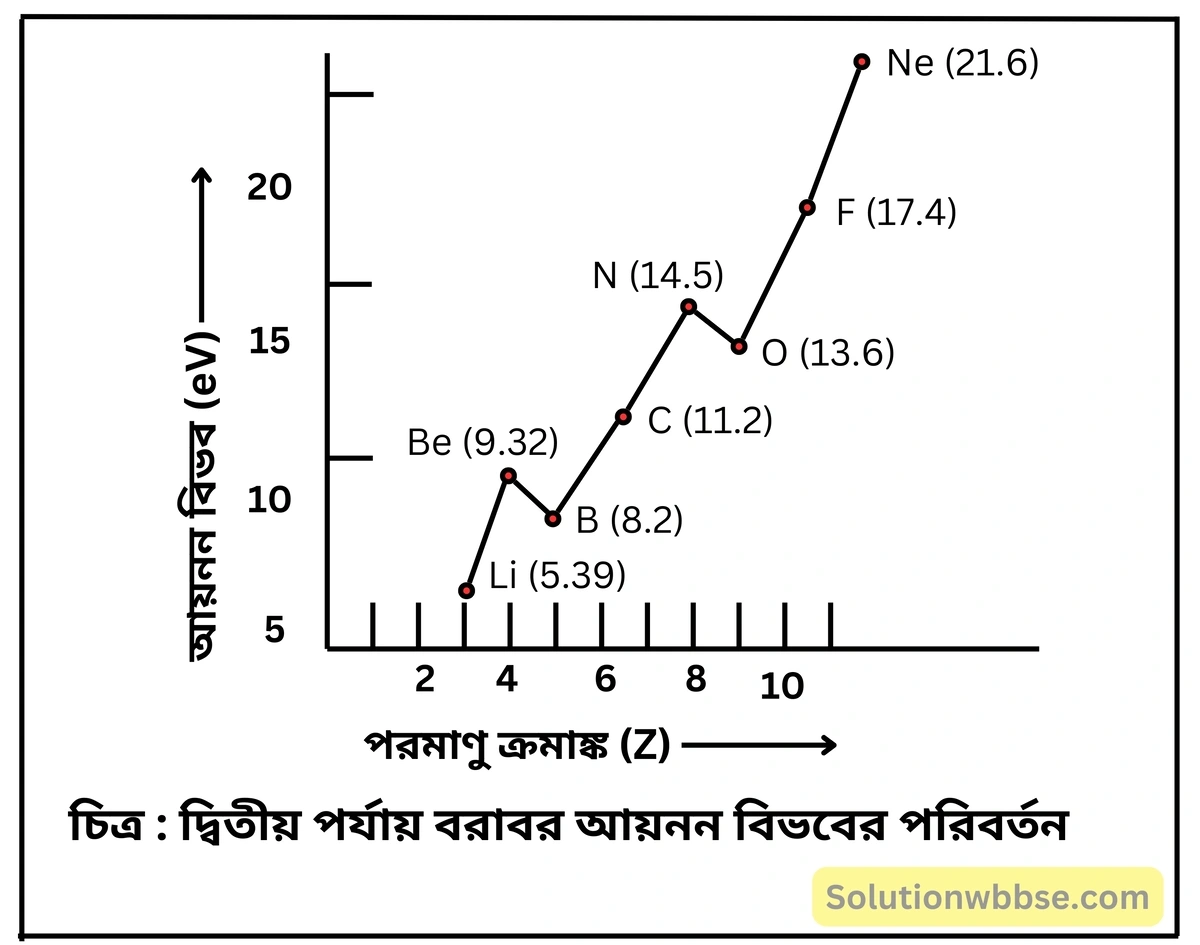
পর্যায়-সারণিতে পর্যায় বরাবর ও শ্রেণি বরাবর মৌলগুলির ‘আয়নন শক্তি’ কীভাবে পরিবর্তিত হয়?
পর্যায়গত পরিবর্তন – কয়েকটি ব্যতিক্রম ছাড়া, সাধারণত একই পর্যায়ের বামদিক থেকে ডানদিকে অগ্রসর হলে মৌলগুলির আয়নন শক্তি ক্রমশ বৃদ্ধি পায়। নির্দিষ্ট পর্যায়ে সবচেয়ে বামদিকের \( IA \) (1 নং) শ্রেণির ক্ষার ধাতুর আয়নন শক্তি সর্বনিম্ন ও সবচেয়ে ডানদিকের শূন্য শ্রেণির (18 নং) নিষ্ক্রিয় মৌলের আয়নন শক্তি সর্বোচ্চ হয়।
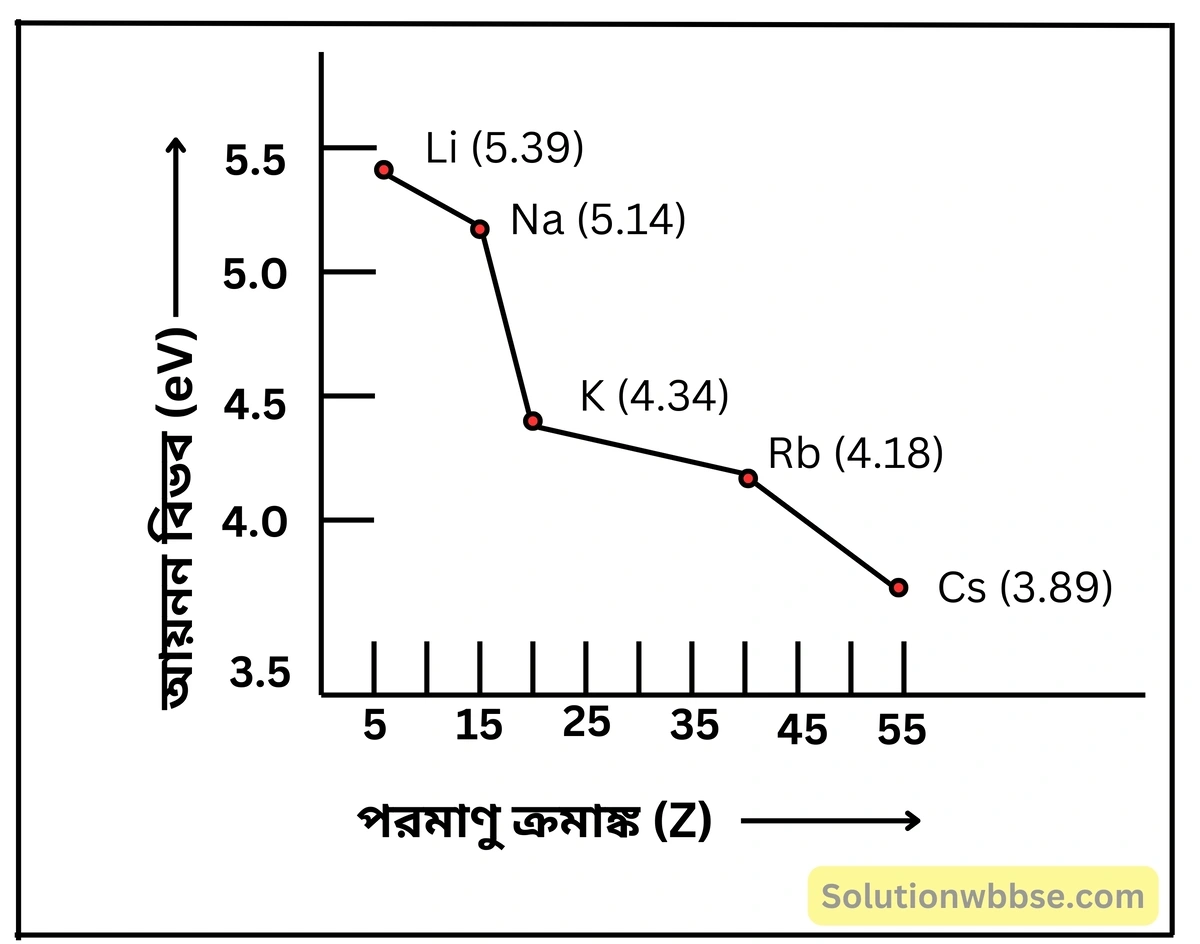
শ্রেণিগত পরিবর্তন – সাধারণত শ্রেণি বরাবর উপর থেকে নীচে নামলে আয়নন শক্তি ক্রমশ হ্রাস পায়।
তড়িৎ-ঋণাত্মকতার সংজ্ঞা দাও।
তড়িৎ-ঋণাত্মকতা (electronegativity) – বিজ্ঞানী পাউলিং -এর মতানুসারে, অন্য কোনো মৌলের পরমাণুর সঙ্গে সমযোজী বন্ধন দ্বারা আবদ্ধ থাকার সময় বন্ধন সৃষ্টিকারী ইলেকট্রন-জোড়কে কোনো মৌলের পরমাণুর নিজের দিকে আকর্ষণ করার ক্ষমতাকে ওই মৌলটির তড়িৎ-ঋণাত্মকতা বলে।
পর্যায় বরাবর বামদিক থেকে ডানদিকে মৌলের তড়িৎ ঋণাত্মকার মান কীভাবে পরিবর্তিত হয় তা কারণসহ লেখো।
পর্যায়-সারণির যে-কোনো পর্যায়ের বামদিক থেকে ডানদিকে গেলে পরমাণুর নিউক্লিয়াসের ধনাত্মক আধান ক্রমশ বৃদ্ধি পায় এবং পরমাণুর আকার ক্রমশ হ্রাস পায়। এই দুইয়ের মিলিত প্রভাব বন্ধনের ইলেকট্রন-জোড়ের প্রতি নিউক্লিয়াসের আকর্ষণকে বৃদ্ধি করে। তাই কোনো পর্যায়ে বামদিক থেকে ডানদিকে গেলে পরমাণুর তড়িৎ-ঋণাত্মকতার মান ক্রমশ বৃদ্ধি পায়। যে-কোনো পর্যায়ের সবচেয়ে বামদিকে \( IA \) শ্রেণিতে অবস্থিত ক্ষার ধাতুর তড়িৎ-ঋণাত্মকতার মান সর্বনিম্ন ও ডানদিকে অবস্থিত \( VIIB \) শ্রেণির হ্যালোজেন মৌলের তড়িৎ-ঋণাত্মকতা সর্বোচ্চ হয়।
শ্রেণি বরাবর মৌলের তড়িৎ-ঋণাকতার মান কীভাবে পরিবর্তিত হয়?
পর্যায়-সারণির যে-কোনো শ্রেণির উপর থেকে নীচের দিকে গেলে পরমাণুর আকার বৃদ্ধি পায়। এর ফলে উপর থেকে নীচে নিউক্লিয়াসের আধান বৃদ্ধি পেলেও আকার বৃদ্ধি পাওয়ায় ইলেকট্রন-জোড়ের প্রতি নিউক্লিয়াসের আকর্ষণ হ্রাস পায়। তাই শ্রেণি বরাবর উপর থেকে নীচের দিকে মৌলগুলির তড়িৎ-ঋণাত্মকতা ক্রমশ হ্রাস পায়।
হ্যালোজেন মৌলগুলির তড়িৎ-ঋণাত্মকতার ক্রম হল – \( I<Br<Cl<F \) -ব্যাখ্যা করো।
দীর্ঘ পর্যায়-সারণির \( 17 \) নং শ্রেণিতে হ্যালোজেন মৌলগুলি অবস্থিত। প্রদত্ত \( F,Cl,Br \) ও \( I \) মৌলগুলি যথাক্রমে \( 2,3,4 \) ও \( 5 \) নং পর্যায়ে অবস্থিত। অর্থাৎ \( F,Cl,Br,I \) একই শ্রেণিতে উপর থেকে নীচে পরপর সজ্জিত থাকে। শ্রেণি বরাবর উপর থেকে নীচের দিকে নিউক্লিয়াসের আধান এবং পরমাণুর আকার উভয়ই বৃদ্ধি পায় বলে ইলেকট্রন-জোড়ের প্রতি নিউক্লিয়াসের আকর্ষণ \( F \) থেকে \( I \) -এ ক্রমশ হ্রাস পায় এবং এর ফলে তড়িৎ-ঋণাত্মকতার ক্রম হয় – \( I<Br<Cl<F \)।
কোন্ মৌলের তড়িৎ-ঋণাত্মকতা সর্বাধিক ও কোন্ মৌলের তড়িৎ-ঋণাত্মকতা সর্বনিম্ন?
ফ্লুরিন \( \left(F\right) \) মৌলটির তড়িৎ-ঋণাত্মকতা সর্বাধিক এবং সিজিয়াম \( \left(Cs\right) \) মৌলের তড়িৎ-ঋণাত্মকতা সর্বনিম্ন।
ইলেকট্রন-আসক্তি (Electron affinity) কী?
ইলেকট্রন-আসক্তি (Electron affinity) – সর্বনিম্ন শক্তির অবস্থায় থাকা কোনো বিচ্ছিন্ন গ্যসীয় পরমাণুর সর্ববহিস্থ শক্তিস্তরে একটি অতিরিক্ত ইলেকট্রন যুক্ত করে পরমাণুটিকে এক একক ঋণাত্মক আধানবাহী গ্যাসীয় আয়নে পরিণত করলে যে পরিমাণ শক্তি নির্গত হয়, তাকেই ওই পরমাণুর বা মৌলের ইলেকট্রন-আসক্তি বলে।
কোনো মৌলের পরমাণুর ইলেকট্রন-আসক্তি এবং ওই পরমাণু থেকে উৎপন্ন একক ঋণাত্মক আধানযুক্ত আয়নের প্রথম আয়নন শক্তির মান একই। তবে ইলেকট্রন-আসক্তির ক্ষেত্রে শক্তি মুক্ত হয় এবং আয়নন শক্তির ক্ষেত্রে শক্তি শোষিত হয়।
যে-কোনো পর্যায়ের বামদিক থেকে ডানদিকে গেলে মৌলগুলির ইলেকট্রন-আসক্তি ক্রমশ বৃদ্ধি পায়। যে-কোনো শ্রেণির উপর থেকে নীচের দিকে গেলে ইলেকট্রন-আসক্তির মান ক্রমশ হ্রাস পায়।
পর্যায় বরাবর মৌলের জারণ ও বিজারণ ধর্মের কীরূপ পরিবর্তন ঘটে? বিজারণ ক্ষমতা অনুসারে প্রদত্ত মৌলগুলিকে সাজাও – \( Na,Al,Si,Mg,P,Cl,S \)
কোনো পর্যায়ের বামদিক থেকে ডানদিকে মৌলসমূহের জারণ ক্ষমতা ক্রমশ বৃদ্ধি পায় এবং বিজারণ ক্ষমতা ক্রমশ হ্রাস পায়।
বিজারণ ক্ষমতা – \( Na>Mg>Al>Si>P>S>Cl \)।
শ্রেণি বরাবর মৌলের জারণ ও বিজারণ ধর্মের কীরূপ পরিবর্তন ঘটে? অতেজস্ক্রিয় হ্যালোজেন মৌলগুলিকে জারণ ক্ষমতার ক্রমানুসারে সাজাও।
পর্যায়-সারণিতে শ্রেণি বরাবর উপর থেকে যত নীচের দিকে যাওয়া যায় ততই বিজারণ ক্ষমতা ক্রমশ বৃদ্ধি পায় কিন্তু জারণ ক্ষমতা ক্রমশ হ্রাস পায়।
অতেজস্ক্রিয় হ্যালোজেন মৌলগুলির জারণ ক্ষমতার ক্রম – \( F>Cl>Br>I \) I
পর্যায়-সারণিতে মৌলসমূহের ধাতব এবং অধাতব ধর্মের কী পরিবর্তন ঘটে লিখ?
কোনো মৌলের পরমাণুর ইলেকট্রন বর্জন করে ক্যাটায়নে পরিণত হওয়ার প্রবণতাকে ওই মৌলের ধাতব ধর্ম বলে। অন্যদিকে কোনো মৌলের পরমাণুর ইলেকট্রন গ্রহণ করে অ্যানায়নে পরিণত হওয়ার প্রবণতাকে ওই মৌলের অধাতব ধর্ম বলে।
কোনো পর্যায়ের বামদিক থেকে ডানদিকে মৌলগুলির ধাতব ধর্ম ক্রমাগত হ্রাস পায় এবং অধাতব ধর্ম ক্রমাগত বৃদ্ধি পায়। কোনো শ্রেণি বরাবর যত উপর থেকে নীচের দিকে যাওয়া যায় ততই ধাতব ধর্ম বৃদ্ধি ও অধাতব ধর্ম হ্রাস পায়।
তৃতীয় পর্যায়ের মৌলগুলিকে পারমাণবিক ব্যাসার্ধের এবং 2 নং শ্রেণির মৌলগুলিকে বিজারণ ক্ষমতার সঠিক ক্রমানুসারে সাজাও।
তৃতীয় পর্যায়ের মৌলগুলির পারমাণবিক ব্যাসার্ধের সঠিক ক্রম হল – \( Na>Mg>Al>Si>P>S>Cl \)।
2 নং শ্রেণির মৌলগুলির বিজারণ ধর্মের সঠিক ক্রম হল – \( Be<Mg<Ca<Sr<Ba<Ra \)।
IA ও IIA শ্রেণির মৌলগুলিকে নিম্নলিখিত ধর্মগুলির বিচারে ক্রমানুসারে সাজাও – (i) পরমাণুর আকার, (ii) আয়নাইজেশন শক্তি বা আয়নন বিভব, (iii) বিজারণ ক্ষমতা
- \( IA \) (বা 1 নং) শ্রেণির ক্ষেত্রে –
- পরমাণুর আকার বৃদ্ধির ক্রম – \( H<Li<Na<K<Rb<Cs<Fr \)
- আয়নাইজেশন শক্তি হ্রাসের ক্রম – \( H>Li>Na>K>Rb>Cs>Fr \)
- বিজারণ ক্ষমতা বৃদ্ধির ক্রম – \( H<Li<Na<K<Rb<Cs<Fr \)
- \( IIA \) (বা 2 নং) শ্রেণির ক্ষেত্রে –
- পরমাণুর আকার বৃদ্ধির ক্রম – \( Be<Mg<Ca<Sr<Ba<Ra \)
- আয়নাইজেশন শক্তি হ্রাসের ক্রম – \( Be>Mg>Ca>Sr>Ba>Ra \)
- বিজারণ ক্ষমতা বৃদ্ধির ক্রম – \( Be<Mg<Ca<Sr<Ba<Ra \)
হ্যালোজেন মৌলগুলিকে নিম্নলিখিত ধর্মগুলির বিচারে ক্রমানুসারে সাজাও – (i) পরমাণুর আকার, (ii) আয়নায়ন (আয়নন) শক্তি, (iii) জারণ ক্ষমতা
হ্যালোজেন মৌলগুলিকে নিম্নলিখিত ধর্মগুলির বিচারে ক্রমানুসারে সাজিয়ে পাই –
- পরমাণুর আকার বৃদ্ধির ক্রম – \( F<Cl<Br<I<At \)
- আয়নাইজেশন শক্তি হ্রাসের ক্রম – \( F>Cl>Br>I>At \)
- জারণ ক্ষমতা হ্রাসের ক্রম – \( F>Cl>Br>I>At \)
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ’ থেকে পর্যায়-সারণি এবং মৌলদের ধর্মের পর্যাবৃত্ততা এর সংক্ষিপ্ত প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করতে পারেন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






মন্তব্য করুন