আজকের আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের দ্বিতীয় অধ্যায় “গ্যাসের আচরণ” অধ্যায়ের কিছু গুরুত্বপূর্ণ অতিসংক্ষিপ্ত প্রশ্ন ও উত্তর নিয়ে আলোচনা করব। এই প্রশ্নগুলো মাধ্যমিক পরীক্ষার জন্য অত্যন্ত গুরুত্বপূর্ণ, কারণ এগুলো পরীক্ষায় প্রায়শই দেখা যায়। আশা করছি, এই আর্টিকেলটি আপনাদের জন্য সহায়ক হবে।

বহু বিকল্পভিত্তিক প্রশ্নোত্তর
0°C উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন V0। চাপ স্থির রেখে তাপমাত্রা 100°C করা হলে আয়তন হবে –
(A) \(\frac{293}{273}V_0\)
(B) \(\frac{283}{273}V_0\)
(C) \(\frac{303}{273}V_0\)
(D) \(\frac{373}{273}V_0\)
উত্তর – (D) \(\frac{373}{273}V_0\)
বাস্তব গ্যাসগুলি আদর্শ গ্যাসের মতো আচরণ করে –
(A) উচ্চচাপ ও নিম্ন উষ্ণতায়
(B) নিম্নচাপ ও উচ্চ উষ্ণতায়
(C) নিম্নচাপ ও নিম্ন উষ্ণতায়
(D) উচ্চচাপ ও উচ্চ উষ্ণতায়
উত্তর – (B) নিম্নচাপ ও উচ্চ উষ্ণতায়
জলের মোলার ভর –
(A) 16 g
(B) 18 g
(C) 20 g
(D) 22 g
উত্তর – (B) 18 g
5 mol হাইড্রোজেন গ্যাসের ভর হল –
(A) 5g
(B) 10 g
(C) 20 g
(D) 15 g
উত্তর – (B) 10 g
বয়েলের সূত্রে ধ্রুবক হল –
(A) শুধুমাত্র গ্যাসের ভর
(B) শুধুমাত্র গ্যাসের তাপমাত্রা
(C) গ্যাসের ভর ও চাপ
(D) গ্যাসের ভর ও উষ্ণতা
উত্তর – (D) গ্যাসের ভর ও উষ্ণতা
আদর্শ গ্যাসের দুটি অণুর সংঘর্ষে –
(A) শুধুমাত্র রৈখিক ভরবেগ সংরক্ষিত থাকে
(B) শুধুমাত্র গতিশক্তি সংরক্ষিত থাকে
(C) রৈখিক ভরবেগ ও গতিশক্তি উভয়েই সংরক্ষিত থাকে
(D) রৈখিক ভরবেগ ও গতিশক্তি কোনোটিই সংরক্ষিত থাকে না
উত্তর – (C) রৈখিক ভরবেগ ও গতিশক্তি উভয়েই সংরক্ষিত থাকে
আদর্শ গ্যাসের অণুগুলির শক্তি –
(A) শুধুমাত্র স্থিতিশক্তি
(B) শুধুমাত্র গতিশক্তি
(C) গতিশক্তি ও স্থিতিশক্তির সমষ্টি
(D) গতিশক্তি ও স্থিতিশক্তির অন্তরফল
উত্তর – (B) শুধুমাত্র গতিশক্তি
স্থির চাপে নির্দিষ্ট ভরের কোনো আদর্শ গ্যাসের V-t লেখচিত্র, তাপমাত্রা অক্ষকে কোন্ তাপমাত্রায় ছেদ করে?
(A) 0°C
(B) -136.5°C
(C) -273°C
(D) 273°C
উত্তর – (C) -273°C
তাপমাত্রার কোন্ স্কেলে তাপমাত্রার মান ঋণাত্মক হওয়া সম্ভব নয়?
(A) সেলসিয়াস স্কেল
(B) ফারেনহাইট স্কেল
(C) পরম স্কেল
(D) (A), (B), (C) তিনটিই
উত্তর – (C) পরম স্কেল
pV = nRT সমীকরণে কোন রাশিটি স্থির?
(A) p
(B) V
(C) T
(D) R
উত্তর – (D) R
CGS পদ্ধতিতে সর্বজনীন গ্যাস ধ্রুবকের মান-
(A) 8.31 × 106 erg⋅mol-1⋅K-1
(B) 8.31 × 107 erg⋅mol-1⋅K-1
(C) 8.31 × 108 erg⋅mol-1⋅K-1
(D) 8.31 × 109 erg⋅mol-1⋅K-1
উত্তর – (B) 8.31 × 107 erg⋅mol-1⋅K-1
নির্দিষ্ট ভরের কোনো গ্যাসের চাপ p ও আয়তন V। উষ্ণতা স্থির রেখে চাপ 25% বৃদ্ধি করলে আয়তন হবে –
(A) 0.6V
(B) 0.75V
(C) 0.8V
(D) 0.85V
উত্তর – (C) 0.8V
1 Pa = কত dyn/cm2?
(A) 1
(B) 10
(C) 100
(D) 1000
উত্তর – (B) 10
p চাপ ও T তাপমাত্রায় V আয়তন He গ্যাসে অণুর সংখ্যাটি x হলে একই চাপ ও তাপমাত্রায় 3V আয়তন O2 গ্যাসে অণুর সংখ্যা হবে –
(A) xটি
(B) 3xটি
(C) \(\frac x3\)টি
(D) 9x টি
উত্তর – (B) 3xটি
পরম স্কেলে জলের হিমাঙ্ক হল –
(A) 0K
(B) 273K
(C) 373K
(D) 173K
উত্তর – (B) 273K
সর্বজনীন গ্যাস ধ্রুবকের মাত্রীয় সংকেত হল –
(A) ML2TN-1Θ-1
(B) ML2T-2N-1Θ-1
(C) ML2T-2N-1Θ
(D) ML2T-1N-1Θ-1
উত্তর – (B) ML2T-2N-1Θ-1
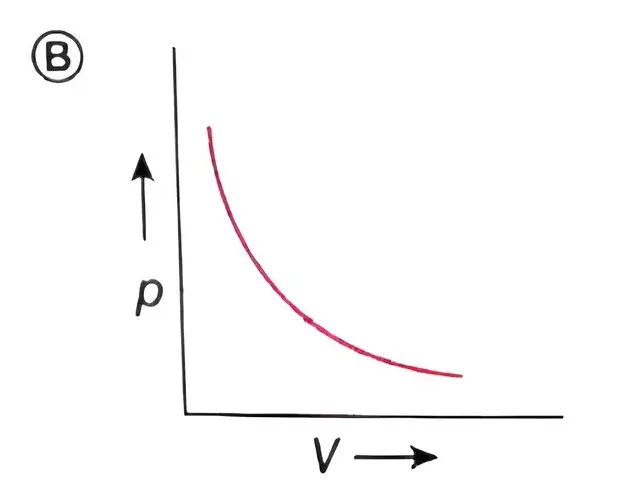
বয়েলের সূত্রের p-V লেখচিত্রের প্রকৃতি হল –
(A) সরলরেখা
(B) বৃত্ত
(C) অধিবৃত্ত
(D) সমপরাবৃত্ত
উত্তর – (D) সমপরাবৃত্ত
বয়েলের সূত্রের pV-p লেখচিত্রের প্রকৃতি হল –
(A) সরলরেখা
(B) বৃত্ত
(C) সমপরাবৃত্ত
(D) কোনোটিই নয়
উত্তর – (A) সরলরেখা
বয়েলের সূত্রের p-V লেখচিত্রটি হল –
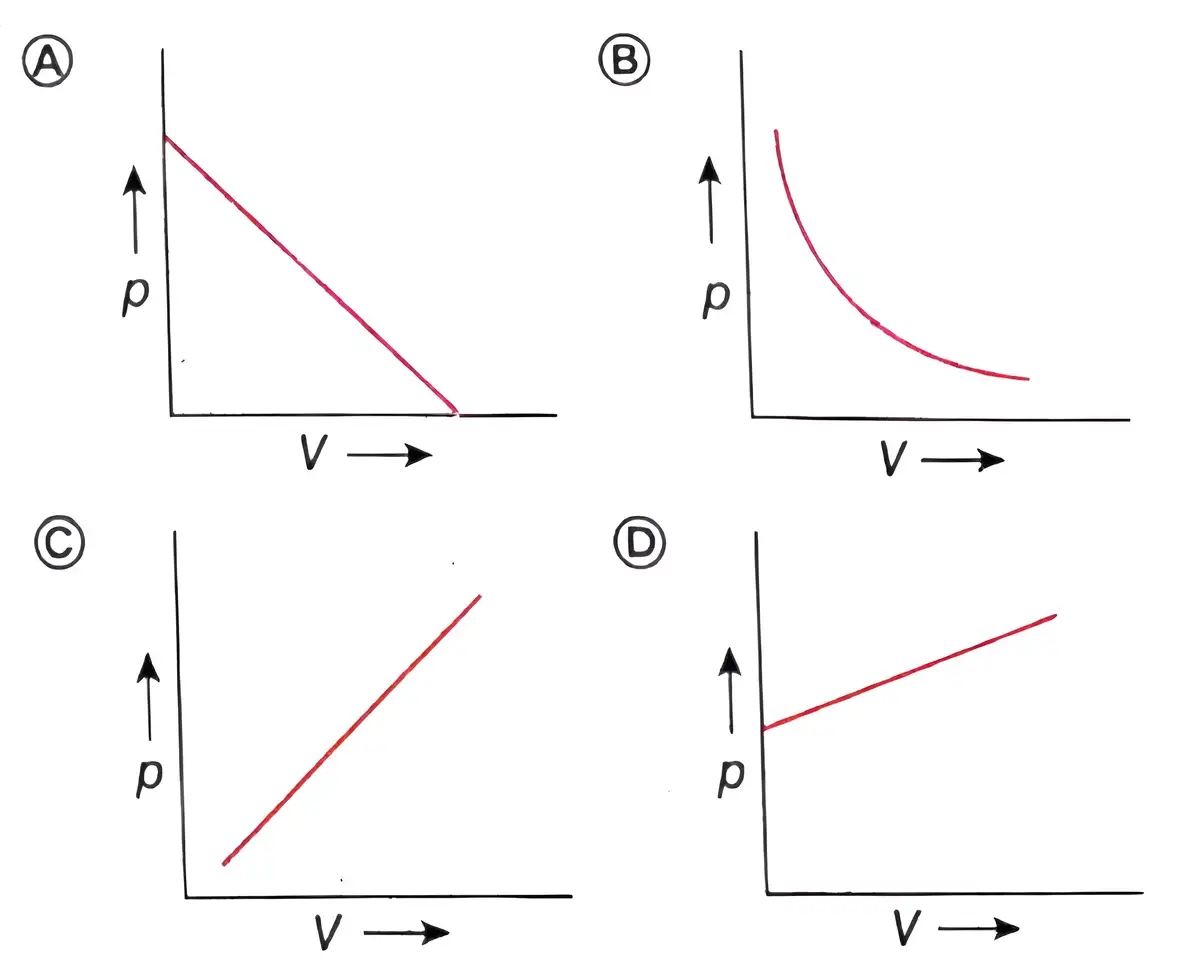
উত্তর –
ফারেনহাইট স্কেলে পরমশূন্য উষ্ণতার মান হল –
(A) -452.4°F
(B) -462.4°F
(C) -459.4°F
(D) -463.4°F
উত্তর – (B) -462.4°F
গ্যাসের গতীয় তত্ত্বানুযায়ী কোন্ তাপমাত্রায় আদর্শ গ্যাসের একটি অণুর গতিশক্তি শূন্য হয়?
(A) 273K
(B) 300K
(C) 0K
(D) 100K
উত্তর – (C) 0K
কোনো আবদ্ধ পাত্রের A ক্ষেত্রফলযুক্ত তলে গ্যাস লম্বভাবে F বল প্রয়োগ করলে গ্যাসের চাপ –
(A) p = F⋅A
(B) \(\frac AF\)
(C) \(\frac FA\)
(D) \(\sqrt{\frac FA}\)
উত্তর – (C) \(\frac FA\)
SI -তে চাপের একক হল –
(A) N/m2
(B) bar
(C) torr
(D) dyn/cm2
উত্তর – (A) N/m2
1m3 = কত cm3?
(A) 103
(B) 104
(C) 105
(D) 106
উত্তর – (D) 106
1m3 = কত L?
(A) 1
(B) 10
(C) 100
(D) 1000
উত্তর – (D) 1000
CGS পদ্ধতি ও SI -তে ক্ষেত্রফলের একক হল –
(A) m2, cm2
(B) m3, cm3
(C) cm3, m3
(D) cm2, m2
উত্তর – (D) cm2,m2
84g N2 = কত mol N2?
(A) 1
(B) 2
(C) 3
(D) 4
উত্তর – (C) 3
STP -তে 2g H2, 28g N2 ও 44g CO2 -এর মধ্যে কোনটির আয়তন বেশি?
(A) 2g H2
(B) 28g N2
(C) 44g CO2
(D) তিনটিরই আয়তন সমান
উত্তর – (D) তিনটিরই আয়তন সমান
অ্যাভোগাড্রো সংখ্যা N হলে 1 mol CO2 -তে পরমাণুর সংখ্যা –
(A) N
(B) 2N
(C) 3N
(D) 4N
উত্তর – (C) 3N
একটি অক্সিজেন অণুর ভর –
(A) 5.31 × 10-23g
(B) 10.62 × 10-23g
(C) 15.93 × 10-23g
(D) 2.65 × 10-23g
উত্তর – (A) 5.31 × 10-23g
STP -তে 11.2L CO2 -এর ভর 22g হলে CO2 -এর আণবিক গুরুত্ব-
(A) 22
(B) 44
(C) 88
(D) 11
উত্তর – (B) 44
7g N2 গ্যাসে অণুর সংখ্যা –
(A) 12.044 × 1023
(B) 1.506 × 1023
(C) 3.011 × 1023
(D) 6.022 × 1023
উত্তর – (B) 1.506 × 1023
নির্দিষ্ট ভরের কোনো গ্যাসের স্থির চাপে তাপমাত্রা 0°C থেকে 30°C পর্যন্ত করলে গ্যাসটির প্রাথমিক ও অন্তিম আয়তনের অনুপাত হল –
(A) 91 : 101
(B) 91 : 100
(C) 91 : 111
(D) 91 : 121
উত্তর – (A) 91 : 101
কোনো নির্দিষ্ট ভরের গ্যাসকে স্থির চাপে 0°C থেকে 273°C পর্যন্ত উত্তপ্ত করা হলে অন্তিম আয়তন হবে প্রাথমিক আয়তনের –
(A) 1.2 গুণ
(B) 1.5 গুণ
(C) 2 গুণ
(D) 3 গুণ
উত্তর – (C) 2 গুণ
ঘরের তাপমাত্রায় 76cm পারদ চাপে কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন 1L। তাপমাত্রা অপরিবর্তিত রাখলে 38 cm পারদ চাপে ওই গ্যাসের আয়তন হবে –
(A) 1.5L
(B) 2L
(C) 3L
(D) 4L
উত্তর – (B) 2L
1K উষ্ণতা বৃদ্ধিতে 1 mol আদর্শ গ্যাস স্থির চাপের বিরুদ্ধে প্রসারিত হলে গ্যাসটি যে কার্য সম্পন্ন করে, তা হল –
(A) R
(B) 2R
(C) 3R
(D) 4R
উত্তর – (A) R
27°C উষ্ণতায় ও 570 mm পারদস্তম্ভের চাপে 2.2 g কার্বন ডাইঅক্সাইডের আয়তন –
(A) 4.92L
(B) 0.82L
(C) 3.28L
(D) 1.64 L
উত্তর – (D) 1.64 L
SI -তে ব্যাপন হারের একক –
(A) m3/s2
(B) m/s2
(C) m2/s
(D) m3/s
উত্তর – (D) m3/s
বাস্তব গ্যাসগুলির আচরণ আদর্শ গ্যাসের আচরণ থেকে সবচেয়ে বেশি বিচ্যুত হয় –
(A) নিম্নচাপ ও নিম্ন উষ্ণতায়
(B) নিম্নচাপ ও উচ্চ উষ্ণতায়
(C) উচ্চচাপ ও নিম্ন উষ্ণতায়
(D) উচ্চচাপ ও উচ্চ উষ্ণতায়
উত্তর – (C) উচ্চচাপ ও নিম্ন উষ্ণতায়
n মোল কোনো গ্যাসে অণু আছে Nটি। \(\frac Nn\) -এর মান হল –
(A) 9.033 × 1023
(B) 12.044 × 1023
(C) 3.011 × 1023
(D) 6.022 × 1023
উত্তর – (D) 6.022 × 1023
স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের চাপ \(\frac14\) ভাগ করা হলে আয়তন বাড়বে –
(A) 2 গুণ
(B) 3 গুণ
(C) 4 গুণ
(D) 5 গুণ
উত্তর – (B) 3 গুণ
pV = RT সমীকরণে SI -তে pV -এর একক –
(A) J⋅mol-1
(B) J⋅K
(C) J⋅K-1
(D) J
উত্তর – (D) J
7g অক্সিজেন গ্যাসের জন্য অবস্থার সমীকরণ –
(A) pV = 7RT
(B) \(\frac{32}7\)RT
(C) \(\frac7{32}\)RT
(D) pV = 14RT
উত্তর – (C) \(\frac7{32}\)RT
শূন্যস্থান পূরণ করো
আদর্শ গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল _____।
উত্তর – আদর্শ গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল নেই।
গ্যাসের উষ্ণতা বৃদ্ধি করলে বা চাপ _____ আয়তন বাড়ে।
উত্তর – গ্যাসের উষ্ণতা বৃদ্ধি করলে বা চাপ হ্রাস করলে আয়তন বাড়ে।
গ্যাসের উষ্ণতা হ্রাস করলে বা চাপ _____ আয়তন কমে।
উত্তর – গ্যাসের উষ্ণতা হ্রাস করলে বা চাপ বৃদ্ধি করলে আয়তন কমে।
বয়েলের পরীক্ষার জন্য প্রয়োজনীয় বায়ু পাম্প তৈরি করেন ____।
উত্তর – বয়েলের পরীক্ষার জন্য প্রয়োজনীয় বায়ু-পাম্প তৈরি করেন রবার্ট হুক।
গভীর জলের তলদেশ থেকে বায়ুর বুদ্বুদ ওপরের দিকে উঠলে আয়তন _____।
উত্তর – গভীর জলের তলদেশ থেকে বায়ুর বুদ্বুদ ওপরের দিকে উঠলে আয়তন বাড়ে।
স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের চাপ চারগুণ করলে _____ চার ভাগের একভাগ হয়।
উত্তর – স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের চাপ চারগুণ করলে আয়তন চার ভাগের একভাগ হয়।
0°C উষ্ণতায় কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন V0 হলে স্থির চাপে 1°C উষ্ণতায় আয়তন _____।
উত্তর – 0°C উষ্ণতায় কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন \(V_0\) হলে স্থির চাপে 1°C উষ্ণতায় আয়তন \(V_0\left(1+\frac t{273}\right) \)।
পরম শূন্য উষ্ণতার চেয়ে কম উষ্ণতা বাস্তবে পাওয়া _____।
উত্তর – পরম শূন্য উষ্ণতার চেয়ে কম উষ্ণতা বাস্তবে পাওয়া যায় না।
বিজ্ঞানী _____ উষ্ণতার পরম স্কেল আবিষ্কার করেন।
উত্তর – বিজ্ঞানী কেলভিন উষ্ণতার পরম স্কেল আবিষ্কার করেন।
কঠিন, তরল ও গ্যাসীয় পদার্থের মধ্যে _____ পদার্থের অণুগুলির মধ্যে আকর্ষণ বল সবচেয়ে বেশি।
উত্তর – কঠিন, তরল ও গ্যাসীয় পদার্থের মধ্যে কঠিন পদার্থের অণুগুলির মধ্যে আকর্ষণ বল সবচেয়ে বেশি।
স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের চাপ ও আয়তন সংক্রান্ত সূত্রটি হল _____ সূত্র।
উত্তর – স্থির উষ্ণতায় নির্দিষ্ট ভরের কোনো গ্যাসের চাপ ও আয়তন সংক্রান্ত সূত্রটি হল বয়েলের সূত্র।
স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন ও তাপমাত্রা সংক্রান্ত সূত্রটি হল _____ সূত্র।
উত্তর – স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন ও তাপমাত্রা সংক্রান্ত সূত্রটি হল চার্লসের সূত্র।
STP -তে 2 mol CO2 -এর ভর _____।
উত্তর – STP -তে 2 mol CO2 -এর ভর 88g।
STP -তে 4g H2 -এর আয়তন _____।
উত্তর – STP -তে 4g H2 -এর আয়তন 44.8L।
জলের মোলার ভর _____।
উত্তর – জলের মোলার ভর 18 g⋅mol-1।
পরীক্ষালব্ধ প্রমাণের অভাবে অ্যাভোগাড্রোর সময়ে অণু ও পরমাণুর সম্পূর্ণ ধারণা ছিল _____।
উত্তর – পরীক্ষালব্ধ প্রমাণের অভাবে অ্যাভোগাড্রোর সময়ে অণু ও পরমাণুর সম্পূর্ণ ধারণা ছিল কল্পনামাত্র।
আবদ্ধ বায়ুর চাপ বায়ুমন্ডলীয় চাপের চেয়ে বেশি হলে ম্যানোমিটারের খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় _____ থাকে।
উত্তর – আবদ্ধ বায়ুর চাপ বায়ুমন্ডলীয় চাপের চেয়ে বেশি হলে ম্যানোমিটারের খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় উঁচুতে থাকে।
আবদ্ধ বায়ুর চাপ বায়ুমণ্ডলীয় চাপের চেয়ে কম হলে ম্যানোমিটারের খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় থাকে _____।
উত্তর – আবদ্ধ বায়ুর চাপ বায়ুমণ্ডলীয় চাপের চেয়ে কম হলে ম্যানোমিটারের খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় থাকে নীচুতে।
মোলার আয়তনের মান গ্যাসের _____ ওপর নির্ভর করে না।
উত্তর – মোলার আয়তনের মান গ্যাসের প্রকৃতির ওপর নির্ভর করে না।
STP -তে 2g H2 গ্যাসে অণুর সংখ্যা N হলে, STP -তে 64 g O2 গ্যাসে অণুর সংখ্যা _____।
উত্তর – STP -তে 2g H2 গ্যাসে অণুর সংখ্যা N হলে, STP -তে 64 g O2 গ্যাসে অণুর সংখ্যা 2N।
অ্যাভোগাড্রো সংখ্যা N হলে, 8.5g NH3 গ্যাসে অণুর সংখ্যা _____।
উত্তর – অ্যাভোগাড্রো সংখ্যা N হলে, 8.5g \(NH_3\) গ্যাসে অণুর সংখ্যা \(\frac N2\)।
কোনো আবদ্ধ গ্যাসের উষ্ণতা বৃদ্ধি করলে অণুগুলির গতিশক্তি _____ পায়।
উত্তর – কোনো আবদ্ধ গ্যাসের উষ্ণতা বৃদ্ধি করলে অণুগুলির গতিশক্তি বৃদ্ধি পায়।
একটি গ্যাসপূর্ণ বেলুন 2-3 দিন রেখে দিলে গ্যাসের _____ জন্য বেলুনটি চুপসে যায়।
উত্তর – একটি গ্যাসপূর্ণ বেলুন 2-3 দিন রেখে দিলে গ্যাসের ব্যাপনের জন্য বেলুনটি চুপসে যায়।
গ্যাস অণুর মুক্তপথ অতিক্রম করতে যে সময় লাগে তার তুলনায় ধাক্কার সময়কাল _____।
উত্তর – গ্যাস অণুর মুক্তপথ অতিক্রম করতে যে সময় লাগে তার তুলনায় ধাক্কার সময়কাল নগণ্য।
দুটি অণুর ধাক্কার ক্ষেত্রে _____ ও গতিশক্তি উভয়ই সংরক্ষিত থাকে।
উত্তর – দুটি অণুর ধাক্কার ক্ষেত্রে রৈখিক ভরবেগ ও গতিশক্তি উভয়ই সংরক্ষিত থাকে।
বাস্তব গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল _____।
উত্তর – বাস্তব গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল আছে।
এক মোল আদর্শ গ্যাসের ক্ষেত্রে \(\frac{pV}T\) -এর মান হল _____।
উত্তর – এক মোল আদর্শ গ্যাসের ক্ষেত্রে \(\frac{pV}T\) -এর মান হল R।
শুষ্ক বায়ু অপেক্ষা আর্দ্র বায়ু _____।
উত্তর – শুষ্ক বায়ু অপেক্ষা আর্দ্র বায়ু হালকা।
\(pV=\frac WM⋅RT\) সমীকরণে M হল _____।
উত্তর – \(pV=\frac WM⋅RT\) সমীকরণে M হল মোলার ভর।
CGS পদ্ধতিতে মোলার ভরের একক _____।
উত্তর – CGS পদ্ধতিতে মোলার ভরের একক g.mol-1।
দু-একটি বাক্যে উত্তর দাও
কোন যন্ত্রের সাহায্যে কোনো পাত্রে আবদ্ধ বায়ুর চাপ মাপা হয়?
ম্যানোমিটার যন্ত্রের সাহায্যে কোনো পাত্রে আবদ্ধ বায়ুর চাপ মাপা হয়।
Pa (পাস্কাল) কিসের একক?
Pa চাপের একক।
Pa (পাস্কাল) ও N/m2 -এর মধ্যে সম্পর্ক কী?
1 Pa = 1 N/m2
ম্যানোমিটার যন্ত্রের সাহায্যে কোনো আবদ্ধ গ্যাসের চাপ নির্ণয়ের সময় খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় উঁচুতে থাকলে কী বোঝা যায়?
এর থেকে বোঝা যায় আবদ্ধ গ্যাসের চাপ বায়ুমণ্ডলীয় চাপের চেয়ে বেশি।
ম্যানোমিটার যন্ত্রের সাহায্যে কোনো আবদ্ধ গ্যাসের চাপ নির্ণয়ের সময় খোলা বাহুতে পারদের লেভেল অন্য বাহুর তুলনায় নীচুতে থাকলে কী বোঝা যায়?
এর থেকে বোঝা যায় আবদ্ধ গ্যাসের চাপ বায়ুমণ্ডলীয় চাপের চেয়ে কম।
1 L = কত cm3?
1 L = 1000 cm3
1 m3 = কত L?
1 m3 = 1000 L
কঠিন, তরল ও গ্যাস – এই তিন ধরনের পদার্থের মধ্যে কোনটিতে অণুগুলির মধ্যে আকর্ষণ সবচেয়ে বেশি?
কঠিন, তরল ও গ্যাস – এই তিন ধরনের পদার্থের মধ্যে কঠিন পদার্থে অণুগুলির মধ্যে আকর্ষণ সবচেয়ে বেশি।
কঠিন, তরল ও গ্যাস – এই তিন ধরনের পদার্থের মধ্যে কোনটিতে অণুগুলির মধ্যে আকর্ষণ সবচেয়ে কম?
কঠিন, তরল ও গ্যাস – এই তিন ধরনের পদার্থের মধ্যে গ্যাসীয় পদার্থে অণুগুলির মধ্যে আকর্ষণ সবচেয়ে কম।
বয়েলের সূত্রে ধ্রুবক কী কী?
বয়েলের সূত্রে ধ্রুবক হল – 1. গ্যাসের ভর ও 2. উষ্ণতা।
চার্লসের সূত্রে ধ্রুবক কী কী?
চার্লসের সূত্রে ধ্রুবক হল – 1. গ্যাসের ভর ও 2. গ্যাসের চাপ।
উষ্ণতার পরম স্কেল ও সেলসিয়াস স্কেলের মধ্যে সম্পর্ক কী?
কোনো বস্তুর উষ্ণতা সেলসিয়াস স্কেলে 1°C এবং পরম স্কেলে উষ্ণতা T K হলে, T = 1 + 273
ফারেনহাইট স্কেলে পরম শূন্য উষ্ণতার মান কত?
ফারেনহাইট স্কেলে পরম শূন্য উষ্ণতার মান -459.4°F
পরম উষ্ণতা কাকে বলে?
পরম স্কেল অনুযায়ী কোনো বস্তুর উষ্ণতাকে পরম উষ্ণতা বলা হয়।
পরম স্কেলে জলের হিমাঙ্কের মান কত?
পরম স্কেলে জলের হিমাঙ্ক 273 K
পরম স্কেলে জলের স্ফুটনাঙ্ক কত?
পরম স্কেলে জলের স্ফুটনাঙ্ক 373 K
চার্লসের সূত্রের V-t লেখচিত্রের প্রকৃতি কী?
চার্লসের সূত্রের V-t লেখচিত্রের প্রকৃতি হল সরলরেখা।
চার্লসের সূত্রের V-t লেখচিত্র উষ্ণতা অক্ষকে কোন্ উষ্ণতায় ছেদ করে?
চার্লসের সূত্রের V-t লেখচিত্র উষ্ণতা অক্ষকে -273°C উষ্ণতায় ছেদ করে।
চার্লসের সূত্রের V-T লেখচিত্রের প্রকৃতি কী?
চার্লসের সূত্রের V-T লেখচিত্রের প্রকৃতি হল সরলরেখা।
চার্লসের সূত্রের V-T লেখচিত্র উষ্ণতা অক্ষকে কোন্ উষ্ণতায় ছেদ করে?
চার্লসের সূত্রের V-T লেখচিত্র উষ্ণতা অক্ষকে 0 K উষ্ণতায় ছেদ করে।
পরম শূন্য উষ্ণতার চেয়ে কম উষ্ণতা বাস্তবে সম্ভব কি?
না, পরম শূন্য উষ্ণতার চেয়ে কম উষ্ণতা বাস্তবে সম্ভব নয়।
পরম শূন্য উষ্ণতায় কোনো আদর্শ গ্যাসের আয়তন কত?
পরম শূন্য উষ্ণতায় কোনো আদর্শ গ্যাসের আয়তন শূন্য।
সেলসিয়াস স্কেলে 400 K উষ্ণতার মান কত?
সেলসিয়াস স্কেলে 400 K উষ্ণতার মান = (400 – 273)°C = 127°C
পরম শূন্য উষ্ণতার মান কি গ্যাসের প্রকৃতি, ভর, আয়তন বা চাপের ওপর নির্ভরশীল?
না, পরম শূন্য উষ্ণতার মান গ্যাসের প্রকৃতি, ভর, আয়তন বা চাপের ওপর নির্ভরশীল নয়।
বাস্তব গ্যাসগুলি নিম্নচাপ না উচ্চচাপ, কখন pV = KT সমীকরণটি মোটামুটি মেনে চলে
বাস্তব গ্যাসগুলি নিম্নচাপে, pV = KT সমীকরণটি মোটামুটি মেনে চলে।
বাস্তব গ্যাসগুলি নিম্ন উষ্ণতা না উচ্চ উষ্ণতা, কখন pV = KT সমীকরণটি মোটামুটি মেনে চলে?
বাস্তব গ্যাসগুলি উচ্চ উষ্ণতায়, pV = KT সমীকরণটি মোটামুটি মেনে চলে।
হাইড্রোজেনের মোলার ভর কত?
হাইড্রোজেনের মোলার ভর 2 g
অক্সিজেনের মোলার ভর কত?
অক্সিজেনের মোলার ভর 32 g
মোলার আয়তন কাকে বলে?
কোনো নির্দিষ্ট উষ্ণতা ও চাপে যে-কোনো গ্যাসীয় পদার্থের (মৌলিক বা যৌগিক) 1 মোল অণুর আয়তনকে মোলার আয়তন বলা হয়।
মোলার আয়তনের মান কি গ্যাসের প্রকৃতির ওপর নির্ভর করে?
না, মোলার আয়তনের মান গ্যাসের প্রকৃতির ওপর নির্ভর করে না।
মোলার আয়তনের মান কীসের ওপর নির্ভরশীল?
মোলার আয়তনের মান গ্যাসের চাপ ও উষ্ণতার ওপর নির্ভরশীল।
STP -তে কোনো গ্যাসীয় পদার্থের মোলার আয়তনের সীমাস্থ মান কত?
STP -তে কোনো গ্যাসীয় পদার্থের মোলার আয়তনের সীমাস্থ মান 22.4 L বা 22400 mL
অ্যাভোগাড্রো প্রকল্পে গ্যাসের আয়তন বলতে – গ্যাস দ্বারা অধিকৃত অঞ্চলের আয়তনকে না গ্যাসের মধ্যে থাকা অণুদের আয়তনকে বোঝায়?
অ্যাভোগাড্রো প্রকল্পে গ্যাসের আয়তন বলতে গ্যাস দ্বারা অধিকৃত অঞ্চলের আয়তনকে বোঝায়।
কোন্ বিজ্ঞানী প্রথম অণুর ধারণা দেন?
বিজ্ঞানী অ্যাভোগাড্রো প্রথম অণুর ধারণা দেন।
অণু ও পরমাণুর মধ্যে পার্থক্য স্পষ্ট করে বুঝিয়ে দেন কোন্ বিজ্ঞানী?
অণু ও পরমাণুর মধ্যে পার্থক্য স্পষ্ট করে বুঝিয়ে দেন বিজ্ঞানী অ্যাভোগাড্রো।
6.022 × 1023 টি CO2 অণুর ভর কত?
6.022 × 1023 টি অণু থাকে 1 mol CO2 – তে।
1 mol CO2 = 44 g CO2
∴ 6.022 × 1023 টি CO2 অণুর ভর 44 g
1 mol NH3 -এর অর্থ কী?
1 mol NH3 -এর অর্থ হল 17 g NH3 অর্থাৎ 6.022 × 1023 টি NH3 অণু।
1 mol ইলেকট্রনে ইলেকট্রনের সংখ্যা কত?
1 mol ইলেকট্রনে ইলেকট্রনের সংখ্যা 6.022 × 1023 টি।
2 mol অক্সিজেনের ভর কত?
2 mol অক্সিজেনের ভর = 32 × 2 g = 64 g
STP -তে 22.4 L কোনো গ্যাসে অণুর সংখ্যা কত?
STP -তে 22.4 L কোনো গ্যাসে অণুর সংখ্যা 6.022 × 1023 টি।
n মোল গ্যাসের ক্ষেত্রে আদর্শ গ্যাস সমীকরণটি লেখো।
মোল গ্যাসের ক্ষেত্রে আদর্শ গ্যাস সমীকরণটি হল, PV = nRT
1 mol গ্যাসের ক্ষেত্রে আদর্শ গ্যাস সমীকরণটি লেখো।
1 mol গ্যাসের ক্ষেত্রে আদর্শ গ্যাস সমীকরণটি হল, pV = RT
PV = nRT সমীকরণটি কি সকল আদর্শ গ্যাসের ক্ষেত্রে সমভাবে প্রযোজ্য?
হ্যাঁ, pV = nRT সমীকরণটি সকল আদর্শ গ্যাসের ক্ষেত্রে সমভাবে প্রযোজ্য।
PV = nRT সমীকরণটি সকল আদর্শ গ্যাসের ক্ষেত্রে সমভাবে প্রযোজ্য কেন?
PV = nRT সমীকরণে এমন কোনো ভৌত রাশি নেই যা গ্যাসের প্রকৃতির ওপর নির্ভরশীল। তাই pV = nRT সমীকরণটি সকল আদর্শ গ্যাসের ক্ষেত্রে সমভাবে প্রযোজ্য।
CGS পদ্ধতিতে সর্বজনীন গ্যাস ধ্রুবক R -এর একক কী?
CGS পদ্ধতিতে সর্বজনীন গ্যাস ধ্রুবক R -এর একক হল erg⋅mol-1⋅K-1
SI – তে সর্বজনীন গ্যাস ধ্রুবক R – এর একক কী?
SI – তে সর্বজনীন গ্যাস ধ্রুবক R – এর একক হল J⋅mol-1⋅K-1
cal⋅mol-1⋅K-1 এককে সর্বজনীন গ্যাস ধ্রুবক R -এর মান কত?
cal⋅mol-1⋅K-1 এককে সর্বজনীন গ্যাস ধ্রুবক R -এর মান 1.987
L⋅atm⋅ml-1⋅K-1 এককে সর্বজনীন গ্যাস ধ্রুবক R -এর মান কত?
L⋅atm⋅mol-1⋅K-1 এককে সর্বজনীন গ্যাস ধ্রুবক R -এর মান 0.082
আদর্শ গ্যাসের অণুগুলির বেগের মান কত?
আদর্শ গ্যাসের অণুগুলির বেগের মান শূন্য থেকে অসীম পর্যন্ত হতে পারে।
মুক্তপথ কাকে বলে?
গ্যাসের অণুগুলি সর্বদা নিজেদের মধ্যে ও পাত্রের দেয়ালের সঙ্গে ধাক্কা খায়। পরপর দুটি ধাক্কার মাঝের পথ একটি অণু সমবেগে যায়। এই পথকে মুক্তপথ বলা হয়।
আদর্শ গ্যাসের দুটি অণুর ধাক্কা কী ধরনের?
আদর্শ গ্যাসের দুটি অণুর ধাক্কা হল স্থিতিস্থাপক সংঘর্ষ, কারণ এক্ষেত্রে রৈখিক ভরবেগ ও গতিশক্তি উভয়ই সংরক্ষিত থাকে।
কী থেকে বলা যায় গ্যাস অণুগুলির কোনো স্থিতিশক্তি নেই?
গ্যাসের অণুগুলি নিজেদের মধ্যে কোনো আকর্ষণ বা বিকর্ষণ বল অনুভব করে না, তাই গ্যাস অণুগুলির কোনো স্থিতিশক্তি নেই।
গ্যাস অণুগুলির শক্তি কী ধরনের?
গ্যাস অণুগুলির সম্পূর্ণ শক্তিই হল গতিশক্তি।
ব্যাপন ক্রিয়ার শর্ত কী?
পরস্পর বিক্রিয়া করে না এমন দুই বা ততোধিক গ্যাসের মধ্যেই ব্যাপন হয়।
অভিকর্ষের বিপরীতে কি ব্যাপন হয়?
হ্যাঁ, অভিকর্ষের বিপরীতে ব্যাপন হতে পারে।
কোন ধরনের পাত্রে কোনো গ্যাস আবদ্ধ রাখলে গ্যাসের ব্যাপন হয়?
মাটি, পোর্সেলিন বা রবারের পাত্রে কোনো গ্যাস আবদ্ধ রাখলে গ্যাসের ব্যাপন হয়।
একটি গ্যাস অণু যখন কোনো পাত্রের অভ্যন্তরে থাকে তখন অণুর ওপর লব্ধি আকর্ষণ বল কত?
একটি গ্যাস অণু যখন কোনো পাত্রের অভ্যন্তরে থাকে তখন অণুর ওপর লব্ধি আকর্ষণ বল শূন্য হয়।
কোনো পাত্রের মধ্যে থাকা কোনো গ্যাস অণুর ওপর কখন লব্ধি আকর্ষণ বল ক্রিয়া করে?
একটি অণু যখন পাত্রের দেয়ালের খুব নিকটবর্তী হয়, তখন অণুর ওপর লব্ধি আকর্ষণ বল ক্রিয়া করে।
আদর্শ গ্যাসকে কি তরলে রূপান্তরিত করা সম্ভব?
আদর্শ গ্যাসের অণুগুলির মধ্যে কোনো আকর্ষণ বল নেই, তাই আদর্শ গ্যাসকে তরলে রূপান্তরিত করা সম্ভব নয়।
বাস্তব গ্যাসকে কি তরলে রূপান্তরিত করা সম্ভব?
বাস্তব গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল বর্তমান, তাই বাস্তব গ্যাসকে তরলে রূপান্তরিত করা সম্ভব।
10 g H2 = কত mol H2?
1 mol H2 = 2 g H2
10 g \(H_2=\frac{10}2\) = 5 mol \(H_2\)
কোনো গ্যাসের মোলার ভর M g ও অ্যাভোগাড্রো সংখ্যা N হলে 1টি অণুর ভর কত?
ওই গ্যাসের 1টি অণুর ভর = \(\frac MNg\)
Class 10 Physical Science – Notes for All Chapters
আজকে আমরা আমাদের আর্টিকেলে মাধ্যমিক ভৌতবিজ্ঞানের দ্বিতীয় অধ্যায় “গ্যাসের আচরণ” নিয়ে কিছু গুরুত্বপূর্ণ অতিসংক্ষিপ্ত প্রশ্ন ও উত্তর আলোচনা করেছি। এই প্রশ্নগুলো মাধ্যমিক পরীক্ষা এবং চাকরির পরীক্ষার জন্য অত্যন্ত গুরুত্বপূর্ণ, কারণ প্রায়শই এসব প্রশ্ন পরিক্ষায় আসে। আশা করি, এই আর্টিকেলটি আপনার জন্য উপকারী হয়েছে। যদি আপনার কোনো প্রশ্ন বা অসুবিধা থাকে, টেলিগ্রামে যোগাযোগ করতে পারেন, আমরা উত্তর দেওয়ার চেষ্টা করবো। এছাড়া, এই পোস্টটি আপনার প্রিয়জনদের সাথে শেয়ার করতে ভুলবেন না, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






মন্তব্য করুন