আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন’ এর কিছু সংক্ষিপ্ত প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

পরীক্ষাগারে অ্যামোনিয়া গ্যাস প্রস্তুতির নীতি ও রাসায়নিক বিক্রিয়ার সমীকরণ দাও।
নীতি – পরীক্ষাগারে সাধারণত অ্যামোনিয়াম ক্লোরাইড (NH4Cl) ও কলিচুন [Ca(OH)2] বা পোড়া চুন (CaO) -এর মিশ্রণকে উত্তপ্ত করে অ্যামোনিয়া গ্যাস প্রস্তুত করা হয়।
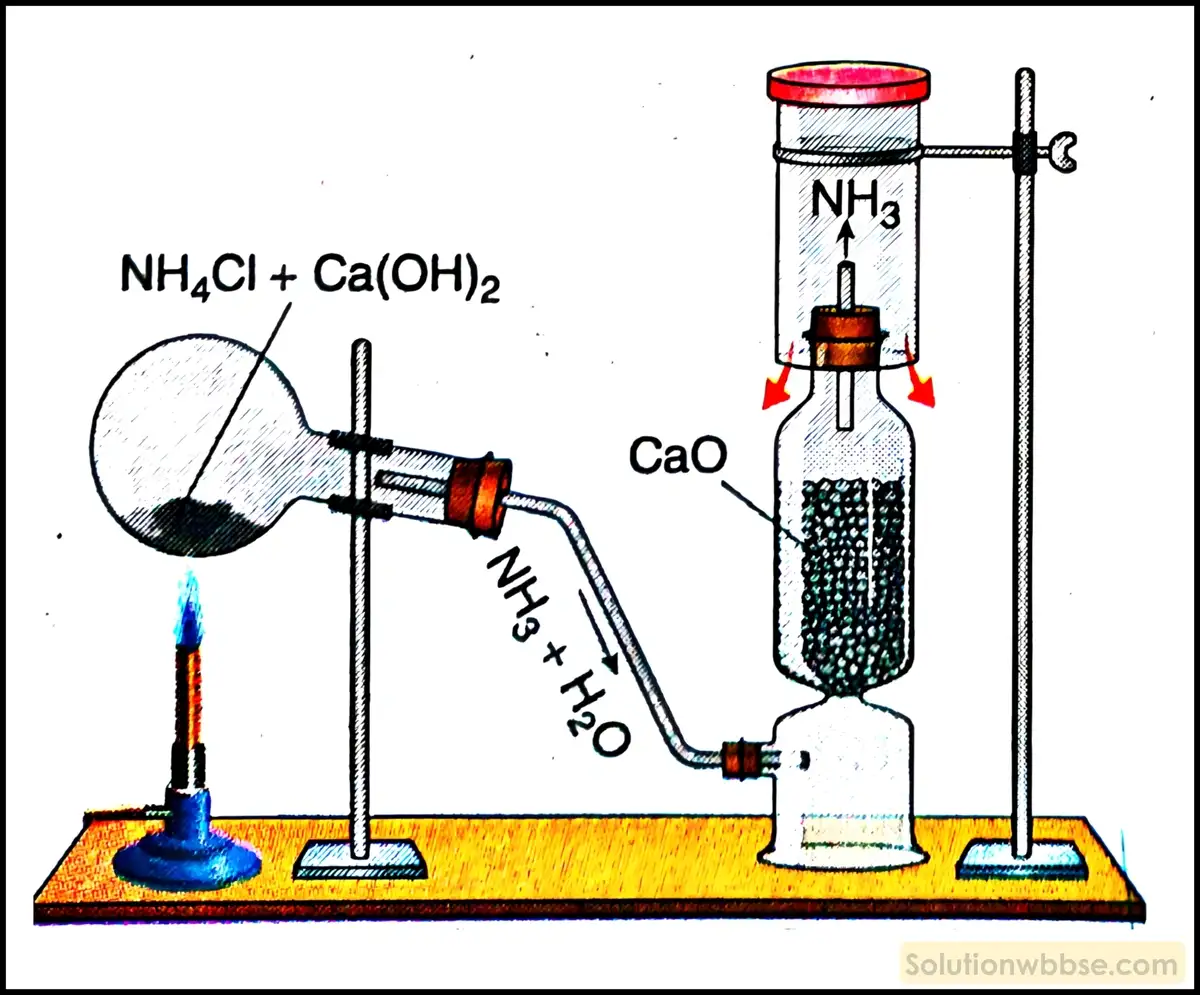
রাসায়নিক বিক্রিয়ার সমীকরণ –
2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
2NH4Cl + CaO → 2NH3↑ + CaCl2 + 2H2O
পরীক্ষাগারে অ্যামোনিয়া প্রস্তুতির সময় NH4Cl ও Ca(OH2) -এর চূর্ণকে শুষ্ক অবস্থায় খুব ভালোভাবে মিশিয়ে তারপর উত্তপ্ত করা উচিত কেন?
শুষ্ক অ্যামোনিয়াম ক্লোরাইড ঊর্ধ্বপাতিত হয়, অর্থাৎ তাপ দিলে কঠিন অবস্থা থেকে সরাসরি বাষ্পে পরিণত হয়। তাই NH4Cl ও Ca(OH2) চূর্ণকে ভালোভাবে না মিশিয়ে উত্তপ্ত করলে NH4Cl ঊর্ধ্বপাতিত হয়ে বিক্রিয়া-মাধ্যম থেকে অপসারিত হতে পারে। অ্যামোনিয়া প্রস্তুতিতে NH4Cl ও Ca(OH2) -এর মিশ্রণকে শুষ্ক অবস্থায় উত্তপ্ত করা হয়, কারণ অ্যামোনিয়া জলে খুব দ্রাব্য। জলীয় দ্রবণকে উত্তপ্ত করলে অ্যামোনিয়া গ্যাস মুক্ত অবস্থায় পাওয়া যাবে না।
পরীক্ষাগারে সাধারণ উষ্ণতায় কীভাবে অ্যামোনিয়া গ্যাস প্রস্তুত করা যায়?
কঠিন কস্টিক পটাশ বা কস্টিক সোডার ওপর ফোঁটা ফোঁটা করে লাইকার অ্যামোনিয়ার দ্রবণ ফেললে দ্রবণের জল কস্টিক পটাশ বা কস্টিক সোডা দ্বারা শোষিত হয় এবং অ্যামোনিয়া গ্যাস নির্গত হয়।
পরীক্ষাগারে অ্যামোনিয়া প্রস্তুত করতে অ্যামোনিয়াম নাইট্রেট ব্যবহার করা যুক্তিযুক্ত নয় কেন?
পরীক্ষাগারে অ্যামোনিয়া প্রস্তুত করতে অ্যামোনিয়াম নাইট্রেট (NH4NO3) ব্যবহার করা যুক্তিযুক্ত নয়, কারণ NH4NO3 -তে তাপ প্রয়োগ করলে বিস্ফোরণ ঘটার সম্ভাবনা থাকে।
অ্যামোনিয়ার নিম্নলিখিত ভৌতধর্মগুলি সম্পর্কে মন্তব্য করো – (i) বর্ণ, (ii) গন্ধ, (iii) জলে দ্রাব্যতা, (iv) বাষ্পঘনত্ব।
অ্যামোনিয়ার প্রদত্ত ভৌতধর্মগুলি নিম্নরূপ –
- বর্ণ – অ্যামোনিয়া গ্যাস বর্ণহীন; তরল অবস্থাতেও এটি বর্ণহীন।
- গন্ধ – অ্যামোনিয়া তীব্র ঝাঁজালো গন্ধযুক্ত গ্যাস।
- জলে দ্রাব্যতা – অ্যামোনিয়া জলে খুব দ্রাব্য। STP-তে 1 আয়তন জলে 1300 আয়তন অ্যামোনিয়া দ্রবীভূত হয়।
- বাষ্পঘনত্ব – অ্যামোনিয়ার বাষ্পঘনত্ব = আণবিক ভর/2 = 17/2 = 8.5
অ্যামোনিয়াকে শীতলীকরণের কাজে ব্যবহার করা যায় কেন?
তরল অ্যামোনিয়ার বাষ্পীভবনের লীনতাপ খুব বেশি। কাজেই বাষ্পীভবনের সময় এটি পরিবেশ থেকে প্রচুর তাপ গ্রহণ করে। এই ভৌতধর্মের কারণে তরল অ্যামোনিয়াকে শীতলীকরণের কাজে বহুল ব্যবহার করা হয়।
শৌচাগার বা আস্তাবলের কাছে অ্যামোনিয়ার ঝাঁজালো গন্ধ পাওয়া যায় কেন?
প্রাণীর মূত্রে ইউরিয়া (NH2CONH2) নামক জৈব উপাদানটি বর্তমান যা ব্যাকটেরিয়ার ক্রিয়ায় বিয়োজিত হয়ে অ্যামোনিয়াতে পরিণত হয়। তাই শৌচাগার বা আস্তাবলের কাছে অ্যামোনিয়ার ঝাঁজালো গন্ধ পাওয়া যায়।
পরীক্ষাগারে উৎপন্ন অ্যামোনিয়া গ্যাসকে কীভাবে জলীয় বাষ্পমুক্ত করা হয়? এক্ষেত্রে একটি বিশেষ রাসায়নিক পদার্থ ব্যবহার করার কারণ কী?
পরীক্ষাগারে উৎপন্ন অ্যামোনিয়া গ্যাসকে বিক্রিয়া-মাধ্যম থেকে নির্গম নলের সাহায্যে একটি চুনস্তম্ভের (CaO) মধ্য দিয়ে পাঠানো হয়। চুনস্তম্ভ অ্যামোনিয়া গ্যাসে উপস্থিত জলীয় বাষ্পকে শোষণ করে নেয় ও শুষ্ক অ্যামোনিয়া নির্গম নল দিয়ে বেরিয়ে আসে।
NH3 ক্ষারধর্মী, তাই এক্ষেত্রে ক্ষারধর্মী শুষ্ককারক পদার্থ পোড়া চুন (CaO) ব্যবহার করা হয়।
জলীয় বাষ্পমুক্ত অ্যামোনিয়া গ্যাসকে কীভাবে সংগ্রহ করা হয়?
অ্যামোনিয়া গ্যাস জলে খুবই দ্রাব্য এবং বায়ুর চেয়ে হালকা। তাই চুনস্তম্ভ থেকে নির্গত শুষ্ক অ্যামোনিয়া গ্যাসকে বায়ুর নিম্ন অপসারণ দ্বারা শুষ্ক গ্যাসজারে সংগ্রহ করা হয়। লাল লিটমাস দ্রবণে সিক্ত কাগজকে গ্যাসজারের মুখে ধরলে যদি তা নীল বর্ণ ধারণ করে তাহলে বুঝতে হবে গ্যাসজারটি NH3 গ্যাস দ্বারা পূর্ণ হয়েছে। তখন গ্যাসজারটির মুখ ঢাকনা দিয়ে বন্ধ করে গ্যাসকে সংরক্ষণ করা হয়।
স্মেলিং সল্ট (Smelling salt) কী?
স্মেলিং সল্টের বোতলে থাকে অ্যামোনিয়াম কার্বনেট ও চুনজল। বোতলটিকে ঝাঁকালে NH3(g) উৎপন্ন হয়। সংজ্ঞাহীন ব্যক্তির সংজ্ঞা ফেরানোর জন্য NH3 -এর ঝাঁজালো গন্ধ ব্যবহার করা হয়।
(NH4)2CO3 + Ca(OH)2 → CaCO3 + 2NH3↑ + 2H2O
অ্যামোনিয়ার জলীয় দ্রবণকে অ্যামোনিয়াম হাইড্রক্সাইড বলা কতটা যুক্তিযুক্ত?
অ্যামোনিয়ার জলীয় দ্রবণে NH4OH অণুর অস্তিত্ব মেলে না। তাই অ্যামোনিয়াম হাইড্রক্সাইড না বলে জলীয় দ্রবণটিকে ‘অ্যাকুয়াস অ্যামোনিয়া’ (aqueous ammonia) বা ‘অ্যামোনিয়ার জলীয় দ্রবণ’ বলা উচিত।
অ্যামোনিয়া গ্যাস হাইড্রোজেন ক্লোরাইডের সংস্পর্শে এলে কী ঘটবে সমীকরণসহ লেখো।
অ্যামোনিয়া গ্যাস হাইড্রোজেন ক্লোরাইডের সংস্পর্শে এলে সাদা ধোঁয়ার সৃষ্টি হয়। এই ধোঁয়া আসলে বায়ুতে ভাসমান কঠিন অ্যামোনিয়াম ক্লোরাইডের সূক্ষ্ম কণার সমষ্টি।
NH3(g) + HCl(g) → NH4Cl(s)
অতিরিক্ত অ্যামোনিয়ার সঙ্গে ক্লোরিনের বিক্রিয়ায় কী ঘটে সমীকরণসহ লেখো।
অতিরিক্ত অ্যামোনিয়ার সঙ্গে ক্লোরিনের বিক্রিয়ায় অ্যামোনিয়া জারিত হয়ে নাইট্রোজেনে পরিণত হয় এবং ক্লোরিন বিজারিত হয়ে অ্যামোনিয়াম ক্লোরাইড (NH4Cl) উৎপন্ন করে।
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
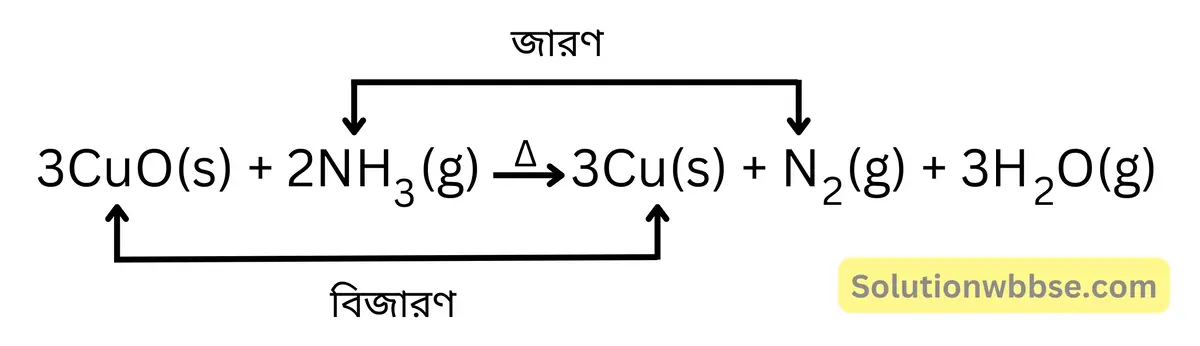
অ্যামোনিয়ার বিজারণ ধর্মের উদাহরণ দাও।
উত্তপ্ত কালো কিউপ্রিক অক্সাইডের উপর দিয়ে অ্যামোনিয়া গ্যাস চালনা করলে কিউপ্রিক অক্সাইড বিজারিত হয়ে লাল বর্ণের ধাতব কপার উৎপন্ন হয় এবং অ্যামোনিয়া জারিত হয়ে নাইট্রোজেনে পরিণত হয়।
অ্যালুমিনিয়াম ক্লোরাইডের জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে কী ঘটবে সমীকরণসহ লেখো।
অ্যালুমিনিয়াম ক্লোরাইডের বর্ণহীন জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে অ্যালুমিনিয়াম হাইড্রক্সাইডের জিলেটিনের মতো সাদা অধঃক্ষেপ উৎপন্ন হয়।
অতিরিক্ত ক্লোরিনের সঙ্গে অ্যামোনিয়ার বিক্রিয়ায় কী ঘটে সমীকরণসহ লেখো।
অতিরিক্ত ক্লোরিনের সঙ্গে অ্যামোনিয়ার বিক্রিয়ায় নাইট্রোজেন ট্রাইক্লোরাইড (NCl3) নামক একটি হলুদ বর্ণের বিস্ফোরকধর্মী তৈলাক্ত তরল পদার্থ এবং হাইড্রোজেন ক্লোরাইড উৎপন্ন হয়। এই বিক্রিয়াতে অ্যামোনিয়া বিজারকরূপে কাজ করে।
NH3 + 3Cl2 → NCl3 + 3HCl
উত্তপ্ত লেড অক্সাইডের ওপর দিয়ে অ্যামোনিয়া গ্যাস চালনা করলে কী ঘটে সমীকরণসহ লেখো।
উত্তপ্ত লেড অক্সাইডের (PbO) ওপর দিয়ে অ্যামোনিয়া গ্যাস চালনা করলে অ্যামোনিয়া হলুদ বর্ণের লেড অক্সাইডকে বিজারিত করে ধূসর বর্ণের ধাতব লেডে পরিণত করে এবং নিজে N2 -তে জারিত হয়।
3PbO (হলুদ) + 2NH3 → 3Pb (ধূসর) + N2 + 3H2O
ফেরিক ক্লোরাইডের জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে কী ঘটবে সমীকরণসহ লেখো।
ফেরিক ক্লোরাইডের হলুদ বর্ণের দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে বাদামি বর্ণের ফেরিক হাইড্রক্সাইড অধঃক্ষিপ্ত হয়।
ধাতব লবণগুলির সাথে অ্যামোনিয়ার জলীয় দ্রবণের বিক্রিয়াগুলির দুটি গুরুত্ব উল্লেখ করো।
ধাতব লবণগুলির সাথে অ্যামোনিয়ার জলীয় দ্রবণের বিক্রিয়াগুলির দুটি গুরুত্ব হল –
- ধাতব লবণগুলির সাথে অ্যামোনিয়ার জলীয় দ্রবণের বিক্রিয়া থেকে বোঝা যায় যে, অ্যামোনিয়া জলীয় দ্রবণে OH– আয়ন উৎপন্ন করে, যা ধাতব ক্যাটায়নের সঙ্গে যুক্ত হয়ে অদ্রাব্য ধাতব হাইড্রক্সাইডের অধঃক্ষেপ সৃষ্টি করে।
- অধঃক্ষিপ্ত ধাতব হাইড্রক্সাইডের বর্ণ দেখে ধাতব ক্যাটায়নটি শনাক্ত করা যায়।
অনুঘটকের উপস্থিতিতে অ্যামোনিয়াকে জারিত করলে কী উৎপন্ন হবে সমীকরণসহ লেখো।
অ্যামোনিয়া ও অক্সিজেনের মিশ্রণকে 700°C উষ্ণতায় উত্তপ্ত প্ল্যাটিনাম অথবা প্ল্যাটিনাম-রোডিয়াম ধাতু সংকরের তৈরি তারজালির (অনুঘটক) ওপর দিয়ে চালনা করলে অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইডে পরিণত হয়।
4NH3 + 5O2 → 4NO + 6H2O
লাইকার অ্যামোনিয়া ও তরল অ্যামোনিয়া বলতে কী বোঝ?
লাইকার অ্যামোনিয়া – অ্যামোনিয়ার 35% গাঢ় জলীয় দ্রবণকে লাইকার (liquor) অ্যামোনিয়া বলে। এর আপেক্ষিক গুরুত্ব প্রায় 0.88।
তরল অ্যামোনিয়া – সাধারণ বায়ুমণ্ডলীয় চাপে ও -33.4°C উষ্ণতায় অ্যামোনিয়া বর্ণহীন তরলে পরিণত হয়। একেই তরল অ্যামোনিয়া বলে।
লাইকার অ্যামোনিয়ার বোতল খোলার সময় বোতলটিকে ঠান্ডা করে নেওয়া উচিত কেন?
লাইকার অ্যামোনিয়ার বোতলে উচ্চচাপে অতিরিক্ত অ্যামোনিয়া গ্যাস জলে দ্রবীভূত থাকে। তাই বোতলটি খোলামাত্র জলে দ্রবীভূত গ্যাস ফোয়ারার মতো ছিটকে বেরিয়ে আসে। অ্যামোনিয়া চোখের পক্ষে খুব ক্ষতিকারক। কিন্তু বোতলের ছিপি খোলার আগে লাইকার অ্যামোনিয়ার বোতলকে ঠান্ডা করে নিলে জলে গ্যাসের দ্রাব্যতা বৃদ্ধি পায়। ফলে বোতল মধ্যস্থ দ্রবণ চাপমুক্ত হয় ও অ্যামোনিয়া দ্রবণ আর ছিটকে বেরিয়ে আসে না।
অ্যামোনিয়ার জলীয় দ্রবণের সঙ্গে কপার সালফেটের জলীয় দ্রবণের বিক্রিয়া ঘটালে তুমি কী কী ইন্দ্রিয়গ্রাহ্য পরিবর্তন লক্ষ করবে?
নীল বর্ণের কপার সালফেটের জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ ধীরে ধীরে যোগ করলে প্রথমে নীলাভ সাদা অধঃক্ষেপ সৃষ্টি হয়। অতিরিক্ত অ্যামোনিয়া দ্রবণ যোগ করলে ওই অধঃক্ষেপ দ্রবীভূত হয়ে যায় এবং গাঢ় নীল দ্রবণ উৎপন্ন হয়।
কপার সালফেটের নীল জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ যোগ করলে কী ঘটে?
কপার সালফেটের নীল জলীয় দ্রবণে অ্যামোনিয়ার জলীয় দ্রবণ ধীরে ধীরে যোগ করলে প্রথমে ক্ষারকীয় কপার সালফেটের [CuSO4⋅Cu(OH)2] নীলাভ সাদা অধঃক্ষেপ পড়ে। অতিরিক্ত অ্যামোনিয়া দ্রবণ যোগ করলে গাঢ় নীল রঙের লবণ কিউপ্রো অ্যামোনিয়াম সালফেট বা টেট্রাঅ্যামিনকপার (II) সালফেট গঠিত হয় যা জলে দ্রাব্য।
নেসলার বিকারক কাকে বলে? নেসলার বিকারকের সংস্পর্শে এলে অ্যামোনিয়ার কী পরিবর্তন লক্ষ করা যায়?
পটাশিয়াম মারকিউরি আয়োডাইডের [K2HgI4] ক্ষারীয় দ্রবণকে নেসলার বিকারক বলে।
নেসলার বিকারক স্বল্প পরিমাণ অ্যামোনিয়ার সঙ্গে বাদামি দ্রবণ এবং অতিরিক্ত পরিমাণ অ্যামোনিয়ার সঙ্গে বাদামি অধঃক্ষেপ উৎপন্ন করে।
নেসলার দ্রবণের সঙ্গে NH3 -এর বিক্রিয়াটি লিখ।
নেসলার দ্রবণের সঙ্গে NH3 -এর বিক্রিয়াটি হল –
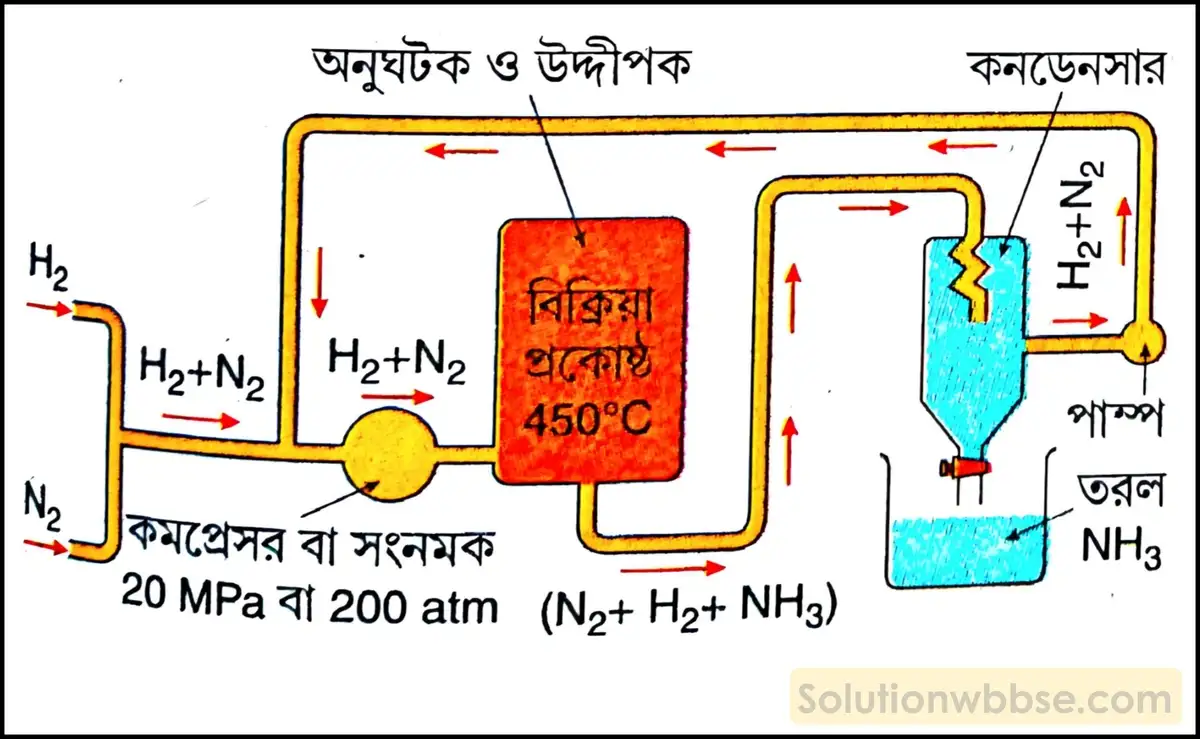
হেবার পদ্ধতিতে অ্যামোনিয়া গ্যাস প্রস্তুতির নীতি ও বিক্রিয়ার সমীকরণ লেখো।
নীতি – অনুঘটকরূপে আয়রন চূর্ণ এবং K2O ও Al2O3 চূর্ণের মিশ্রণ উদ্দীপকরূপে ব্যবহার করে 450°C উষ্ণতা ও 200 বায়ুমণ্ডলীয় চাপে নাইট্রোজেন ও হাইড্রোজেন গ্যাসের (1 : 3 আয়তন অনুপাতে) প্রত্যক্ষ সংযোগে অ্যামোনিয়া গ্যাস উৎপন্ন হয়।
বিক্রিয়ায় সমীকরণ – N2(g) + 3H2(g) ⇌ 2NH3(g) + 22.4 kcal
সার হিসেবে ইউরিয়া গুরুত্বপূর্ণ কেন?
ইউরিয়া জলে অত্যন্ত দ্রাব্য এবং জলশোষক পদার্থ। ইউরিয়াতে প্রায় শতকরা 46 ভাগ নাইট্রোজেন আছে। সবরকম মাটি ও ফসলের জন্য ইউরিয়া বিশেষ উপযোগী নাইট্রোজেনঘাটিত সার হিসেবে ব্যবহৃত হয়। বীজবপন বা চারা রোপনের সময় মূল সার হিসেবে অথবা ফসলের বৃদ্ধির সময় এই সার প্রয়োজন হয়। তাই সার হিসেবে ইউরিয়া বিশেষ গুরুত্বপূর্ণ।
পরীক্ষাগারে হাইড্রোজেন সালফাইড প্রস্তুতির নীতি ও বিক্রিয়ার সমীকরণ লেখো।
নীতি – সাধারণ উষ্ণতায় ফেরাস সালফাইডের (FeS) সঙ্গে লঘু সালফিউরিক অ্যাসিডের (H2SO4) বিক্রিয়ায় পরীক্ষাগারে হাইড্রোজেন সালফাইড গ্যাস উৎপন্ন করা হয়।
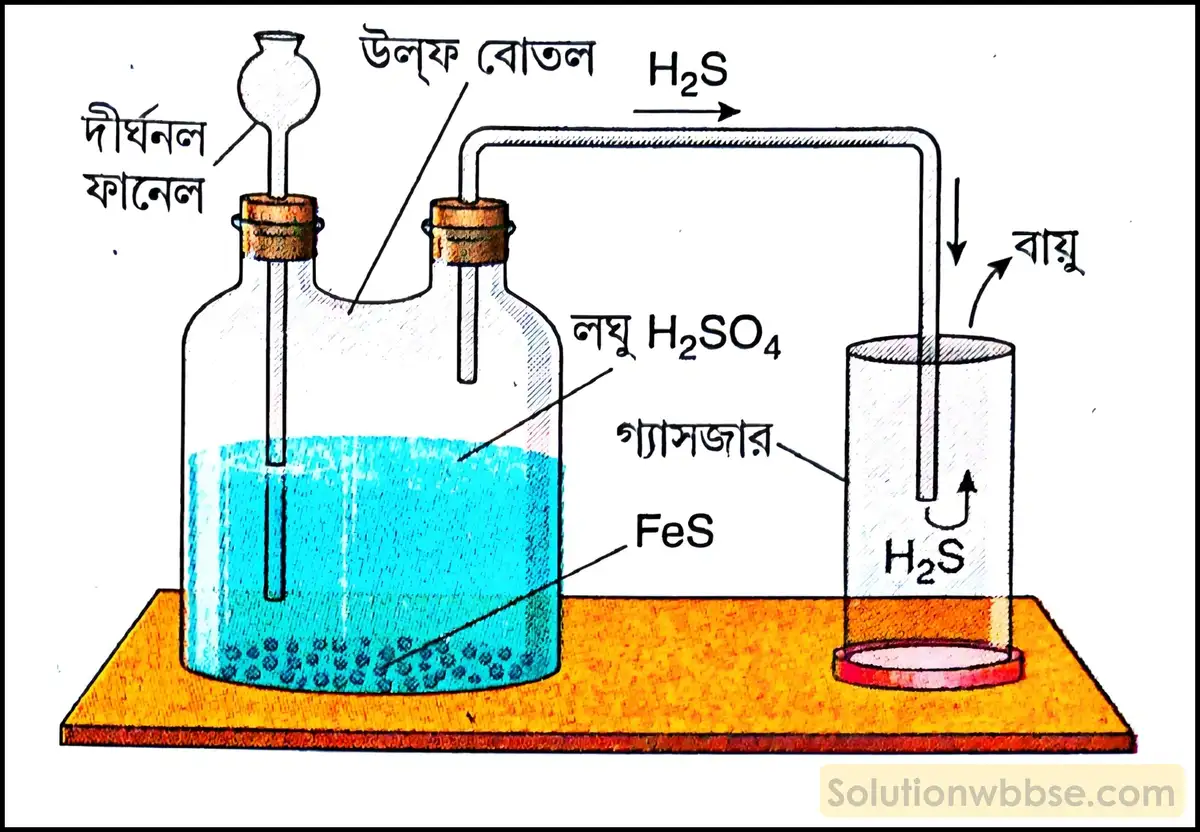
বিক্রিয়ায় সমীকরণ – FeS(s) + H2SO4(l) → FeSO4(s) + H2S(g)↑
H2S প্রস্তুতিতে গাঢ় H2SO4 ব্যবহার করা হয় না কেন?
গাঢ় H2SO4 জারক অ্যাসিড হওয়ায় এটি উৎপন্ন H2S -কে সালফারে জারিত করে ও নিজে SO2 -তে বিজারিত হয়।
FeS + H2SO4 → FeSO4 + H2S
H2S + H2SO4 → S↓ + SO2↑ + 2H2O
H2S প্রস্তুতিতে HNO3 ব্যবহার করা হয় না কেন?
নাইট্রিক অ্যাসিড জারক পদার্থ হওয়ায় এটি উৎপন্ন হাইড্রোজেন সালফাইডকে সালফারে জারিত করে ও নিজে NO2 -তে বিজারিত হয়।
FeS + 2HNO3 → Fe(NO3)2 + H2S
H2S + 2HNO3→ S↓ + 2NO2 + 2H2O
কী ধরনের গ্যাস প্রস্তুতিতে কিপ্-যন্ত্র ব্যবহার করা যায়? কিপ্-যন্ত্র ব্যবহারের সুবিধা কী?
যেসব গ্যাস তৈরি করতে তাপের প্রয়োজন হয় না (যেমন – CO2, H2, H2S ইত্যাদি), সেই সব গ্যাস প্রস্তুত করতে কিপ্-যন্ত্র ব্যবহার করা যায়।
সুবিধা – পরীক্ষাগারে কিপ্-যন্ত্র ব্যবহার করে প্রয়োজনমতো নিরবচ্ছিন্নভাবে কোনো গ্যাসের (যেমন – H2S) উৎপাদন করা যায় আবার প্রয়োজনে দ্রুত গ্যাস উৎপাদন বন্ধ করে দেওয়া যায়।
H2S -এর প্রদত্ত ভৌতধর্মগুলি সম্পর্কে লেখো – (i) বর্ণ, (ii) গন্ধ, (iii) বাষ্পঘনত্ব, (iv) জলে দ্রাব্যতা
H2S -এর প্রদত্ত ভৌতধর্মগুলি হল –
- বর্ণ – হাইড্রোজেন সালফাইড বর্ণহীন গ্যাস।
- গন্ধ – হাইড্রোজেন সালফাইডের গন্ধ পচা ডিমের মতো।
- বাষ্পঘনত্ব – H2S -এর আণব ভর = 2 × 1 + 32 = 34; অতএব বাষ্পঘনত্ব 34/2 = 17
- জলে দ্রাব্যতা – ঠান্ডা জলে H2S মোটামুটি দ্রবীভূত হলেও গরম জলে এর দ্রাব্যতা অনেক কম।
হাইড্রোজেন সালফাইড একটি বিষাক্ত গ্যাস – ব্যাখ্যা করো।
হাইড্রোজেন সালফাইড পচা ডিমের মতো দুর্গন্ধযুক্ত বর্ণহীন বিষাক্ত গ্যাস। এর সংস্পর্শে চোখ-জ্বালা, মাথাধরা, বমিভাব ইত্যাদি উপসর্গ দেখা দেয়। এই গ্যাসে শ্বাসগ্রহণ করলে মানুষ সংজ্ঞাহীন হয়ে পড়ে এবং বেশি সময় ধরে শ্বাস নিলে মৃত্যু পর্যন্ত ঘটতে পারে। তাই 5 ppm -এর বেশি মাত্রায় H2S আছে এমন বায়ুতে শ্বাসগ্রহণ করা বিপজ্জনক। প্রকৃতপক্ষে, কোশের অত্যাবশ্যক প্রোটিনগুলির সঙ্গে H2S -এর বিক্রিয়ার ফলেই এই বিষক্রিয়া ঘটে।
কোন্ কোন্ শর্তে H2S গ্যাসের দহনে যথাক্রমে S ও SO2 উৎপন্ন হয়? প্রতিক্ষেত্রে বিক্রিয়ার সমীকরণ দাও।
H2S অক্সিজেন বা বায়ুতে নীল শিখাসহ জ্বলে। অপর্যাপ্ত অক্সিজেনে H2S -এর দহনে হলুদাভ সালফারের গুঁড়ো ও জল উৎপন্ন হয়, কিন্তু পর্যাপ্ত অক্সিজেনে দহনের ফলে SO2 ও জল উৎপন্ন হয়।
2H2S + O2 → 2S + 2H2O
2H2S + 3O2 → 2SO2 + 2H2O
H2S জলীয় দ্রবণে দ্বি-ক্ষারীয় অ্যাসিডরূপে আচরণ করে – ব্যাখ্যা করো।
H2S জলীয় দ্রবণে স্বল্প মাত্রায় আয়নিত হয়ে দুই ধাপে H+ উৎপন্ন করে।
H2S ⇌ H+ + HS–; HS– ⇌ H+ + S2-
তাই জলীয় দ্রবণে এটি দ্বি-ক্ষারীয় অ্যাসিডরূপে আচরণ করে। তাই দেখা যায়, H2S -এর জলীয় দ্রবণের সঙ্গে ক্ষারের বিক্রিয়ায় দু-ধরনের লবণ উৎপন্ন হয়, যেমন –
H2S + NaOH → NaHS + H2O
NaHS + NaOH → Na2S + H2O
NaHS একটি আম্লিক লবণ এবং Na2S একটি প্রশম লবণ। সুতরাং, H2S অণুতে দুটি প্রতিস্থাপনযোগ্য H -পরমাণু বর্তমান, অর্থাৎ এটি একটি দ্বি-ক্ষারীয় অ্যাসিড।
H2S দ্বারা সম্পৃক্ত জলকে খোলা বাতাসে রাখলে ঘোলা হয়ে যায় কেন?
H2S দ্বারা সম্পৃক্ত জলকে খোলা বাতাসে রাখলে জলে দ্রবীভূত H2S বাতাসের অক্সিজেন দ্বারা আংশিক জারিত হয়ে অদ্রাব্য সালফার উৎপন্ন করে যা কোলয়েডের আকারে জলে ভাসতে থাকে। ফলে জলটি ঘোলা হয়ে যায়।
2H2S + O2 → 2S↓ + 2H2O
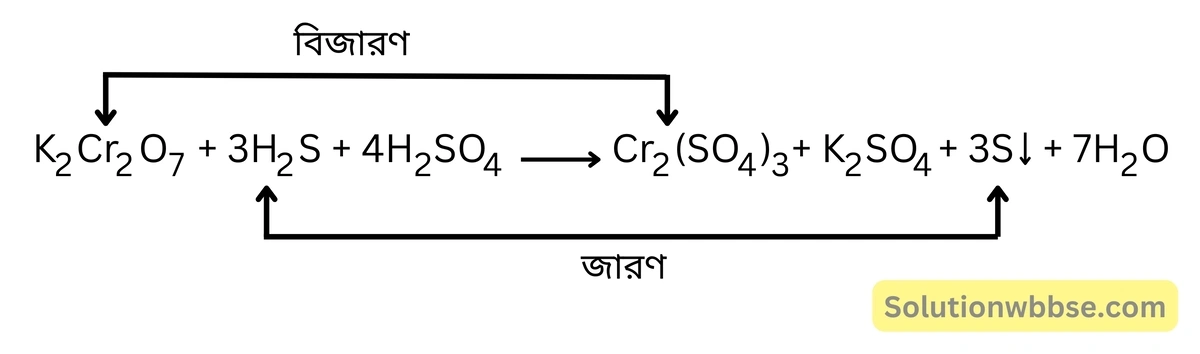
H2S -এর বিজারণ ধর্মের উদাহরণ দাও অথবা অ্যাসিডযুক্ত পটাশিয়াম ডাইক্রোমেটের জলীয় দ্রবণে H2S গ্যাস চালনা করলে কী ঘটবে সমীকরণসহ লেখো।
অ্যাসিডযুক্ত পটাশিয়াম ডাইক্রোমেটের কমলা বর্ণের জলীয় দ্রবণে H2S গ্যাস চালনা করলে ডাইক্রোমেট বিজারিত হয়ে সবুজ বর্ণের ক্রোমিক লবণে [Cr2(SO4)3] পরিণত হয়, ফলে দ্রবণের বর্ণ সবুজ হয়ে যায়।
কপার সালফেটের জলীয় দ্রবণে H2S গ্যাস চালনা করলে কী ঘটবে সমীকরণসহ লেখো।
কপার সালফেটের নীল বর্ণের জলীয় দ্রবণে H2S গ্যাস চালনা করলে কালো বর্ণের কপার সালফাইড অধঃক্ষিপ্ত হয়।
লেড নাইট্রেটের জলীয় দ্রবণে H2S গ্যাস চালনা করলে কী ঘটবে সমীকরণসহ লেখো।
লেড নাইট্রেটের বর্ণহীন জলীয় দ্রবণে H2S গ্যাস চালনা করলে লেড সালফাইডের কালো অধঃক্ষেপ উৎপন্ন হয়।
সিলভার নাইট্রেটের জলীয় দ্রবণে H2S গ্যাস চালনা করলে কী ঘটবে সমীকরণসহ লেখো।
সিলভার নাইট্রেটের বর্ণহীন জলীয় দ্রবণে H2S গ্যাস চালনা করলে সিলভার সালফাইডের কালো অধঃক্ষেপ উৎপন্ন হবে।
লেড অ্যাসিটেটে সিক্ত কাগজ H2S গ্যাসে ধরলে কালো হয়ে যায় কেন?
লেড অ্যাসিটেটে সিক্ত কাগজ H2S গ্যাসে ধরলে বর্ণহীন লেড অ্যাসিটেটের সঙ্গে H2S -এর বিক্রিয়ায় কালো বর্ণের লেড সালফাইড (PbS) অধঃক্ষিপ্ত হয়, ফলে কাগজটি কালো হয়ে যায়।
হাইড্রোজেন সালফাইডকে ক্ষারীয় সোডিয়াম নাইট্রোপ্রুসাইডের দ্রবণের সাহায্যে কীভাবে শনাক্ত করবে?
কস্টিক সোডার জলীয় দ্রবণে পরীক্ষণীয় গ্যাসটিকে চালনা করে এতে সদ্য-প্রস্তুত সোডিয়াম নাইট্রোপ্রুসাইডের দ্রবণ যোগ করলে যদি বর্ণহীন দ্রবণটি বেগুনি বর্ণ ধারণ করে তবে পরীক্ষণীয় গ্যাসটিকে হাইড্রোজেন সালফাইড বলে শনাক্ত করা যায়।
কীভাবে প্রমাণ করবে যে হাইড্রোজেন সালফাইডে হাইড্রোজেন আছে?
হাইড্রোজেন সালফাইড উত্তপ্ত অবস্থায় Cu, Pb প্রভৃতি ধাতুর সঙ্গে বিক্রিয়ায় যে গ্যাস উৎপন্ন করে তা নীল শিখায় জ্বলে এবং বায়ুতে দহনের ফলে জল উৎপন্ন করে। সুতরাং, গ্যাসটি হল হাইড্রোজেন। এই বিক্রিয়াগুলি দ্বারা প্রমাণিত হয় যে, হাইড্রোজেন সালফাইডে হাইড্রোজেন আছে।
Cu + H2S → CuS + H2↑, Pb + H2S → PbS + H2↑
কালো রঙের একটি ধাতব যৌগ A, লঘু H2SO4 -এর সঙ্গে বিক্রিয়ায় বিশেষ গন্ধযুক্ত একটি গ্যাস B উৎপন্ন করে। B গ্যাসটিকে আম্লিক K2Cr2O7 দ্রবণের মধ্য দিয়ে চালনা করলে C যৌগ উৎপন্ন হওয়ায় দ্রবণের বর্ণ কমলা থেকে পরিবর্তিত হয়ে সবুজ হয়। A, B ও C -কে শনাক্ত করো। বিক্রিয়াগুলির সমীকরণ দাও।
A – ফেরাস সালফাইড (FeS),
B – হাইড্রোজেন সালফাইড (H2S),
C – ক্লোমিক সালফেট [Cr2(SO4)3]
বিক্রিয়া –
1. FeS + H2SO4 → FeSO4 + H2S
2.
অ্যামোনিয়াম নাইট্রাইটকে সরাসরি উত্তপ্ত করে N2 গ্যাস উৎপন্ন করা হয় না কেন?
অ্যামোনিয়াম নাইট্রাইট একটি অস্থায়ী যৌগ। এর তাপ বিয়োজন বিক্রিয়াটি দ্রুতগতিতে ঘটে। তাই NH4NO2 -কে সরাসরি উত্তপ্ত করে N2 গ্যাস প্রস্তুত করতে গেলে বিস্ফোরণের সম্ভাবনা থাকে। সেকারণে NH4NO2 -এর জলীয় দ্রবণকে সরাসরি উত্তপ্ত না করে সোডিয়াম নাইট্রাইট (NaNO2) ও অ্যামোনিয়াম ক্লোরাইডের (NH4Cl) গাঢ় জলীয় দ্রবণকে আণবিক ভর অনুপাতে মিশিয়ে সতর্কভাবে উত্তপ্ত করে N2 প্রস্তুত করা হয়।
কঠিন অবস্থায় NH4Cl ও NaNO2 মিশ্রণকে উত্তপ্ত করে N2 প্রস্তুত করা হয় না কেন?
NH4Cl -কে কঠিন অবস্থায় তাপ দিলে সরাসরি বাষ্পে পরিণত হয়, অর্থাৎ ঊর্ধ্বপাতিত হয়। তাই NH4Cl ও NaNO2 -র কঠিন মিশ্রণকে উত্তপ্ত করে N2 প্রস্তুত করা হয় না। যেহেতু N2 জলে খুব সামান্য দ্রাব্য তাই NH4Cl ও NaNO2 -এর জলীয় দ্রবণ নিয়ে উত্তপ্ত করে N2 গ্যাস উৎপন্ন করা হয়।
বৈদ্যুতিক বালবে N2 ব্যবহার করা হয় কেন?
বৈদ্যুতিক বাল্বে বায়ু থাকলে বাল্বের টাংস্টেন ফিলামেন্ট বায়ুর O2 দ্বারা জারিত হয়ে কেটে যেতে পারে। তাই বাল্বের মধ্যে নিষ্ক্রিয় পরিমণ্ডল সৃষ্টি করতে N2 গ্যাস ব্যবহার করা হয়। (বর্তমানে অবশ্য তাপসঞ্চালন ক্ষমতা বেশি হওয়ায় এ কাজে আর্গন গ্যাস ব্যবহার করা হয়।)
ধাতু শিল্পে N2 ব্যবহার করা হয় কেন?
ধাতু শিল্পে কোনো কোনো ধাতুর নিষ্কাশনে O2 মুক্ত নিষ্ক্রিয় পরিমণ্ডলের প্রয়োজন হয়, কারণ O2 -এর উপস্থিতিতে উৎপন্ন ধাতু জারিত হয়ে অক্সাইড যৌগে পরিণত হতে পারে। N2 নিষ্ক্রিয় প্রকৃতির হওয়ায়, N2 -এর সাহায্যে O2 -কে দূরীভূত করে নিষ্ক্রিয় পরিমণ্ডল সৃষ্টি করা হয়।
তরল নাইট্রোজেনের ব্যবহার লেখো।
তরল নাইট্রোজেন -196°C -এর চেয়েও কম উষ্ণতা সৃষ্টি করতে পারে। এজন্য রক্ত সংরক্ষণে, কর্নিয়া প্রতিস্থাপনের কাজে তরল N2 হিমায়করূপে ব্যবহৃত হয়। তাছাড়া খাদ্যবস্তুকে দ্রুত হিমায়িত করতে এর ব্যবহার আছে। N2 নিষ্ক্রিয় প্রকৃতির হওয়ায় একে এসব ক্ষেত্রে নিরাপদে ব্যবহার করা যায়।
সাধারণ উষ্ণতায় নাইট্রোজেন রাসায়নিকভাবে নিষ্ক্রিয় কেন?
নাইট্রোজেন অণুতে দুটি N -পরমাণু সমযোজী ত্রি-বন্ধন দ্বারা পরস্পরের সঙ্গে যুক্ত থাকে (:N≡N:)। এই ত্রি-বন্ধন অত্যন্ত স্থিতিশীল। তাই N2 অণুকে বিয়োজিত করে দুটি N -পরমাণুতে পরিণত করতে প্রচুর শক্তির প্রয়োজন হয়। সাধারণ রাসায়নিক বিক্রিয়ায় এই পরিমাণ শক্তি পাওয়া যায় না বলে নাইট্রোজেন পারমাণবিক অবস্থায় এসে বিক্রিয়ায় অংশগ্রহণ করতে পারে না। তাই সাধারণ উষ্ণতায় N2 রাসায়নিকভাবে নিষ্ক্রিয় হয়।
সক্রিয় নাইট্রোজেন কাকে বলে?
কম চাপে (<1 mm) নাইট্রোজেন গ্যাসের মধ্যে তড়িৎ-ক্ষরণ করা হলে ওই গ্যাস থেকে মৃদু আলো বিকিরণ হয়। তড়িৎ-ক্ষরণ বন্ধ হলেও গ্যাস থেকে ওইরকম আলোর বিকিরণ চলতে থাকে। এই দীপ্তিমান নাইট্রোজেন সাধারণ নাইট্রোজেন অপেক্ষা অনেক বেশি সক্রিয় হয়। তাই একে সক্রিয় নাইট্রোজেন বলে। মনে করা হয় যে, সক্রিয় নাইট্রোজেন আণবিক ও পারমাণবিক নাইট্রোজেনের মিশ্রণ। এই মিশ্রণে নাইট্রোজেন পারমাণবিক অবস্থায় থাকার জন্য এটি বেশি সক্রিয় হয়।
শর্ত ও রাসায়নিক সমীকরণসহ নাইট্রোজেন ও অক্সিজেন গ্যাসের বিক্রিয়ায় কী ঘটে লেখো।
নাইট্রোজেন ও অক্সিজেন গ্যাসের মিশ্রণে তড়িৎস্ফুলিঙ্গের সাহায্যে প্রায় 3000°C উষ্ণতা সৃষ্টি করলে নাইট্রোজেন, অক্সিজেনের সঙ্গে যুক্ত হয়ে নাইট্রিক অক্সাইড উৎপন্ন করে। বিক্রিয়াটি উভমুখী প্রকৃতির ও তাপশোষক।
N2 + O2 ⇌ 2NO – 43.3 kcal
শর্ত ও রাসায়নিক সমীকরণসহ নাইট্রোজেন ও হাইড্রোজেন গ্যাসের বিক্রিয়ায় কী ঘটে লেখো।
450°C উষ্ণতায় ও 200 বায়ুমণ্ডলীয় চাপে আয়রন-চূর্ণ অনুঘটক এবং K2O ও Al2O3 উদ্দীপকের উপস্থিতিতে নাইট্রোজেন, হাইড্রোজেনের সাথে যুক্ত হয়ে অ্যামোনিয়া গ্যাস উৎপন্ন করে। বিক্রিয়াটি উভমুখী ও তাপ উৎপাদক।
N2 + 3H2 ⇌ 2NH3 + 22.4 kcal
নাইট্রোলিম কীভাবে প্রস্তুত করা হয়?
1100°C উষ্ণতায় উত্তপ্ত ক্যালশিয়াম কার্বাইডের (CaC2) ওপর দিয়ে নাইট্রোজেন গ্যাস চালনা করলে ক্যালশিয়াম সায়ানামাইড (CaNCN) ও কার্বনের ধূসর মিশ্রণ উৎপন্ন হয়, যাকে নাইট্রোলিম (Nitrolim) বলে।
নাইট্রোলিম কীভাবে সার হিসেবে কাজ করে?
জমিতে ব্যবহৃত নাইট্রোলিম ধীরে ধীরে আর্দ্রবিশ্লেষিত হয়ে অ্যামোনিয়াতে পরিণত হয়। NH3, ব্যাকটেরিয়ার প্রভাবে বায়ুর O2 দ্বারা জারিত হয়ে নাইট্রেট লবণে পরিণত হয়। এই নাইট্রেট লবণ জলে দ্রাব্য এবং উদ্ভিদ মূলরোমের সাহায্যে তা খাদ্য হিসেবে গ্রহণ করে।
CaNCN(s) + 3H2O(l) → CaCO3(s) + 2NH3(g)
নাইট্রোজেন চক্র ও নাইট্রোজেন বন্ধন বলতে কী বোঝ?
নাইট্রোজেন চক্র – যে প্রক্রিয়ার মাধ্যমে নাইট্রোজেন বায়ুমণ্ডল ও জীবমণ্ডলের মধ্যে চক্রাকারে, নিরবচ্ছিন্নভাবে আবর্তিত হয় এবং পরিবেশে নাইট্রোজেনের ভারসাম্য রক্ষিত হয় সেই প্রক্রিয়াকেই নাইট্রোজেন চক্র বলে।
নাইট্রোজেন বন্ধন – প্রাকৃতিক বা কৃত্রিম উপায়ে বায়ুমণ্ডলের নাইট্রোজেনকে নাইট্রোজেন-ঘটিত যৌগে রূপান্তরিত করার প্রক্রিয়াকে নাইট্রোজেন বন্ধন বলে।
অস্ওয়াল্ড পদ্ধতিতে HNO3 প্রস্তুতিতে ব্যবহৃত অ্যামোনিয়া ও বায়ুর মিশ্রণটি বিশুদ্ধ ও ধূলিকণামুক্ত হওয়া উচিত কেন?
অ্যামোনিয়া ও বায়ুর মিশ্রণ বিশুদ্ধ ও ধূলিকণামুক্ত না হলে প্রক্রিয়াটিতে ব্যবহৃত মূল্যবান অনুঘটক নষ্ট হয়ে যেতে পারে। ধূলিকণা অনুঘটকের পৃষ্ঠতলে সঞ্চিত হলে পৃষ্ঠতল আবৃত হয়ে যাবে ও বিক্রিয়কগুলি অনুঘটকের পৃষ্ঠতলের সংস্পর্শে আসতে পারবে না। তাছাড়া কোনো অশুদ্ধি যদি অনুঘটকের সাথে বিক্রিয়া ঘটায় তবে অনুঘটকের কার্যকারিতা নষ্ট হয়ে যাবে। অশুদ্ধি ও ধূলিকণা এক্ষেত্রে অনুঘটক বিষ (Catalytic poison)-রূপে কাজ করে।
অস্ওয়াল্ড পদ্ধতিতে HNO3 প্রস্তুতির সময় অ্যামোনিয়া ও বায়ুর মিশ্রণকে খুব দ্রুত উত্তপ্ত প্ল্যাটিনাম তারজালি অনুঘটকের উপর দিয়ে চালনা করা হয় কেন?
অ্যামোনিয়া ও বায়ুর মিশ্রণকে খুব দ্রুত উত্তপ্ত প্ল্যাটিনাম তারজালির উপর দিয়ে চালনা করা হয়। এক্ষেত্রে গ্যাস মিশ্রণ ও অনুঘটকের সংস্পর্শকাল 0.0014 সেকেন্ড হওয়া উচিত। এর কারণ অনুঘটকের সঙ্গে মিশ্রণের সংস্পর্শকাল দীর্ঘ হলে অ্যামোনিয়া NO -এ পরিণত না হয়ে N2 -তে পরিণত হয়।
4NH3 + 3O2 → 2N2 + 6H2O
অস্ওয়াল্ড পদ্ধতিতে প্রস্তুত লঘু HNO3 -কে গাঢ় করা হয় কীভাবে?
অস্ওয়াল্ড পদ্ধতিতে প্রস্তুত লঘু HNO3 (প্রায় 50%) -কে 120°C উষ্ণতায় উত্তপ্ত করে প্রথমে ঘন করা হয়। এই ঘন অ্যাসিডকে গাঢ় H2SO4 -এর সঙ্গে মিশিয়ে পাতিত করলে 98% HNO3 উৎপন্ন হয়।
স্পর্শ পদ্ধতিতে H2SO4 প্রস্তুতিতে অনুঘটক হিসেবে কী ব্যবহার করা যায়? পদ্ধতিটিকে স্পর্শ পদ্ধতি বলা হয় কেন?
স্পর্শ পদ্ধতিতে H2SO4 প্রস্তুতিতে নিম্নলিখিত যে-কোনো একটি অনুঘটকরূপে ব্যবহার করা যায় –
- প্ল্যাটিনাম চূর্ণাবৃত অ্যাসবেসটস্
- ভ্যানাডিয়াম পেন্টক্সাইড (V2O5)।
অনুঘটকের কঠিন পৃষ্ঠতলের সংস্পর্শে বিক্রিয়কগুলি রাসায়নিক বিক্রিয়া সম্পন্ন করে বলে এই পদ্ধতিকে স্পর্শ পদ্ধতি বলা হয়।
স্পর্শ পদ্ধতিতে H2SO4 প্রস্তুতিতে Pt অনুঘটক ব্যবহার করা হয় না কেন?
Pt -অনুঘটকের উপস্থিতিতে SO2 গ্যাসের জারণে শতকরা প্রায় 100 ভাগ SO3 উৎপাদন করা সম্ভব হয়। কিন্তু এটি অত্যন্ত দামী পদার্থ এবং বিক্রিয়া-মিশ্রণে যদি সামান্যতম অপদ্রব্য (ধূলিকণা, আর্সেনিয়াস অক্সাইড প্রভৃতি) উপস্থিত থাকে, তাহলে Pt -এর কার্যকারিতা বিনষ্ট হয়।
স্পর্শ পদ্ধতিতে V2O5 -কে অনুঘটকরূপে ব্যবহার করার কারণ কী?
প্ল্যাটিনাইজ্ড অ্যাসবেসটস্ অনুঘটকটি V2O5 অনুঘটক অপেক্ষা অধিক কার্যকারী হলেও সামান্যতম অপদ্রব্যের উপস্থিতিতে এর কার্যকারিতা দ্রুত হ্রাস পায়। অপরদিকে, V2O5 অনুঘটকটি প্ল্যাটিনাইজড অ্যাসবেসটস্ অপেক্ষা কম কার্যকারী হলেও এটি সস্তা এবং এর বিষক্রিয়ার সম্ভাবনা কম।
স্পর্শ পদ্ধতিতে H2SO4 প্রস্তুতির সময় SO2 ও O2 গ্যাসের মিশ্রণকে অনুঘটকের উপর দিয়ে চালনা করার আগে মিশ্রণটি বিশুদ্ধ ও ধূলিকণামুক্ত কিনা দেখে নেওয়া হয় কেন?
SO2 ও O2 -এর মিশ্রণে ধূলিকণা ও অশুদ্ধি (বিশেষত আর্সেনিয়াস অক্সাইড) উপস্থিত থাকলে মূল্যবান অনুঘটক নষ্ট হয়ে যাবার সম্ভাবনা থাকে। এগুলি অনুঘটক বিষ হিসেবে কাজ করে অনুঘটকের কার্যকারিতা নষ্ট করে।
ওলিয়াম কাকে বলে?
98% গাঢ় H2SO4 -এ অতিরিক্ত পরিমাণে SO3 গ্যাস চালনা করলে, গ্যাসটি অ্যাসিডে শোষিত হয়ে H2S2O7 সংকেতবিশিষ্ট যে তৈলাক্ত তরল পদার্থ উৎপন্ন হয়, তাকে ওলিয়াম বা ধূমায়মান সালফিউরিক অ্যাসিড (Oleum or fuming sulphuric acid) বলে। এর রাসায়নিক নাম পাইরোসালফিউরিক অ্যাসিড (Pyrosulphuric acid) |
H2SO4 + SO3 → H2S2O7
সালফান কাকে বলে?
বায়ুর উপস্থিতিতে ওলিয়াম থেকে SO3 গ্যাস অপসৃত হয়ে, ধোঁয়ার সৃষ্টি করে। এজন্য ওলিয়ামকে ধূমায়মান সালফিউরিক অ্যাসিড বলে। 100% ওলিয়ামকে সালফান বলে। 100% ওলিয়ামের অর্থ 100% সালফিউরিক অ্যাসিডের মধ্যে 100% SO3 গ্যাস শোষিত রয়েছে।
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন’ এর কিছু সংক্ষিপ্ত প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






Leave a Comment