আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘আয়নীয় ও সমযোজী বন্ধন’ এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও প্রতিযোগিতামূলক পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

আয়নীয় যৌগের ক্ষেত্রে ‘অষ্টকের ধারণার’ বহুল ব্যবহার বাঞ্ছনীয় নয় কেন?
সমস্ত আয়নীয় যৌগের ক্ষেত্রে যোজ্যতা-কক্ষে 8টি ইলেকট্রনের উপস্থিতি তথা অষ্টকপূর্তির দ্বারা যৌগগুলির স্থায়িত্ব ব্যাখ্যা করা যায় না। সন্ধিগত মৌলের বিভিন্ন যৌগে দেখা যায় ধাতব আয়নটির সর্ববহিস্থ কক্ষে 8টি ইলেকট্রন থাকার নিয়মটি পালিত হয় না। যেমন – FeCl2 যৌগে Fe2+ আয়নের সর্ববহিস্থ কক্ষে 14টি ইলেকট্রন থাকে ও FeCl3 যৌগে Fe3+ আয়নের সর্ববহিস্থ কক্ষে 13টি ইলেকট্রন থাকে। সুতরাং দুটি ক্ষেত্রেই অষ্টকের ধারণার ব্যতিক্রম ঘটছে। আবার ক্ষার ধাতু Li দ্বারা গঠিত LiH যৌগে Li+ আয়নের যোজ্যতা-কক্ষে 2টি ও H– আয়নের যোজ্যতা-কক্ষে 2টি ইলেকট্রন আছে। এক্ষেত্রেও অষ্টক সূত্রের ব্যতিক্রম ঘটছে। সুতরাং, আয়নীয় যৌগের ক্ষেত্রে স্থায়িত্ব ব্যাখ্যায় অষ্টকের ধারণার বহুল ব্যবহার বাঞ্ছনীয় নয়।
আয়নীয় যৌগ গঠিত হওয়ার শর্তগুলি আলোচনা করো।
আয়নীয় যৌগ গঠিত হওয়ার শর্তগুলি নিম্নরূপ –
- অংশগ্রহণকারী মৌলগুলির যোজক-ইলেকট্রন সংখ্যা – ক্যাটায়ন গঠনকারী মৌলটির যোজক-ইলেকট্রন সংখ্যা 1, 2 বা 3 এবং তড়িৎ-ঋণাত্মক মৌলটির যোজক-ইলেকট্রন সংখ্যা 5, 6 বা 7 হওয়া প্রয়োজন।
- অংশগ্রহণকারী মৌলগুলির তড়িৎ-ঋণাত্মকতার পার্থক্য – ক্যাটায়ন গঠনকারী মৌলের তড়িৎ-ঋণাত্মকতা কম ও অ্যানায়ন গঠনকারী মৌলের তড়িৎ-ঋণাত্মকতা বেশি হতে হবে।
- অংশগ্রহণকারী পরমাণুগুলির আকার – ক্যাটায়ন গঠনকারী পরমাণুর আকার বড়ো ও অ্যানায়ন গঠনকারী পরমাণুর আকার ছোটো হলে আয়নীয় বন্ধন গঠনের প্রবণতা বাড়ে।
- অংশগ্রহণকারী মৌলগুলির আয়নন বিভব ও ইলেকট্রন-আসক্তি – ক্যাটায়ন গঠনকারী মৌলের আয়নন বিভবের মান কম ও অ্যানায়ন গঠনকারী মৌলের ইলেকট্রন-আসক্তি বেশি হওয়া প্রয়োজন।
- আয়নগুলির আধানের পরিমাণ – ক্যাটায়ন ও অ্যানায়নের আধান কম হওয়া প্রয়োজন। ক্যাটায়ন কম আধানবিশিষ্ট হলে বর্জিত ইলেকট্রনকে পুনরায় নিজের দিকে ফিরিয়ে আনার প্রবণতা কম হয়। অনুরূপে, অ্যানায়ন কম ঋণাত্মক আধানবিশিষ্ট হলে গৃহীত ইলেকট্রনের ক্যাটায়নের দিকে ফিরে যাওয়ার প্রবণতা কম থাকে।
আয়নীয় যৌগের বৈশিষ্ট্য আলোচনা করো।
আয়নীয় যৌগের বৈশিষ্ট্যগুলি নিম্নরূপ –
- ভৌত অবস্থা – আয়নীয় যৌগে বিপরীত তড়িদ্গ্রস্ত আয়নগুলি ত্রিমাত্রিকভাবে সজ্জিত হয়ে বিশেষ জ্যামিতিক আকারবিশিষ্ট কঠিন কেলাস গঠন করে।
- গলনাঙ্ক ও স্ফুটনাঙ্ক – আয়নীয় যৌগের গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত উচ্চমানের হয়।
- দ্রাব্যতা – আয়নীয় যৌগগুলি সাধারণত ধ্রুবীয় দ্রাবকে দ্রাব্য কিন্তু অধ্রুবীয় দ্রাবকে অদ্রাব্য।
- তড়িৎ পরিবাহিতা – কঠিন অবস্থায় তড়িৎ পরিবহণ না করলেও আয়নীয় যৌগগুলি গলিত বা জলে দ্রবীভূত অবস্থায় তড়িৎ পরিবহণ করে এবং রাসায়নিকভাবে বিশ্লেষিত হয়।
- বিক্রিয়ার গতিবেগ – দ্রবণে আয়নীয় যৌগের বিক্রিয়া দ্রুতগতিতে সম্পন্ন হয়।
- সমাবয়বতা – তড়িৎযোজী যৌগগুলি সমাবয়বতা ধর্ম প্রদর্শন করে না।
আয়নীয় বন্ধনের বৈশিষ্ট্যগুলি উল্লেখ করো।
আয়নীয় বন্ধনের বৈশিষ্ট্যগুলি নিম্নরূপ –
- তীব্র তড়িৎ-ধনাত্মক ও তীব্র তড়িৎ-ঋণাত্মক মৌলের পরমাণুর মধ্যে এই ধরনের বন্ধন গঠিত হয়।
- আয়নীয় বন্ধন প্রকৃতপক্ষে বিপরীত আধানগ্রস্ত ক্যাটায়ন ও অ্যানায়নের মধ্যে স্থির তড়িৎ-আকর্ষণ বল। আয়নীয় বন্ধনকে প্রকৃত বন্ধন বলা যায় না।
- আয়নীয় বন্ধনের নির্দিষ্ট কোনো অভিমুখ নেই।
- সমযোজী বন্ধনের তুলনায় আয়নীয় বন্ধন দুর্বল প্রকৃতির।
- ধ্রুবীয় বা পোলার দ্রাবকে আয়নীয় বন্ধন সহজেই ভেঙে যায় এবং ক্যাটায়ন ও অ্যানায়নগুলি কেলাস থেকে মুক্ত হয়ে পড়ে।
তীব্র সক্রিয় ধাতু, সোডিয়াম (Na) জলের সাথে সাধারণ উষ্ণতায় বিস্ফোরণসহ বিক্রিয়া করে। আবার ক্লোরিন (Cl) সক্রিয় অধাতব মৌল যার তীব্র জারক ধর্ম আছে। তবে NaCl যৌগটিকে খাদ্যলবণ হিসেবে আমরা নিরাপদে ব্যবহার করতে পারি কীভাবে?
পরমাণুর তুলনায় আয়ন বেশি সুস্থিত ও রাসায়নিকভাবে নিষ্ক্রিয় হয়। রাসায়নিকভাবে যুক্ত হওয়ার সময় Na -পরমাণু 1টি ইলেকট্রন ত্যাগ করে Na+ আয়নে পরিণত হয় এবং নিষ্ক্রিয় মৌল নিয়নের মতো ইলেকট্রন-বিন্যাস লাভ করে সুস্থিত হয়। অন্যদিকে, Cl -পরমাণু ওই বর্জিত ইলেকট্রনটি গ্রহণ করে Cl– আয়নে পরিণত হয় ও নিষ্ক্রিয় মৌল আর্গনের ইলেকট্রন-বিন্যাস লাভ করে সুস্থিত হয়। NaCl যৌগের কেলাস অসংখ্য Na+ ও Cl– আয়নের সমবায়ে গঠিত হওয়ায় কেলাসটিতে Na বা Cl -পরমাণুর রাসায়নিক সক্রিয়তা থাকে না। তাই খাদ্যলবণ হিসেবে সোডিয়াম ক্লোরাইডকে আমরা নিরাপদে ব্যবহার করতে পারি।
আয়নীয় যৌগ গঠনের ক্ষেত্রে সুস্থিত জালক ও জালক শক্তির গুরুত্ব ব্যাখ্যা করো।
কোনো আয়নীয় কেলাসের মধ্যে গঠনকারী আয়নগুলি যে সুষম ও পর্যায়ক্রমিক ত্রিমাত্রিক বিন্যাসে সজ্জিত থাকে তাকে কেলাস-জালক বলে। আয়নীয় কেলাস গঠনের সময় বিপরীত তড়িদ্গ্রস্ত ক্যাটায়ন ও অ্যানায়নগুলি অসীম দূরত্ব থেকে পরস্পরের নিকটবর্তী হয়ে স্থির-তাড়িতিক আকর্ষণ বলের প্রভাবে একত্রিত হওয়ায় আয়নগুলির মোট স্থিতিশক্তি হ্রাস পায়, ফলে কিছু শক্তি মুক্ত হয়। গ্যাসীয় ক্যাটায়ন ও অ্যানায়ন থেকে এক গ্রাম-সংকেত ভরের আয়নীয় কেলাস উৎপন্ন হওয়ার সময় নির্গত শক্তিকে জালক শক্তি (lattice energy) বলে। জালক শক্তির পরিমাণ যত বেশি হয় আয়নীয় যৌগের গঠন প্রক্রিয়া তত অনুকূল হয় এবং কেলাসের গঠন তত সুস্থিত হয়।
সমযোজী যৌগ গঠিত হওয়ার শর্তগুলি আলোচনা করো।
সমযোজী যৌগ গঠিত হওয়ার শর্তগুলি নিম্নরূপ –
- যোজক-ইলেকট্রনের সংখ্যা – সমযোজী বন্ধন গঠনে অংশগ্রহণকারী পরমাণুদুটির প্রতিটির যোজক-ইলেকট্রনের সংখ্যা 4, 5, 6 বা 7 হতে হবে (H -পরমাণু ছাড়া)।
- পরমাণুগুলির আয়নন শক্তি – সমযোজী বন্ধন গঠিত হতে হলে বন্ধন গঠনে অংশগ্রহণকারী পরমাণুগুলির আয়নন শক্তি বেশি হতে হবে।
- ইলেকট্রন-আসক্তি – সমযোজী বন্ধন গঠনে অংশগ্রহণকারী পরমাণু দুটির ইলেকট্রন-আসক্তি প্রায় সমান হতে হবে।
- তড়িৎ-ঋণাত্মকতা – সমযোজী বন্ধনে অংশগ্রহণকারী পরমাণু দুটির তড়িৎ-ঋণাত্মকতার মান সমান বা প্রায় সমান হতে হবে।
সমযোজী যৌগের বৈশিষ্ট্যগুলি উল্লেখ করো।
সমযোজী যৌগের বৈশিষ্ট্যগুলি নিম্নরূপ-
- ভৌত অবস্থা – সাধারণ উষ্ণতা ও চাপে সমযোজী যৌগগুলি সাধারণত গ্যাসীয় বা তরল হয়। আণবিক গুরত্ব বেশি হলে এদের নরম প্রকৃতির কঠিন অবস্থাতেও পাওয়া যায়।
- গলনাঙ্ক ও স্ফুটনাঙ্ক – সমযোজী যৌগগুলির অণুর পৃথক অস্তিত্ব আছে এবং তাদের পারস্পরিক আকর্ষণ বল দুর্বল প্রকৃতির। তাই আয়নীয় যৌগের তুলনায় এদের গলনাঙ্ক ও স্ফুটনাঙ্ক কম হয়। ব্যতিক্রম – SiO2, হীরক, SiC ইত্যাদি।
- দ্রাব্যতা – সমযোজী যৌগ সাধারণত ধ্রুবীয় দ্রাবকে অদ্রাব্য কিন্তু অধ্রুবীয় দ্রাবকে দ্রাব্য। ব্যতিক্রম – HCl সমযোজী হলেও ধ্রুবীয় দ্রাবক জলে দ্রবীভূত হয়।
- তড়িৎ পরিবাহিতা – বিশুদ্ধ সমযোজী যৌগ তড়িৎ পরিবহণ করে না। ব্যতিক্রম – HCl -এর জলীয় দ্রবণ পরিবহণ করে।
- বিক্রিয়ার গতিবেগ – সমযোজী যৌগগুলির বিক্রিয়া ধীরগতিতে ঘটে।
- সমাবয়বতা – সমযোজী যৌগে প্রায়ই সমাবয়বতা ধর্ম দেখা যায়।
সমযোজী বন্ধনের বৈশিষ্ট্যগুলি উল্লেখ করো।
সমযোজী বন্ধনের বৈশিষ্ট্যগুলি নিম্নে উল্লেখ করা হল –
- সমযোজী বন্ধনে অংশগ্রহণকারী পরমাণুগুলির তড়িৎ-ঋণাত্মকতা সমান বা প্রায় সমান হয়।
- সমযোজী বন্ধন গঠনকালে দুটি পরমাণুর মধ্যে এক বা একাধিক ইলেকট্রন-জোড় গঠিত হয়। ইলেকট্রন-জোড়গুলির উভয় পরমাণু কর্তৃক সমভাবে ব্যবহারের ফলে উদ্ভূত আকর্ষণ বলই হল সমযোজী বন্ধন।
- সমযোজী বন্ধনের নির্দিষ্ট অভিমুখ আছে।
- আয়নীয় বন্ধনের তুলনায় সমযোজী বন্ধন বেশি শক্তিশালী হয়।
- সমযোজী বন্ধন সাধারণ ধ্রুবীয় বা অধ্রুবীয় দ্রাবকে বিয়োজিত হয় না। তবে HCl -এর মতো ধ্রুবীয় সমযোজী যৌগ ধ্রুবীয় দ্রাবক জলের উপস্থিতিতে বিপরীত তড়িদ্গ্রস্ত আয়নে বিয়োজিত হয়।
বিভিন্ন প্রকার সমযোজী বন্ধন সম্পর্কে আলোচনা করো।
সমযোজী বন্ধন তিন প্রকারের হয়, যথা –
- সমযোজী এক-বন্ধন – সমযোজী বন্ধন গঠনে অংশগ্রহণকারী দুটি পরমাণুর মধ্যে একটি ইলেকট্রন-জোড় সমভাবে ব্যবহৃত হয়ে পরমাণু দুটির মধ্যে সমযোজী এক-বন্ধনের সৃষ্টি হয়। যেমন – H2 অণু (H-H), Cl2 অণু (Cl-Cl), HCl অণু (H-Cl) প্রভৃতির ক্ষেত্রে সমযোজী এক-বন্ধন উপস্থিত।
- সমযোজী দ্বি-বন্ধন – সমযোজী বন্ধন গঠনে অংশগ্রহণকারী দুটি পরমাণুর মধ্যে দুটি ইলেকট্রন-জোড় সমভাবে ব্যবহৃত হয়ে পরমাণু দুটির মধ্যে সমযোজী দ্বি-বন্ধনের সৃষ্টি হয়। যেমন – O2(O=O) অণুতে সমযোজী দ্বি-বন্ধন উপস্থিত।
- সমযোজী ত্রি-বন্ধন – সমযোজী বন্ধন গঠনে অংশগ্রহণকারী দুটি পরমাণুর মধ্যে তিনটি ইলেকট্রন-জোড় সমভাবে ব্যবহৃত হয়ে পরমাণু দুটির মধ্যে সমযোজী ত্রি-বন্ধনের সৃষ্টি হয়। যেমন – N2(N≡N) অণুতে সমযোজী ত্রিবন্ধন উপস্থিত।
বন্ধন ইলেকট্রন-জোড় ও নিঃসঙ্গ ইলেকট্রন-জোড় বলতে কী বোঝ?
বন্ধন ইলেকট্রন-জোড় – সমযোজী যৌগ গঠনের সময় দুটি পরমাণুর সর্ববহিস্থ কক্ষ থেকে সমসংখ্যক ইলেকট্রন মিলে এক বা একাধিক ইলেকট্রন-জোড় গঠন করে এবং উভয় পরমাণুই ওই ইলেকট্রন-জোড় বা জোড়গুলিকে সমভাবে ব্যবহার করে। এই ইলেকট্রন-জোড় বা জোড়গুলিই উভয় পরমাণুর মধ্যে বন্ধনরূপে কাজ করে পরমাণু দুটির মধ্যে রাসায়নিক মিলন ঘটিয়ে মৌল বা যৌগের অণু উৎপন্ন করে। এই ইলেকট্রন-জোড়গুলিকে বন্ধন ইলেকট্রন-জোড় বলে।
নিঃসঙ্গ ইলেকট্রন-জোড় – সমযোজী বন্ধন গঠিত হওয়ার সময় অনেকক্ষেত্রে বন্ধনে অংশগ্রহণকারী পরমাণু দুটির যোজ্যতা-কক্ষে এমন ইলেকট্রন-জোড় থেকে যায় যারা রাসায়নিক বন্ধন গঠনে অংশগ্রহণ করে না। এরূপ ইলেকট্রন-জোড়গুলিকে নিঃসঙ্গ ইলেকট্রন-জোড় বলে।
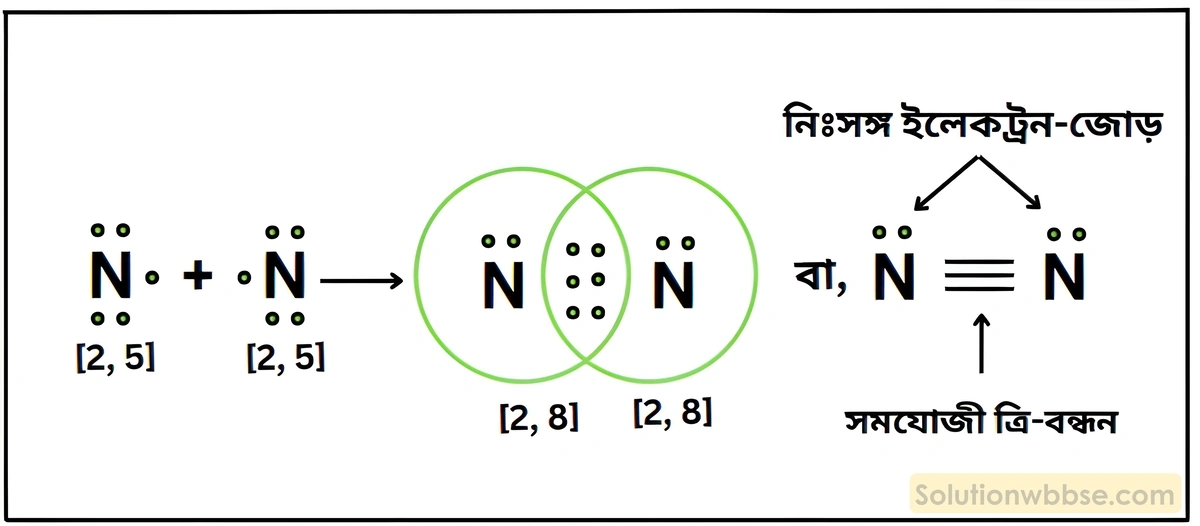
উদাহরণ – N2 অণুতে তিনটি বন্ধন ইলেকট্রন-জোড় আছে এবং প্রতিটি N -পরমাণুর যোজ্যতা-কক্ষে 1টি করে নিঃসঙ্গ ইলেকট্রন-জোড় আছে।
নিম্নলিখিত ধর্মগুলির ভিত্তিতে আয়নীয় বা তড়িৎযোজী যৌগের সাথে সমযোজী যৌগের পার্থক্য লেখো – (i) ভৌত অবস্থা, (ii) কাঠিন্য ও ভঙ্গুরতা এবং (iii) গলনাঙ্ক ও স্ফুটনাঙ্ক।
প্রদত্ত ধর্মগুলির ভিত্তিতে আয়নীয় ও সমযোজী যৌগের পার্থক্যগুলি নিম্নরূপ –
| ধর্ম | আয়নীয় বা তড়িৎযোজী যৌগ | সমযোজী যৌগ |
| i. ভৌত অবস্থা | আয়নীয় যৌগগুলি সাধারণ চাপ ও উষ্ণতায় কেলাসিত কঠিন পদার্থ | সমযোজী যৌগগুলি সাধারণ চাপ ও উষ্ণতায় গ্যাসীয়, তরল বা কোমল-কঠিন হতে পারে। |
| ii. কাঠিন্য ও ভঙ্গুরতা | আয়নীয় যৌগের কেলাস কঠিন হলেও আঘাত লাগলে সহজে ভেঙে যায় অর্থাৎ এগুলি ভঙ্গুর প্রকৃতির। | সমযোজী যৌগগুলির মধ্যে যেগুলি কঠিন, সেগুলি সাধারণত মোমের মতো নরম। তবে কয়েকটি বিরাট আকারবিশিষ্ট সমযোজী কেলাস গঠিত হয় যাদের কাঠিন্য খুব বেশি। |
| iii. গলনাঙ্ক ও স্ফুটনাঙ্ক | আয়নীয় যৌগের গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত বেশি হয়। | কিছু কিছু কঠিন যৌগ (যেমন – SiO2) ছাড়া সমযোজী যৌগগুলির গলনাঙ্ক ও স্ফুটনাঙ্ক আয়নীয় যৌগের তুলনায় সাধারণত কম হয়। |
নিম্নলিখিত ধর্মগুলির ভিত্তিতে আয়নীয় যৌগের সাথে সমযোজী যৌগের পার্থক্য লেখো – (i) তড়িৎ পরিবাহিতা, (ii) দ্রাব্যতা এবং (iii) রাসায়নিক বিক্রিয়ার গতিবেগ।
প্রদত্ত ধর্মগুলির ভিত্তিতে আয়নীয় ও সমযোজী যৌগের পার্থক্যগুলি নিম্নরূপ –
| ধর্ম | আয়নীয় যৌগ | সমযোজী যৌগ |
| i. তড়িৎ পরিবাহিতা | আয়নীয় যৌগগুলি কঠিন অবস্থায় তড়িৎ পরিবহণ করে না, কিন্তু গলিত বা উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় তড়িতের পরিবাহী হয়। | বিশুদ্ধ সমযোজী যৌগগুলি তড়িতের কুপরিবাহী, তবে কিছু কিছু ধ্রুবীয় সমযোজী যৌগ (যেমন – HCl) ধ্রুবীয় দ্রাবকে দ্রবীভূত হয়ে তড়িৎ পরিবহণ করে। |
| ii. দ্রাব্যতা | আয়নীয় যৌগগুলি সাধারণত ধ্রুবীয় দ্রাবকে দ্রবীভূত হয় কিন্তু অধ্রুবীয় দ্রাবকে দ্রবীভূত হয় না। | সমযোজী যৌগগুলি সাধারণত অধ্রুবীয় দ্রাবকে দ্রবীভূত হয়। তবে বেশ কিছু সমযোজী যৌগ, (যেমন – HCl, চিনি, গ্লুকোজ, ইথানল ইত্যাদি) ধ্রুবীয় দ্রাবক জলে দ্রবীভূত হয়। |
| iii. রাসায়নিক বিক্রিয়ার গতিবেগ | দ্রবণে আয়নীয় যৌগগুলি আয়নে বিয়োজিত হয়ে বিক্রিয়া করার ফলে এই জাতীয় যৌগগুলির বিক্রিয়া যথেষ্ট দ্রুতগতিতে ঘটে। | সমযোজী যৌগগুলি দ্রবণে আণবিক অবস্থায় বিক্রিয়া করে, তাই এদের বিক্রিয়া ধীরগতিতে ঘটে। |
নিম্নলিখিত ধর্মগুলির ভিত্তিতে আয়নীয় যৌগের সাথে সমযোজী যৌগের পার্থক্য লেখো – (i) বন্ধনের প্রকৃতি, (ii) সমাবয়বতা ও (iii) তড়িদবিশ্লেষ্য প্রকৃতি।
প্রদত্ত ধর্মগুলির ভিত্তিতে আয়নীয় ও সমযোজী যৌগের পার্থক্যগুলি নিম্নরূপ –
| ধর্ম | আয়নীয় যৌগ | সমযোজী যৌগ |
| i. বন্ধনের প্রকৃতি | দুটি বিপরীত আধানযুক্ত আয়নের মধ্যে স্থির-তাড়িতিক আকর্ষণ বলের মাধ্যমে আয়নীয় যৌগ গঠিত হয়। আয়নীয় যৌগে স্বতন্ত্র অণুর অস্তিত্ব থাকে না। | দুটি পরমাণু যৌথভাবে এক বা একাধিক ইলেকট্রন-জোড় সমভাবে ব্যবহার করে সমযোজী অণু গঠন করে। সমযোজী যৌগে স্বতন্ত্র অণুর অস্তিত্ব আছে। |
| ii. সমাবয়বতা | আয়নীয় বন্ধনের নির্দিষ্ট কোনো অভিমুখ না থাকায় আয়নীয় যৌগের ক্ষেত্রে সমাবয়বতা ধর্ম দেখা যায় না। | একই আণবিক সংকেতবিশিষ্ট কিন্তু বিভিন্ন গঠন-সংকেত এবং ধর্মবিশিষ্ট বিভিন্ন সমযোজী যৌগ দেখা যায়। অর্থাৎ, সমযোজী যৌগের ক্ষেত্রে অনেক সময় সমাবয়বতা ধর্ম দেখা যায়। |
| iii. তড়িদবিশ্লেষ্য প্রকৃতি | সমস্ত আয়নীয় যৌগ বিগলিত অবস্থায় অথবা উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় তড়িদবিশ্লেষ্যরূপে কাজ করে। | বেশিরভাগ সমযোজী যৌগই তড়িৎ-অবিশ্লেষ্য। তবে কিছু ধ্রুবীয় সমযোজী যৌগ (যেমন – HCl) ধ্রুবীয় দ্রাবকে আয়নিত হয়, কাজেই এরা দ্রবণে তড়িদবিশ্লেষিত হয়। |
আয়নীয় বন্ধন ও সমযোজী বন্ধনের পার্থক্য লেখো।
আয়নীয় ও সমযোজী বন্ধনের পার্থক্যগুলি নিম্নরূপ –
| বিষয় | আয়নীয় বন্ধন | সমযোজী বন্ধন |
| বন্ধন গঠন-প্রক্রিয়া | তড়িৎ-ধনাত্মক মৌলের পরমাণুর ইলেকট্রন বর্জন এবং তড়িৎ-ঋণাত্মক মৌলের পরমাণুর ইলেকট্রন গ্রহণের মাধ্যমে আয়নীয় বন্ধন গঠিত হয়। | বন্ধন সৃষ্টিকারী দুটি পরমাণুর সর্ববহিস্থ কক্ষ থেকে সমান সংখ্যক ইলেকট্রন এসে ইলেকট্রন-জোড় সৃষ্টি করলে সেই ইলেকট্রন-জোড় পরমাণু দুটি দ্বারা সমভাবে ব্যবহৃত হয়ে সমযোজী বন্ধন গঠিত হয়। |
| তড়িৎ-ঋণাত্মকতার পার্থক্য | পরমাণুগুলির তড়িৎ-ঋণাত্মকতার পার্থক্য খুব বেশি হলে আয়নীয় বন্ধন গঠিত হয়। | পরমাণুগুলির তড়িৎ-ঋণাত্মকতা সমান বা প্রায় সমান হলে সমযোজী বন্ধন গঠিত হয়। |
| বন্ধনের প্রকৃতি | দুটি বিপরীত তড়িৎধর্মী আয়নের মধ্যে স্থির-তাড়িতিক আকর্ষণ বলের দ্বারা আয়নীয় বন্ধন গঠিত হয়। | দুটি পরমাণু থেকে সমান সংখ্যক ইলেকট্রন এসে এক বা একাধিক ইলেকট্রন-জোড় গঠন করে এবং উভয় পরমাণু কর্তৃক সেগুলি সমভাবে ব্যবহারের ফলে উদ্ভূত আকর্ষণ বলই হল সমযোজী বন্ধন। |
| বন্ধনের দিক্দর্শিতা ও সমাবয়বতা | আয়নীয় বন্ধন দিকহীন এবং সমাবয়বতা ধর্ম প্রদর্শন করে না। | সমযোজী বন্ধনের নির্দিষ্ট অভিমুখ আছে এবং এর ফলে এরা সমাবয়বতা প্রদর্শন করে। |
| বন্ধনের দৃঢ়তা | স্থির-তাড়িতিক আকর্ষণ বলকে অতিক্রম করে আয়নগুলি সঞ্চরণশীল হতে পারে অর্থাৎ আয়নীয় বন্ধন দুর্বল প্রকৃতির। | ইলেকট্রন-জোড় সহজে পৃথক হয় না অর্থাৎ সমযোজী বন্ধন দৃঢ় ও শক্তিশালী প্রকৃতির। |
NaCl যৌগে কীরূপ বন্ধন আছে ব্যাখ্যা করো।
Na -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 1 এবং Cl -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 7। একটি Na -পরমাণু যখন একটি Cl -পরমাণুর সঙ্গে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তখন Na -পরমাণুটি তার সর্ববহিস্থ কক্ষের 1টি ইলেকট্রন ত্যাগ করে Na+ ক্যাটায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ne(K = 2, L = 8) -এর ইলেকট্রন-বিন্যাস লাভ করে।
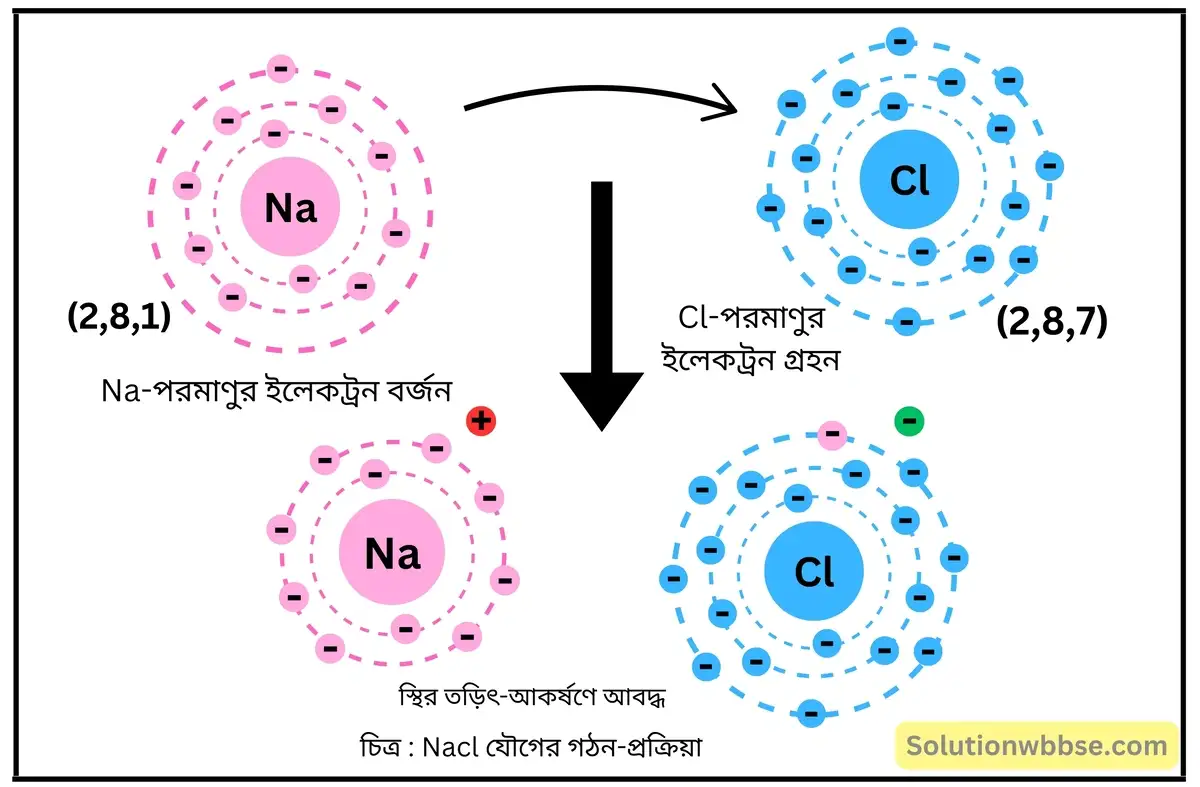
অন্যদিকে, Cl -পরমাণু Na দ্বারা বর্জিত ইলেকট্রন গ্রহণ করে Cl– আয়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ar -এর ইলেকট্রন-বিন্যাস লাভ করে। এরপর বিপরীত তড়িৎধর্মী Na+ ও Cl– স্থির-তাড়িতিক আকর্ষণ বলের মাধ্যমে পরস্পর যুক্ত হয়ে আয়নীয় যৌগ NaCl গঠন করে।
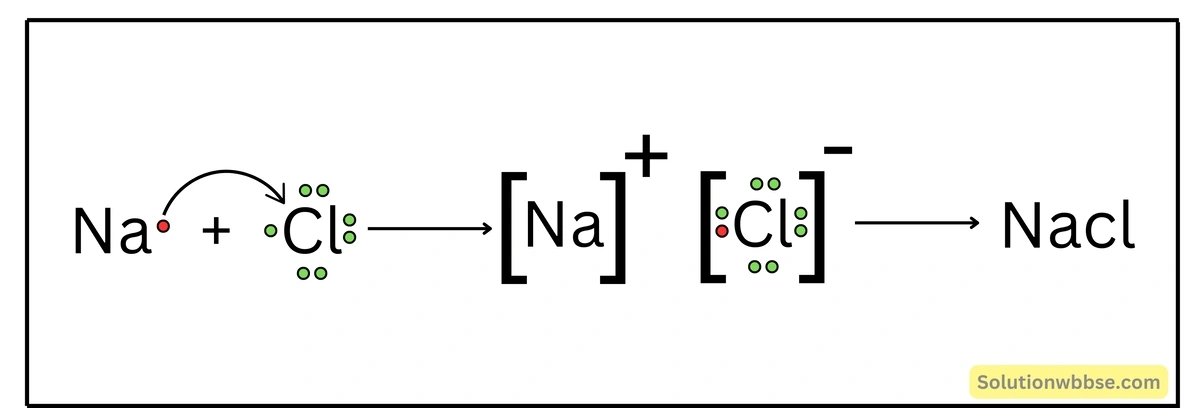
সোডিয়াম ক্লোরাইডের সংকেত NaCl না লিখে (NaCl)n লেখা উচিত – ব্যাখ্যা করো।
সোডিয়াম ক্লোরাইড একটি আয়নীয় যৌগ। আয়নীয় যৌগের ক্ষেত্রে বিচ্ছিন্ন একক অণুর অস্তিত্ব নেই। অসংখ্য ক্যাটায়ন ও অ্যানায়ন পরস্পর স্থির-তাড়িতিক আকর্ষণ বলের দ্বারা যুক্ত হয়ে আয়নীয় যৌগের কেলাস গঠন করে।
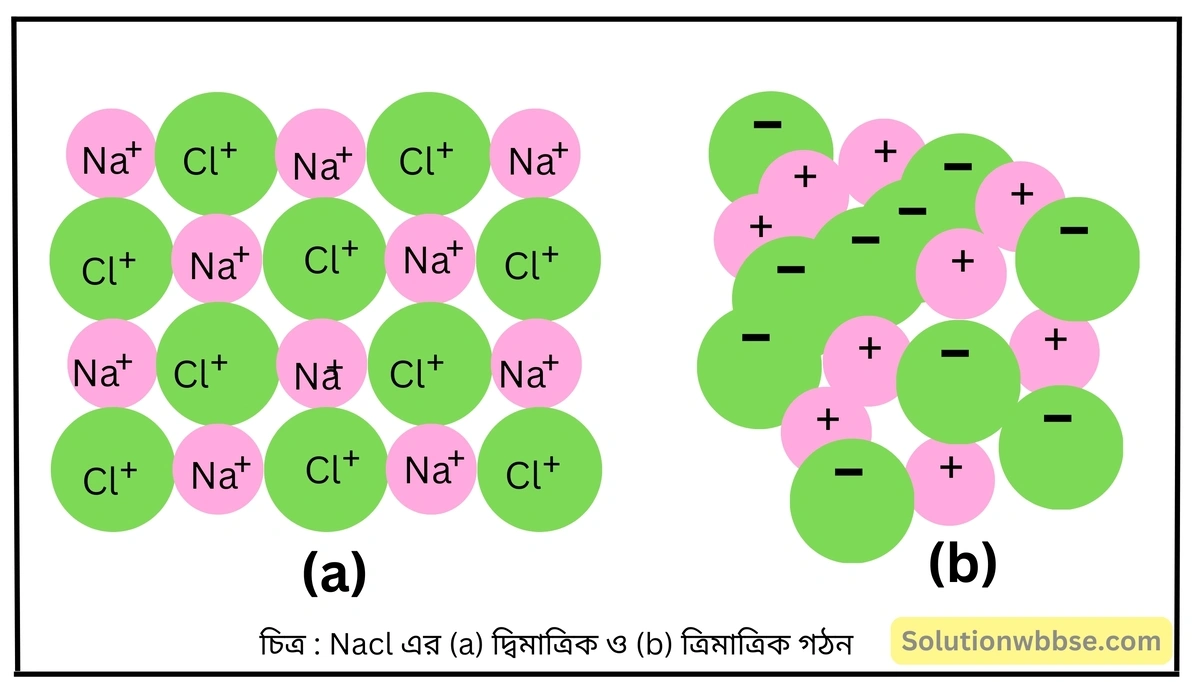
NaCl কেলাসে অসংখ্য Na+ ও Cl– আয়ন ঘনসন্নিবিষ্ট হয়ে ত্রিমাত্রিকভাবে এরূপে সজ্জিত থাকে যে প্রতিটি Na+ আয়ন 6টি Cl– আয়ন দ্বারা এবং প্রতিটি Cl– আয়ন 6টি Na+ আয়ন দ্বারা বেষ্টিত থাকে। তাই NaCl যৌগে বিচ্ছিন্ন অণুর অস্তিত্ব নেই। কেলাস গঠনটি প্রশম হওয়ায় বোঝা যায়, কেলাসে সমসংখ্যক Na+ ও Cl– আয়ন রয়েছে। এর ফলে সোডিয়াম ক্লোরাইড কেলাসকে একমাত্র (NaCl)n সংকেত দ্বারাই প্রকাশ করা উচিত, যেখানে n -এর মান কেলাসটির ওপর নির্ভর করবে।
কোঅর্ডিনেশন সংখ্যা কাকে বলে?
আয়নীয় যৌগের কেলাসে একটি নির্দিষ্ট আয়নের চতুর্দিকে নিকটতম ও সমদূরত্বে অবস্থিত বিপরীত আধানযুক্ত আয়নের সংখ্যাকে ওই পরমাণুর কোঅর্ডিনেশন সংখ্যা বলে। সোডিয়াম ক্লোরাইড কেলাসে Na+ এবং Cl– উভয় আয়নের কোঅর্ডিনেশন সংখ্যা 6।
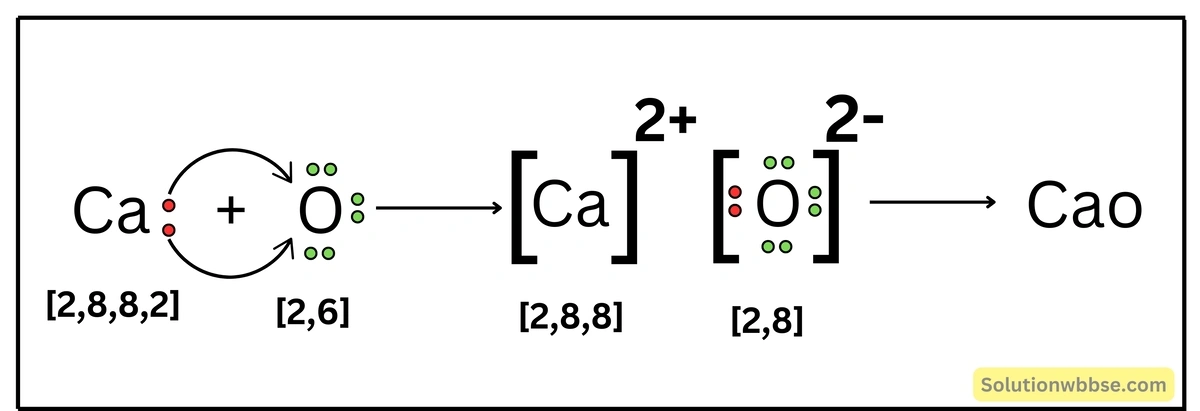
CaO যৌগে কীরূপ বন্ধন আছে ব্যাখ্যা করো।
Ca -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 8, N = 2 এবং O -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 6। একটি Ca -পরমাণু যখন একটি O -পরমাণুর সঙ্গে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তখন Ca -পরমাণুটি তার সর্ববহিস্থ কক্ষের 2টি ইলেকট্রন ত্যাগ করে Ca2+ ক্যাটায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ar -এর ইলেকট্রন-বিন্যাস (K = 2, L = 8, M = 8) লাভ করে। অন্যদিকে, O -পরমাণু Ca দ্বারা বর্জিত ইলেকট্রন দুটি গ্রহণ করে O2- অ্যানায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ne -এর ইলেকট্রন-বিন্যাস (K = 2, L = 8) লাভ করে। এরপর বিপরীত তড়িৎধর্মী Ca2+ ও O2- স্থির-তাড়িতিক আকর্ষণ বলের মাধ্যমে পরস্পর যুক্ত হয়ে আয়নীয় যৌগ CaO গঠন করে।
MgCl2 যৌগ কীভাবে গঠিত হয় ব্যাখ্যা করো।
Mg -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 2 এবং Cl -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 7। Mg -পরমাণু যখন 2টি Cl -পরমাণুর সঙ্গে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তখন Mg -পরমাণুটি তার সর্ববহিস্থ কক্ষের 2টি ইলেকট্রন ত্যাগ করে Mg2+ ক্যাটায়নে পরিণত হয় এবং নিকটবর্তী নিষ্ক্রিয় মৌল Ne -এর ইলেকট্রন-বিন্যাস (K = 2, L = 8) লাভ করে। অন্যদিকে, 2টি Cl -পরমাণুর প্রতিটি Mg দ্বারা বর্জিত দুটি ইলেকট্রনের একটি করে গ্রহণ করে Cl– অ্যানায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ar -এর ইলেকট্রন-বিন্যাস (K = 2, L = 8, M = 8) লাভ করে। এরপর বিপরীত তড়িৎধর্মী Mg2+ ও 2টি Cl– স্থির-তাড়িতিক আকর্ষণ বলের মাধ্যমে পরস্পর যুক্ত হয়ে আয়নীয় যৌগ MgCl2 গঠন করে।
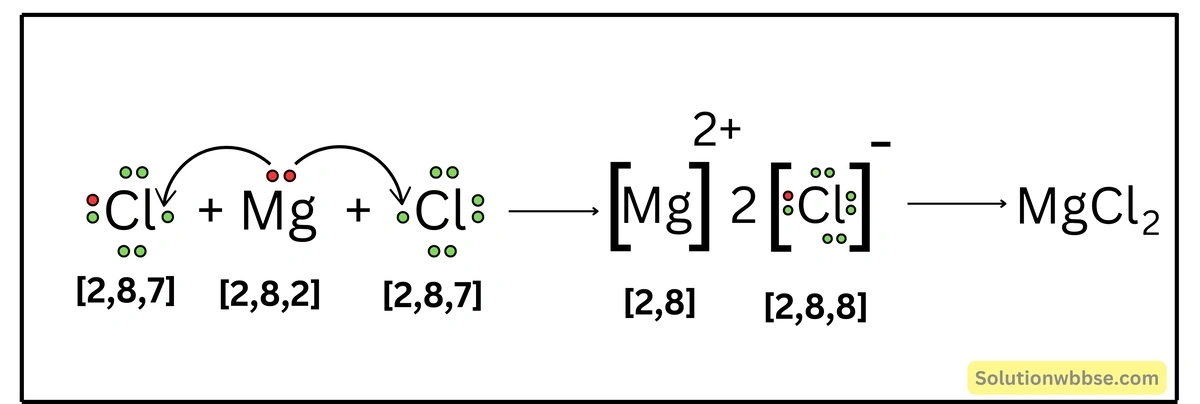
NaF যৌগ কীভাবে গঠিত হয় ব্যাখ্যা করো।
Na -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 1 এবং F -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 7। একটি Na -পরমাণু যখন একটি F -পরমাণুর সাথে রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তখন Na -পরমাণুটি তার সর্ববহিস্থ কক্ষের একটি ইলেকট্রন ত্যাগ করে Na+ ক্যাটায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ne -এর ইলেকট্রন-বিন্যাস (K = 2, L = 8) লাভ করে। অন্যদিকে, F -পরমাণু Na -পরমাণু দ্বারা বর্জিত একটি ইলেকট্রন গ্রহণ করে F– অ্যানায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল Ne -এর মতো ইলেকট্রন-বিন্যাস লাভ করে। এরপর বিপরীতধর্মী Na+ ও F– স্থির-তাড়িতিক আকর্ষণ বলের মাধ্যমে পরস্পর যুক্ত হয়ে আয়নীয় যৌগ NaF গঠন করে।
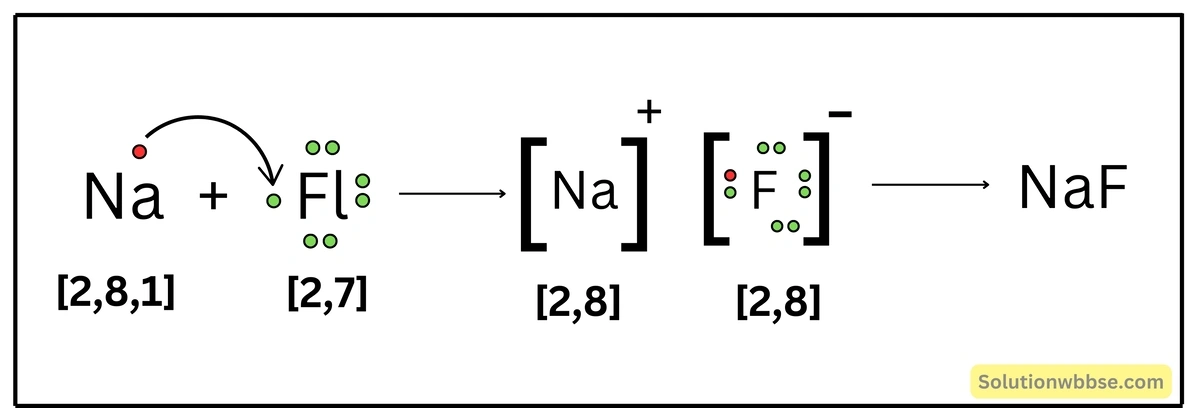
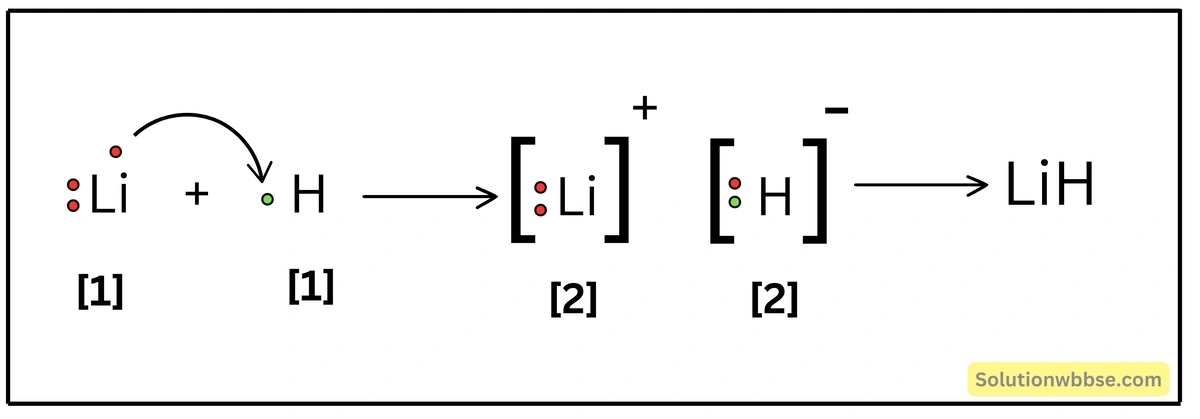
LiH যৌগে কীরূপ বন্ধন আছে ব্যাখ্যা করো।
Li -পরমাণুর ইলেকট্রন-বিন্যাস – K = 2, L = 1 এবং H -পরমাণুর ইলেকট্রন-বিন্যাস – K = 1। একটি Li -পরমাণু যখন একটি H -পরমাণুর সঙ্গে রাসায়নিক বিক্রিয়ার অংশগ্রহণ করে, তখন Li -পরমাণুটি তার সর্ববহিস্থ কক্ষের 1টি ইলেকট্রনকে ত্যাগ করে Li+ ক্যাটায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল He -এর ইলেকট্রন-বিন্যাস (K = 2) লাভ করে। অন্যদিকে, H -পরমাণু Li দ্বারা বর্জিত ইলেকট্রনটি গ্রহণ করে H– অ্যানায়নে পরিণত হয় ও নিকটবর্তী নিষ্ক্রিয় মৌল He -এর ইলেকট্রন-বিন্যাস লাভ করে। এরপর বিপরীত তড়িৎধর্মী Li+ ও H– স্থির-তাড়িতিক, আকর্ষণ বলের মাধ্যমে পরস্পর যুক্ত হয়ে LiH যৌগ গঠন করে।
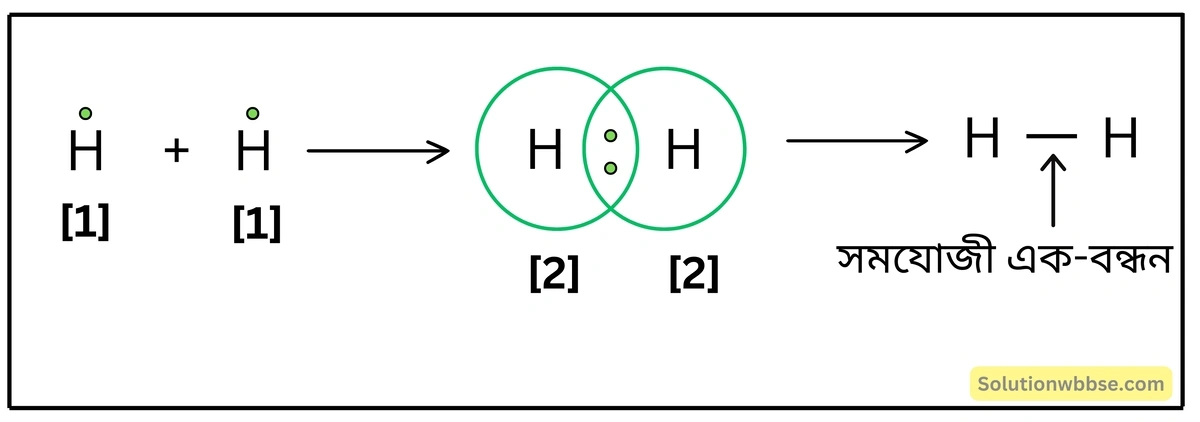
লুইস-ডট ডায়াগ্রামের সাহায্যে H2 অণুর গঠন ব্যাখ্যা করো।
হাইড্রোজেন অণু দ্বি-পরমাণুক। দুটি H -পরমাণু সমযোজী বন্ধনের মাধ্যমে রাসায়নিকভাবে মিলিত হয়ে হাইড্রোজেন অণু (H2) গঠন করে। হাইড্রোজেন পরমাণুর K -কক্ষে 1টি মাত্র ইলেকট্রন থাকে। দুটি H -পরমাণুর প্রত্যেকটির 1টি করে ইলেকট্রন মিলিত হয়ে একটি ইলেকট্রন-জোড় গঠন করে এবং উভয় পরমাণুই এই ইলেকট্রন-জোড় সমভাবে ব্যবহার করে। এর ফলে, উভয় পরমাণুই নিকটতম নিষ্ক্রিয় মৌল হিলিয়াম (He) পরমাণুর সুস্থিত ইলেকট্রন-বিন্যাস লাভ করে। এভাবে, দুটি H -পরমাণু সমযোজী বন্ধনে আবদ্ধ হয়ে সমযোজী হাইড্রোজেন অণু গঠন করে।
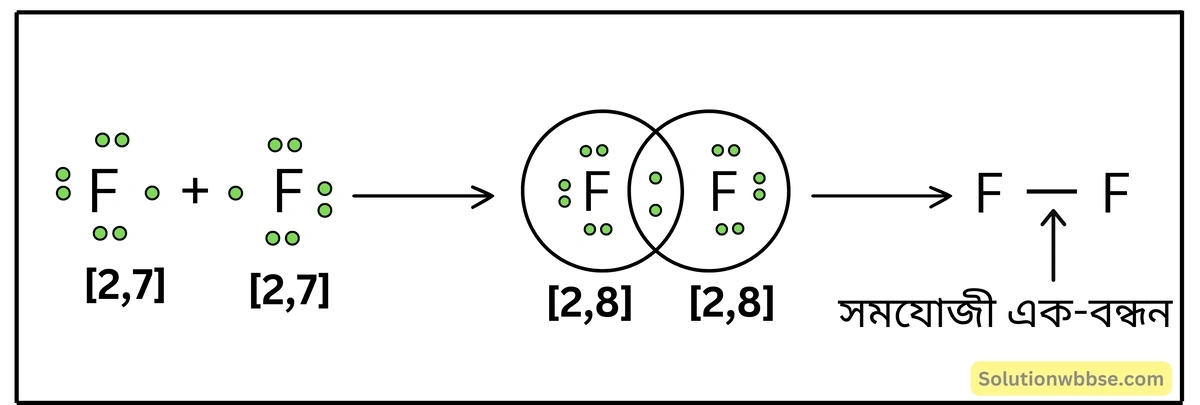
লুইস-ডট ডায়াগ্রামের সাহায্যে F2 অণুর গঠন ব্যাখ্যা করো।
অথবা, একটি সমযোজী মৌলিক অণু গঠনের উদাহরণ দাও।
দুটি F -পরমাণু সমযোজী বন্ধনের মাধ্যমে রাসায়নিকভাবে মিলিত হয়ে F2 অণু গঠন করে। F -পরমাণুর K -কক্ষে 2টি ও L -কক্ষে 7টি ইলেকট্রন থাকে।
F2 অণু গঠনকালে দুটি F -পরমাণুর প্রত্যেকটির যোজ্যতা-কক্ষ থেকে 1টি করে ইলেকট্রন এসে একটি ইলেকট্রন-জোড়
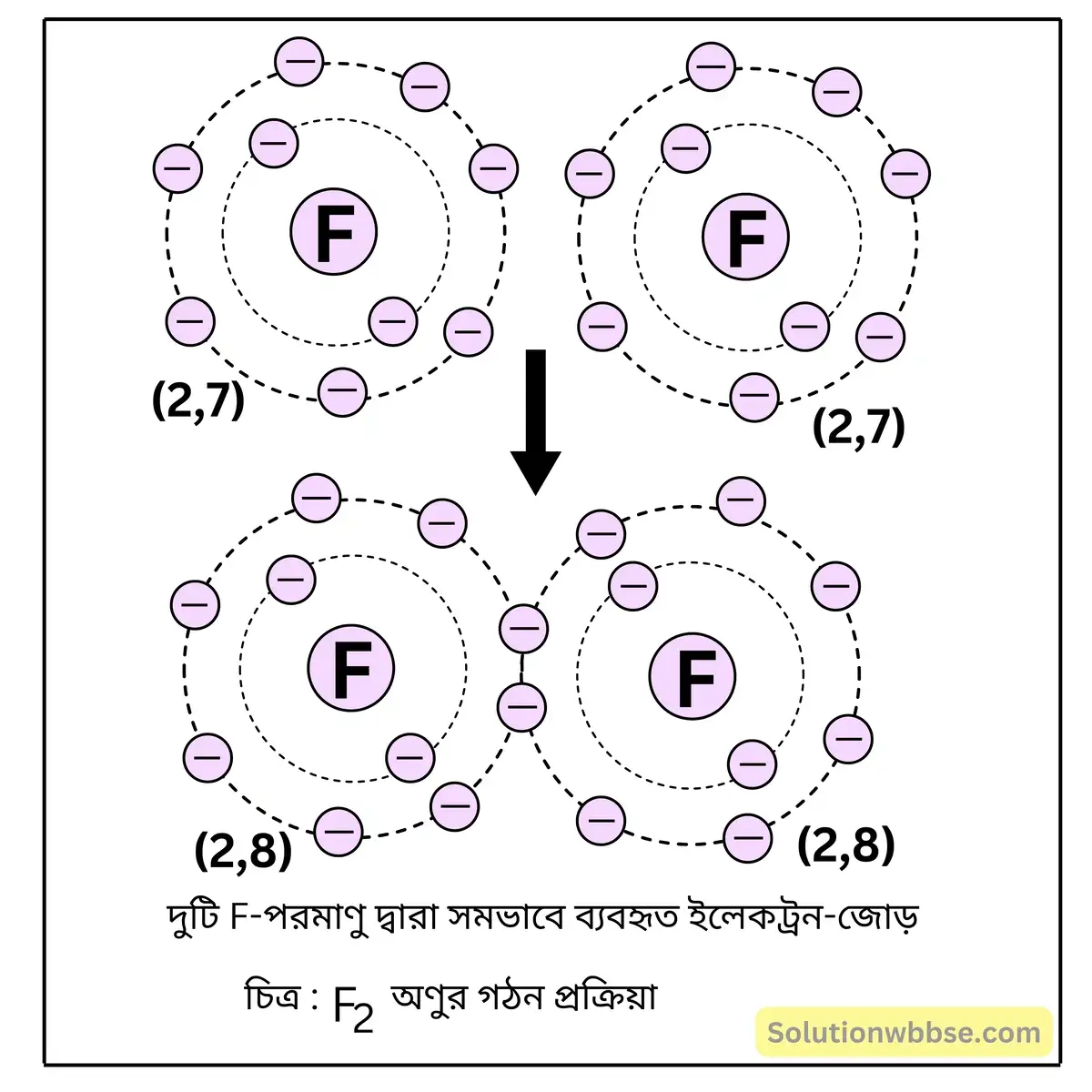
গঠন করে এবং উভয় পরমাণুই এই ইলেকট্রন-জোড় সমভাবে ব্যবহার করে। এর ফলে, উভয় পরমাণুই নিকটতম নিষ্ক্রিয় মৌল নিয়নের (Ne) পরমাণুর সুস্থিত ইলেকট্রন-বিন্যাস (2, 8) অর্জন করে। এভাবে দুটি F -পরমাণু সমযোজী বন্ধনে যুক্ত হয়ে F2 অণু গঠন করে।
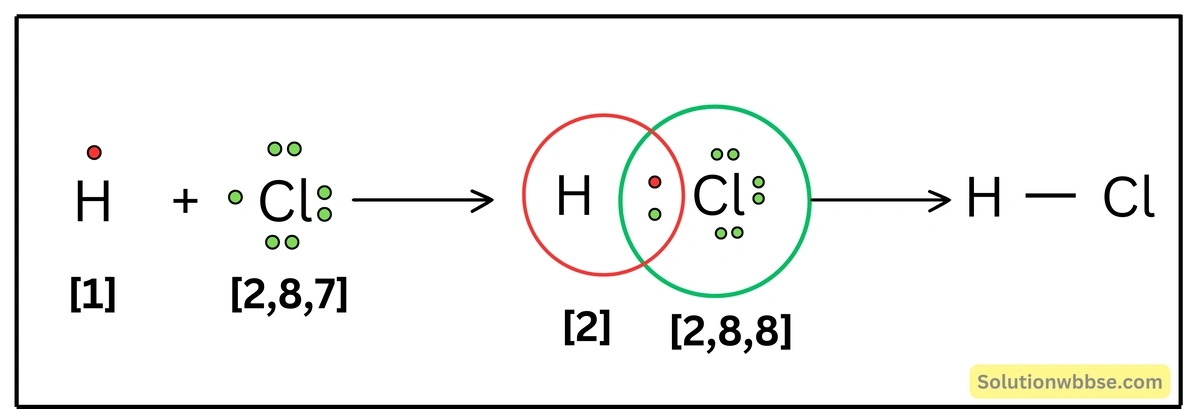
HCl অণু কীভাবে গঠিত হয়, লুইস-ডট ডায়াগ্রামের সাহায্যে ব্যাখ্যা করো।
অথবা, একটি সমযোজী যৌগিক অণু গঠনের উদাহরণ দাও।
একটি হাইড্রোজেন ও একটি ক্লোরিন পরমাণু, সমযোজী বন্ধন দ্বারা রাসায়নিকভাবে যুক্ত হয়ে HCl অণুর সৃষ্টি করে। H -পরমাণুর যোজ্যতা-কক্ষে অর্থাৎ K -কক্ষে 1টি ইলেকট্রন এবং Cl -পরমাণুর যোজ্যতা-কক্ষে অর্থাৎ M -কক্ষে 7টি ইলেকট্রন থাকে। রাসায়নিক বন্ধন গঠনের সময়, H -পরমাণুর 1টি ইলেকট্রন ও Cl -পরমাণুর M -কক্ষের 1টি ইলেকট্রন মিলে 1টি ইলেকট্রন-জোড় গঠন করে। উভয় পরমাণুর দ্বারাই ওই ইলেকট্রন-জোড় সমভাবে ব্যবহৃত হয়। এর ফলে H -পরমাণু, He -পরমাণুর মতো ও Cl -পরমাণু, Ar -পরমাণুর সুস্থিত ইলেকট্রন-বিন্যাস লাভ করে। এভাবে 1টি H -পরমাণু ও 1টি Cl -পরমাণু সমযোজী বন্ধনের মাধ্যমে যুক্ত হয়ে HCl অণু গঠন করে।
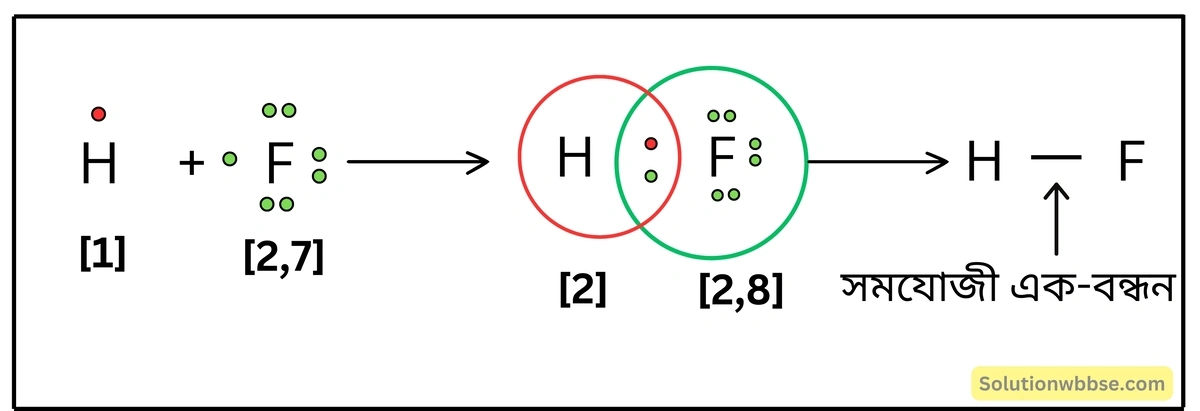
লুইস-ডট ডায়াগ্রামের সাহায্যে HF অণুর গঠন ব্যাখ্যা করো।
HF অণু গঠনের সময় H ও F -পরমাণুর (2, 7) যোজ্যতা-কক্ষ থেকে 1টি করে ইলেকট্রন এসে 1টি ইলেকট্রন-জোড় গঠিত হয়। এই ইলেকট্রন-জোড়কে উভয় পরমাণুই সমভাবে ব্যবহার করে। ফলে H -পরমাণু, He -পরমাণুর এবং F -পরমাণু, Ne -পরমাণুর সুস্থিত ইলেকট্রন-বিন্যাস লাভ করে। H ও F -পরমাণু সমযোজী বন্ধনে আবদ্ধ হয়ে HF অণু গঠন করে।
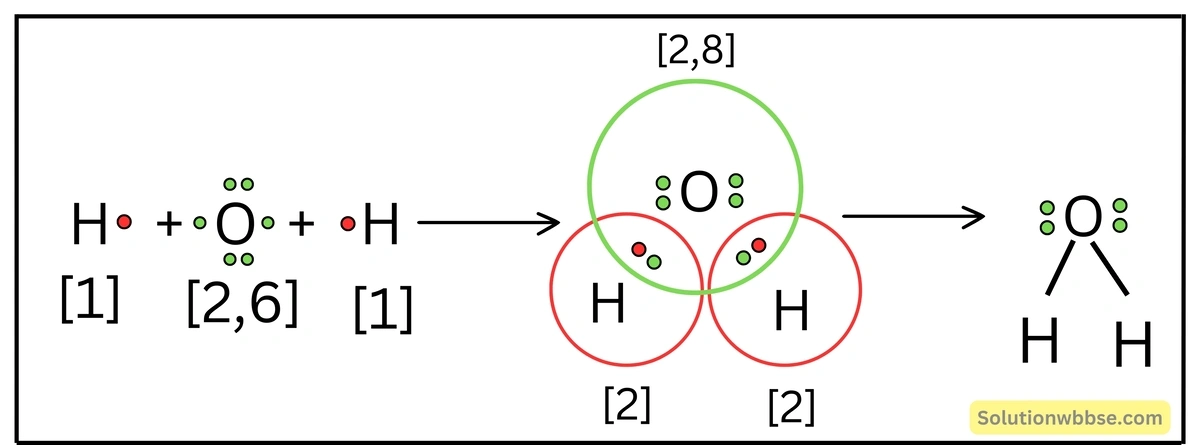
লুইস-ডট ডায়াগ্রামের সাহায্যে H2O অণুর গঠন ব্যাখ্যা করো।
H2O অণু গঠনের সময় 1টি O -পরমাণুর (2, 6) 2টি ইলেকট্রন পৃথকভাবে দুটি H -পরমাণুর প্রতিটির 1টি করে ইলেকট্রনের সঙ্গে যুক্ত হয়ে 2টি পৃথক ইলেকট্রন-জোড় গঠন করে। 2টি ইলেকট্রন-জোড়কে O -পরমাণু ও H -পরমাণু দুটি সমভাবে ব্যবহার করে নিকটবর্তী নিষ্ক্রিয় গ্যাসের স্থায়ী ইলেকট্রন বিন্যাস প্রাপ্ত হয়। এক্ষেত্রে, O -পরমাণুর বহিস্তম কক্ষে উপস্থিত একজোড়া ইলেকট্রন-জোড় নিঃসঙ্গ ইলেকট্রন-জোড়রূপে অবস্থান করে এবং বন্ধনে অংশ নেয় না।
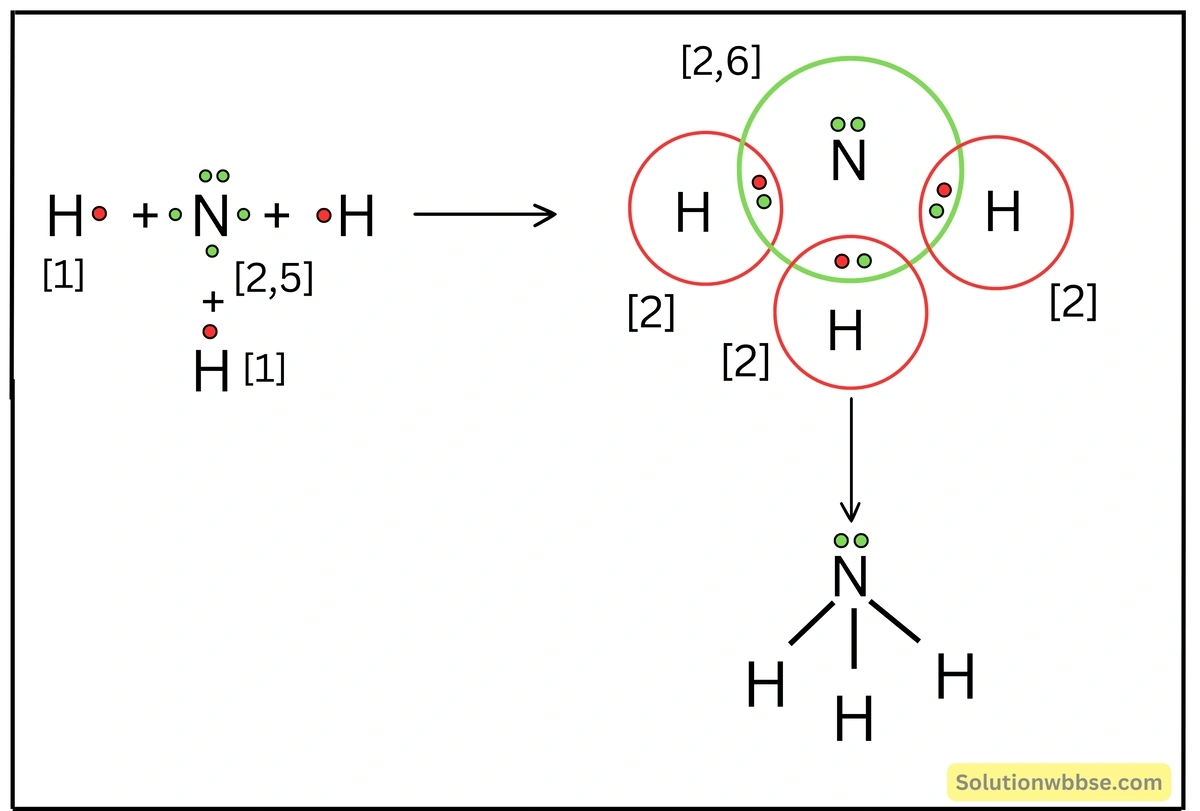
লুইস-ডট ডায়াগ্রামের সাহায্যে NH3 অণুর উৎপত্তি ব্যাখ্যা করো।
NH3 অণু গঠনের সময় N -পরমাণুর (2, 5) বহিস্তম কক্ষের 3টি ইলেকট্রন, 3টি H -পরমাণুর সঙ্গে পৃথকভাবে 3টি ইলেকট্রন-জোড় গঠন করে। এক্ষেত্রে প্রতিটি ইলেকট্রন-জোড়কে H ও N -পরমাণু সমভাবে ব্যবহার করে। ফলে, N -পরমাণুটি Ne -পরমাণু এবং H -পরমাণুগুলি, He -পরমাণুর সুস্থিত ইলেকট্রন-বিন্যাস লাভ করে। এক্ষেত্রে N -পরমাণুর বহিস্তম কক্ষের একজোড়া ইলেকট্রন নিঃসঙ্গ ইলেকট্রন-জোড়রূপে অবস্থান করে, যেগুলি বন্ধনে অংশ নেয় না।
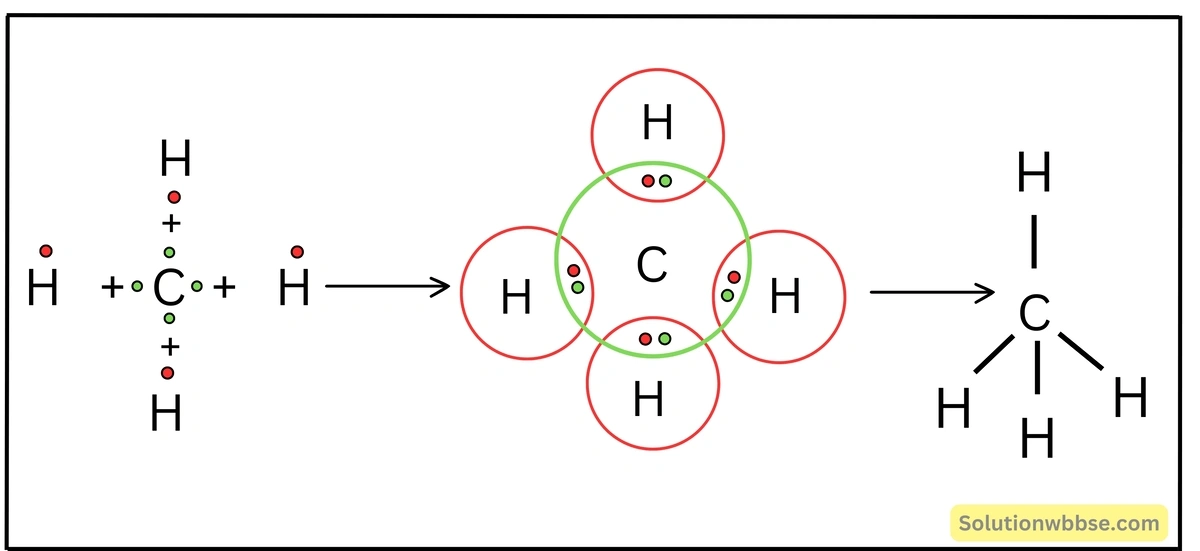
লুইস-ডট ডায়াগ্রামের সাহায্যে CH4 অণুর গঠন ব্যাখ্যা করো।
1টি C -পরমাণু (2, 4), 4টি H -পরমাণুর সঙ্গে সমযোজী বন্ধনে আবদ্ধ হয়ে মিথেন (CH4) অণু গঠন করে। C -পরমাণু, 4টি H -পরমাণুর সাথে রাসায়নিকভাবে যুক্ত হওয়ার সময় C -পরমাণুর বহিস্তম কক্ষের 4টি ইলেকট্রন 4টি H -পরমাণুর প্রতিটির 1টি ইলেকট্রনের সাথে পৃথকভাবে ইলেকট্রন-জোড় গঠন করে। এক্ষেত্রে প্রতিটি ইলেকট্রন-জোড়কে সমভাবে ব্যবহার করে C -পরমাণু, Ne -পরমাণুর এবং H -পরমাণুটি He -পরমাণুর সুস্থিত ইলেকট্রন বিন্যাস লাভ করে। ফলে 4টি C-H সমযোজী বন্ধন গঠিত হয় ও CH4 অণুর সৃষ্টি হয়।
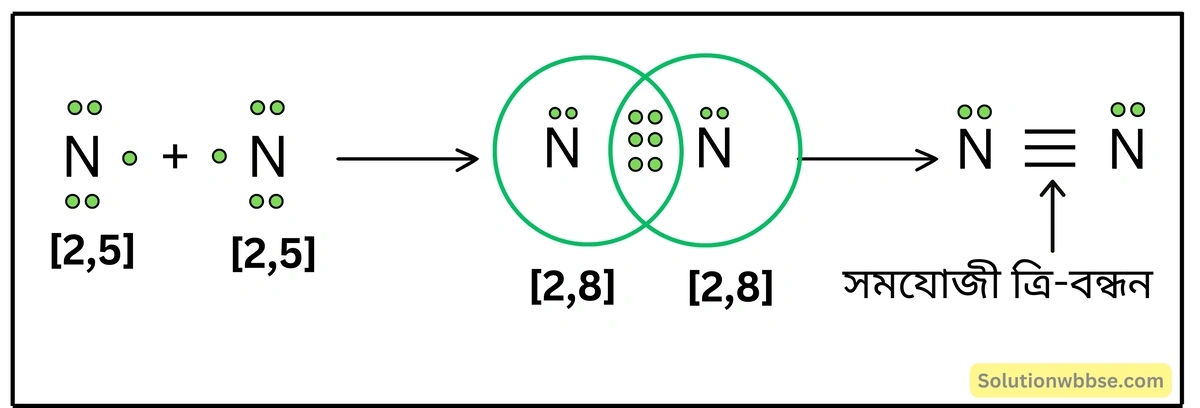
N2 অণু কীভাবে গঠিত হয় লুইস-ডট ডায়াগ্রামের সাহায্যে ব্যাখ্যা করো।
2টি N -পরমাণুর (2, 5) সংযোগে N2 অণু গঠনের সময় একটি N -পরমাণুর বহিস্তম কক্ষের 3টি ইলেকট্রন অপর N -পরমাণুর বহিস্তম কক্ষের 3টি ইলেকট্রনের সাথে 3টি ইলেকট্রন-জোড় গঠন করে। এর ফলে প্রতিটি N -পরমাণু নিকটবর্তী নিষ্ক্রিয় মৌল নিয়নের ইলেকট্রন-বিন্যাস লাভ করে সুস্থিত হয়। দুটি N -পরমাণুর মাঝে 3টি সমযোজী বন্ধন গঠিত হয়ে N2 অণু উৎপন্ন হয়।
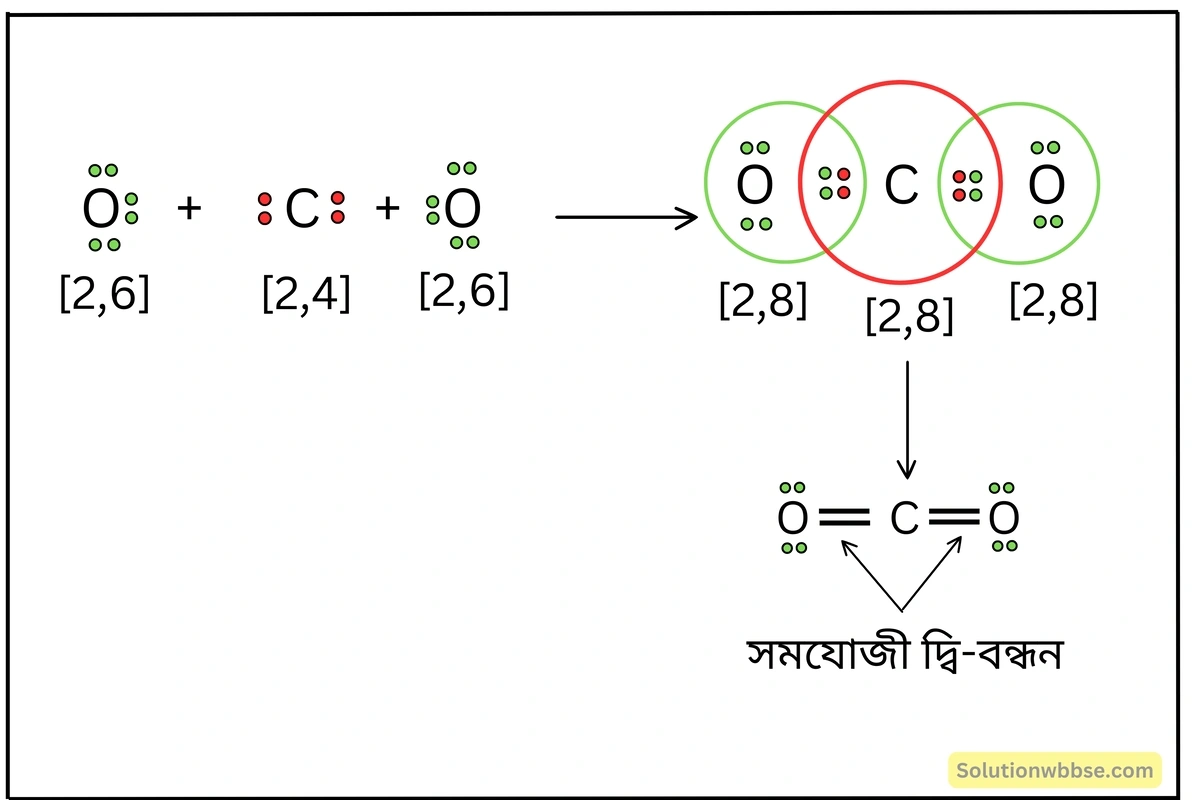
লুইস-ডট ডায়াগ্রামের সাহায্যে CO2 অণু কীভাবে গঠিত হয় ব্যাখ্যা করো।
CO2 অণু গঠনের সময় C -পরমাণুর বহিস্তম কক্ষের 4টি ইলেকট্রনের মধ্যে দুটি ইলেকট্রন একটি O -পরমাণুর বহিস্তম কক্ষের 2টি ইলেকট্রনের সাথে জোড়বদ্ধ হয় এবং দুটি ইলেকট্রন-জোড় গঠন করে। অনুরূপভাবে, C -পরমাণুর বহিস্তম কক্ষের অবশিষ্ট ইলেকট্রন দুটি অপর একটি O -পরমাণুর বহিস্তম কক্ষের দুটি ইলেকট্রনের সাথে মিলে দুটি ইলেকট্রন-জোড় গঠন করে। ফলে C ও O উভয়ে নিকটবর্তী নিষ্ক্রিয় মৌল নিয়নের (Ne) ইলেকট্রন-বিন্যাস লাভ করে সুস্থিত হয়। C ও প্রতিটি O -পরমাণুর মধ্যে সমযোজী দ্বি-বন্ধন গঠিত হয় যার ফলে CO2 অণু উৎপন্ন হয়।
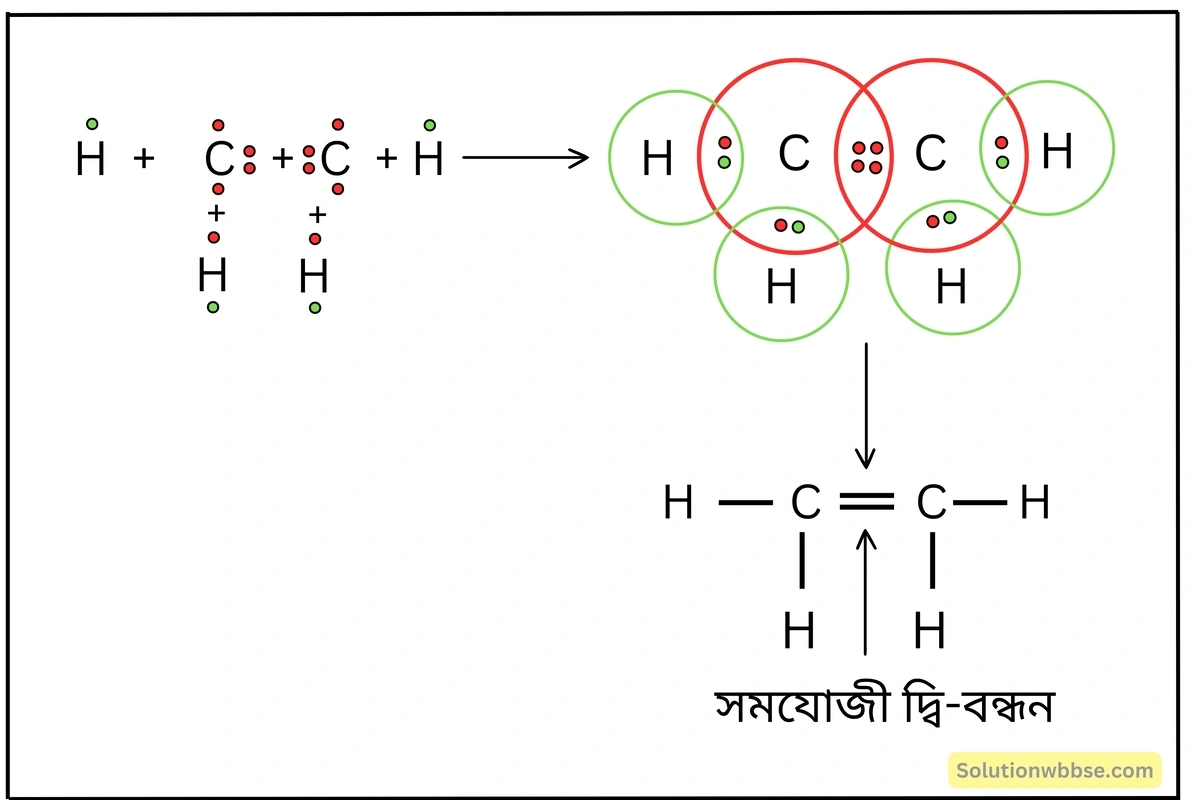
লুইস-ডট ডায়াগ্রামের সাহায্যে C2H4 অণুর গঠন ব্যাখ্যা করো।
2টি C -পরমাণু এবং 4টি H -পরমাণুর সংযোগে ইথিলিন (C2H4) অণু গঠিত হয়। এক্ষেত্রে, দুটি C -পরমাণু পরস্পরের মধ্যে 2টি ইলেকট্রন-জোড় গঠনের মাধ্যমে C=C বন্ধনের সৃষ্টি করে। প্রতিটি C -পরমাণু আবার অবশিষ্ট দুটি যোজক ইলেকট্রন ব্যবহার করে 2টি H -পরমাণুর সঙ্গে পৃথক পৃথকভাবে ইলেকট্রন-জোড় গঠন করে। ফলে অণুটিতে C=C বন্ধনের পাশাপাশি 4টি C-H বন্ধন উপস্থিত থাকে।
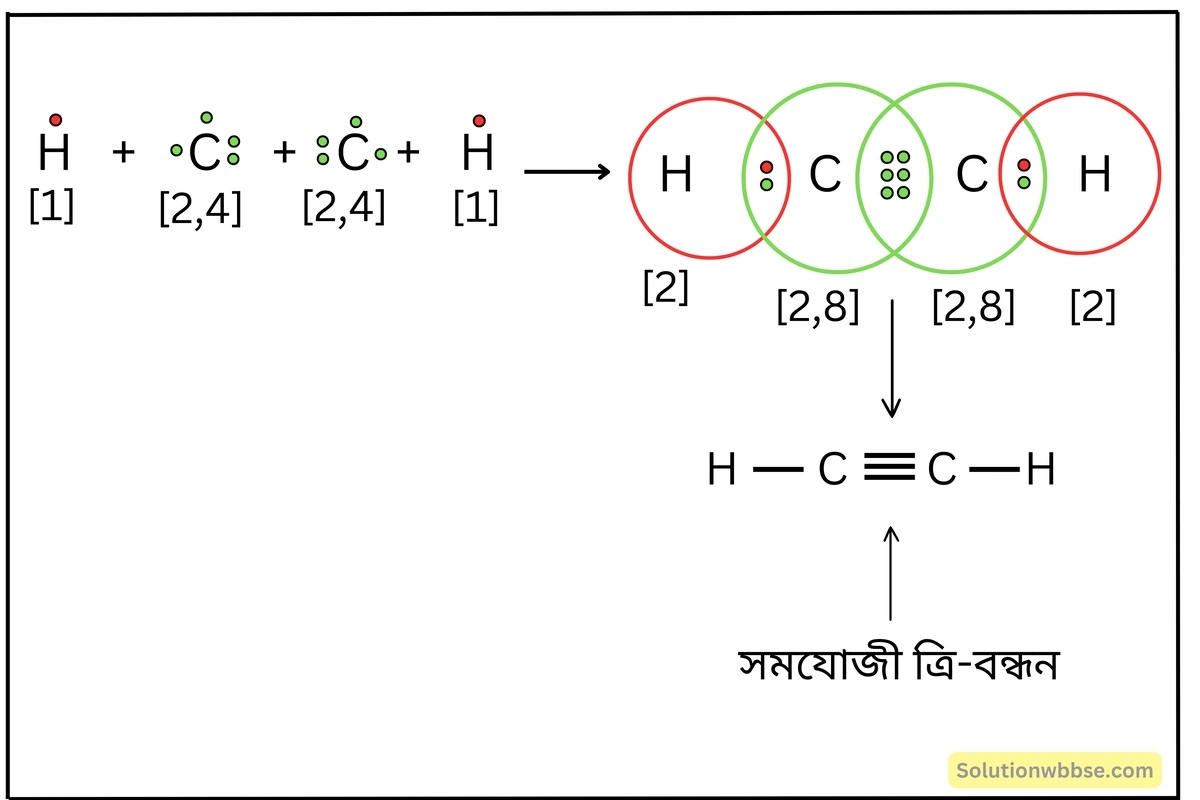
লুইস-ডট ডায়াগ্রামের সাহায্যে C2H2 অণুর গঠন ব্যাখ্যা করো।
2টি C -পরমাণু ও 2টি H -পরমাণুর সংযোগে অ্যাসিটিলিন (C2H2) অণু গঠিত হয়। এক্ষেত্রে 2টি C -পরমাণু তাদের বহিস্তম কক্ষের 3টি করে ইলেকট্রন দ্বারা 3টি ইলেকট্রন-জোড় গঠনের মাধ্যমে C≡C বন্ধনের সৃষ্টি করে। প্রতিটি C -পরমাণু আবার তাদের বহিস্তম কক্ষের অবশিষ্ট ইলেকট্রনটি ব্যবহার করে 1টি করে H -পরমাণুর সঙ্গে ইলেকট্রন-জোড় গঠন করে। ফলে প্রতিটি C -পরমাণু নিকটতম নিষ্ক্রিয় গ্যাস Ne -এর স্থায়ী ইলেকট্রন বিন্যাস লাভ করে। অণুটিতে C≡C বন্ধনের পাশাপাশি 2টি C-H বন্ধন বর্তমান।
X, Y ও Z মৌলগুলির পারমাণবিক সংখ্যা যথাক্রমে 9, 10 এবং 11। (i) তিনটি মৌলের ইলেকট্রন-বিন্যাস থেকে বলো কোন্ মৌলটি কেবলমাত্র তড়িৎযোজী এবং কোন্ মৌলটি তড়িৎযোজী ও সমযোজী-উভয়প্রকার বন্ধন গঠন করবে? (ii) X, Y ও Z মৌল তিনটির সমন্বয়ে গঠিত যৌগগুলির লুইস-ডট ডায়াগ্রাম অঙ্কন করো।
i. X -এর ইলেকট্রন-বিন্যাস – K = 2, L = 7
Y -এর ইলেকট্রন-বিন্যাস – K = 2, L = 8
Z -এর ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 1
X -এর সর্ববহিস্থ কক্ষে 7টি ইলেকট্রন উপস্থিত, তাই এটি আয়নীয় ও সমযোজী, উভয় প্রকার বন্ধন গঠনে সক্ষম। Y মৌলটির ক্ষেত্রে অষ্টক পূর্তি ঘটেছে। তাই এটি রাসায়নিকভাবে নিষ্ক্রিয়। Z -এর সর্ববহিস্থ কক্ষে 1টি ইলেকট্রন উপস্থিত, তাই এটি কেবলমাত্র আয়নীয় বন্ধন গঠনে অংশ নেবে।
ii. X ও Z -এর সমন্বয়ে গঠিত আয়নীয় যৌগটি হল ZX।
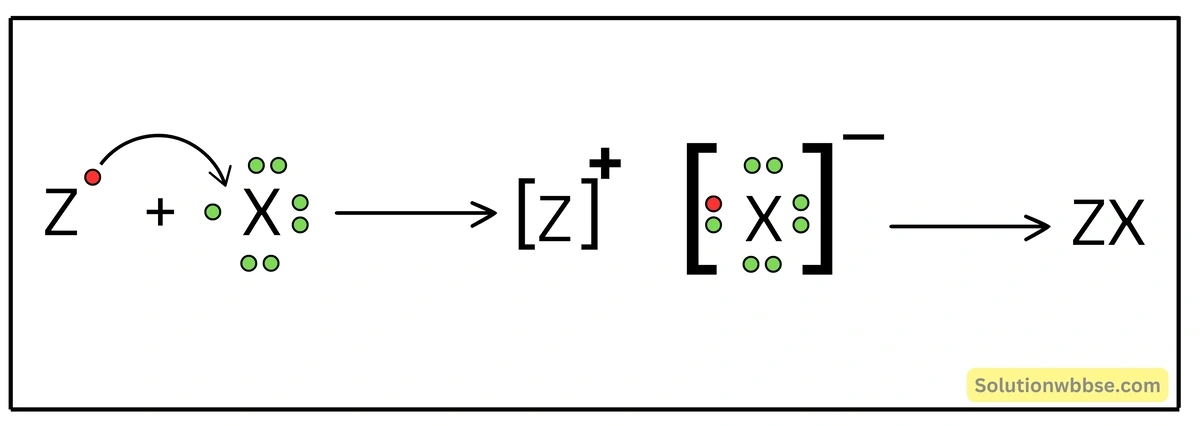
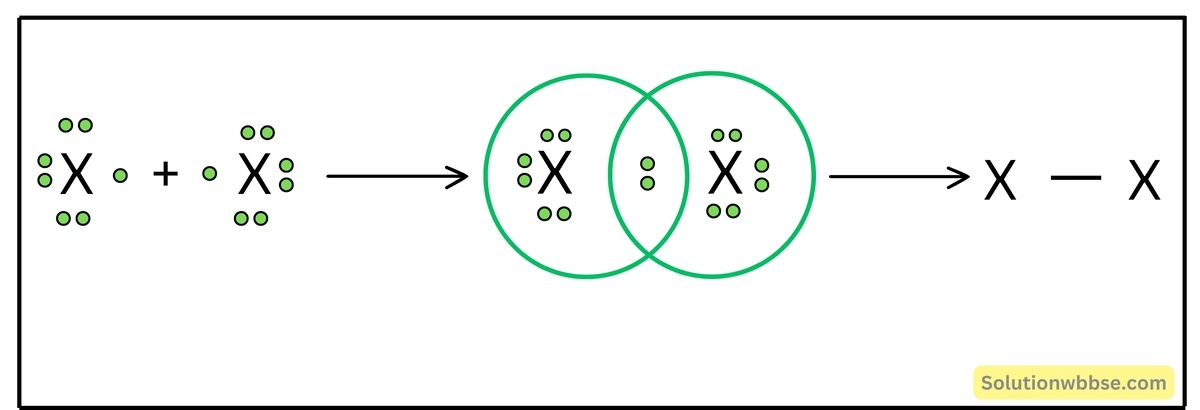
X মৌলের দুটি পরমাণু সমযোজী বন্ধনে আবদ্ধ হয়ে সমযোজী মৌল অণু X2 গঠন করবে।
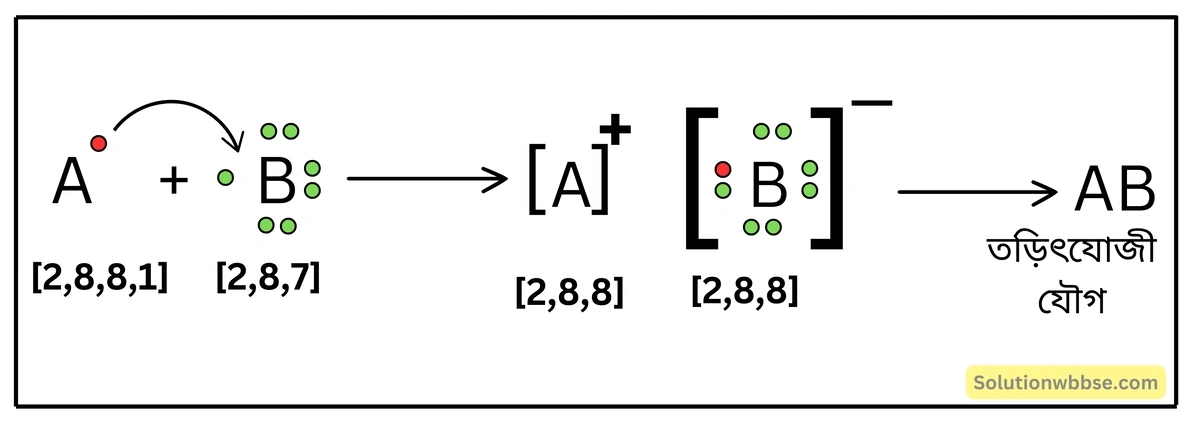
দুটি মৌল A ও B -এর পরমাণু-ক্রমাঙ্ক যথাক্রমে 19 এবং 17। A ও B রাসায়নিকভাবে সংযুক্ত হলে কী ধরনের যৌগ গঠন করবে? তোমার উত্তরের স্বপক্ষে যুক্তি দাও।
A -মৌলের ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 8, N = 1 এবং B -মৌলের ইলেকট্রন-বিন্যাস – K = 2, L = 8, M = 7।
ইলেকট্রন-বিন্যাস থেকে বোঝা যায়, A -মৌলের পরমাণুটি এর সর্ববহিস্থ কক্ষের ইলেকট্রনটি বর্জন করে নিকটতম নিষ্ক্রিয় মৌল আর্গনের (Ar) সুস্থিত ইলেকট্রন-বিন্যাস [2, 8, 8] অর্জন করবে। অন্যদিকে, B মৌলের পরমাণু তার সর্ববহিস্থ কক্ষে, A পরমাণুর বর্জিত ইলেকট্রনটি গ্রহণ করে অষ্টকপূর্তি ঘটাবে এবং নিকটতম নিষ্ক্রিয় মৌল আর্গনের পরমাণুর মতো সুস্থিত ইলেকট্রন-বিন্যাস অর্জন করবে। এভাবে A মৌলের একযোজী ক্যাটায়ন ও B মৌলের একযোজী অ্যানায়ন সৃষ্টি হলে তারা পরস্পর স্থির-তাড়িতিক আকর্ষণে আবদ্ধ হয়ে তড়িৎযোজী যৌগ গঠন করবে।
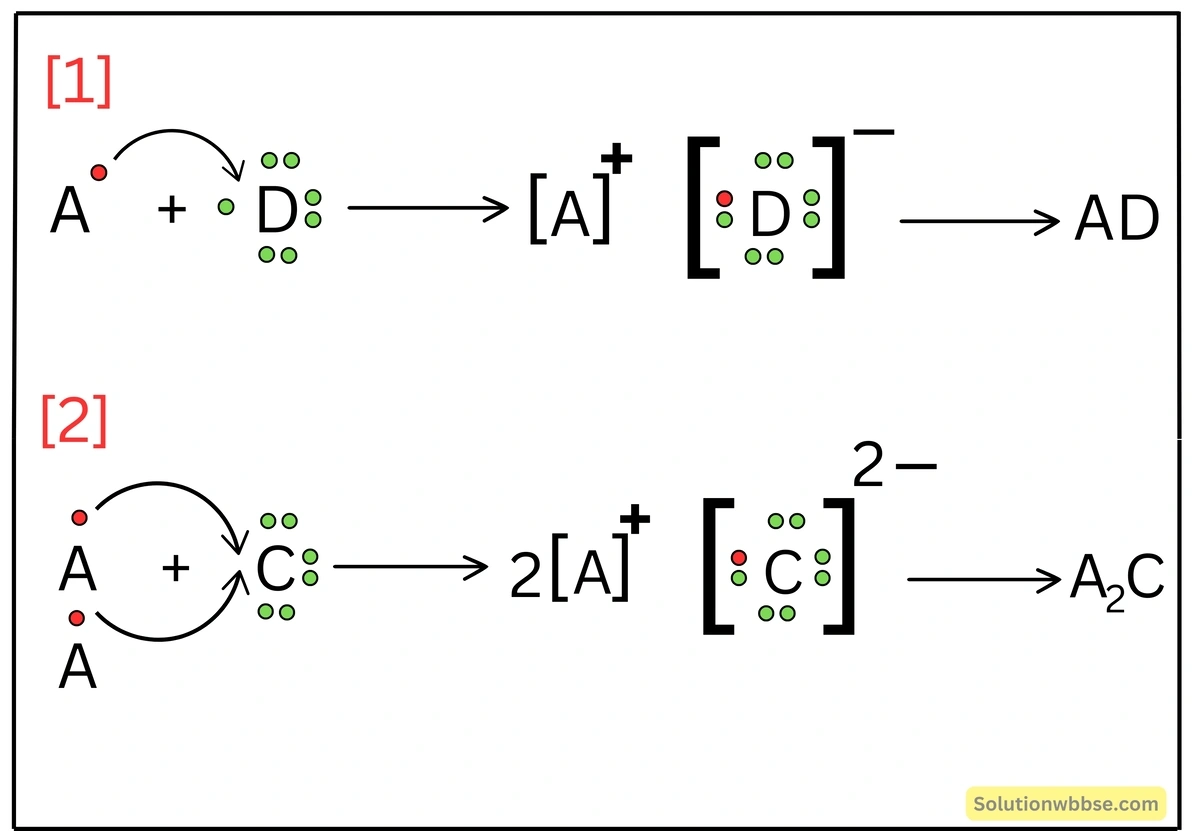
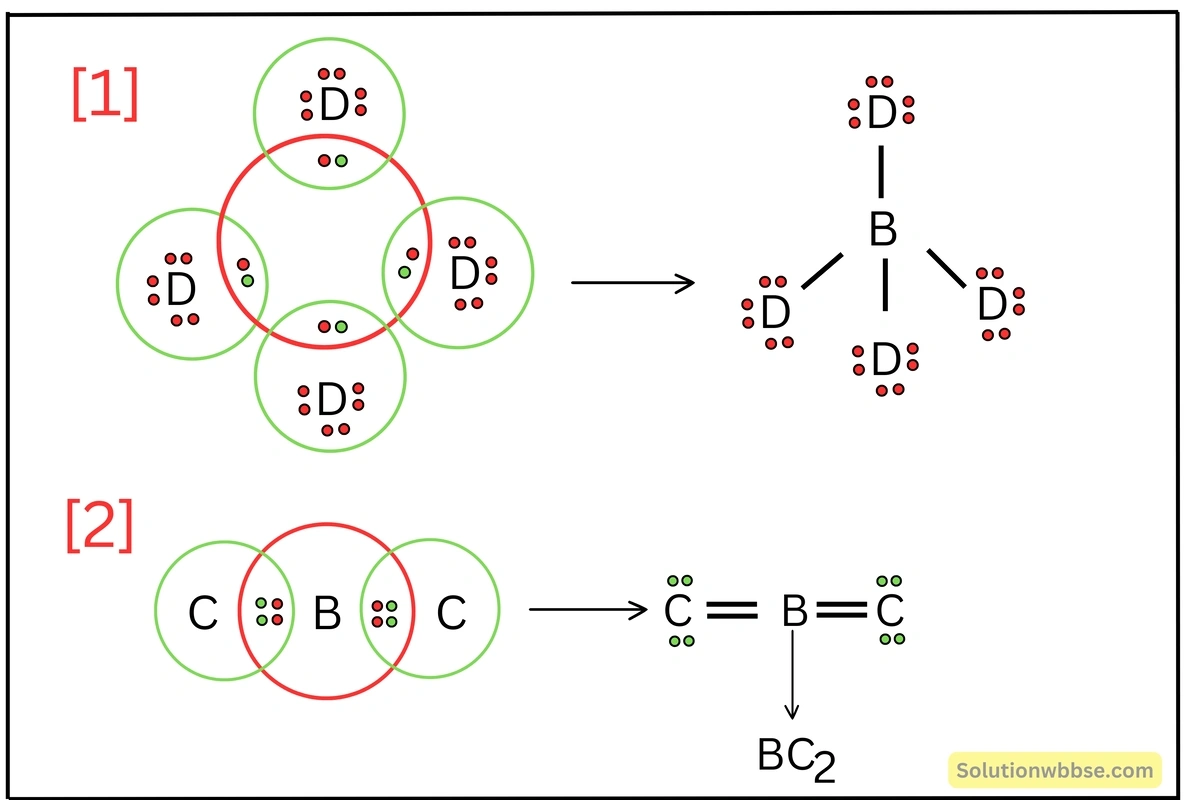
A, B, C এবং D মৌলের যোজ্যতা-কক্ষে ইলেকট্রনের সংখ্যা যথাক্রমে 1, 4, 6 ও 7। যে-কোনো দুটি করে মৌল বেছে নিয়ে দুটি আয়নীয় ও দুটি সমযোজী যৌগ গঠন করো ও তাদের লুইস-ডট গঠন অঙ্কন করো।
| মৌল | A | B | C | D |
| যোজ্যতা-ইলেকট্রনের সংখ্যা | 1 | 4 | 6 | 7 |
এক্ষেত্রে গঠিত আয়নীয় যৌগগুলি হবে –
এক্ষেত্রে গঠিত সমযোজী যৌগগুলি হবে –
X, Y ও Z মৌল তিনটির পারমাণবিক সংখ্যা যথাক্রমে 6, 9 ও 12। এদের মধ্যে – (i) কোনটি অ্যানায়ন গঠন করতে পারে? (ii) কোনটি ক্যাটায়ন গঠন করতে পারে? (iii) Y ও Z রাসায়নিক বন্ধনে আবদ্ধ হলে কী ধরনের বন্ধন সৃষ্টি হবে? উৎপন্ন যৌগের সংকেত কী হবে?
| মৌল | X | Y | Z |
| পারমাণবিক সংখ্যা | 6 | 9 | 12 |
| ইলেকট্রন-বিন্যাস | [2, 4] | [2, 7] | [2, 8, 2] |
- মৌল তিনটির মধ্যে Y অ্যানায়ন গঠন করতে পারে, কারণ একটি ইলেকট্রন গ্রহণ করে Y– আয়ন গঠিত হলে এর অষ্টকপূর্তি ঘটবে।
- মৌল তিনটির মধ্যে Z ক্যাটায়ন গঠন করতে পারে, কারণ 2টি ইলেকট্রন ত্যাগ করে Z2+ আয়ন গঠিত হলে এর অষ্টকপূর্তি ঘটবে।
- Y -এর তড়িৎযোজ্যতা 1 এবং Z -এর তড়িৎযোজ্যতা 2। তাই এদের দ্বারা সৃষ্ট যৌগের সংকেত হবে ZY2 এবং এদের বন্ধনের প্রকৃতি হবে তড়িৎযোজী বা আয়নীয়।
নীচের ছকটি পূরণ করো –
| সংশ্লিষ্ট মৌল | Na | P | C |
| ক্লোরাইড যৌগের সংকেত | |||
| বন্ধনের প্রকৃতি | |||
| ক্লোরাইড যৌগের ভৌত অবস্থা |
| সংশ্লিষ্ট মৌল | Na | P | C |
| ক্লোরাইড যৌগের সংকেত | Nacl | PCl3, PCl5 | CCl4 |
| বন্ধনের প্রকৃতি | আয়নীয় | সমযোজী, সমযোজী | সমযোজী |
| ক্লোরাইড যৌগের ভৌত অবস্থা | কঠিন | তরল, তরল | তরল |
একটি মৌল X, অক্সিজেনের সাথে যুক্ত হয়ে অক্সাইড যৌগ, X2O উৎপন্ন করে। গলিত অক্সাইডটি তড়িতের পরিবাহী হলে – (i) X -এর যোজ্যতা-কক্ষে কটি ইলেকট্রন থাকে? (ii) মেন্ডেলিফের পর্যায় সারণির কোন্ শ্রেণিতে X অবস্থিত? (iii) X, ক্লোরিনের সাথে যৌগ গঠন করলে সেই যৌগের সংকেত ও প্রকৃতি কী হবে?
গলিত অক্সাইডটি তড়িৎ পরিবহণ করে অর্থাৎ যৌগটি আয়নীয় প্রকৃতির। O তড়িৎ-ঋণাত্মক অধাতু হওয়ায় X নিশ্চয়ই তড়িৎ-ধনাত্মক ধাতব মৌল হবে।
- X2O যৌগে X -এর যোজ্যতা 1। অতএব, X -এর যোজ্যতা-কক্ষে 1টি ইলেকট্রন আছে।
- X-মৌলটি মেন্ডেলিফের পর্যায় সারণিতে IA শ্রেণিতে অবস্থিত।
- ক্লোরিন অধাতু এবং X ধাতু। অতএব, উৎপন্ন যৌগের প্রকৃতি আয়নীয় বা তড়িৎযোজী হবে। এক্ষেত্রে উৎপন্ন যৌগের সংকেত হবে XCl।
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘আয়নীয় ও সমযোজী বন্ধন’ এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






Leave a Comment