আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন’ এর কিছু দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

পরীক্ষাগারে উৎপন্ন NH3 গ্যাসকে জলীয় বাষ্প মুক্ত করতে গাঢ় H2SO4, ফসফরাস পেন্টক্সাইড (P2O5) বা অনার্দ্র CaCl2 ব্যবহার করা যায় না কেন?
অ্যামোনিয়া ক্ষারীয় পদার্থ, তাই গাঢ় H2SO4 বা P2O5 প্রভৃতি আম্লিক প্রকৃতির শুষ্ককারক বা জলশোষক পদার্থ দ্বারা অ্যামোনিয়াকে শুষ্ক করা যায় না। গাঢ় H2SO4 ও P2O5 অ্যামোনিয়ার সাথে বিক্রিয়া করে যথাক্রমে অ্যামোনিয়াম সালফেট ও অ্যামোনিয়াম ফসফেট উৎপন্ন করে।
2NH3 + H2SO4 → (NH4)2SO4
6NH3 + P2O5 + 3H2O → 2(NH4)3PO4
আবার, অনার্দ্র CaCl2 অ্যামোনিয়াকে শোষণ করে যুতযৌগ গঠন করে বলে এটিকে ব্যবহার করে অ্যামোনিয়াকে জলীয় বাষ্পমুক্ত করা যায় না।
CaCl2 + 8NH3 → CaCl2⋅8NH3 (যুতযৌগ)
কোল্ড স্টোরেজ, কারখানা বা অ্যামোনিয়ার ট্যাংক থেকে NH3 গ্যাস দুর্ঘটনাজনিত কারণে নির্গত হলে প্রতিকারের জন্য কী কী ব্যবস্থা নেওয়া উচিত?
অ্যামোনিয়া তীব্র ঝাঁজালো গন্ধবিশিষ্ট ক্ষারকীয় গ্যাস, যা চোখের পক্ষে খুব ক্ষতিকর। অ্যামোনিয়া গ্যাস প্রশ্বাসের সাথে ফুসফুসে গেলে শ্বাসকষ্ট শুরু হয়।
অ্যামোনিয়া গ্যাস জলে খুব দ্রাব্য হওয়ায় সামান্য আয়তনের জলেই অনেক বেশি পরিমাণ গ্যাস শোষিত হয়। তাই প্রথমেই গ্যাস আক্রান্ত মানুষের চোখে, মুখে প্রচুর জলের ঝাপটা দিতে হবে এবং জলে ভেজানো রুমাল বা কাপড় দিয়ে চোখ, মুখ ও নাক ঢেকে রাখতে হবে। এর ফলে গ্যাসটি জলে দ্রবীভূত হয়ে যাবে এবং চোখ ও ফুসফুস আক্রান্ত হবে না। এরপর আক্রান্ত মানুষকে ওই স্থান থেকে দ্রুত সরিয়ে নিয়ে গিয়ে ডাক্তারবাবুর পরামর্শ নেওয়া দরকার। তাছাড়া ওই এলাকায় প্রচুর জল ছড়াতে হবে। ফলে বায়ুতে ছড়িয়ে পড়া অ্যামোনিয়া গ্যাস ওই জলে গ্যাস শোষিত হয়ে যাবে ও মানুষের ক্ষতির সম্ভাবনা অনেক কমে যাবে।
অ্যামোনিয়া যে একটি ক্ষারকীয় প্রকৃতির যৌগ তা কীভাবে বোঝা যায়?
অ্যামোনিয়ার জলীয় দ্রবণ (NH4OH) লাল লিটমাস কাগজকে নীল করে অথবা অ্যামোনিয়াপূর্ণ গ্যাসজারে ভিজে লাল লিটমাস কাগজ প্রবেশ করালে তার বর্ণ নীল হয়ে যায়। আবার অ্যামোনিয়া বিভিন্ন অ্যাসিড যেমন, হাইড্রোক্লোরিক অ্যাসিড ও সালফিউরিক অ্যাসিডের সাথে বিক্রিয়ায় যথাক্রমে অ্যামোনিয়াম ক্লোরাইড ও অ্যামোনিয়াম সালফেট লবণ উৎপন্ন করে।
NH3 + HCl → NH4Cl,
2NH3 + H2SO4 → (NH4)2SO4
উপরিউক্ত পর্যবেক্ষণগুলি থেকে বোঝা যায় যে, অ্যামোনিয়া একটি ক্ষারকীয় প্রকৃতির যৌগ।
ইউরিয়ার শিল্পোৎপাদনের শর্ত ও বিক্রিয়ার সমীকরণ দাও।
প্রায় 175 বায়ুমণ্ডলীয় চাপ ও 170-190°C উষ্ণতায় বদ্ধপাত্রে অ্যামোনিয়া ও কার্বন ডাইঅক্সাইড গ্যাসের বিক্রিয়া ঘটিয়ে ইউরিয়ার শিল্পোৎপাদন করা হয়।
বিক্রিয়া – ইউরিয়া উৎপাদন দুটি ধাপে সংঘটিত হয় –
1. প্রথম ধাপে অ্যামোনিয়া ও কার্বন ডাইঅক্সাইড পরস্পর বিক্রিয়া করে অ্যামোনিয়াম কার্বামেট উৎপন্ন করে। এই ধাপটি তাপদায়ী।
2. দ্বিতীয় ধাপে অ্যামোনিয়াম কার্বামেট বিয়োজিত হয়ে ইউরিয়া উৎপন্ন করে। এই ধাপটি তাপগ্রাহী।
ইউরিয়া উৎপাদনের দুটি ধাপই উভমুখী; প্রথম ধাপের বিক্রিয়া প্রায় সম্পূর্ণতা লাভ করলেও দ্বিতীয় ধাপের বিক্রিয়াটিতে অ্যামোনিয়াম কার্বামেটের 40-60% ইউরিয়াতে রূপান্তরিত হয়।
শিল্পক্ষেত্রে অ্যামোনিয়ার প্রধান প্রধান ব্যবহারগুলি উল্লেখ করো।
শিল্পক্ষেত্রে অ্যামোনিয়ার ব্যবহারগুলি নিম্নরূপ –
- অ্যামোনিয়াম সালফেট, অ্যামোনিয়াম নাইট্রেট, অ্যামোনিয়াম ফসফেট, ইউরিয়া ইত্যাদি সার প্রস্তুতিতে অ্যামোনিয়া ব্যবহৃত হয়।
- অস্ওয়াল্ড পদ্ধতিতে নাইট্রিক অ্যাসিড ও সল্ভে পদ্ধতিতে সোডিয়াম কার্বনেট প্রস্তুতিতে অ্যামোনিয়া ব্যবহৃত হয়।
- তরল অ্যামোনিয়ার বাষ্পীভবনের লীনতাপের মান বেশি হওয়ায় রেফ্রিজারেটর, বরফ তৈরির কারখানায় ও কোল্ড স্টোরেজে শীতলীকরণের কাজে হিমায়করূপে অ্যামোনিয়াকে ব্যবহার করা হয়।
- কৃত্রিম রেয়ন, প্লাস্টিক, রবার ইত্যাদি এবং স্মেলিং সল্ট প্রস্তুতিতে NH3 ব্যবহৃত হয়।
ইউরিয়ার প্রধান প্রধান ব্যবহারগুলি উল্লেখ করো।
ইউরিয়ার ব্যবহারগুলি নিম্নরূপ –
- ইউরিয়া কৃষিকার্যে নাইট্রোজেনঘটিত জৈব সার হিসেবে ব্যাপকভাবে ব্যবহৃত হয়।
- ইউরিয়া থেকে কালাজ্বরের ওষুধ ইউরিয়া স্টিবামিন তৈরি করা হয়। এছাড়া ইউরিয়া ব্যবহার করে ঘুমের ওষুধ বারবিটিউরেট তৈরি করা হয়।
- সেলোফেন কাগজ, রেয়ন, নাইট্রোসেলুলোজ (বিস্ফোরক পদার্থ) প্রভৃতির শিল্পোৎপাদনে ইউরিয়া ব্যবহৃত হয়।
- ইউরিয়া ফর্ম্যালডিহাইড নামক রেজিন তৈরিতে ইউরিয়া ব্যবহার করা হয়।
পরীক্ষাগারে উৎপন্ন H2S -এ অশুদ্ধি হিসেবে কী কী মিশে থাকে? এই অশুদ্ধিগুলিকে কীভাবে অপসারণ করা যায়?
পরীক্ষাগারে উৎপন্ন H2S -এর মধ্যে অশুদ্ধিরূপে হাইড্রোজেন, জলীয় বাষ্প এবং সামান্য অ্যাসিড বাষ্প থাকে।
- অশুদ্ধিযুক্ত H2S গ্যাসকে প্রথমে U -নলে রাখা সোডিয়াম হাইড্রোজেন সালফাইডের সম্পৃক্ত জলীয় দ্রবণের মধ্য দিয়ে প্রবাহিত করে অ্যাসিড বাষ্প মুক্ত করা হয়। NaHS + HCl → NaCl + H2S↑
- এরপর গ্যাসটিকে অপর একটি U -নলে রাখা P2O5 -এর মধ্য দিয়ে চালনা করে জলীয় বাষ্প মুক্ত করা হয়।
- এই শুষ্ক ও অ্যাসিড বাষ্পমুক্ত গ্যাসকে কঠিন কার্বন ডাই-অক্সাইড বা শুষ্ক বরফ দিয়ে ঠান্ডা করলে H2S তরলে পরিণত হয় এবং H2 গ্যাস বেরিয়ে যায়। তরল H2S -কে সাধারণ উষ্ণতায় আনলে বিশুদ্ধ H2S পাওয়া যায়।
পরীক্ষাগারে উৎপন্ন H2S গ্যাসকে জলীয় বাষ্পমুক্ত করতে গাঢ় H2SO4, অনার্দ্র CaCl2 বা পোড়াচুন (CaO) ব্যবহার করা হয় না কেন?
পরীক্ষাগারে উৎপন্ন H2S গ্যাসকে জলীয় বাষ্পমুক্ত করতে গাঢ় H2SO4 ব্যবহার করা হলে H2S গাঢ় H2SO4 দ্বারা জারিত হয়ে সালফারে পরিণত হয়।
H2S + H2SO4 → S↓ + SO2↑ + 2H2O
অপরদিকে, CaCl2 -এর সঙ্গে বিক্রিয়া করে H2S ক্যালশিয়াম সালফাইড গঠন করে এবং HCl গ্যাস নির্গত হয়।
CaCl2 + H2S → CaS + 2HCl
H2S জলের উপস্থিতিতে মৃদু অম্লধর্মী হওয়ায় পোড়াচুন বা ক্যালশিয়াম অক্সাইডের সাথে বিক্রিয়া করে ক্যালশিয়াম সালফাইড লবণ গঠন করে।
CaO + H2S → CaS + H2O
কিপ্-যন্ত্রে H2S প্রস্তুতি সংক্ষেপে বর্ণনা করো।
পরীক্ষাগারে প্রয়োজনমতো H2S পাওয়ার জন্য এবং প্রয়োজন না হলে H2S -এর উৎপাদন বন্ধ রাখার জন্য কিপ্-যন্ত্র ব্যবহার করা হয়।
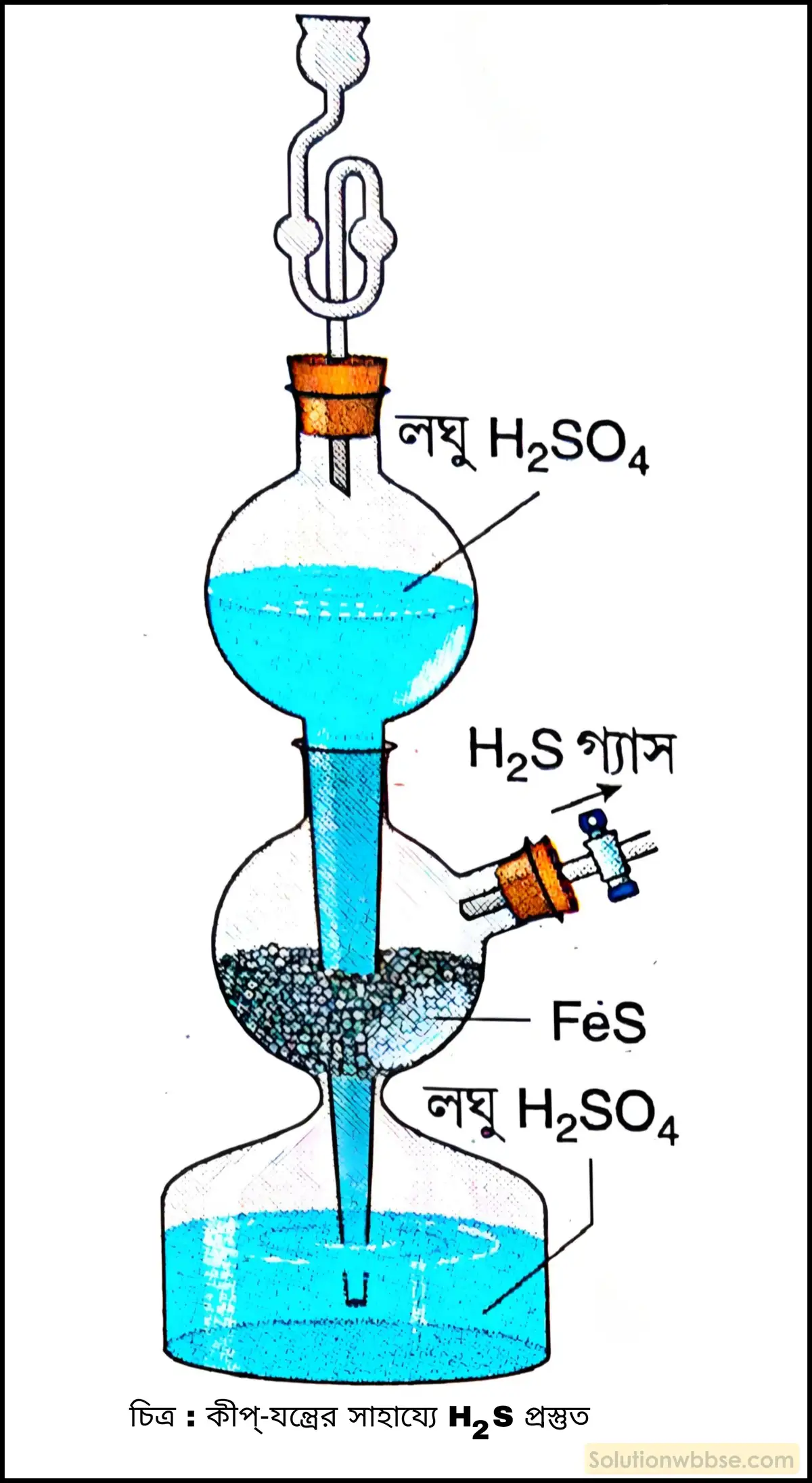
পদ্ধতি –
- কিপ্-যন্ত্রের মাঝের গোলকে ফেরাস সালফাইড (FeS) -এর টুকরো রেখে উপরের গোলকের ফানেলের মধ্য দিয়ে লঘু H2SO4 ঢাললে, অ্যাসিড, FeS -এর সংস্পর্শে এসে H2S গ্যাস উৎপন্ন করে, যা স্টপকক্ লাগানো নির্গম নল দিয়ে বের হয়।
- স্টপককটি বন্ধ করলে উৎপন্ন গ্যাস বেরিয়ে যেতে না পেরে অ্যাসিডের উপর চাপ দেয়। ফলে অ্যাসিড নীচের গোলকে নেমে যায় এবং লম্বা নল বেয়ে উপরের গোলকে কিছুটা উঠে আসে। এর ফলে অ্যাসিড ও FeS -এর সংযোগ বিচ্ছিন্ন হয় এবং H2S -এর উৎপাদন বন্ধ হয়।
- স্টপককটি খুলে দিলে মাঝের গোলকে জমে থাকা H2S গ্যাস বেরিয়ে যায়। চাপ কমে যাওয়ায় উপরের গোলক থেকে অ্যাসিড নেমে আসে এবং মাঝের গোলকে যায়। তখন আবার FeS অ্যাসিডের সংস্পর্শে আসে এবং H2S উৎপন্ন হতে শুরু করে।
বিক্রিয়ার সমীকরণ –
FeS + H2SO4 → FeSO4 + H2S↑
রূপোর তৈরি জিনিস বা তৈলচিত্রের সাদা রং পুরোনো হলে কালো হয়ে যায় কেন?
বায়ুর মধ্যে সামান্য H2S মিশে থাকে, যা ধীরে ধীরে রুপোর সঙ্গে বিক্রিয়া করে রুপোর উপর কালো বর্ণের সিলভার সালফাইড (Ag2S) -এর আস্তরণ গঠন করে। এর ফলে রুপোর জিনিস কালো হয়ে যায়।
2Ag + H2S → Ag2S + H2
তৈলচিত্রের সাদা রঙে লেড যৌগ [যেমন – PbCO3, Pb(OH)2] থাকে। এইসব লেড যৌগ বাতাসের H2S -এর সঙ্গে বিক্রিয়া করে কালো বর্ণের লেড সালফাইড (PbS) -এ পরিণত হয়। তাই তৈলচিত্রের সাদা রং কালো হয়ে যায়।
Pb(OH)2 + H2S → PbS + 2H2O
PbCO3 + H2S → PbS + H2CO3
পুরোনো তৈলচিত্রের সাদা রঙ পুনরুদ্ধার কী?
তৈলচিত্রে ‘লেড হোয়াইট’ নামক যে সাদা রঙ ব্যবহৃত হয় তা বিভিন্ন লেডঘটিত যৌগের সংমিশ্রণে তৈরি। তৈলচিত্র দীর্ঘদিন বায়ুতে উন্মুক্ত থাকলে বায়ুতে উপস্থিত H2S -এর সঙ্গে এই লেড যৌগগুলি ধীরে ধীরে বিক্রিয়া করে অদ্রাব্য কালো লেড সালফাইডে পরিণত হয়, ফলে তৈলচিত্র কালো হয়ে যায়। লঘু H2O2 দ্রবণ দিয়ে ধুয়ে ফেললে তৈলচিত্রের লেড সালফাইড জারিত হয়ে দ্রাব্য, সাদা লেড সালফেটে পরিণত হয় এবং তৈলচিত্রের উজ্জ্বলতা পুনরায় ফিরে আসে।
H2S -এর বিভিন্ন ব্যবহারগুলি উল্লেখ করো।
H2S -এর ব্যবহারগুলি নিম্নরূপ –
- বিভিন্ন সালফাইড ও বাইসালফাইড লবণ প্রস্তুতিতে H2S ব্যবহার করা হয়।
- পরীক্ষাগারে বিজারক দ্রব্যরূপে H2S ব্যবহৃত হয়।
- অজৈব লবণের গুণগত (qualitative) ও পরিমাণগত (quantitative) বিশ্লেষণের ক্ষেত্রে অধঃক্ষেপণ-বিকারক হিসেবে H2S সর্বাধিক ব্যবহৃত হয়।
ব্যাবহারিক রসায়নে H2S -এর ব্যবহার লিখ।
জলে যেসব ধাতব সালফাইড স্বল্প দ্রাব্য, সেইসব ধাতুর লবণের জলীয় দ্রবণে H2S চালনা করলে ধাতুটি সালফাইডরূপে অধঃক্ষিপ্ত হয়। অধঃক্ষিপ্ত ধাতব সালফাইডের বিভিন্ন বর্ণ দেখে ধাতুগুলিকে শনাক্ত করা যায়।
| বর্ণ | কালো | কমলা | হলুদ | সাদা |
| ধাতব সালফাইড | Ag2S, CuS, PbS, HgS, CoS, NiS | Sb2S3 | CdS, As2S3, SnS | ZnS |
পরীক্ষাগারে নাইট্রোজেন গ্যাস প্রস্তুতির নীতি ও বিক্রিয়ার সমীকরণ দাও।
নীতি – সোডিয়াম নাইট্রাইট ও অ্যামোনিয়াম ক্লোরাইডকে 1 : 1 মোল অনুপাতে মিশিয়ে ওই মিশ্রণের গাঢ় জলীয় দ্রবণকে সতর্কভাবে তাপ প্রয়োগ করে পরীক্ষাগারে নাইট্রোজেন গ্যাস উৎপন্ন করা হয়।
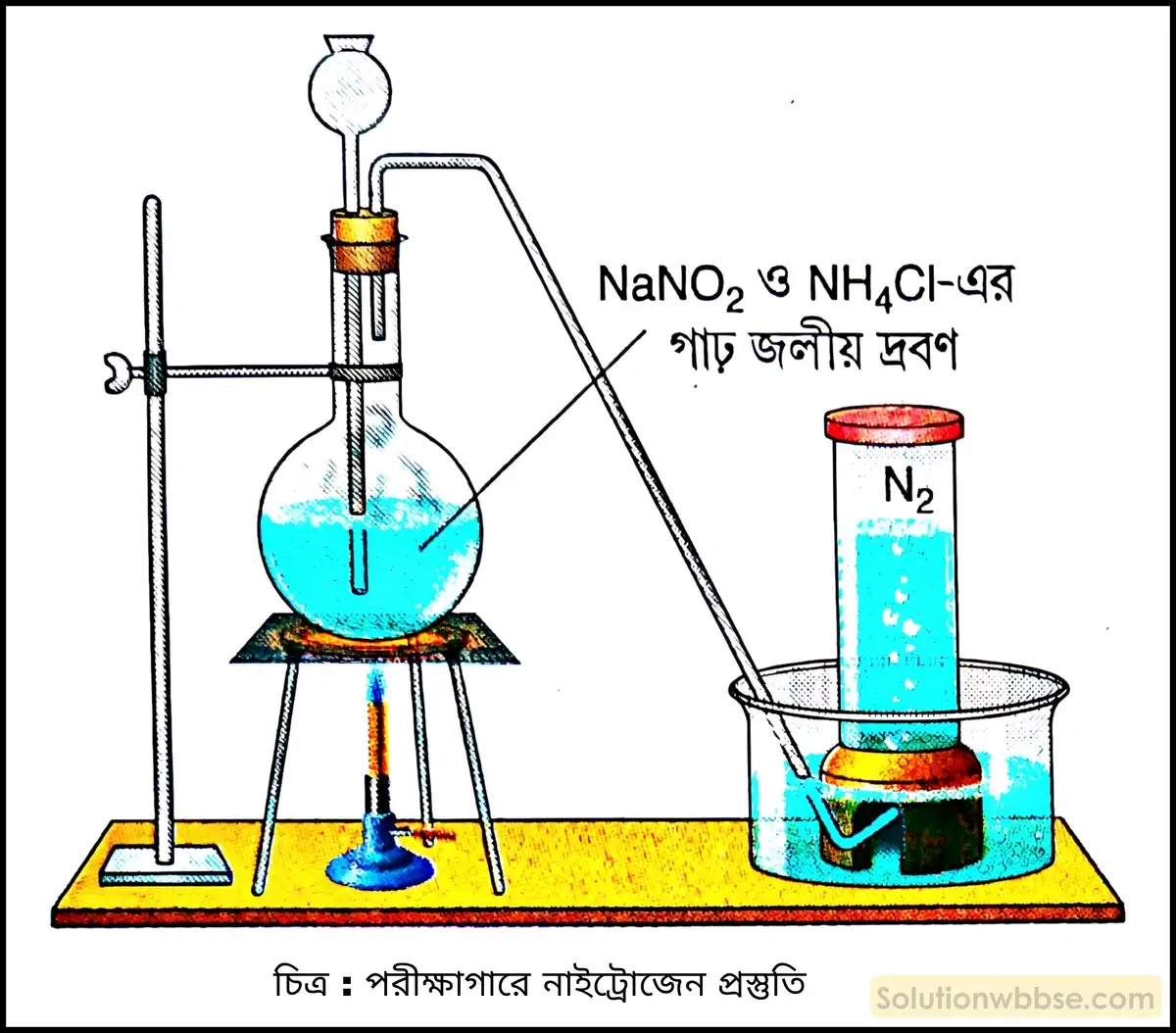
বিক্রিয়াটি দুটি ধাপে ঘটে-
1. প্রথম ধাপে সোডিয়াম নাইট্রাইট ও অ্যামোনিয়াম ক্লোরাইডের বিক্রিয়ায় সোডিয়াম ক্লোরাইড ও অ্যামোনিয়াম নাইট্রাইট উৎপন্ন হয়।
NaNO2 + NH4Cl → NH4NO2 + NaCl
2. অ্যামোনিয়াম নাইট্রাইট উৎপন্ন হওয়ামাত্রই তাপে বিয়োজিত হয়ে নাইট্রোজেন উৎপন্ন করে।
NH4NO2 → N2↑ + 2H2O
পরীক্ষাগারে উৎপন্ন নাইট্রোজেনে অশুদ্ধি হিসেবে কী কী মিশে থাকে? অশুদ্ধিগুলিকে কীভাবে অপসারিত করা যায়?
পরীক্ষাগারে উৎপন্ন নাইট্রোজেনে অশুদ্ধি হিসেবে সামান্য পরিমাণ ক্লোরিন, অ্যামোনিয়া, নাইট্রোজেনের বিভিন্ন অক্সাইড ও জলীয় বাষ্প মিশে থাকে।
নাইট্রোজেনে উপস্থিত অশুদ্ধিগুলিকে নিম্নরূপে অপসারিত করা যায় –
- গ্যাসটিকে প্রথমে গাঢ় কস্টিক সোডার (NaOH) দ্রবণের মধ্য দিয়ে চালনা করে Cl2 অপসারণ করা হয়।
- এরপর গ্যাসটিকে গাঢ় H2SO4 -এর মধ্য দিয়ে চালনা করলে NH3 গ্যাস ও জলীয় বাষ্প অপসারিত হয়।
- সবশেষে গ্যাসটিকে উত্তপ্ত কপার কুচির ওপর দিয়ে চালনা করলে নাইট্রোজেনের বিভিন্ন অক্সাইডগুলি বিজারিত হয়ে N2 -তে পরিণত হয়।
2NO +2Cu → N2 + 2CuO,
N2O + Cu → N2 + CuO
নির্গত বিশুদ্ধ ও শুষ্ক N2 গ্যাসকে পারদের নিম্ন অপসারণ দ্বারা সংগ্রহ করা হয়।
বায়ু থেকে কীভাবে নাইট্রোজেন গ্যাস প্রস্তুত করা যায়?
বায়ুতে প্রায় 78% নাইট্রোজেন, 21% অক্সিজেন, স্বল্প পরিমাণ CO2 ও জলীয় বাষ্প থাকে। এছাড়া বায়ুতে খুব সামান্য পরিমাণে হিলিয়াম, নিয়ন, আর্গন, ক্রিপ্টন প্রভৃতি নিষ্ক্রিয় গ্যাস এবং SO2, NH3 প্রভৃতি উপস্থিত থাকে। প্রথমে বায়ুকে গাঢ় KOH দ্রবণের মধ্য দিয়ে চালনা করে CO2 ও SO2 এবং পরে গাঢ় H2SO4 -এর মধ্য দিয়ে চালনা করে NH3 ও জলীয় বাষ্প দূর করা হয়। এরপর দহন নলে রাখা উত্তপ্ত কপার কুচির ওপর দিয়ে চালনা করলে অক্সিজেন, কপার অক্সাইড গঠন করে। অপসারিত হয় এবং নাইট্রোজেন গ্যাস পাওয়া যায়।
নাইট্রোজেনের কয়েকটি উল্লেখযোগ্য ব্যবহার লেখো।
নাইট্রোজেনের কয়েকটি উল্লেখযোগ্য ব্যবহার নিম্নরূপ –
- বায়ুমণ্ডলের নাইট্রোজেনকে অ্যামোনিয়া ও নাইট্রিক অ্যাসিডের শিল্পোৎপাদনে ব্যবহার করা হয়।
- বিভিন্ন নাইট্রোজেন-ঘটিত সার, যেমন – অ্যামোনিয়াম সালফেট, অ্যামোনিয়াম নাইট্রেট, ইউরিয়া, নাইট্রোলিম ইত্যাদি প্রস্তুতিতে নাইট্রোজেন ব্যবহৃত হয়।
- রাসায়নিক বিক্রিয়ায় নিষ্ক্রিয় পরিমণ্ডল সৃষ্টি করতে নাইট্রোজেন ব্যবহৃত হয়।
- গ্যাস থার্মোমিটার প্রস্তুত করতে এবং বৈদ্যুতিক বালব ও টিউবে নাইট্রোজেন ব্যবহৃত হয়।
- নিম্ন উষ্ণতা সৃষ্টি করতে তরল নাইট্রোজেন (স্ফুটনাঙ্ক -195.8°C) প্রচুর পরিমাণে ব্যবহৃত হয়।
লোহিততপ্ত অথবা জ্বলন্ত Mg -ফিতা N2 -পূর্ণ গ্যাসজারে প্রবেশ করালে কী ঘটবে সমীকরণসহ লেখো। উৎপন্ন পদার্থের আর্দ্রবিশ্লেষণ করলে কী উৎপন্ন হবে?
লোহিততপ্ত অথবা জ্বলন্ত Mg -ফিতা N2 পূর্ণ গ্যাসজারে প্রবেশ করালে তা উজ্জ্বল শিখায় জ্বলতে থাকে এবং হলুদ আভাযুক্ত ম্যাগনেশিয়াম নাইট্রাইডের গুঁড়ো পাওয়া যায়।
ম্যাগনেশিয়াম নাইট্রাইডকে জল সহযোগে ফোটালে এটি আর্দ্রবিশ্লেষিত হয়ে ম্যাগনেশিয়াম হাইড্রক্সাইড ও বিশিষ্ট ঝাঁজালো গন্ধযুক্ত অ্যামোনিয়া গ্যাস উৎপন্ন করবে।
প্রাকৃতিক উপায়ে বাতাসের মুক্ত N2 -এর যৌগে আবদ্ধ হওয়ার প্রক্রিয়াটি ব্যাখ্যা করো।
অথবা, বর্ষাকালে বজ্রপাত ও আকাশে উচ্চমাত্রার তড়িৎ-ক্ষরণ উদ্ভিদকূলের জন্য উপকারী-ব্যাখ্যা করো।
বর্ষাকালে বজ্রপাত ও আকাশে উচ্চমাত্রার তড়িৎ-ক্ষরণের সময় বায়ুর অক্সিজেন ও নাইট্রোজেন রাসায়নিকভাবে যুক্ত হয়ে নাইট্রিক অক্সাইড (NO) গঠন করে।
এই নাইট্রিক অক্সাইড বাতাসের O2 দ্বারা জারিত হয়ে নাইট্রোজেন ডাইঅক্সাইড (NO2) -তে পরিণত হয়।
2NO + O2 → 2NO2
উৎপন্ন NO2 বৃষ্টির জলের সঙ্গে বিক্রিয়া করে নাইট্রাস অ্যাসিড (HNO2) ও নাইট্রিক অ্যাসিড (HNO3) -এ পরিণত হয়, যা বৃষ্টির জলের সাথে মাটিতে নেমে আসে।
2NO2 + H2O → HNO3 + HNO2
HNO3 মাটিতে উপস্থিত ক্যালশিয়াম কার্বনেট, সোডিয়াম কার্বনেট ইত্যাদি ক্ষারকীয় পদার্থের সঙ্গে বিক্রিয়া করে জলে দ্রাব্য নাইট্রেট লবণ গঠন করে। উদ্ভিদ এই লবণগুলি গ্রহণ করে প্রোটিন সংশ্লেষে কাজে লাগায়।
সুতরাং বর্ষাকালে বজ্রপাত ও আকাশে উচ্চমাত্রার তড়িৎক্ষরণ উদ্ভিদকূলের জন্য উপকারী।
ট্রামগাড়ির পেন্টোগ্রাফ ও তড়িৎ পরিবাহী তারের মধ্যে সংযোগ বিচ্ছিন্ন হওয়ার সময় সামান্য বাদামি বর্ণের ধোঁয়ার সৃষ্টি হয় কেন?
ট্রামগাড়ির পেন্টোগ্রাফ এবং তড়িৎ পরিবাহী তারের মধ্যে সংযোগ বিচ্ছিন্ন হওয়ার সময় যে বিদ্যুৎ-স্ফুলিঙ্গের সৃষ্টি হয় তাতে উৎপন্ন উচ্চ তাপমাত্রায় বায়ুর N2 ও O2 গ্যাস যুক্ত হয়ে নাইট্রিক অক্সাইড (NO) উৎপন্ন হয়। উৎপন্ন NO বায়ুর অক্সিজেন দ্বারা জারিত হয়ে বাদামি বর্ণের NO2 গ্যাস উৎপন্ন করে। ফলে বাদামি ধোঁয়ার সৃষ্টি হয়।
ম্যাগনেশিয়ামের সঙ্গে একটি বর্ণহীন, গন্ধহীন গ্যাস, A -এর বিক্রিয়ায় B যৌগ উৎপন্ন হয়। B -যৌগকে জল দিয়ে ফোটালে ঝাঁজালো গন্ধবিশিষ্ট C গ্যাস উৎপন্ন হয় যা HCl সিক্ত কাচদন্ডের সংস্পর্শে ঘন সাদা ধোঁয়া D উৎপন্ন করে। A, B, C ও D -কে শনাক্ত করো। বিক্রিয়াগুলির সমীকরণ দাও।
- A – নাইট্রোজেন (N2),
- B – ম্যাগনেশিয়াম নাইট্রাইড (Mg3N2),
- C – অ্যামোনিয়া (NH3),
- D – অ্যামোনিয়াম ক্লোরাইড (NH4Cl)
বিক্রিয়া –
- 3Mg + N2 → Mg3N2
- Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
- NH3 + HCl → NH4Cl
হাইড্রোক্লোরিক অ্যাসিডের শিল্পোৎপাদন পদ্ধতি সংক্ষেপে বর্ণনা করো।
হাইড্রোক্লোরিক অ্যাসিডের শিল্পোৎপাদন পদ্ধতি – বর্তমানে আধুনিক সংশ্লেষণ পদ্ধতি দ্বারা হাইড্রোক্লোরিক অ্যাসিডের শিল্পোৎপাদন করা হয়। শিল্পোৎপাদন পদ্ধতিটি নিম্নলিখিত ধাপগুলির মাধ্যমে সম্পন্ন হয় –
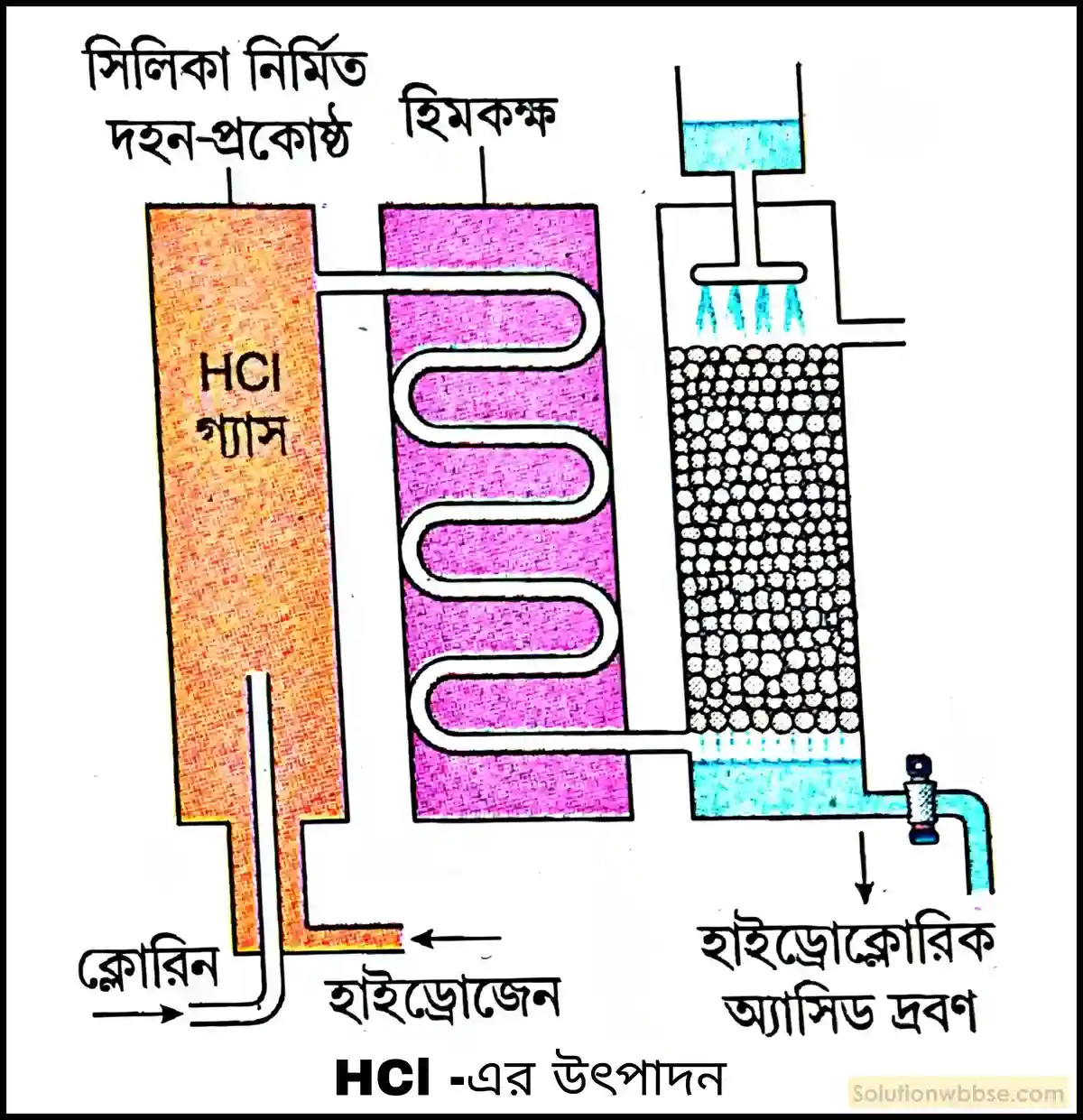
- প্রায় সমান আয়তনের হাইড্রোজেন ও ক্লোরিন গ্যাসের মিশ্রণ একটি সিলিকানির্মিত দহন-প্রকোষ্ঠের মধ্যে দহন করা হয়। দহনের ফলে H2 ও Cl2 পরস্পর যুক্ত হয়ে HCl গ্যাস উৎপন্ন করে – H2(g) + Cl2(g) → HCl(g)।
- উৎপন্ন HCl গ্যাসকে কুণ্ডলীকৃত নলের মাধ্যমে হিমকক্ষের মধ্য দিয়ে চালনা করে শীতল করা হয়।
- শীতল HCl গ্যাসকে জলে শোষিত করে হাইড্রোক্লোরিক অ্যাসিডের সম্পৃক্ত দ্রবণ প্রস্তুত করা হয়।
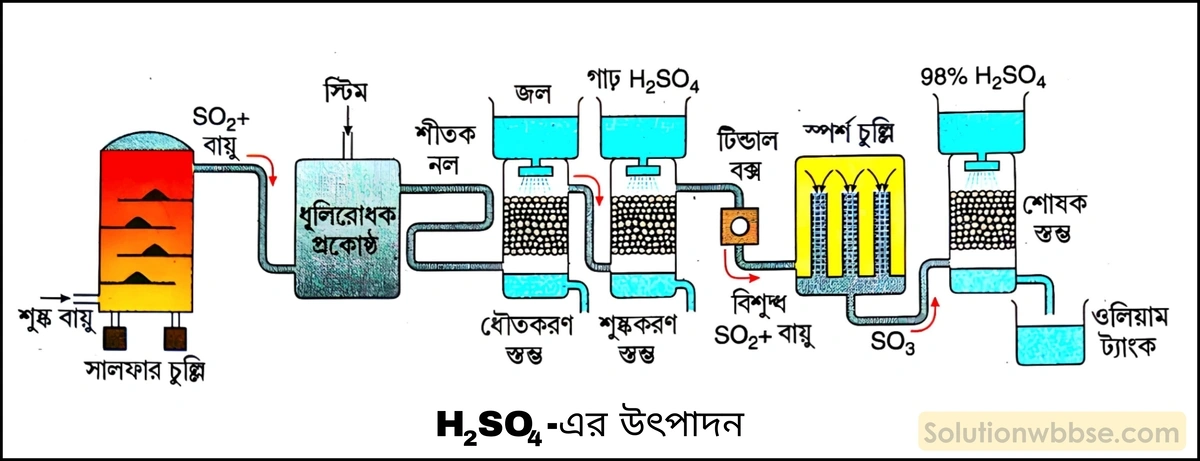
স্পর্শ পদ্ধতিতে সালফিউরিক অ্যাসিড প্রস্তুতির নীতি ও প্রতিটি ধাপের রাসায়নিক সমীকরণ দাও।
স্পর্শ পদ্ধতিতে সালফিউরিক অ্যাসিড প্রস্তুতি –
1. সালফার বা আয়রন পাইরাইট্স্ (FeS2) -কে অতিরিক্ত বায়ুতে পুড়িয়ে সালফার ডাইঅক্সাইড (SO2) গ্যাস প্রস্তুত করা হয়।
S(s) + O2(g) → SO2(g)
4FeS2(s) +11O2(g) → 2Fe2O3(s) +8SO2(g)
2. উৎপন্ন SO2 গ্যাসকে বিশুদ্ধ ও শুদ্ধ করে ধূলিকণামুক্ত অতিরিক্ত বায়ুর সাথে মিশিয়ে 450°C উষ্ণতায় ও 1.5 বায়ুমণ্ডলীয় চাপে, উত্তপ্ত প্ল্যাটিনাম চূর্ণাবৃত অ্যাসবেসটস্ বা ভ্যানাডিয়াম পেন্টক্সাইড (V2O5) অনুঘটকের ওপর দিয়ে চালনা করা হয়। এর ফলে SO2 গ্যাস বায়ুর O2 দ্বারা জারিত হয়ে সালফার ট্রাইঅক্সাইড (SO3) -এ পরিণত হয়। বিক্রিয়াটি তাপমোচী ও উভমুখী।
2SO2(g) + O2(g) ⇌ 2SO3(g) + 45 kcal
3. উৎপন্ন SO2 গ্যাসকে ঠান্ডা করে একটি কোকখণ্ড পূর্ণ শোষক স্তম্ভে 98% গাঢ় H2SO4 দ্বারা শোষণ করানো হয়। এর ফলে পাইরোসালফিউরিক অ্যাসিড (H2S2O7) বা ওলিয়াম উৎপন্ন হয়। লেডের আস্তরণযুক্ত ট্যাংকে ওলিয়ামকে সংগ্রহ করা হয়।
SO3(g) + H2SO4(l) → H2S2O7(l)
4. পরবর্তী ধাপে ওলিয়ামের সঙ্গে পরিমাণমতো পাতিত জল মিশিয়ে 98% গাঢ় H2SO4 প্রস্তুত করা হয়।
H2S2O7(l) + H2O(l) → 2H2SO4(l)
স্পর্শ পদ্ধতিতে H2SO4 প্রস্তুতির সময় SO3 -কে সরাসরি জলে দ্রবীভূত করে H2SO4 প্রস্তুত করা হয় না কেন?
সালফার ট্রাইঅক্সাইড (SO3) -কে সরাসরি জলে দ্রবীভূত করে H2SO4 উৎপন্ন করা যায়। কিন্তু এই প্রক্রিয়ায় কতকগুলি অসুবিধার সম্মুখীন হতে হয় –
- SO3 জলের সাথে দ্রুত বিক্রিয়া করে এবং তাপদায়ী বিক্রিয়ার ফলে প্রচুর তাপ উৎপন্ন হয়। উৎপন্ন তাপের প্রভাবে জলে SO3 -এর দ্রাব্যতা কমে যায়, ফলে বেশিরভাগ SO3 অণুই জলে শোষিত না হয়ে শোষক স্তম্ভ থেকে বেরিয়ে যায়।
- উৎপন্ন তাপের প্রভাবে জলীয় বাষ্প ও সালফিউরিক অ্যাসিডের ছোটো ছোটো কণা একত্রিত হয়ে একরকম ঘন সাদা কুয়াশার সৃষ্টি করে এবং একে ঘনীভূত করা সহজসাধ্য নয়।
- এছাড়া, তাপের প্রভাবে উৎপন্ন H2SO4 -এর কিছু অংশ বিয়োজিত হয়ে পুনরায় SO3 ও O2 উৎপন্ন করে। এর ফলে H2SO4 -এর উৎপাদন কমে যায়।
এইসব কারণে SO3 -কে সরাসরি জলে দ্রবীভূত করে H2SO4 প্রস্তুত করা হয় না।
অস্ওয়াল্ড পদ্ধতিতে নাইট্রিক অ্যাসিডের শিল্পপ্রস্তুতির নীতি ও রাসায়নিক সমীকরণ লেখো।
জার্মান বিজ্ঞানী অস্ওয়াল্ড (1902) বায়ুর O2 -এর সাহায্যে অ্যামোনিয়ার অনুঘটকীয় জারণের দ্বারা নাইট্রিক অ্যাসিডের শিল্পপ্রস্তুতির উপায় উদ্ভাবন করেন। এই পদ্ধতির বিভিন্ন ধাপগুলি নিম্নরূপ –
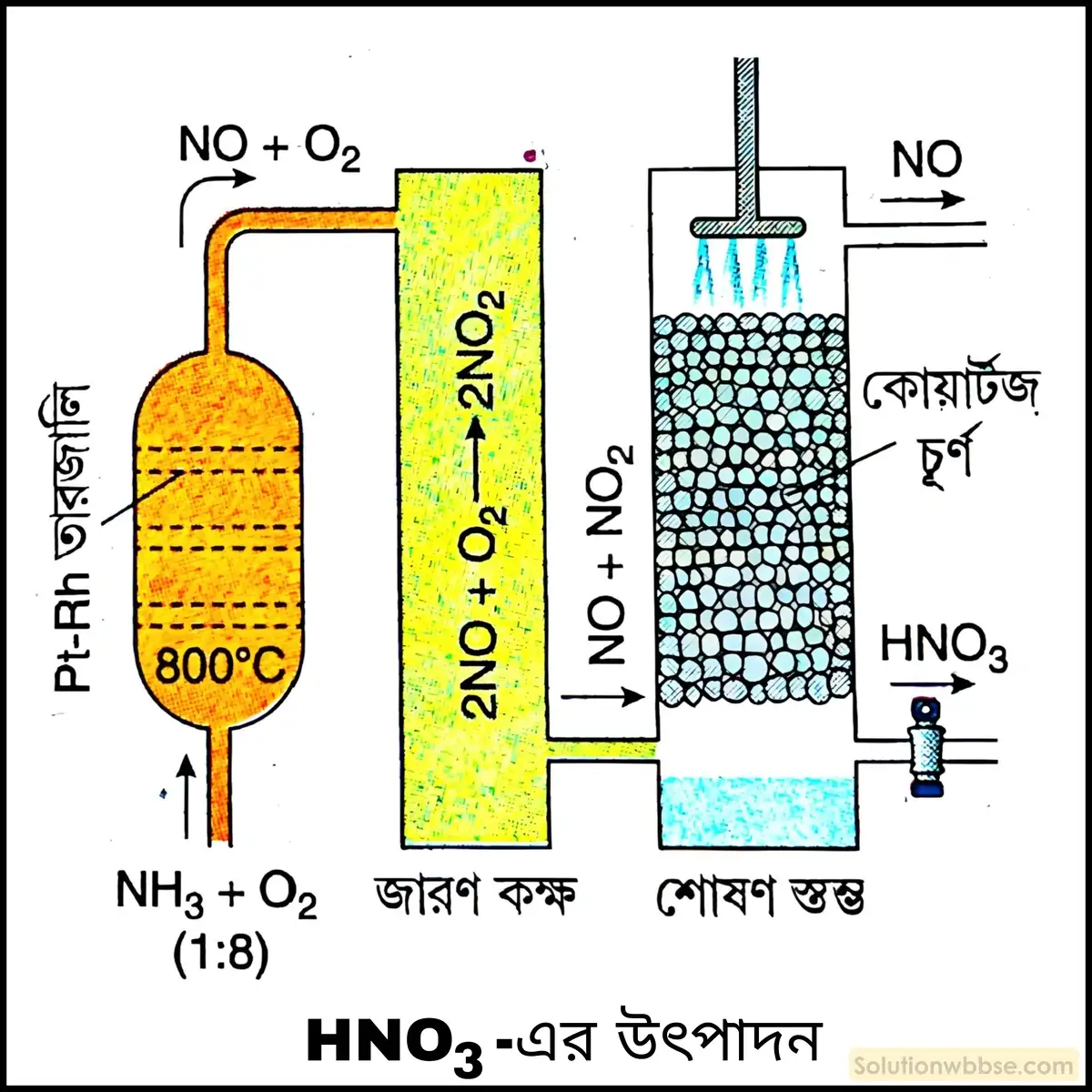
প্রথম ধাপ – শুষ্ক ও বিশুদ্ধ অ্যামোনিয়া এবং ধূলিকণামুক্ত বায়ুর মিশ্রণকে (1 : 7.5 আয়তন অনুপাতে) 5-7 বায়ুমণ্ডলীয় চাপে ও 700-800°C উষ্ণতায় উত্তপ্ত প্ল্যাটিনাম বা প্ল্যাটিনাম-রোডিয়াম (Pt-Rh) ধাতুসংকর নির্মিত তারজালির মধ্য দিয়ে অতিদ্রুত প্রবাহিত করা হয়। অনুঘটক ও গ্যাস মিশ্রণের সংস্পর্শকাল 0.0014 সেকেন্ডের বেশি হওয়া বাঞ্ছনীয় নয়। এর ফলে অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড (NO) -এ পরিণত হয়। বিক্রিয়াটি উভমুখী ও তাপ উৎপাদক।
4NH3(g) + 5O2(g) ⇌ 4NO(g) + 6H2O + 216 kcal
দ্বিতীয় ধাপ – উৎপন্ন গ্যাস মিশ্রণকে ঠান্ডা করে (50°C -এ এনে) বায়ুর O2 দ্বারা নাইট্রিক অক্সাইডকে জারিত করে নাইট্রোজেন ডাইঅক্সাইড (NO2) উৎপন্ন করা হয়।
2NO(g) + O2(g) ⇌ 2NO2(g) +27.2 kcal
তৃতীয় ধাপ – উৎপন্ন NO2 গ্যাসকে জলে শোষণ করলে HNO3 উৎপন্ন হয়। প্রাপ্ত প্রায় 50% HNO3 -কে 120°C উষ্ণতায় উত্তপ্ত করে গাঢ় H2SO4 -সহ পাতিত করলে 98% HNO3 পাওয়া যায়।
3NO2(g) + H2O(l) ⇌ 2HNO3(aq) + NO(g)
নির্গত NO -কে পুনরায় HNO3 উৎপাদনে ব্যবহার করা যায়।
হেবার পদ্ধতিতে অ্যামোনিয়া, স্পর্শ পদ্ধতিতে H2SO4 ও অস্ওয়াল্ড পদ্ধতিতে HNO3 প্রস্তুতির সময় কোন্ কোন্ অনুঘটক কী কী ভৌত অবস্থায় ব্যবহার করা হয়? অনুঘটকগুলিকে এরূপভাবে ব্যবহারের কারণ কী?
হেবার পদ্ধতিতে অ্যামোনিয়া উৎপাদনে আয়রন (Fe) চূর্ণ অনুঘটকরূপে ব্যবহার করা হয়। স্পর্শ পদ্ধতিতে H2SO4 উৎপাদনে প্ল্যাটিনাম চূর্ণাবৃত অ্যাসবেসটস্ বা ভ্যানাডিয়াম পেন্টক্সাইড (V2O5) চূর্ণ অনুঘটকরূপে ব্যবহার করা হয়। অস্ওয়াল্ড পদ্ধতিতে HNO3 প্রস্তুতিতে প্ল্যাটিনাম ধাতু বা প্ল্যাটিনাম-রোডিয়াম (Pt-Rh) সংকর ধাতুর তৈরি তারজালি অনুঘটকরূপে ব্যবহৃত হয়।
প্রতিটি ক্ষেত্রেই গ্যাসীয় বিক্রিয়কগুলি কঠিন অনুঘটকের উপস্থিতিতে বিক্রিয়া করে এবং অনুঘটকগুলিকে চূর্ণ অবস্থায় ব্যবহার করে পৃষ্ঠতলের পরিমাণ বৃদ্ধি করা হয়। এরূপভাবে অনুঘটক ব্যবহারের কারণ নিম্নরূপ –
কঠিন অনুঘটকের উপস্থিতিতে কোনো গ্যাসীয় বিক্রিয়া সংঘটনকালে বিক্রিয়ক অণুগুলি অনুঘটকের পৃষ্ঠতলে অধিশোষিত হয়। এরূপ অধিশোষণের ফলে বিক্রিয়ক অণুগুলির মধ্যে বিক্রিয়াপথ সুগম হয়। অনুঘটকের পৃষ্ঠতলের ক্ষেত্রফল যত বেশি হবে তত বেশি সংখ্যক বিক্রিয়ক অণু অধিশোষিত হতে পারবে, ফলে বিক্রিয়ার হার বৃদ্ধি পাবে।
বিচূর্ণ কঠিন অনুঘটকের উপস্থিতিতে গ্যাসীয় বিক্রিয়ার হার বৃদ্ধি পায় কেন?
গ্যাসীয় বিক্রিয়ক পদার্থের অণুগুলি যখন কঠিন অনুঘটকের পৃষ্ঠতলের সংস্পর্শে আসে তখন অনুঘটকের পৃষ্ঠতলে উপস্থিত পরমাণুগুলির সঙ্গে বিক্রিয়কের অণু বা পরমাণুগুলির একপ্রকার দুর্বল রাসায়নিক বন্ধনের সৃষ্টি হয়। এইভাবে বিক্রিয়কের অণু বা পরমাণুগুলি কঠিন অনুঘটকের পৃষ্ঠতলে একটি স্তর সৃষ্টি করে শোষিত অবস্থায় থাকে। এই প্রক্রিয়াকে রাসায়নিক অধিশোষণ বলা হয়। রাসায়নিক অধিশোষণের ফলে বিক্রিয়ক গ্যাসীয় অণু-গুলির মধ্যে বিক্রিয়া সহজে সংঘটিত হয় ও বিক্রিয়া-হার বাড়ে।
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায়ের ‘পদার্থের ভৌত রাসায়নিক ধর্মসমূহ‘ থেকে ‘পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ন’ এর কিছু দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করুন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






মন্তব্য করুন