আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ’ থেকে পর্যায়-সারণি এবং মৌলদের ধর্মের পর্যাবৃত্ততা এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও প্রতিযোগিতামূলক পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

ডোবেরিনারের ত্রয়ী সূত্রটি কী? মৌলের শ্রেণিবিন্যাসে এই সূত্রটি বিশেষ সহায়ক হয়নি কেন?
ডোবেরিনারের ত্রয়ী সূত্র (1817) – রাসায়নিক ধর্মে সাদৃশ্য আছে এমন তিনটি করে মৌলকে পারমাণবিক ভরের ক্রমানুযায়ী সাজিয়ে এক-একটি শ্রেণি গঠন করলে মাঝের মৌলটির পারমাণবিক ভর মোটামুটিভাবে অন্য দুটির পারমাণবিক ভরের গড় মানের সমান হয়।
উদাহরণ – Li(7), Na(23), K(39) রাসায়নিকভাবে সদৃশ তিনটি মৌলের মধ্যে সোডিয়ামের পারমাণবিক গুরুত্ব = \(\frac{7+39}2\) = 23।

ত্রয়ী সূত্রের প্রয়োগ মাত্র কয়েকটি মৌলের ক্ষেত্রে সীমাবদ্ধ ছিল, সমস্ত মৌলের ক্ষেত্রে এই সূত্র প্রয়োগ করা যায় না। তাই মৌলের শ্রেণিবিন্যাসে এই সূত্র বিশেষ সহায়ক হয়নি।
মৌলের শ্রেণিবিন্যাসে বিজ্ঞানী লোথার মেয়ারের অবদান মূল্যায়ন করো।
জার্মান বিজ্ঞানী লোথার মেয়ার (1870) মৌলসমূহের পারমাণবিক গুরুত্বের সঙ্গে বিভিন্ন ভৌতধর্মের (যেমন – পারমাণবিক আয়তন, গলনাঙ্ক, স্ফুটনাঙ্ক ইত্যাদি) পর্যাবৃত্তি সম্পর্কে গবেষণা করেন। তিনি স্বতন্ত্রভাবে একটি পর্যায়-সূত্র প্রকাশ করেছিলেন যা মেন্ডেলিফের পর্যায়-সূত্রের অনুরূপ।

মেন্ডেলিফ ও লোথার মেয়ার দুজনেই পর্যায়-সূত্রের বিষয়ে গবেষণার জন্য স্বীকৃতি পেলেও মেন্ডেলিফের সূত্রটি সামান্য আগে প্রকাশিত হওয়ায় পর্যায়-সূত্রের সঙ্গে মেন্ডেলিফের নামই সচরাচর উচ্চারিত হয়। কিন্তু মৌলের পর্যাবৃত্তি সম্পর্কে ধারণা প্রদান এবং পর্যাবৃত্তি অনুসারে মৌলের শ্রেণিবিভাগের ক্ষেত্রে লোথার মেয়ারের অবদান অনস্বীকার্য।
মেন্ডেলিফের পর্যায়-সারণি কীভাবে মৌলের সুশৃঙ্খল শ্রেণিবিন্যাসে সহায়ক হয়েছিল? উদাহরণ দাও।
পর্যায়-সারণির একটি নির্দিষ্ট শ্রেণির একই উপশ্রেণির অন্তর্গত মৌলসমূহ ও তাদের অনুরূপ যৌগগুলির রাসায়নিক ধর্মে সাদৃশ্য লক্ষ করা যায়। কোনো শ্রেণির অন্তর্গত কোনো উপশ্রেণিভুক্ত একটি মৌল ও ওই মৌলের বিভিন্ন যৌগের ধর্মাবলি জানা থাকলে, ওই উপশ্রেণিভুক্ত অন্যান্য মৌলসমূহ ও তাদের অনুরূপ যৌগগুলির বিভিন্ন ধর্ম সম্পর্কে একটি নির্দিষ্ট ধারণা পাওয়া যায়। এর ফলে রাসায়নচর্চা অনেক সহজ, সরল ও সংক্ষিপ্ত হয়েছে।

যেমন – IA শ্রেণির (1 নং) অন্তর্ভুক্ত সোডিয়াম (Na) ও তার যৌগগুলির ধর্ম জানা থাকলে ওই শ্রেণির অন্যান্য মৌল পটাশিয়াম (K), রুবিডিয়াম (Rb) ও সিজিয়াম (Cs) এবং ওদের সংশ্লিষ্ট যৌগগুলির ধর্ম সম্পর্কে সহজেই ধারণা করা যায়।
মেন্ডেলিফের পর্যায়-সারণি কীভাবে নতুন মৌল আবিষ্কারের প্রেরণা যুগিয়েছিল? উদাহরণ দাও।
মেন্ডেলিফ পর্যায়-সারণি প্রস্তুতির সময় অনাবিষ্কৃত কিছু মৌলের জন্য পর্যায়-সারণিতে কয়েকটি স্থান ফাঁকা রেখেছিলেন। অনাবিষ্কৃত এইসব মৌল সম্পর্কে তিনি ভবিষ্যদবাণী করেছিলেন। এই ফাঁকা স্থানগুলি বৈজ্ঞানিকদের নতুন নতুন মৌল আবিষ্কারের প্রেরণা জুগিয়েছিল। যেমন – মেন্ডেলিফ একা-বোরন, একা-অ্যালুমিনিয়াম ও একা-সিলিকন নামে মৌলগুলির অস্তিত্ব ও তাদের বিভিন্ন ধর্ম সম্পর্কে ভবিষ্যদবাণী করেছিলেন। তাঁর জীবদ্দশাতেই এই মৌলগুলি আবিষ্কৃত হয় এবং এদের নাম দেওয়া হয়েছে যথাক্রমে স্ক্যান্ডিয়াম \( \left({}_{21}Sc\right) \), গ্যালিয়াম \( \left({}_{31}Ga\right) \) ও জার্মেনিয়াম \( \left({}_{32}Ge\right) \)। আশ্চর্যজনকভাবে মেন্ডেলিফের করা ভবিষ্যদবাণীর সঙ্গে এই মৌলগুলির ধর্ম প্রায় অক্ষরে অক্ষরে মিলে যায়।
মেন্ডেলিফের পর্যায়-সারণি কীভাবে মৌলের যোজ্যতা ও সন্দেহজনক পারমাণবিক গুরুত্বের সংশোধনে সহায়ক হয়েছিল? উদাহরণের সাহায্যে বুঝিয়ে দাও।
পর্যায়-সারণির সাহায্যে কয়েকটি মৌলের সঠিক যোজ্যতা নির্ণয় এবং সন্দেহজনক পারমাণবিক গুরুত্ব সংশোধন করা সম্ভব হয়েছে।
যেমন – মেন্ডেলিফের সময় বেরিলিয়াম \( (Be) \) -এর নির্ণীত পারমাণবিক গুরুত্ব সঠিক ছিল না। অ্যালুমিনিয়ামের সাথে বেরিলিয়ামের ধর্মের সাদৃশ্য দেখে ধারণা করা হয়েছিল যে অ্যালুমিনিয়ামের মতো বেরিলিয়ামেরও যোজ্যতা 3। \( Be \) -এর যোজ্যতা 3 ধরে এর পারমাণবিক গুরুত্ব নির্ণয় করা হয়েছিল 13.5। কিন্তু 13.5 পারমাণবিক গুরুত্ববিশিষ্ট মৌলের জন্য পর্যায়-সারণির \( IIIA \) শ্রেণিতে কোনো স্থান খালি না থাকায় মেন্ডেলিফ \( Be \) -কে \( IIA \) শ্রেণিতে স্থাপন করেন ও সংশোধিত যোজ্যতাকে 2 ধরেন। এর ফলে \( Be \) -এর পারমাণবিক গুরুত্ব সংশোধিত হয় ও তার মান নির্ণীত হয় 9।
মেন্ডেলিফের পর্যায়-সারণি কীভাবে পরমাণুর গঠন ও ইলেকট্রন-বিন্যাস সম্পর্কে ধারণা প্রদানের সহায়ক হয়েছিল?
পর্যায়-সারণির একই শ্রেণির একই উপশ্রেণির অন্তর্গত মৌলগুলির রাসায়নিক ধর্ম একই প্রকারের হয়। আবার, একই রাসায়নিক ধর্মসম্পন্ন মৌলগুলির সর্ববহিস্থ কক্ষের ইলেকট্রন-বিন্যাসও অনুরূপ হয়ে থাকে। তাই একই শ্রেণির মৌলগুলির পরমাণুর ইলেকট্রন-বিন্যাস মোটামুটিভাবে একইরকম হয়। এর ফলে কোনো শ্রেণির 1টি মৌলের ইলেকট্রন-বিন্যাস জানা থাকলে ওই শ্রেণির অন্যান্য মৌলগুলির ইলেকট্রন-বিন্যাস সম্পর্কে সহজেই ধারণা পাওয়া যায়। আবার, ইলেকট্রন-বিন্যাস সম্পর্কে ধারণা পাওয়া গেলে পরমাণুর গঠন সম্পর্কেও অনুমান করা যায়।
মেন্ডেলিফের পর্যায়-সারণি কীভাবে মৌলের ভৌত ও রাসায়নিক ধর্ম সম্পর্কে ধারণা প্রদান করতে সাহায্য করে?
পর্যায়-সারণিতে শ্রেণি বরাবর বা পর্যায় বরাবর মৌলের ভৌত ও রাসায়নিক ধর্মগুলি সুনির্দিষ্ট কারণ মেনেই পরিবর্তিত হয়। পর্যায়-সারণির সম্যক ধারণা থাকলে, পর্যায়-সারণিতে কোনো মৌলের অবস্থান এবং ওই মৌলের বিভিন্ন ভৌত ও রাসায়নিক ধর্ম (যেমন – পরমাণুর আকার, গলনাঙ্ক, স্ফুটনাঙ্ক, ঘনত্ব, বিভিন্ন যৌগের প্রকৃতি, জারণ বা বিজারণ ক্ষমতা ইত্যাদি) সম্পর্কে জানা যায়।
মেন্ডেলিফের পর্যায়-সারণিতে উপশ্রেণির প্রয়োজন হয়েছিল কেন?
মেন্ডেলিফ মৌলগুলিকে ক্রমবর্ধমান পারমাণবিক গুরুত্ব অনুসারে সাজানোর সময় সমধর্মসম্পন্ন মৌলগুলিকে একই শ্রেণিতে অন্তর্ভুক্ত করার পদ্ধতি অনুসরণ করেছিলেন। কোনো একটি শ্রেণির অন্তর্ভুক্ত মৌলসমূহের ধর্মাবলি একই রকমের হবে বলে প্রত্যাশা করা হয়েছিল। কিন্তু বাস্তবে দেখা গেল 0 (শূন্য) এবং \( VIII \) শ্রেণি ছাড়া অন্যান্য শ্রেণির মৌলগুলির ধর্মগত যথেষ্ট সাদৃশ্য না থাকা সত্ত্বেও কোনো কোনো মৌলকে ভিন্নধর্মী অন্য মৌলসমূহের সাথে একই শ্রেণিতে স্থান দেওয়া হয়েছে। এই অসামঞ্জস্য দূর করার জন্য \( I \) থেকে \( VII \) নং শ্রেণিগুলির প্রত্যেকটিকে \( A \) ও \( B \) এই দুটি করে উপশ্রেণিতে ভাগ করা হয়। একই শ্রেণির অন্তর্ভুক্ত একই উপশ্রেণির মৌলগুলি সমধর্মী হয় কিন্তু একই শ্রেণিভুক্ত ভিন্ন উপশ্রেণির মৌলগুলি সমধর্মী হয় না।
যেমন – \( IA \) -তে অবস্থিত \( Li,\;Na,\;K,\;Rb,\;Cs \) ইত্যাদি মৌল সমধর্মী কিন্তু এরা \( IB \) শ্রেণির \( Cu,\;Ag,\;Au \) ইত্যাদি মৌলের সমধর্মী নয়।
মেন্ডেলিফের পর্যায়-সারণিতে VIII শ্রেণির প্রতিটি ঘরে 3টি করে মৌল রাখা হয়েছে কেন? এদের কোন্ বিশেষ নাম দেওয়া হয়েছে?
মেন্ডেলিফের পর্যায়-সারণিতে যাতে একইরকম ধর্মবিশিষ্ট মৌলগুলি একই শ্রেণিতে অবস্থান করে সেই দিকে লক্ষ রাখা হয়েছিল। পর্যায়-সারণির চতুর্থ, পঞ্চম ও ষষ্ঠ পর্যায়ের \( VIII \) শ্রেণির প্রতিটি ঘরে তিনটি করে মৌল যথাক্রমে \( \left(Fe,\;Co,\;Ni\right) \), \( \left(Ru,\;Rh,\;Pd\right) \) ও \( \left(Os,\;Ir,\;Pt\right) \) রাখা হয়েছে। কারণ এদের ধর্মগত সাদৃশ্য খুব বেশি ও পারমাণবিক ভর খুব কাছাকাছি।
\( VIII \) শ্রেণির প্রতিটি পর্যায়ে স্থাপিত তিনটি করে মৌলের গুচ্ছকে মেন্ডেলিফের ত্রয়ী মৌল বলা হয়।
কোনো মৌলের সমস্থানিকগুলিকে পর্যায়-সারণির একই ঘরে স্থান দেওয়া মেন্ডেলিফের পর্যায়-সারণির অন্যতম ত্রুটি – ব্যাখ্যা করো।
মেন্ডেলিফের পর্যায়-সারণিতে মৌলগুলিকে ক্রমবর্ধমান পারমাণবিক ভর অনুসারে পরপর সাজানো হয়েছে। কিন্তু বিভিন্ন সমস্থানিকগুলির পারমাণবিক ভর ভিন্ন হওয়া সত্ত্বেও একটি মৌলের সমস্ত সমস্থানিকগুলিকে একই স্থানে (একই পর্যায়ে ও একই গ্রুপে) রাখা হয়েছে যা পর্যায়-সারণির মূলনীতির পরিপন্থী। তাই একে মেন্ডেলিফের পর্যায়-সারণির ত্রুটি বলা যায়।
কিন্তু আধুনিক পর্যায়-সূত্র অনুসারে বর্তমানে মেন্ডেলিফের সংশোধিত পর্যায়-সারণিতে মৌলগুলিকে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজানো হয়। যেহেতু একই মৌলের বিভিন্ন সমস্থানিকের পরমাণু-ক্রমাঙ্ক একই হয়, তাই আধুনিক সংশোধিত পর্যায়-সারণিতে একই মৌলের বিভিন্ন আইসোটোপগুলির পর্যায়-সারণিতে একই স্থানে অবস্থানকে আর পর্যায়-সারণির ত্রুটি বলা যায় না।
মোজলের X-রশ্মির বর্ণালি-সংক্রান্ত পরীক্ষার পর্যবেক্ষণ ও সিদ্ধান্ত উল্লেখ করো।
বিজ্ঞানী মোজলে (Mosely, 1913) বিভিন্ন ধাতুনির্মিত টার্গেট বা অ্যান্টিক্যাথোডের উপর ক্যাথোড রশ্মি নিক্ষেপ করে যে X-রশ্মি উৎপন্ন হয় সেটি সম্পর্কে পরীক্ষা-নিরীক্ষা করেন।
পর্যবেক্ষণ –
- তিনি লক্ষ করেন, বিভিন্ন ধাতুর সঙ্গে ক্যাথোড রশ্মির সংঘর্ষের ফলে উৎপন্ন X-রশ্মির কম্পাঙ্ক বিভিন্ন কিন্তু নির্দিষ্ট ধাতুর ক্ষেত্রে এটি নির্দিষ্ট।
- তিনি আরও লক্ষ করেন অ্যান্টিক্যাথোডে ব্যবহৃত ধাতব মৌলগুলির পরমাণু-ক্রমাঙ্ক (A) -এর সাথে নির্গত X-রশ্মির কম্পাঙ্কের বর্গমূলের (\(\sqrt v\)) লেখচিত্র সরলরৈখিক কিন্তু পারমাণবিক ভরের সাথে X-রশ্মির কম্পাঙ্কের বর্গমূলের লেখচিত্র সরলরৈখিক নয়।
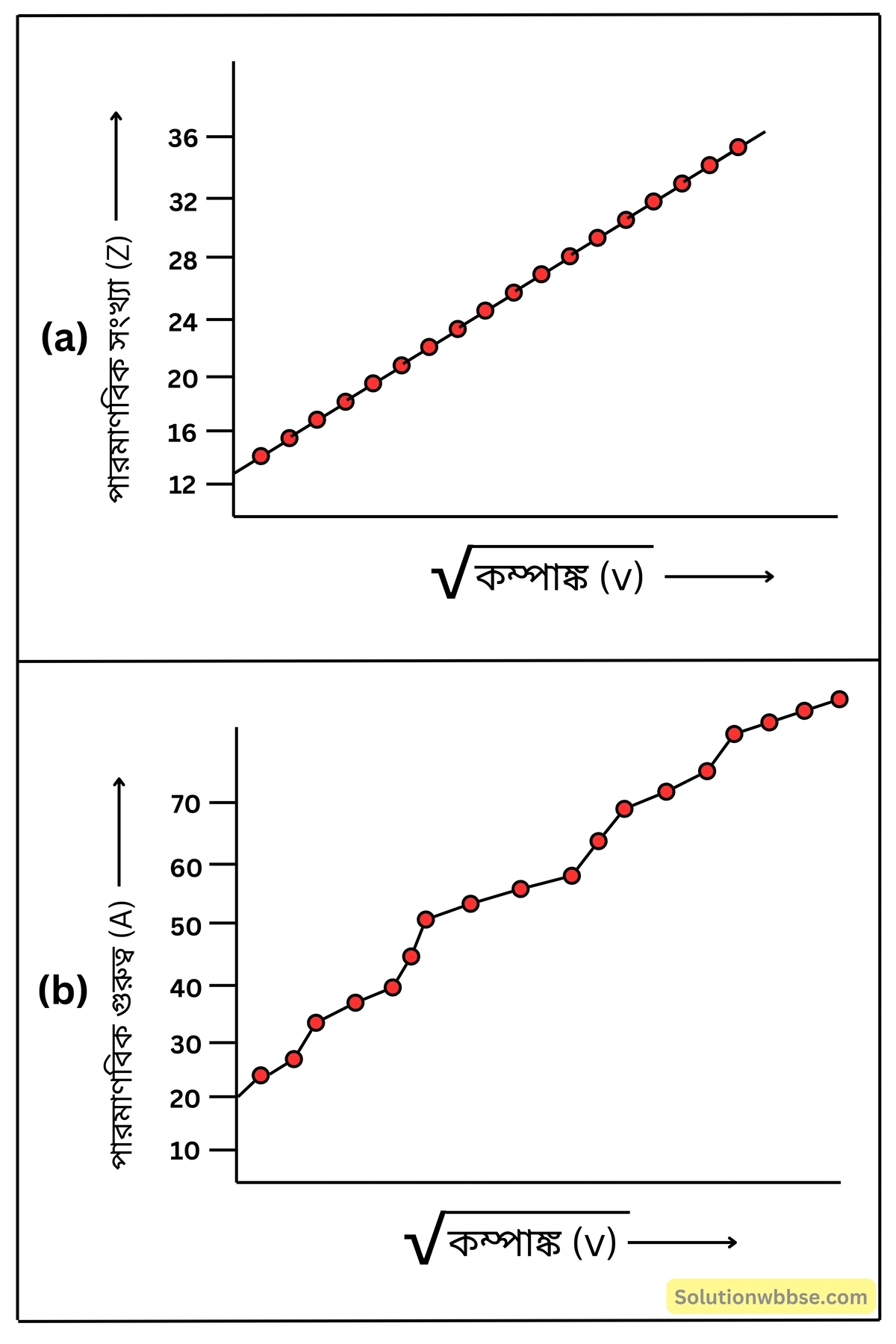
সিদ্ধান্ত – এর থেকে মোজলে সিদ্ধান্তে আসেন, পরমাণু-ক্রমাঙ্ক মৌলের মূলগত ধর্মের নিয়ন্ত্রক, পারমাণবিক গুরুত্ব নয়।
বিরল মৃত্তিকা মৌলসমূহের পর্যায়-সারণিতে অবস্থান, পর্যায়-সারণির মূলনীতির পরিপন্থী – ব্যাখ্যা করো।
ষষ্ঠ পর্যায়ের \( IIIA \) শ্রেণির ল্যান্থানামের \( \left({}_{57}La\right) \) পরবর্তী 14টি মৌল, যথা – সিরিয়াম \( \left({}_{58}Ce\right) \) থেকে লুটেশিয়াম \( \left({}_{71}Lu\right) \) -এর ধর্ম ল্যান্থানামের ধর্মের অনুরূপ। এদের ল্যান্থানাইড মৌল বলে। পারমাণবিক ভর ভিন্ন হওয়া সত্ত্বেও শুধু ধর্মের সাদৃশ্যের জন্য এদের পর্যায়-সারণির ষষ্ঠ পর্যায়ের \( IIIA \) শ্রেণিতে ল্যান্থানামের সাথে একই ঘরে স্থান দেওয়া হয়েছে। স্থানাভাবের জন্য এদের পর্যায়-সারণির নীচে পৃথক একটি অনুভূমিক সারিতে রাখা হয়েছে।
এভাবে ভিন্ন ভিন্ন পারমাণবিক গুরুত্বের মৌলগুলিকে একই ঘরে স্থান দেওয়া পর্যায়-সারণির মূলনীতির সঙ্গে সামঞ্জস্যপূর্ণ নয়।
মেন্ডেলিফের পর্যায়-সারণির তুলনায় দীর্ঘ পর্যায়-সারণির অধিক গ্রহণযোগ্যতার 3টি কারণ উল্লেখ করো।
মেন্ডেলিফের পর্যায়-সারণির তুলনায় দীর্ঘ পর্যায়-সারণির অধিক গ্রহণযোগ্যতার কারণগুলি নিম্নরূপ –
- মেন্ডেলিফের পর্যায়-সারণিতে মৌলগুলিকে প্রাথমিকভাবে ক্রমবর্ধমান পারমাণবিক ভর অনুসারে ও পরবর্তীকালে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজানো হয়েছে। কিন্তু দীর্ঘ পর্যায়-সারণিতে মৌলগুলিকে ইলেকট্রন-বিন্যাস অনুযায়ী সাজানো হয়েছে। এরূপ সজ্জায় প্রতিটি শ্রেণির মৌলগুলির যোজ্যতা-কক্ষের ইলেকট্রন-বিন্যাস একই রকম হয়। তাই মৌলসমূহের রাসায়নিক ধর্ম ও একই শ্রেণির মৌলগুলির সাদৃশ্য ব্যাখ্যা করতে দীর্ঘ পর্যায়-সারণি অধিকতর কার্যকারী।
- মেন্ডেলিফের পর্যায়-সারণিতে বা তার আধুনিক সংস্করণে একই শ্রেণির অন্তর্গত বিভিন্ন উপশ্রেণির মৌলগুলির ধর্মগত মিল খুবই কম। দীর্ঘ পর্যায়-সারণিতে উপশ্রেণিগুলির বিলোপ ঘটিয়ে নতুন শ্রেণির সংস্থান করে পর্যায়-সারণির সজ্জাকে আরও যুক্তিযুক্ত করা হয়েছে।
- মেন্ডেলিফের পর্যায়-সারণিতে \( VIII \) শ্রেণির প্রতিটি ঘরে তিনটি করে মৌলকে স্থান দেওয়া হয়েছিল, যেমন – \( \left(Fe,\;Co,\;Ni\right) \), \( \left(Ru,\;Rh,\;Pd\right) \) ও \( \left(Os,Ir,\;Pt\right) \) যা পর্যায়-সারণির মূলনীতির পরিপন্থী। দীর্ঘ পর্যায়-সারণিতে এই মৌলগুলি পৃথক পৃথক শ্রেণিতে স্থান পেয়েছে।
দীর্ঘ পর্যায়-সারণির কয়েকটি ত্রুটি উল্লেখ করো।
দীর্ঘ পর্যায়-সারণি মেন্ডেলিফের পর্যায়-সারণির অধিকাংশ অসঙ্গতি দূর করতে সক্ষম হলেও এতে কিছু ত্রুটি এখনও রয়ে গিয়েছে –
- এই সারণিতে হাইড্রোজেনের অবস্থান এখনও সুনির্দিষ্ট করা যায়নি। একে সঠিকভাবে কোনো একটি নির্দিষ্ট শ্রেণির অন্তর্ভুক্ত করা যায়নি।
- ইলেকট্রন-বিন্যাসের ভিত্তিতে হিলিয়ামের অবস্থান 2 নং শ্রেণিতে হওয়ার কথা, কিন্তু নিষ্ক্রিয় গ্যাসের সঙ্গে ধর্মের সাদৃশ্যের জন্য মৌলটিকে 18 নং শ্রেণিতে স্থান দেওয়া হয়েছে।
- মেন্ডেলিফের পর্যায়-সারণির মতো এখানেও ল্যান্থানাইড এবং অ্যকটিনাইড সারির প্রত্যেকটি মৌলকে পৃথক পৃথকভাবে উপযুক্ত স্থানে বসানো সম্ভব হয়নি। এদেরকে মূল সারণির নীচে পৃথকভাবে অনুভূমিক সারিতে স্থান দেওয়া হয়েছে।
ক্ষার ধাতু ও হ্যালোজেন মৌলগুলির ধর্মের পার্থক্য উল্লেখ করো।
ক্ষার ধাতু ও হ্যালোজেনের ধর্মের পার্থক্যগুলি নিম্নরূপ –
| বিষয় | ক্ষার ধাতু (IA) | হ্যালোজেন (VIIB) |
| ভৌত অবস্থা | নরম প্রকৃতির কঠিন পদার্থ, ছুরি দিয়ে কাটা যায়। | দ্বি-পরমাণুক গ্যাসীয় বা তরল বা কঠিন পদার্থ। |
| পরিবাহিতা | তাপ ও তড়িতের সুপরিবাহী। | তাপ ও তড়িতের কুপরিবাহী। |
| আয়নন শক্তি | কোনো পর্যায়ে এদের আয়নন শক্তির মান সবচেয়ে কম। | কোনো পর্যায়ে এদের আয়নন শক্তির মান সবচেয়ে বেশি। |
| তড়িৎ-ঋণাত্মকতা | নির্দিষ্ট পর্যায়ে এদের তড়িৎ-ঋণাত্মকতার মান সর্বনিম্ন হয়। | নির্দিষ্ট পর্যায়ে এদের তড়িৎ-ঋণাত্মকতার মান সর্বোচ্চ হয়। |
| জারণ এবং বিজারণ ধর্ম | তীব্র বিজারক পদার্থ। | তীব্র জারক পদার্থ। |
| অ্যাসিডের সাথে বিক্রিয়া | অ্যাসিডের সাথে দ্রুত বিক্রিয়া করে হাইড্রোজেন গ্যাস মুক্ত করে। | সাধারণত অ্যাসিডের সাথে বিক্রিয়া করে না। |
| যৌগ গঠন | অধাতব মৌলের সাথে আয়নীয় যৌগ গঠন করে। | ধাতব মৌলের সাথে আয়নীয় যৌগ এবং অধাতব মৌলের সাথে সমযোজী যৌগ গঠন করে। |
| উদাহরণ | Li, Na, K, Rb, Cs, Fr | F, Cl, Br, I, At |
IA শ্রেণির ক্ষার ধাতুগুলির সঙ্গে হাইড্রোজেনের ধর্মের পার্থক্যগুলি উল্লেখ করো।
ক্ষার ধাতু ও হাইড্রোজেনের ধর্মের পার্থক্যগুলি নিম্নরূপ –
| ক্ষার ধাতু | হাইড্রোজেন |
| ক্ষার ধাতুগুলি সাধারণ উষ্ণতায় কঠিন মৌল। | হাইড্রোজেন সাধারণ উষ্ণতায় গ্যাসীয় মৌল। |
| ক্ষার ধাতুগুলি বাষ্পীয় অবস্থায় এক-পরমাণুক। | হাইড্রোজেন দ্বি-পরমাণুক। |
| ক্ষার ধাতুগুলি তীব্র তড়িৎ-ধনাত্মক ধাতব মৌল। | হাইড্রোজেন তড়িৎ-ধনাত্মক হলেও অধাতব মৌল। |
| ক্ষার ধাতুগুলি আয়নিত হয়ে সর্বদাই ক্যাটায়ন উৎপন্ন করে। যেমন – Na – e → Na+ K – e → K+ | হাইড্রোজেন সাধারণত ক্যাটায়ন গঠন করলেও ধাতব হাইড্রাইড যৌগে অ্যানায়নরূপে অবস্থান করে। NaH ⇌ Na+ + H– CaH2 ⇌ Ca2+ + 2H– |
VIIB (বা 17 নং) শ্রেণির হ্যালোজেন মৌলগুলির সাথে হাইড্রোজেনের ধর্মের পার্থক্যগুলি উল্লেখ করো।
হ্যালোজেন মৌল ও হাইড্রোজেনের ধর্মের পার্থক্যগুলি নিম্নরূপ –
| হ্যালোজেন | হাইড্রোজেন |
| হ্যালোজেনগুলি তড়িৎ-ঋণাত্মক মৌল। | হাইড্রোজেন তড়িৎ-ধনাত্মক মৌল। |
| সাধারণ উষ্ণতায় ফ্লুরিন (F2) ও ক্লোরিন (Cl2) গ্যাস, ব্রোমিন (Br2) তরল ও আয়োডিন (I2) কঠিন। | সাধারণ উষ্ণতায় হাইড্রোজেন একটি গ্যাস। |
| হ্যালোজেনগুলি সাধারণত জারক পদার্থ যদিও আয়োডিনের বিজারণ ধর্মও দেখা যায়। | হাইড্রোজেন সাধারণত বিজারক পদার্থ। |
| হ্যালোজেন মৌলগুলির সর্ববহিস্থ কক্ষে 7টি করে ইলেকট্রন থাকে। | হাইড্রোজেনের একমাত্র কক্ষটিতে 1টি ইলেকট্রন থাকে। |
আধুনিক পর্যায়-সারণিতে প্রদত্ত মৌলগুলির অবস্থান উল্লেখ করো – \({}_{12}M,\;{}_{15}P\) ও \({}_{53}I\)
আধুনিক পর্যায়-সারণিতে প্রদত্ত মৌলগুলির অবস্থান নিম্নরূপ –
| মৌল | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | পর্যায়-সারণিতে অবস্থান | পর্যায়-সারণিতে অবস্থান |
| K | L | M | N | O | পর্যায় | শ্রেণি | |
| 12Mg | 2 | 8 | 2 | তৃতীয় | 2 নং | ||
| 15P | 2 | 8 | 5 | তৃতীয় | 15 নং | ||
| \({}_{53}I\) | 2 | 8 | 18 | 18 | 7 | পঞ্চম | 17 নং |
পর্যায়গত ধর্ম (Periodic properties) বলতে কী বোঝায়?
পরমাণু-ক্রমাঙ্ক বৃদ্ধির সাথে পর্যায়-সারণির বিভিন্ন পর্যায়ভুক্ত মৌলগুলির ভৌত ও রাসায়নিক ধর্ম পরিবর্তিত হয় এবং পরমাণু-ক্রমাঙ্কের নির্দিষ্ট ব্যবধানে একই প্রকার ধর্মের পুনরাবৃত্তি লক্ষ করা যায়। আবার একই শ্রেণির অন্তর্গত মৌলগুলির ভৌত ও রাসায়নিক ধর্ম সাদৃশ্যপূর্ণ হলেও পরমাণু-ক্রমাঙ্ক বৃদ্ধির সঙ্গে মৌলগুলির সদৃশ ধর্মের সামান্য হলেও তারতম্য ঘটে। মৌলের যেসব ভৌত ও রাসায়নিক ধর্ম পর্যায়গত ও শ্রেণিগতভাবে পরিবর্তিত ও পুনরাবৃত্ত হয় তাদের ‘পর্যায়গত ধর্ম’ বলে। যেমন – পারমাণবিক ব্যাসার্ধ, আয়নীভবন শক্তি, তড়িৎ-ঋণাত্মকতা, জারণ ও বিজারণ ধর্ম ইত্যাদি হল পর্যায়গত ধর্ম।
মৌলের ধর্মসমূহের পর্যায়বৃত্তির কারণ কী?
মৌলের ভৌত ও রাসায়নিক ধর্ম তার পরমাণু-ক্রমাঙ্কের উপর নির্ভরশীল। পরমাণুর ইলেকট্রন সংখ্যা মৌলের পরমাণু-ক্রমাঙ্কের সমান হয়। তাই মৌলের ভৌত ও রাসায়নিক ধর্ম পরমাণুর সর্ববহিস্থ কক্ষের বা যোজ্যতা-কক্ষের ইলেকট্রন-বিন্যাসের উপর নির্ভর করে। দেখা যায়, 8, 18 বা 32 পরমাণু-ক্রমাঙ্কের ব্যবধানে মৌলসমূহের সর্ববহিস্থ কক্ষের ইলেকট্রন-বিন্যাস একই রকম হয়। তাই মৌলগুলিকে ক্রমবর্ধমান পরমাণু-ক্রমাঙ্ক অনুসারে সাজালে একটি নির্দিষ্ট সংখ্যার ব্যবধানে (যেমন – 8,18 বা 32) এদের ধর্মের পুনরাবৃত্তি ঘটে। তাই বলা যায় মৌলের ধর্মসমূহের পর্যাবৃত্তির কারণ হল নির্দিষ্ট পরমাণু-ক্রমাঙ্কের ব্যবধানে যোজ্যতা-কক্ষে একই ধরনের ইলেকট্রন-বিন্যাসের পুনরাবৃত্তি।
পর্যায়-সারণিতে পর্যায় বরাবর বামদিক থেকে ডানদিকে পারমাণবিক ব্যাসার্ধ কীভাবে পরিবর্তিত হয়? ওই পরিবর্তনের কারণ ব্যাখ্যা করো।
আদর্শ মৌলগুলির ক্ষেত্রে যে-কোনো পর্যায়ে বামদিক থেকে ডানদিকে গেলে পারমাণবিক ব্যাসার্ধ হ্রাস পায়। যে-কোনো পর্যায়ে 1 নং শ্রেণির মৌলের পরমাণু আকার সবচেয়ে বড়ো হয় ও 17 নং শ্রেণির মৌলগুলির পরমাণুর আকার সবচেয়ে ছোটো হয়।
ব্যাখ্যা – একই পর্যায়ভুক্ত মৌলের পরমাণুগুলির ক্ষেত্রে ইলেকট্রনীয় কক্ষপথ অপরিবর্তিত থাকায় বামদিক থেকে পর্যায় বরাবর ডানদিকে গেলে পার্থক্যসূচক ইলেকট্রনগুলি একই কক্ষে স্থান পায়। আবার পরমাণ-ক্রমাঙ্ক বৃদ্ধি পাওয়ার সাথে সাথে প্রোটন সংখ্যা বৃদ্ধি পাওয়ায় নিউক্লিয়াসের ধনাত্মক আধান বৃদ্ধি পায়। এর ফলে বাইরের কক্ষে উপস্থিত ইলেকট্রনগুলির উপর নিউক্লিয়াসের আকর্ষণ বৃদ্ধি পায় এবং পর্যায় বরাবর বাম থেকে ডানদিকে পরমাণবিক ব্যাসার্ধ ক্রমশ কমতে থাকে।
পর্যায়-সারণিতে শ্রেণি বরাবর মৌলগুলির পারমাণবিক ব্যাসার্ধ কীভাবে পরিবর্তিত হয়? এই পরিবর্তনের কারণ ব্যাখ্যা করো।
পর্যায়-সারণির যে-কোনো শ্রেণির উপর থেকে যত নীচের দিকে যাওয়া যায় মৌলগুলির পারমাণবিক ব্যাসার্ধ উল্লেখযোগ্যভাবে বৃদ্ধি পায়।
ব্যাখ্যা – শ্রেণি বরাবর উপর থেকে নীচের দিকে যাওয়ার সময় পরমাণু-ক্রমাঙ্ক বৃদ্ধির সাথে সাথে নতুন নতুন ইলেকট্রনীয় কক্ষপথের সংযোজন ঘটে। ফলে বাইরের কক্ষের ইলেকট্রনগুলি ক্রমশ নিউক্লিয়াস থেকে দূরে চলে যায়। তাছাড়া নিউক্লিয়াসকে ঘিরে যেসব ইলেকট্রনপূর্ণ কক্ষ আছে, সেগুলি নিউক্লিয়াস ও বাইরের কক্ষের ইলেকট্রনের মধ্যে পর্দার মতো কাজ করে। এর ফলে নিউক্লিয়াস ও বাইরের কক্ষের ইলেকট্রনের মধ্যে আকর্ষণ বল দুর্বল হয়ে যায়। নিউক্লিয়াসের প্রোটন সংখ্যা বৃদ্ধির কারণে আকর্ষণ বল বৃদ্ধি পাওয়ার যে সম্ভাবনা থাকে তার তুলনায় অতিরিক্ত কক্ষপথের সংযোজন ও ভেতরের পূর্ণ কক্ষপথগুলির নিউক্লিয়াসকে আবৃত করে রাখা এই দুটির মিলিত প্রভাব বেশি হয়। তাই শ্রেণি বরাবর উপর থেকে নীচে নামলে পারমাণবিক ব্যাসার্ধ ক্রমশ বৃদ্ধি পায়।
মৌলের আয়নন বিভব বা আয়নন শক্তির মান কোন্ কোন্ বিষয়ের উপর নির্ভর করে?
কোনো মৌলের আয়নন বিভবের মান নিম্নলিখিত বিষয়গুলির উপর নির্ভর করে –
- পরমাণুর আকার – মৌলের আয়নন শক্তির মান বাইরের কক্ষের ইলেকট্রনগুলির উপর নিউক্লিয়াসের কুলম্বীয় আর্কষণ বলের মানের উপর নির্ভর করে। নিউক্লিয়াসের আকর্ষণ বল যত বেশি হয় বহিস্থ কক্ষের ইলেকট্রনকে মুক্ত করতে তত বেশি শক্তির প্রয়োজন হয়। পরমাণুর আকার যত বড়ো হয় বাইরের কক্ষের ইলেকট্রনগুলি নিউক্লিয়াস থেকে তত দূরে থাকে এবং এদের উপর নিউক্লিয়াসের আকর্ষণ বল তত কম হয়। তাই পরমাণুর আকার যত বড়ো হয় আয়নন শক্তি তত কম হয় এবং পরমাণুর আকার যত ছোটো হয় আয়নন শক্তি তত বেশি হয়।
- নিউক্লিয়াসের আধান – নিউক্লিয়াসের আধান যত বেশি হবে বাইরের কক্ষের ইলেকট্রনের ওপর নিউক্লিয়াসের আকর্ষণ বল ততই বেশি হবে। এর ফলে বাইরের কক্ষ থেকে ইলেকট্রন অপসারণের জন্য আরও বেশি শক্তির প্রয়োজন হবে। অর্থাৎ আয়নন শক্তির মান আরও বৃদ্ধি পায়।
পর্যায়-সারণিতে পর্যায় ও শ্রেণি বরাবর মৌলগুলির জারণ এবং বিজারণ ধর্মের পরিবর্তনের কারণ ব্যাখ্যা করো।
পর্যায়গতভাবে জারণ এবং বিজারণ ধর্মের পরিবর্তনের কারণ – একই পর্যায়ের মৌলগুলির ক্ষেত্রে বামদিক থেকে ডানদিকে যাওয়ার সময় পরমাণু-ক্রমাঙ্ক বৃদ্ধির সাথে পরমাণুর নিউক্লিয়াসে প্রোটন সংখ্যা একটি একটি করে বৃদ্ধি পায় এবং সেই সঙ্গে একই বহিস্থ কক্ষপথে ইলেকট্রন সংখ্যাও একটি একটি করে বৃদ্ধি পায়। সুতরাং বামদিক থেকে ডানদিকে গেলে বহিস্থ কক্ষপথের ইলেকট্রনগুলির উপর নিউক্লিয়াসের আকর্ষণ বল ক্রমশ বৃদ্ধি পায় ও পরমাণুর ইলেকট্রন ত্যাগের প্রবণতা হ্রাস পায়। পাশাপাশি ইলেকট্রন গ্রহণ করে নিকটতম নিষ্ক্রিয় মৌলের সুস্থিত ইলেকট্রন-বিন্যাস লাভের প্রবণতাও বৃদ্ধি পায়। এর ফলে বামদিকের মৌলগুলির ইলেকট্রন ত্যাগের প্রবণতা তথা বিজারণ ধর্ম বেশি এবং ডানদিকের মৌলগুলির ইলেকট্রন গ্রহণ করার প্রবণতা তথা জারণ ধর্ম বেশি। তাই বামদিক থেকে ডানদিকে গেলে মৌলের বিজারণ ধর্ম ক্রমশ হ্রাস পায় ও জারণ ধর্ম বৃদ্ধি পায়। কোনো পর্যায়ে \( IA \) (1 নং) শ্রেণির মৌল সবচেয়ে শক্তিশালী বিজারক ও \( VIIB \) (17 নং) শ্রেণির মৌল সবচেয়ে শক্তিশালী জারক হয়।
শ্রেণিগতভাবে জারণ এবং বিজারণ ধর্মের পরিবর্তনের কারণ – পর্যায়-সারণির যে-কোনো শ্রেণির উপর থেকে যত নীচে যাওয়া যায়, বহিস্তম কক্ষটি পরমাণুর নিউক্লিয়াস থেকে তত দূরবর্তী হয়। এর ফলে যোজ্যতা-কক্ষের ইলেকট্রনের ওপর পরমাণুর নিউক্লিয়াসের আকর্ষণ বল ক্রমশ হ্রাস পায়। তাই উপর থেকে নীচে কোনো শ্রেণি বরাবর মৌলগুলির ইলেকট্রন বর্জনের প্রবণতা ক্রমশ বৃদ্ধি পায় অর্থাৎ বিজারণ ধর্ম ক্রমশ বৃদ্ধি পায় এবং জারণ ধর্ম ক্রমশ হ্রাস পায়।
মৌলের তড়িৎ-ঋণাত্মকতার মান কোন্ কোন্ বিষয়ের ওপর নির্ভর করে?
মৌলের তড়িৎ-ঋণাত্মকতার মান নিম্নলিখিত বিষয়গুলির ওপর নির্ভর করে –
- পরমাণুর আকার – পরমাণুর আকার যত ছোটো হয় বন্ধন ইলেকট্রন-জোড়ের ওপর নিউক্লিয়াসের আকর্ষণ ততই বৃদ্ধি পায়। তাই ক্ষুদ্রাকার পরমাণুর তড়িৎ-ঋণাত্মকতা অপেক্ষাকৃত বড়ো আকারের পরমাণুর তুলনায় বেশি হয়।
- যোজ্যতা-কক্ষের আগে উপস্থিত ইলেকট্রনীয় কক্ষপথের সংখ্যা – যোজ্যতা-কক্ষের আগে নিউক্লিয়াসকে ঘিরে যত বেশি সংখ্যক কক্ষপথ থাকবে পরমাণুর আকার তত বড়ো হবে এবং তড়িৎ-ঋণাত্মকতা তত কম হবে।
- আয়নন শক্তি – মৌলের আয়নন শক্তি যত বেশি হবে তার তড়িৎ-ঋণাত্মকতা তত বেশি হবে।
- নিউক্লিয়াসের ধনাত্মক আধান – নিউক্লিয়াসের ধনাত্মক আধান যত বেশি হবে ততই সেটি বন্ধন ইলেকট্রন-জোড়কে নিজের দিকে বেশি আকর্ষণ করবে এবং পরমাণুর তড়িৎ-ঋণাত্মকতাও তত বেশি হবে।
তড়িৎ-ঋণাত্মকতার পাউলিং স্কেল কাকে বলে? উদাহরণ দাও।
বিজ্ঞানী পাউলিং বিভিন্ন মৌলের তড়িৎ-ঋণাত্মকতা নির্ণয় করেন। H -এর তড়িৎ-ঋণাত্মকতার মান 2.1 ধরে, এর সাপেক্ষে অন্যান্য মৌলের তড়িৎ-ঋণাত্মকতার যে মান নির্ণয় করা হয়েছে, তাকে পাউলিং -এর স্কেল বলে।
1 নং গ্রুপের মৌলগুলির তড়িৎ-ঋণাত্মকতা – \( Li-1.0,\;Na-0.9,\;K-0.8,\;Rb-0.8,\;Cs-0.7,\;Fr-0.7 \)
দ্বিতায় পর্যায়ের মৌলগুলির তড়িৎ-ঋণাত্মকতা – \( Li-1.5,\;Be-1.5,\;B-2.0,\;C-2.5,\;N-3.0,\;O-3.5,\;F-4.0 \)
হ্যালোজেন (17 নং শ্রেণি) মৌলগুলির তড়িৎ-ঋণাত্মকতা – \( F-4.0,\;Cl-3.0,\;Br-2.8,\;I-2.5,\;At-2.2 \)
A, B ও C মৌল তিনটির পরমাণু-ক্রমাঙ্ক যথাক্রমে 9, 13 এবং 17। (i) আধুনিক বা দীর্ঘ পর্যায়-সারণিতে এদের অবস্থান নির্ণয় করো। (ii) মৌলগুলির মধ্যে কোনটি সর্বাপেক্ষা তড়িৎ-ধনাত্মক এবং কোনটি সবচেয়ে তড়িৎ-ঋণাত্মক?
প্রদত্ত প্রশ্নগুলির উত্তর নিম্নরূপ –
1.
| মৌল | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | আধুনিক বা দীর্ঘ পর্যায়- সারণিতে অবস্থান | আধুনিক বা দীর্ঘ পর্যায়- সারণিতে অবস্থান |
| K | L | M | N | পর্যায় | শ্রেণি | |
| 9A | 2 | 7 | দ্বিতীয় | 17 | ||
| 13B | 2 | 8 | 3 | তৃতীয় | 13 | |
| 17C | 2 | 8 | 7 | তৃতীয় | 17 |
2. মৌলগুলির মধ্যে B সর্বাপেক্ষা তড়িৎ-ধনাত্মক ও A সর্বাপেক্ষা তড়িৎ-ঋণাত্মক।
A, B ও C তিনটি মৌলের পরমাণু-ক্রমাঙ্ক যথাক্রমে (Z – 2), Z এবং (Z + 1)। এদের মধ্যে B একটি নিষ্ক্রিয় মৌল। (i) এদের মধ্যে কোনটির তড়িৎ-ঋণাত্মকতা সর্বাধিক? (ii) কোনটির আয়নন শক্তি সর্বাধিক? (iii) A ও C দ্বারা গঠিত যৌগের প্রকৃতি ও সংকেত কী হবে?
প্রদত্ত প্রশ্নের উত্তর নিম্নরূপ –
- B -এর পরমাণু-ক্রমাঙ্ক Z এবং B একটি নিষ্ক্রিয় মৌল। তাই, B -এর যোজ্যতা-কক্ষে 8টি ইলেকট্রন আছে। অতএব, (Z – 2) পরমাণু-ক্রমাঙ্কবিশিষ্ট A মৌলের যোজ্যতা-কক্ষে ইলেকট্রনের সংখ্যা (8 – 2) = 6 এবং (Z + 1) পরমাণু-ক্রমাঙ্কবিশিষ্ট C মৌলের যোজ্যতা-কক্ষে ইলেকট্রনের সংখ্যা 1। সুতরাং, C মৌলটি ক্ষার ধাতু। অর্থাৎ, A মৌলটির তড়িৎ-ঋণাত্মকতা সর্বাধিক।
- B নিষ্ক্রিয় মৌল হওয়ায় এটির আয়নন শক্তি সর্বাধিক।
- A -র যোজ্যতা-কক্ষে 6টি ইলেকট্রন থাকায় এর যোজ্যতা (8 – 6) = 2, C -এর যোজ্যতা-কক্ষে 1টি ইলেকট্রন থাকায় এর যোজ্যতা 1। সুতরাং, A ও C দ্বারা গঠিত যৌগের সংকেত হবে C2A। C ক্ষার ধাতু ও A তড়িৎ-ঋণাত্মক মৌল হওয়ায় যৌগটির প্রকৃতি তড়িৎযোজী বা আয়নীয় হরে।
A, B, C মৌলগুলির পরমাণবিক সংখ্যা যথাক্রমে 6, 8 এবং 10। C একটি নিষ্ক্রিয় মৌল। (i) কোন্ মৌলটির তড়িৎ-ঋণাত্মকতা সবচেয়ে বেশি? (ii) কোন্ মৌলটির পরমাণুর আকার সবচেয়ে কম? (iii) B মৌল মেন্ডেলিফের পর্যায়-সারণিতে কোথায় অবস্থিত?
6A -এর ইলেকট্রন-বিন্যাস – K(2)L(4)
8B -এর ইলেকট্রন-বিন্যাস – K(2)L(6)
10C -এর ইলেকট্রন-বিন্যাস – K(2)L(8)
- ইলেকট্রন-বিন্যাস থেকে বলা যায়, B মৌলটির তড়িৎ-ঋণাত্মকতা সবচেয়ে বেশি।
- C মৌলটির পরমাণুর আকার সবচেয়ে ছোটো।
- B মৌলটি মেন্ডেলিফের পর্যায়-সারণিতে দ্বিতীয় পর্যায়ের \( VIB \) শ্রেণিতে অবস্থিত।
পর্যায়-সারণির অংশবিশেষ নীচে দেওয়া হল যেখানে মৌলগুলির প্রকৃত চিহ্নের পরিবর্তে তাদের A, B, C ইত্যাদি ইংরেজি বর্ণমালার বিভিন্ন অক্ষর দ্বারা চিহ্নিত করা হয়েছে। পর্যায়-সারণিটি লক্ষ করে নীচের প্রশ্নগুলির উত্তর দাও।
শ্রেণি
| পর্যায় | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 2 | A | F | K | M | O | |||
| 3 | B | D | G | H | L | N | ||
| 4 | C | E | I | J | P |
- এদের মধ্যে কোনটি সবচেয়ে তড়িৎ-ঋণাত্মক মৌল?
- 1 মৌলটির যোজ্যতা-কক্ষে কতগুলি ইলেকট্রন আছে?
- D ও N দ্বারা গঠিত যৌগের সংকেত নির্ণয় করো।
- প্রদত্ত মৌলগুলির মধ্যে কোনটি সবচেয়ে বড়ো?
- এদের মধ্যে কোন্ মৌলগুলির যোজ্যতা 4?
- কোন্ মৌলটির আয়নন শক্তি সর্বাধিক?
প্রদত্ত প্রশ্নের উত্তর নিম্নরূপ –
- এদের মধ্যে সবচেয়ে তড়িৎ-ঋণাত্মক মৌলটি হল M।
- J মৌলটির যোজ্যতা-কক্ষে ইলেকট্রন আছে 5টি।
- D ও N দ্বারা গঠিত যৌগের সংকেত DN2 [যেহেতু D -এর যোজ্যতা 2 ও N -এর যোজ্যতা (8 – 7) = 1]।
- প্রদত্ত মৌলগুলির মধ্যে সবচেয়ে বড়ো আকারের মৌল C।
- H ও I মৌলদুটির যোজ্যতা 4।
- O মৌলটির আয়নন শক্তি সবচেয়ে বেশি।
পর্যায়-সারণির কোনো নির্দিষ্ট পর্যায়ের কয়েকটি মৌলকে বামদিক থেকে ডানদিকে পরপর উল্লেখ করা হল। Li, Be, B, C, O, F, Ne
(i) মৌলগুলি কোন্ পর্যায়ের সদস্য? (ii) উক্ত পর্যায়ের মৌলগুলির মধ্যে একটি অনুপস্থিত আছে। সেটি কোন্ মৌল এবং তার অবস্থান উল্লেখ করো। (iii) প্রদত্ত মৌলগুলির মধ্যে কোন্ মৌলটি ক্যাটিনেশন (catenation) ধর্ম প্রদর্শন করে? (iv) F, Be এবং N -কে ক্রমবর্ধমান তড়িৎ-ঋণাত্মকতা অনুসারে সাজাও। (v) প্রদত্ত মৌলগুলির মধ্যে কোনটি হ্যালোজেন মৌল? (vi) এদের মধ্যে ক্ষারীয় মৃত্তিকা ধাতু কোনটি?
প্রদত্ত প্রশ্নগুলির উত্তর নিম্নরূপ –
- প্রদত্ত মৌলগুলি দ্বিতীয় পর্যায়ের সদস্য।
- এদের মধ্যে অনুপস্থিত মৌলটি হল N এবং এটির অবস্থান C ও O -এর মধ্যবর্তী স্থানে।
- এদের মধ্যে ক্যাটিনেশন ধর্ম প্রদর্শন করে C।
- তড়িৎ-ঋণাত্মকতা বৃদ্ধির ক্রম – Be < N < F
- এদের মধ্যে হ্যালোজেন মৌলটি হল F
- এদের মধ্যে ক্ষারীয় মৃত্তিকা ধাতু হল Be
পর্যায়-সারণির একটি শ্রেণির সদস্য মৌলগুলির নাম নিম্নরূপ – (a) বোরন, (b) অ্যালুমিনিয়াম, (c) গ্যালিয়াম, (d) ইন্ডিয়াম, (e) থ্যালিয়াম। প্রদত্ত মৌলগুলির সাপেক্ষে নীচের প্রশ্নগুলির উত্তর দাও।
(i) এদের মধ্যে কোন্ মৌলটি সর্বাধিক ধাতব চরিত্র-বিশিষ্ট? (ii) এদের মধ্যে কার তড়িৎ-ঋণাত্মকতা সর্বাধিক? (iii) যদি অ্যালুমিনিয়ামের ইলেকট্রন-বিন্যাস K = 2, L = 8, M = 3 হয় তবে থ্যালিয়ামের যোজ্যতা-কক্ষে কয়টি ইলেকট্রন থাকবে? (iv) বোরনের পরমাণু-ক্রমাঙ্ক 5। বোরন ক্লোরিনের সাথে বিক্রিয়া করে যৌগ গঠন করলে উৎপন্ন যৌগের সংকেত কী হবে? (v) এই শ্রেণির মৌলগুলির মধ্যে কোনটির আয়নন শক্তি সর্বনিম্ন? (vi) উক্ত শ্রেণির ডানদিকে অবস্থিত শ্রেণিটির মৌলগুলির যোজ্যতা-কক্ষে কতগুলি ইলেকট্রন থাকবে?
প্রদত্ত প্রশ্নগুলির উত্তর নিম্নরূপ –
- সর্বাধিক ধাতব চরিত্রবিশিষ্ট মৌলটি হল থ্যালিয়াম।
- এদের মধ্যে বোরনের তড়িৎ-ঋণাত্মকতা সবচেয়ে বেশি।
- থ্যালিয়ামের যোজ্যতা-কক্ষেও অ্যালুমিনিয়ামের মতো 3টি ইলেকট্রন থাকবে।
- বোরন ও ক্লোরিনের বিক্রিয়া দ্বারা গঠিত যৌগের সংকেত হবে \( BCl_3 \)।
- এই শ্রেণির মৌলগুলির মধ্যে থ্যালিয়ামের আয়নায়ন শক্তি সর্বনিম্ন।
- উক্ত শ্রেণির ডানদিকে অবস্থিত শ্রেণির মৌলগুলির যোজ্যতা কক্ষে 4টি ইলেকট্রন থাকবে।
A, B ও C মৌলগুলির পারমাণবিক সংখ্যা হল যথাক্রমে 3, 11 ও 19।
(i) মেন্ডেলিফের পর্যায়-সারণি এবং আধুনিক বা দীর্ঘ পর্যায়-সারণিতে মৌল তিনটির অবস্থান কোথায়? (ii) এদের মধ্যে কোনটির বিজারণ ধর্ম সবচেয়ে বেশি? (iii) B -এর সঙ্গে ক্লোরিনের বিক্রিয়ায় সমযোজী না তড়িৎযোজী যৌগ উৎপন্ন হয়?
1.
| মৌল | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | ইলেকট্রন-বিন্যাস | পর্যায়-সারণিতে অবস্থান | পর্যায়-সারণিতে অবস্থান |
| K | L | M | N | পর্যায় | শ্রেণি | |
| 3A | 2 | 1 | দ্বিতীয় | মেন্ডেলিফের পর্যায়-সারণিতে IA শ্রেণি, দীর্ঘ পর্যায়-সারণিতে 1 নং শ্রেণি | ||
| 11B | 2 | 8 | 1 | তৃতীয় | মেন্ডেলিফের পর্যায়-সারণিতে IA শ্রেণি, দীর্ঘ পর্যায়-সারণিতে 1 নং শ্রেণি | |
| 19C | 2 | 8 | 8 | 1 | চতুর্থ | মেন্ডেলিফের পর্যায়-সারণিতে IA শ্রেণি, দীর্ঘ পর্যায় সারণিতে 1 নং শ্রেণি |
- এদের মধ্যে C মৌলের বিজারণ ধর্ম সবচেয়ে বেশি।
- B -এর যোজ্যতা-কক্ষে 1টি ইলেকট্রন আছে, অর্থাৎ এটি একটি ক্ষার ধাতু। অন্যদিকে ক্লোরিন একটি তীব্র তড়িৎ-ঋণাত্মক মৌল এবং এটি একটি অধাতু, তাই B -এর সাথে ক্লোরিনের রাসায়নিক বিক্রিয়ায় একটি তড়িৎযোজী যৌগ উৎপন্ন হবে।
নির্দেশ অনুসারে সাজাও (i) O, Te, Se, S (ক্রমবর্ধমান তড়িৎ-ঋণাত্মকতা) (ii) I, F, Br, Cl (ক্রমবর্ধমান বিজারণ ক্ষমতা) (iii) K, Na, F, Cl, Br (পরমাণুর আকার বৃদ্ধি) (iv) Mg, Al, Si, Na (আয়ন বিভব বৃদ্ধি) (v) Na, Cs, K, Rb, Li (ক্রমবর্ধমান পারমাণবিক আয়তন)
নির্দেশ অনুসারে প্রদত্ত মৌলগুলির ক্রম নিম্নরূপ –
- Te < Se < S < O
- F < Cl < Br < I
- F < Cl < Br < Na < K
- Na < Al < Mg < Si
- Li < Na < K < Rb < Cs
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ’ থেকে পর্যায়-সারণি এবং মৌলদের ধর্মের পর্যাবৃত্ততা এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করতে পারেন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






মন্তব্য করুন