আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ’ থেকে ‘ধাতুবিদ্যা’ এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য ও প্রতিযোগিতামূলক পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ।

সংকর ধাতু বলতে কী বোঝ? একটি পরিচিত সংকর ধাতুর উপাদানসহ নাম লেখো।
দুই বা ততোধিক ধাতুর সংযোগের ফলে এরং কোনো কোনো ক্ষেত্রে ধাতব মৌলের সাথে অধাতব মৌলের সংযোগের ফলে, উপাদান মৌলগুলি থেকে পৃথক বৈশিষ্ট্যযুক্ত এবং মুখ্যত ধাতুর মতো আচরণকারী যে সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণ উৎপন্ন হয়, তাকে ধাতু-সংকর বা সংকর ধাতু (alloy) বলে।
পেতল একটি পরিচিত সংকর ধাতু যার উপাদান হল কপার (60-80%) এবং জিংক (20-40%)।

বিশুদ্ধ ধাতুর তুলনায় সংকর ধাতু ব্যবহারের তিনটি উপযোগিতা উদাহরণসহ উল্লেখ করো।
বিশুদ্ধ ধাতুর তুলনায় সংকর ধাতু ব্যবহারের তিনটি উপযোগিতা উদাহরণসহ নীচে উল্লেখ করা হল –
| উপযোগিতা | উদাহরণ |
| কাঠিন্য | অনেক ক্ষেত্রেই বিশুদ্ধ ধাতুর তুলনায় সংকর ধাতুর কাঠিন্য অনেক বেশি হয়। যেমন – তামা বা কপার একটি নরম ধাতু, কিন্তু এর সংকর ধাতু পেতল (Cu + Zn) বা ব্রোঞ্জ (Cu + Sn + সামান্য Zn) অনেক বেশি শক্ত। |
| অধিকতর ক্ষয়রোধী প্রবণতা | সংকর ধাতুতে উপাদান মৌলগুলির রাসায়নিক সক্রিয়তা তথা জারিত হওয়ার প্রবণতা এবং জলবায়ুর ক্রিয়ায় ক্ষয়ে যাওয়ার প্রবণতা কমে যায়। ফলে সংকর ধাতু অধিকতর স্থায়ী হয়। যেমন – জলীয় বাষ্প ও অক্সিজেনের প্রভাবে লোহায় মরচে পড়লেও লোহার সংকর ধাতু স্টেইনলেস স্টিলে মরচে পড়ে না। |
| তাপ ও তড়িৎ পরিবাহিতার মাত্রা নিয়ন্ত্রণ | তাপ ও তড়িৎ পরিবাহিতা প্রয়োজনমতো বাড়ানো বা কমানোর জন্য সংকর ধাতু ব্যবহার করা হয়। যেমন – নিকেল, লোহা ও ক্রোমিয়ামের সংকর ধাতু নাইক্রোমের রোধাঙ্ক উপাদান ধাতুগুলির থেকে বেশি। |
আয়রনের তিনটি সংকর ধাতুর নাম, সংযুতি ও ব্যবহার উল্লেখ করো।
Fe -এর তিনটি সংকর ধাতুর সংযুতি ও ব্যবহার নিম্নরূপ –
| ধাতু-সংকর | সংযুতি | ব্যবহার |
| স্টেইনলেস স্টিল | Fe – 73%, Cr – 18%, Ni – 8%, C – 1% | বাসনপত্র, ছুরি, কাঁচি, শল্য চিকিৎসার যন্ত্রপাতি, বিভিন্ন যন্ত্রাংশ তৈরিতে ব্যবহৃত হয়। |
| নিকেল স্টিল | Fe – 96-98%, Ni – 2-4% | বর্ম, গাড়ির যন্ত্রাংশ, গিয়ার, এরোপ্লেনের প্রপেলার, তার ইত্যাদি তৈরিতে ব্যবহৃত হয়। |
| ইনভার | Fe – 64%, Ni – 36%, অতি নগণ্য পরিমাণ কার্বন | পরিমাপের যন্ত্র (যেমন – মিটার-স্কেল) এবং ঘড়ির পেন্ডুলাম প্রস্তুতিতে ব্যবহৃত হয়। |
সংকর ধাতুর কয়েকটি বৈশিষ্ট্য উল্লেখ করো।
সংকর ধাতুর কয়েকটি বৈশিষ্ট্য নিম্নরূপ –
- সংকর ধাতু সমসত্ত্ব বা অসমসত্ত্ব হতে পারে।
- সংকর ধাতুর ধর্ম তার উপাদান ধাতুগুলির ধর্ম থেকে ভিন্ন হয়।
- সংকর ধাতুর গলনাঙ্ক তার উপাদানগুলির গলনাঙ্কের থেকে বেশি বা কম হতে পারে।
- বেশিরভাগ সংকর ধাতু কঠিন হয়ে থাকে, তবে সংকর ধাতু তরলও হতে পারে।
পারদ-সংকর কাকে বলে? ব্যবহার লিখ?
কোনো সংকর ধাতুর একটি উপাদান পারদ (Hg) হলে, ওই সংকর ধাতুকে পারদ-সংকর (amal-gam) বলে।
পারদ-সংকর ধাতুর ব্যবহার –
- দস্তার পারদ-সংকর তড়িৎকোশ তৈরিতে ও জৈব রসায়নে ক্লিমেনশন বিজারণ বিক্রিয়ায় ব্যবহৃত হয়।
- টিনের পারদ-সংকর আয়না তৈরিতে ব্যবহৃত হয়।
- সোডিয়ামের পারদ-সংকর জৈব রসায়নে বিজারকরূপে ব্যবহৃত হয়।
- রুপোর পারদ-সংকর দাঁতের চিকিৎসায় ব্যবহৃত হয়।
এমন তিনটি সংকর ধাতুর সংযুতি ও ব্যবহার উল্লেখ করো যেগুলিতে উপাদানরূপে কপার ও জিংক উভয়ই উপস্থিত।
পেতল বা ব্রাস, ব্রোঞ্জ এবং জার্মান সিলভার – এই সংকর-ধাতুগুলিতে উপাদানরূপে কপার ও জিংক উভয়ই উপস্থিত।
| ধাতু-সংকর | সংযুতি | ব্যবহার |
| পেতল বা ব্রাস | Cu – 60-80%, Zn – 20-40% | টেলিস্কোপ, ব্যারোমিটার ইত্যাদি যন্ত্রের নানা যন্ত্রাংশ, বাসনপত্র, পাইপ, জলের কল, মূর্তি ইত্যাদি তৈরিতে ব্যবহৃত হয়। |
| ব্রোঞ্জ | Cu – 80%, Sn – 18% ও Zn – 2% | মূর্তি, মুদ্রা, বাসনপত্র, মেডেল ইত্যাদি তৈরিতে ব্রোঞ্জ ব্যবহৃত হয়। |
| জার্মান সিলভার | Cu – 25-30%, Zn – 25-30%, Ni – 40-50% | বাসনপত্র, শৌখিন দ্রব্য যেমন – ফুলদানি তৈরিতে কাজে লাগে। |
অ্যালুমিনিয়ামের গুরুত্বপূর্ণ ধাতু-সংকরগুলির নাম, সংযুতি ও ব্যবহার উল্লেখ করো।
Al -এর গুরুত্বপূর্ণ সংকর ধাতুর সংযুতি ও ব্যবহার নিম্নরূপ –
| ধাতু-সংকর | সংযুতি | ব্যবহার |
| ম্যাগনেলিয়াম | Al – 90-95%, Mg – 5-10% | হালকা যন্ত্রপাতি, তুলাদন্ড ও বৈজ্ঞানিক যন্ত্রপাতি তৈরিতে ব্যবহৃত হয়। |
| ডুরালুমিন | Al – 95%, Cu – 4%, Mg – 0.5%, Mn – 0.5% | বিমান ও মোটরগাড়ির কাঠামো, বিভিন্ন যন্ত্রাংশ, প্রেসার কুকার, রান্নার বাসনপত্র ও জলযানের কাঠামো নির্মাণে ব্যবহৃত হয়। |
| অ্যালুমিনিয়াম-ব্রোঞ্জ | Al – 10%, Cu – 90% | মুদ্রা, মূর্তি, ফুলদানি, বাসনপত্র প্রস্তুতিতে ব্যবহৃত হয়। |
খনিজ ও আকরিকের মধ্যে পার্থক্য লেখো।
খনিজ ও আকরিকের মধ্যে পার্থক্যগুলি হল –
| খনিজ | আকরিক |
| ভূগর্ভে বা ভূপৃষ্ঠে প্রাপ্ত প্রকৃতিজাত অজৈব পদার্থ-সমূহ যাদের মধ্যে ধাতুগুলি মুক্ত অবস্থায় বা যৌগরূপে অন্যান্য অশুদ্ধির সঙ্গে মিশ্রিত অবস্থায় থাকে, তাদের খনিজ বলে। যেমন – কপারের খনিজ হল কপার পাইরাইট্স্ (Cu2S⋅Fe2S3)। | যেসব খনিজ থেকে অপেক্ষাকৃত সহজ উপায়ে এবং কম খরচে উচ্চ-গুণমানসম্পন্ন ধাতু নিষ্কাশন করা সম্ভব হয় তাদের উক্ত ধাতুর আকরিক বলে। যেমন – রেড হিমাটাইট ও আয়রন পাইরাইট্স্ উভয়ই আয়রনের খনিজ হলেও কেবলমাত্র রেড হিমাটাইট আয়রনের আকরিক, আয়রন পাইরাইট্স্ নয়। |
| সকল খনিজ আকরিক নয়। | সকল আকরিকই খনিজ। |
কী কী উপায়ে জারণ সংঘটিত হতে পারে লেখো।
নিম্নলিখিত 3টি উপায়ে জারণ সংঘটিত হতে পারে, যথা –
- কোনো পরমাণু থেকে ইলেকট্রন বর্জিত হলে জারণ ঘটে, যেমন – Na – e → Na+, Al – 3e → Al3+
- ক্যাটায়ন থেকে ইলেকট্রনের বর্জনে জারণ ঘটে, যেমন – Cu+ → Cu2+ + e, Fe2+ → Fe3+ + e
- অ্যানায়ন থেকে ইলেকট্রন বর্জিত হলেও জারণ সংঘটিত হয়, যেমন – S2- → S + 2e, 2Cl– → Cl2 + 2e
কী কী উপায়ে বিজারণ ক্রিয়া সংঘটিত হতে পারে উল্লেখ করো।
নিম্নলিখিত 4টি উপায়ে বিজারণ সংঘটিত হতে পারে –
1. কোনো পরমাণু দ্বারা ইলেকট্রন গৃহীত হলে জারণ ঘটে, যেমন – Cl + e → Cl–, O + 2e → O2-
2. ক্যাটায়ন দ্বারা ইলেকট্রনের গ্রহণে বিজারণ ঘটে, যেমন – Na+ + e → Na, Mg2+ + 2e → Mg2+
3. উচ্চ যোজ্যতাবিশিষ্ট কোনো ক্যাটায়ন ইলেকট্রন গ্রহণ করে বিজারিত হয়ে নিম্ন যোজ্যতাবিশিষ্ট ক্যাটায়নে পরিণত হয়, যেমন – Fe3+ + e → Fe2+, Sn4+ + 2e → Sn2+
4. নিম্ন আধানবিশিষ্ট অ্যানায়নগুলি ইলেকট্রন গ্রহণ করে তথা বিজারিত হয়ে উচ্চ আধানবিশিষ্ট অ্যানায়নে পরিণত হয়, যেমন – \(O^-+e\rightarrow O^{2-},MnO_4^-+e\rightarrow MnO_4^{2-}\)
আকরিক থেকে ধাতু নিষ্কাশন কার্যত ধাতব যৌগের বিজারণ – উদাহরণসহ ব্যাখ্যা করো।
যে ধাতব যৌগ থেকে প্রয়োজনীয় ধাতুকে সহজে ও স্বল্পব্যয়ে নিষ্কাশন করা হয় তাকেই সংশ্লিষ্ট ধাতুটির আকরিক বলা হয়। ধাতব যৌগে ধাতুটি ধনাত্মক জারণ স্তরে থাকে, কিন্তু নিষ্কাশনের পর এটি মুক্ত ধাতুতে পরিণত হয় যার জারণ সংখ্যা শূন্য (0)। কাজেই নিষ্কাশন প্রক্রিয়ার সময় ধাতব যৌগ গঠনকারী ধাতব আয়ন ইলেকট্রন গ্রহণ করে ধাতুতে পরিণত হয়। সুতরাং বলা যায়, আকরিক থেকে ধাতু নিষ্কাশন কার্যত ধাতব যৌগের বিজারণ।
Mn+ + (ধাতব আয়ন) + ne → M (মুক্ত ধাতু)
উদাহরণ – জিংক অক্সাইড (ZnO) -এর সঙ্গে অতিরিক্ত কোক-চূর্ণ ভালোভাবে মিশিয়ে মিশ্রণটিকে অগ্নিসহ মাটির তৈরি বকযন্ত্রে (retort) নিয়ে 1300-1400°C উষ্ণতায় উত্তপ্ত করলে জিংক অক্সাইড বিজারিত হয়ে ধাতব জিংক উৎপন্ন করে।
ZnO + C → Zn + CO↑
সব আকরিকই খনিজ পদার্থ, কিন্তু সব খনিজ পদার্থকে আকরিক বলা যায় না – ব্যাখ্যা করো।
প্রকৃতির মধ্যে বিভিন্ন ধাতব যৌগকে পাথরের মতো কঠিন অবস্থায় কখনো ভূগর্ভের নীচে, কখনো ভূ-পৃষ্ঠের ওপরে পাওয়া যায়। এইসব প্রকৃতিজাত পদার্থগুলিকে খনিজ বলা হয়। খনিজ পদার্থের মধ্যে ধাতব উপাদানটি ছাড়াও অন্যান্য অপ্রয়োজনীয় পদার্থ, যেমন – মাটি, বালি, কাদা ইত্যাদি মিশ্রিত অবস্থায় থাকে। অন্যদিকে, যে খনিজ পদার্থ থেকে সহজ উপায়ে এবং সুলভে উচ্চমানের ধাতু নিষ্কাশন করা যায়, তাকে আকরিক বলে। যেমন – বক্সাইট (Al2O3⋅2H2O) ও চায়না-ক্লে (Al2O3⋅2SiO2⋅2H2O) উভয়ই Al -এর খনিজ হলেও বক্সাইট থেকে সহজে ও কম খরচে উচ্চমানের Al নিষ্কাশন করা সম্ভব হয়। অন্যদিকে, প্রচুর পরিমাণে Al উপস্থিত থাকলেও চায়না-ক্লে থেকে সহজে ও কম খরচে AI নিষ্কাশন সম্ভব নয়। তাই চায়না-ক্লে, Al -এর আকরিক নয়। সুতরাং বলা যায়, সব আকরিকই খনিজ পদার্থ, কিন্তু সব খনিজ পদার্থকে আকরিক বলা যায় না।
পাইরাইট্স্ খনিজ থেকে আয়রন নিষ্কাশন করা হয় কেন?
প্রকৃতির মধ্যে আয়রন পাইরাইট্স্ (FeS2) বেশি পরিমাণে পাওয়া যায়। কিন্তু তা সত্ত্বেও এই খনিজ থেকে আয়রন নিষ্কাশন করা হয় না। এর কারণ হল, এই খনিজটির মধ্যে সালফারের পরিমাণ এত বেশি থাকে যে এর থেকে প্রাপ্ত আয়রনের মধ্যে সালফার বেশ কিছু পরিমাণে থেকে যায়, ফলে প্রাপ্ত আয়রন ভঙ্গুর হয়ে যায়।
কার্বন-বিজারণ পদ্ধতিতে কীভাবে জিংক ধাতু নিষ্কাশন করা হয় আলোচনা করো।
কার্বন-বিজারণ পদ্ধতিতে জিংকের নিষ্কাশনের ক্ষেত্রে জিংকের আকরিক জিংক ব্লেন্ড (ZnS) বা ক্যালামাইন (ZnCO3) -কে প্রথমে জিংক অক্সাইড (ZnO) -এ পরিণত করা হয়। জিংক অক্সাইডে পরিণত আকরিকের সঙ্গে অতিরিক্ত কোক চূর্ণ ভালোভাবে মিশিয়ে মিশ্রণটিকে অগ্নিসহ মৃত্তিকানির্মিত রিটর্ট (retort) বা বকযন্ত্রে নিয়ে 1300-1400°C উষ্ণতায় উত্তপ্ত করা হয়। এর ফলে জিংক অক্সাইড ধাতব জিংকে বিজারিত হয় এবং কার্বন মনোক্সাইড (CO) গ্যাস উৎপন্ন হয়। এক্ষেত্রে বিজারক হিসেবে কোক চূর্ণ ব্যবহার করা হয়।
ZnO + C → Zn + CO↑
তড়িদ্বিশ্লেষণ পদ্ধতিতে Na, K প্রভৃতি ধাতুর নিষ্কাশনের ক্ষেত্রে ধাতুগুলির লবণের জলীয় দ্রবণের তড়িদ্বিশ্লেষণ করা হয় না কেন?
ধাতুগুলির লবণের গলিত দ্রবণের পরিবর্তে জলীয় দ্রবণ ব্যবহার করা হলে দ্রবণে ধাতব লবণের বিয়োজনে উৎপন্ন ধাতব ক্যাটায়নের পাশাপাশি জলের বিয়োজনে উৎপন্ন H+ আয়ন উপস্থিত থাকে। এখন, Na, K প্রভৃতি ধাতুর লবণের জলীয় দ্রবণের তড়িদ্বিশ্লেষণে ক্যাথোডে ধাতব আয়নের পরিবর্তে H+ আয়ন বিজারিত হয়। ফলে ক্যাথোডে সংশ্লিষ্ট ধাতুর পরিবর্তে হাইড্রোজেন গ্যাস মুক্ত হয়। তাই তড়িদ্বিশ্লেষণ পদ্ধতিতে Na, K প্রভৃতি ধাতুর নিষ্কাশনের ক্ষেত্রে ধাতুগুলির লবণের জলীয় দ্রবণ ব্যবহৃত হয় না।
উদাহরণসহ থার্মিট পদ্ধতির কার্যপ্রণালী সংক্ষেপে বিবৃত করো।
উচ্চ উষ্ণতায় অক্সিজেনের প্রতি অ্যালুমিনিয়ামের তীব্র আসক্তি থাকে। অ্যালুমিনিয়ামের চেয়ে কম তড়িৎ-ধনাত্মক ধাতুর (যেমন – আয়রন, ক্রোমিয়াম, ম্যাঙ্গানিজ ইত্যাদির) অক্সাইডকে অ্যালুমিনিয়াম চূর্ণ সহযোগে উচ্চ উষ্ণতায় উত্তপ্ত করলে ওই অক্সাইডগুলি অ্যালুমিনিয়াম দ্বারা বিজারিত হয়ে গলিত ধাতুতে পরিণত হয়। এই পদ্ধতিকে গোল্ডস্মিডের থার্মিট পদ্ধতি বলে। অ্যালুমিনিয়ামের সাথে ধাতব অক্সাইডের বিক্রিয়ায় প্রচুর তাপ উৎপন্ন হয় এবং বিক্রিয়াকালীন উষ্ণতা প্রায় 2000°C হয়। এই উচ্চ উষ্ণতায় নিষ্কাশিত ধাতু গলিত অবস্থায় থাকে।
উদাহরণ – ফেরিক অক্সাইড (Fe2O3) -কে অ্যালুমিনিয়াম চূর্ণের সাথে মিশিয়ে (3 : 1 অনুপাতে) বিশেষ ধরনের তাপসহ মুচির মধ্যে নিয়ে তাতে Mg -গুঁড়ো ও BaO2 -এর মিশ্রণ রেখে Mg ফিতার সাহায্যে আগুন ধরানো হয়। এর ফলে প্রচুর তাপ উৎপন্ন হয় ও উচ্চ উষ্ণতার সৃষ্টি হয়। উচ্চ উষ্ণতায় ফেরিক অক্সাইড, অ্যালুমিনিয়াম দ্বারা বিজারিত হয় ও গলিত ধাতু (আয়রন) উৎপন্ন হয়। গলিত ধাতু মুচির নীচের ছিদ্রের মাধ্যমে বেরিয়ে আসে।
বিক্রিয়া – Fe2O3 + 2Al → 2Fe (গলিত) + Al2O3
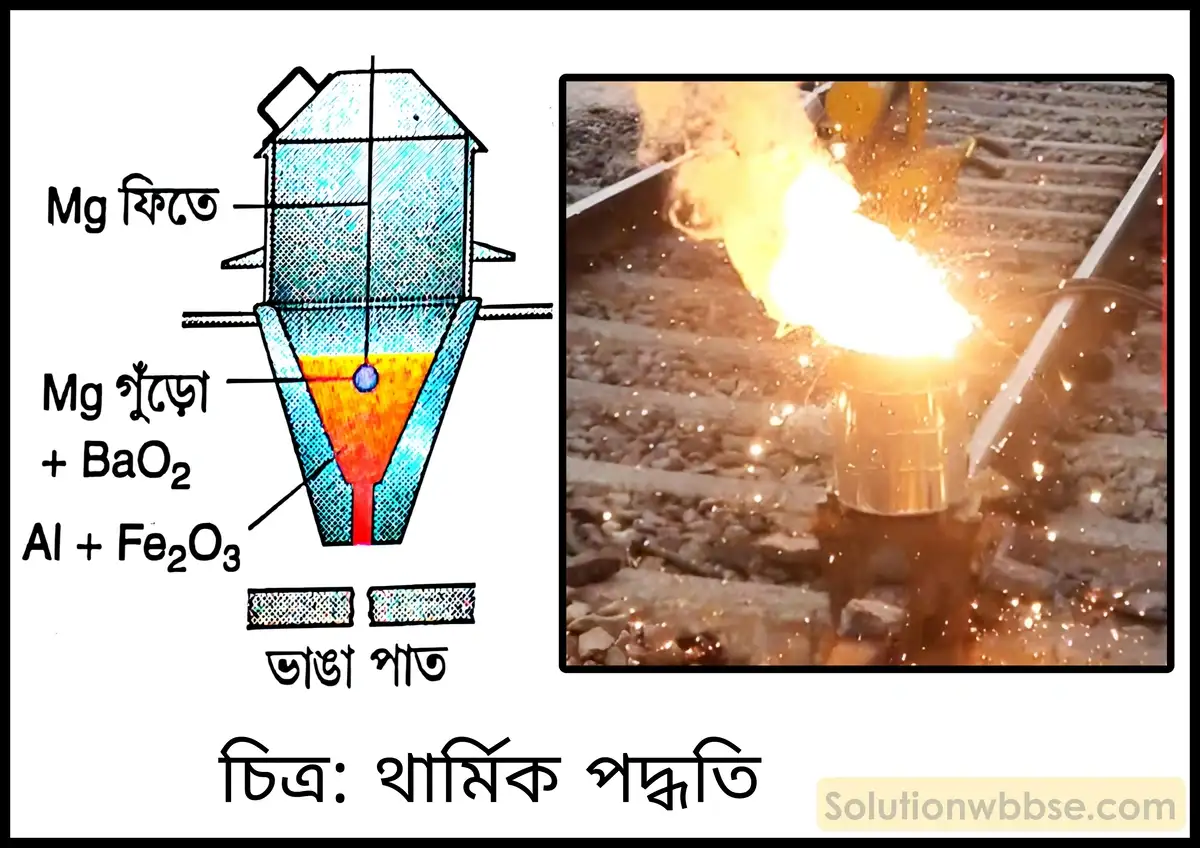
থার্মিট পদ্ধতির তিনটি উপযোগিতা উল্লেখ করো।
থার্মিট পদ্ধতির তিনটি উপযোগিতা হল –
- থার্মিট পদ্ধতিতে ধাতু নিষ্কাশনের জন্য বৃহৎ পরিকাঠামোর প্রয়োজন হয় না। এই পদ্ধতিতে অল্প পরিমাণ ধাতুকে তার অক্সাইড থেকে নিষ্কাশিত করে প্রয়োজন অনুসারে সরাসরি কাজে লাগানো যায়।
- থার্মিট পদ্ধতিতে রেললাইন, ট্রামলাইন, বড়ো বড়ো লোহার মেশিন বা জাহাজের ভাঙা অংশ জোড়া লাগানো হয়। এসব এক্ষেত্রে রেললাইন, ট্রামলাইন প্রভৃতির ভাঙা অংশকে মেরামতের জন্য কারখানা বা অন্যত্র সরিয়ে নিয়ে যাওয়ার প্রয়োজন হয় না, ওই স্থানে রেখেই মেরামত করা যায়।
- থার্মিট পদ্ধতিতে প্রচুর পরিমাণ অনার্দ্র Al2O3 উপজাত পদার্থ হিসেবে উৎপন্ন হয়। চুল্লির অভ্যন্তরে আস্তরণের জন্য অগ্নিসহ ইট তৈরি করতে ও ধাতু পালিশ করার জন্য এমারি চূর্ণ (emery powder) -রূপে এই Al2O3 ব্যবহৃত হয়।
লোহার মরচে পড়ার সময় সংঘটিত জারণ-বিজারণ বিক্রিয়াগুলি ব্যাখ্যা করো।
অথবা, লোহায় কীভাবে মরচে পড়ে তা রাসায়নিক সমীকরণসহ ব্যাখ্যা করো।
লোহায় মরচে পড়া প্রকৃতপক্ষে একটি তড়িৎ-রাসায়নিক বিক্রিয়া। আয়রন খণ্ডে বিভিন্ন ধরনের অশুদ্ধির (যেমন, কার্বন) উপস্থিতি, অসমসত্ত্ব রাসায়নিক সংযুতি এবং মুক্ত ও অসম পৃষ্ঠতল প্রভৃতি কারণে খণ্ডের একটি অংশে Fe -পরমাণুর জারণ অপর অংশ অপেক্ষা সহজে সংঘটিত হয়। যে অংশে সহজে জারণ ঘটে তাকে অ্যানোড অঞ্চল ও যে অংশে জারণ সহজে ঘটে না তাকে ক্যাথোড অঞ্চল বলা যায়।
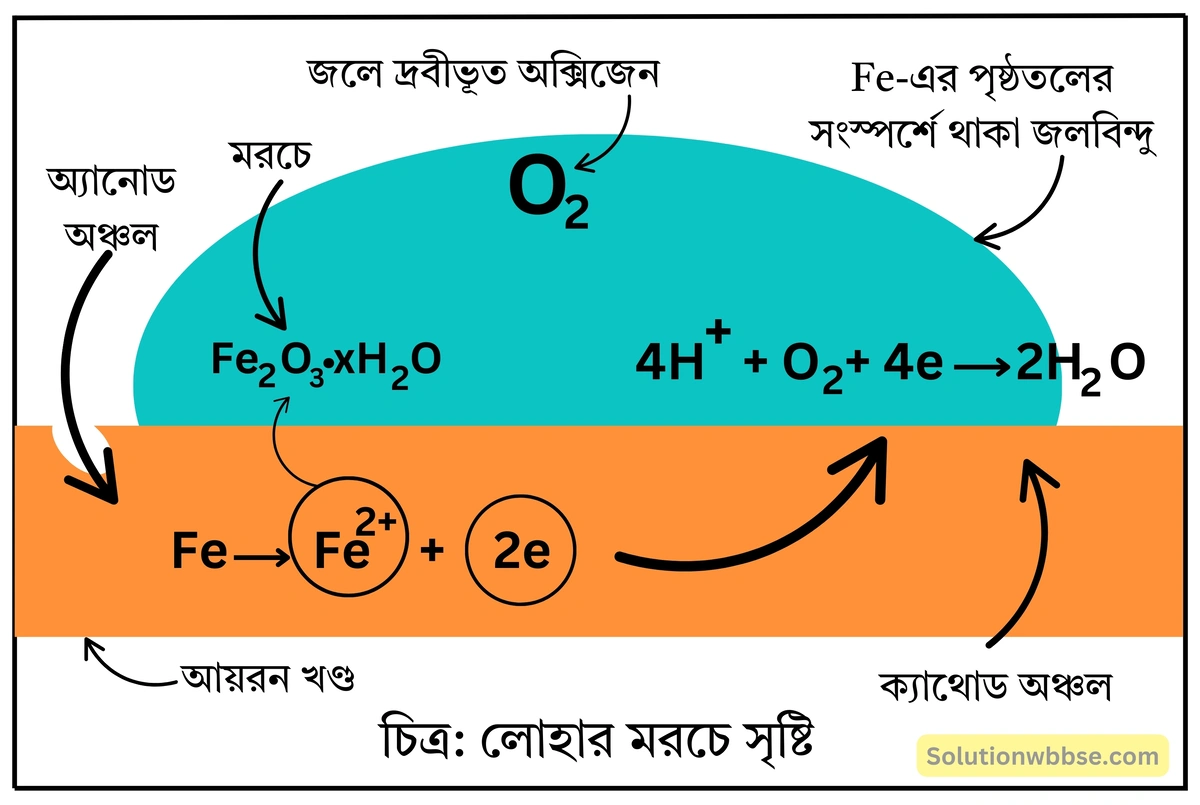
অ্যানোড অঞ্চলে Fe -পরমাণু ইলেকট্রন ত্যাগ করে জারিত হয়ে Fe2+ আয়নে পরিণত হয় এবং জলের মধ্যে চলে আসে। Fe -পরমাণু দ্বারা বর্জিত ইলেকট্রন লোহার খণ্ডের মধ্য দিয়ে বাহিত হয়ে ক্যাথোড অঞ্চলে যায়। ক্যাথোড অঞ্চলে আয়রন খণ্ডের সংস্পর্শে থাকা জলে দ্রবীভূত O2 এই আগত ইলেকট্রনের দ্বারা H2O -তে বিজারিত হয়। বিজারণ বিক্রিয়াটি H+ -এর উপস্থিতিতে সংঘটিত হয়। এই H+ আয়ন মূলত জলে দ্রবীভূত বায়ুমণ্ডলীয় CO2 ও H2O -এর বিক্রিয়ায় গঠিত H2CO3 -এর আয়নীভবনের ফলে বা জলের অণুর বিয়োজনের ফলে উৎপন্ন হয়।
অ্যানোড বিক্রিয়া – 2Fe → 2Fe2+ + 4e
ক্যাথোড বিক্রিয়া – 4H+ + 4e → 4H, 4H + O2 → 2H2O
সামগ্রিক বিক্রিয়া – 2Fe + O2 + 4H+ → 2Fe2+ + 2H2O
অ্যানোড অঞ্চলে উৎপন্ন Fe2+ বায়ুর অক্সিজেনের উপস্থিতিতে পুনরায় জারিত হয়ে সোদক ফেরিক অক্সাইড বা মরচে (Fe2O3⋅xH2O) গঠন করে।
4Fe2+ + O2 + 4H2O → 2Fe2O3 + 8H+
Fe2O3 + xH2O → Fe2O3⋅xH2O (মরচে)
সক্রিয়তা সারির ওপরের দিকে অবস্থিত কোনো ধাতুকে কীভাবে নিষ্কাশন করা হয় উদাহরণসহ আলোচনা করো।
সক্রিয়তা সারিতে ওপরের দিকে অবস্থিত ধাতুগুলি তীব্র তড়িৎ-ধনাত্মক হওয়ায় খুব সক্রিয় এবং এদের অক্সাইডগুলি খুব স্থায়ী। তাই কার্বন-বিজারণ পদ্ধতিতে এই ধাতুগুলির নিষ্কাশন সম্ভব হয় না। এক্ষেত্রে উপযুক্ত তড়িদ্দ্বারসহ ধাতুগুলির গলিত হাইড্রক্সাইড বা ক্লোরাইড লবণের তড়িদ্বিশ্লেষণ করে ধাতুগুলিকে নিষ্কাশিত করা হয়। উদাহরণস্বরূপ, আয়রন ক্যাথোড ও গ্রাফাইট অ্যানোড ব্যবহার করে গলিত সোডিয়াম ক্লোরাইডের মধ্য দিয়ে তড়িৎপ্রবাহ চালনা করে সোডিয়াম ধাতুর নিষ্কাশন করা হয়। ক্যাথোডে সোডিয়াম ধাতু সঞ্চিত হয়।
গলিত NaCl -এর বিয়োজন – NaCl (গলিত) → Na+ + Cl–
ক্যাথোড বিক্রিয়া – Na+ + e → Na (বিজারণ)
অ্যানোড বিক্রিয়া – Cl– – e → Cl (জারণ), Cl + Cl → Cl2
তড়িদ্বিশ্লেষণ পদ্ধতিতে কীভাবে বিশুদ্ধ অ্যালুমিনা (Al2O3) থেকে অ্যালুমিনিয়াম ধাতু নিষ্কাশন করা হয় ব্যাখ্যা করো।
অ্যালুমিনিয়াম ধাতু নিষ্কাশনের জন্য প্রথমে বক্সাইট (Al2O3⋅2H2O) আকরিক থেকে বিশুদ্ধ অ্যালুমিনা প্রস্তুত করা হয়। অ্যালুমিনার সাথে উপযুক্ত পরিমাণে ফ্লুওস্পার (CaF2) ও ক্রায়োলাইট (AlF3⋅3NaF) মিশিয়ে মিশ্রণটিকে গলানো হয়। এই গলিত মিশ্রণের তড়িদ্বিশ্লেষণ করলে ক্যাথোডে অ্যালুমিনিয়াম ধাতু উৎপন্ন হয়।
গলিত Al2O3 -এর বিয়োজন – Al2O3 (গলিত) ⇌ 2Al3+ + 3O2-
ক্যাথোড বিক্রিয়া – 2Al3+ + 6e → 2Al (বিজারণ)
অ্যানোড বিক্রিয়া – 3O2- → 3O + 6e; 3O + 3O → 3O2↑
মরচে পড়া থেকে রক্ষা করতে লোহার ওপর জিংক লেপন না টিন লেপন – কোনটি বেশি উপযোগী হবে?
জিংক প্রলিপ্ত লোহার ওপরের আস্তরণে কোথাও চিড় ধরলে বা দস্তার প্রলেপ উঠে গেলেও লোহা অবিকৃত থাকে কিন্তু জিংক ক্ষয় পেতে থাকে। কারণ জিংক, লোহার চেয়ে অধিক তড়িৎ-ধনাত্মক ধাতু (সক্রিয়তা সারিতে Zn, Fe -এর ওপরে অবস্থিত) হওয়ায় লোহার আগে জিংক জলের সঙ্গে বিক্রিয়া করে।
টিনের প্রলেপে কোথাও চিড় ধরলে বা কোনো স্থানে প্রলেপ উঠে গেলে টিন অবিকৃত থাকে কিন্তু লোহায় দ্রুত মরচে ধরে ক্ষয়ে যায়। এর কারণ টিনের চেয়ে লোহা বেশি তড়িৎ-ধনাত্মক ধাতু। তাই লোহার জারিত হওয়ায় প্রবণতা টিনের থেকে বেশি। তাই লোহাকে মরচে পড়া থেকে রক্ষা করতে টিন লেপনের চেয়ে জিংক লেপন বেশি উপযোগী।
সমুদ্রগামী জাহাজের ইস্পাত-নির্মিত কাঠামোর সঙ্গে প্রায়ই ম্যাগনেশিয়ামের ব্লক যুক্ত করা হয় কেন?
সমুদ্রের নোনা জলের সংস্পর্শে জাহাজের ইস্পাত-নির্মিত অংশে মরচে পড়ে যায়। মরচে পড়া নিবারণ করতেই জাহাজের ইস্পাত-নির্মিত কাঠামোর সঙ্গে ম্যাগনেশিয়ামের ব্লক যুক্ত হয়। কারণ এক্ষেত্রে Mg -ব্লকযুক্ত লোহার জাহাজটি একটি তড়িৎকোশের মতো আচরণ করে। ধাতুর সক্রিয়তা সারিতে Mg -এর অবস্থান Fe -এর ওপরে, তাই Mg অ্যানোড ও Fe ক্যাথোডের মতো আচরণ করে। সমুদ্রের জল এক্ষেত্রে তড়িদ্বিশ্লেষ্য হিসেবে ক্রিয়া করে। যেহেতু অ্যানোডেই জারণ সংঘটিত হয়, তাই Mg জারিত হয়ে Mg2+ হিসেবে দ্রবীভূত হতে থাকে। যতক্ষণ পর্যন্ত Mg -ব্লক সংযুক্ত থাকে Fe জারিত হয় না, অর্থাৎ লোহায় মরচে পড়ে না। Mg -ব্লক ক্ষয়প্রাপ্ত হলে নতুন ব্লক সংযোজিত করা হয়।
মরচে পড়ার ক্ষতিকারক প্রভাবগুলি উল্লেখ করো।
মরচে পড়ার ক্ষতিকারক প্রভাবগুলি হল –
- মরচে পড়ার ফলে আয়রননির্মিত বস্তুগুলির ঔজ্জ্বল্য নষ্ট হয়ে যায়।
- গৃহস্থালির সরঞ্জাম থেকে শুরু করে পরিবহণ শিল্প, কৃষিক্ষেত্রে ও সামরিক প্রয়োজনে লোহা ব্যাপকভাবে ব্যবহৃত হয়। মরচে পড়ার ফলে লোহার জিনিস ক্ষয়প্রাপ্ত হয়ে ব্যবহারের অযোগ্য হয়ে পড়ে এবং আমরা আর্থিক ক্ষতির সম্মুখীন হই।
- ঘরবাড়ি, সেতু, জাহাজের কাঠামো ইত্যাদিতে ব্যবহৃত লোহার কাঠামোয় মরচে পড়লে সেগুলির দৃঢ়তা নষ্ট হয় ও ক্রমশ ভঙ্গুর হয়ে পড়ে। ফলে এগুলির গঠন দুর্বল হয়ে পড়ে এবং ব্যবহারের পক্ষে বিপজ্জনক হয়।
গুপ্তযুগের লৌহস্তম্ভে মরিচে পড়েনি কেন?
দিল্লির মেহেরৌলিতে কুতুবমিনারের কাছে গুপ্তযুগের যে লৌহস্তম্ভটি দেখতে পাওয়া যায় সেটি প্রায় 1600 বছরের পুরোনো, কিন্তু তাতে আজও তেমন মরচে ধরেনি। স্তম্ভটি প্রায় 8 মিটার উঁচু যার 93 সেন্টিমিটার মাটিতে প্রোথিত আছে এবং প্রোথিত অংশেই অতিসামান্য মরচের চিহ্ন দেখা যায়। খোলা আকাশের নীচে উন্মুক্ত অবস্থায় জল ও বাতাসের অক্সিজেনের সংস্পর্শে এতদিন অবিকৃতভাবে দাঁড়িয়ে থেকে এটি প্রাচীন ভারতের উন্নত ধাতুবিদ্যার ব্যবহারের সাক্ষ্য দিয়ে চলেছে।

স্যার রবার্ট হ্যাডফিল্ড (Sir Robert Hadfield) এই স্তম্ভের উপাদানের রাসায়নিক বিশ্লেষণ করে নিম্নলিখিত উপাদানগুলির কথা জানিয়েছেন –
| উপাদান | পরিমাণ (%) |
| লোহা | 99.620 |
| কার্বন | 0.080 |
| সিলিকন | 0.046 |
| ফসফরাস | 0.114 |
লোহায় মরচে পড়া নিবারণের উপায়গুলি উল্লেখ করো।
লোহায় মরচে পড়া নিবারণের উপায়গুলি নিম্নরূপ –
- আয়রন বা আয়রননির্মিত দ্রব্যের ওপর আলকাতরা, রং বা বার্নিশের প্রলেপ দিয়ে মরচে পড়া রোধ করা হয়।
- মরচে নিবারণের জন্য আয়রননির্মিত দ্রব্যের ওপর জিংক, নিকেল বা ক্রোমিয়ামের প্রলেপ দেওয়া হয়।
- লোহিততপ্ত আয়রন বা আয়রননির্মিত দ্রব্যের ওপর দিয়ে স্টিম চালনা করলে আয়রনের পৃষ্ঠতলে ফেরোসোফেরিক অক্সাইড (Fe3O4) -এর আস্তরণ সৃষ্টি হয় যা আয়রনকে জল ও বায়ুর সংস্পর্শ থেকে রক্ষা করে।
- মাটির নীচের জল তেলবাহী লোহার পাইপের সঙ্গে Mg -ব্লক যুক্ত করে পাইপের মরচে রোধ করা হয়।
মাটির নীচে বা সমুদ্রের নীচে থাকা জল বা তেলবাহী লোহার পাইপে দ্রুত মরচে পড়ার সম্ভাবনা থাকে কেন? পাইপগুলিকে মরচে পড়া থেকে কীভাবে রক্ষা করা যায়?
মাটির নীচের জলে বা সমুদ্রের জলে ক্লোরাইড \(\left(Cl^-\right)\), সালফেট \(\left(SO_4^{2-}\right)\) ইত্যাদি আয়নের উপস্থিতি লোহায় মরচে উৎপন্ন হওয়াকে ত্বরান্বিত করে।
মাটির নীচে বা সমুদ্রের নীচে থাকা জল বা তেলবাহী লোহার পাইপকে মরচে পড়ার হাত থেকে রক্ষা করার জন্য ওইসব পাইপের সঙ্গে উচ্চ তড়িৎ-ধনাত্মক ধাতুর (যেমন – ম্যাগনেশিয়াম) পাত বা যন্ত্রকে অন্তরিত পরিবাহী তারের মাধ্যমে বৈদ্যুতিক সংযোগে রাখা হয়। এক্ষেত্রে লোহার পাইপ ক্যাথোড, ম্যাগনেশিয়াম পাত অ্যানোড ও আয়নমিশ্রিত জল তড়িদ্বিশ্লেষ্য রূপে ক্রিয়া করে। ম্যাগনেশিয়াম, লোহার তুলনায় সক্রিয়তা শ্রেণিতে ওপরে অবস্থিত হওয়ায় এটি লোহার আগেই জারিত হয়ে যায়, ফলে লোহায় মরচে পড়ে না। কিছুকাল ব্যবহারের পর ম্যাগনেশিয়ামের পাত ক্ষয়প্রাপ্ত হলে নতুন পাত সংযোজিত করা হয়।
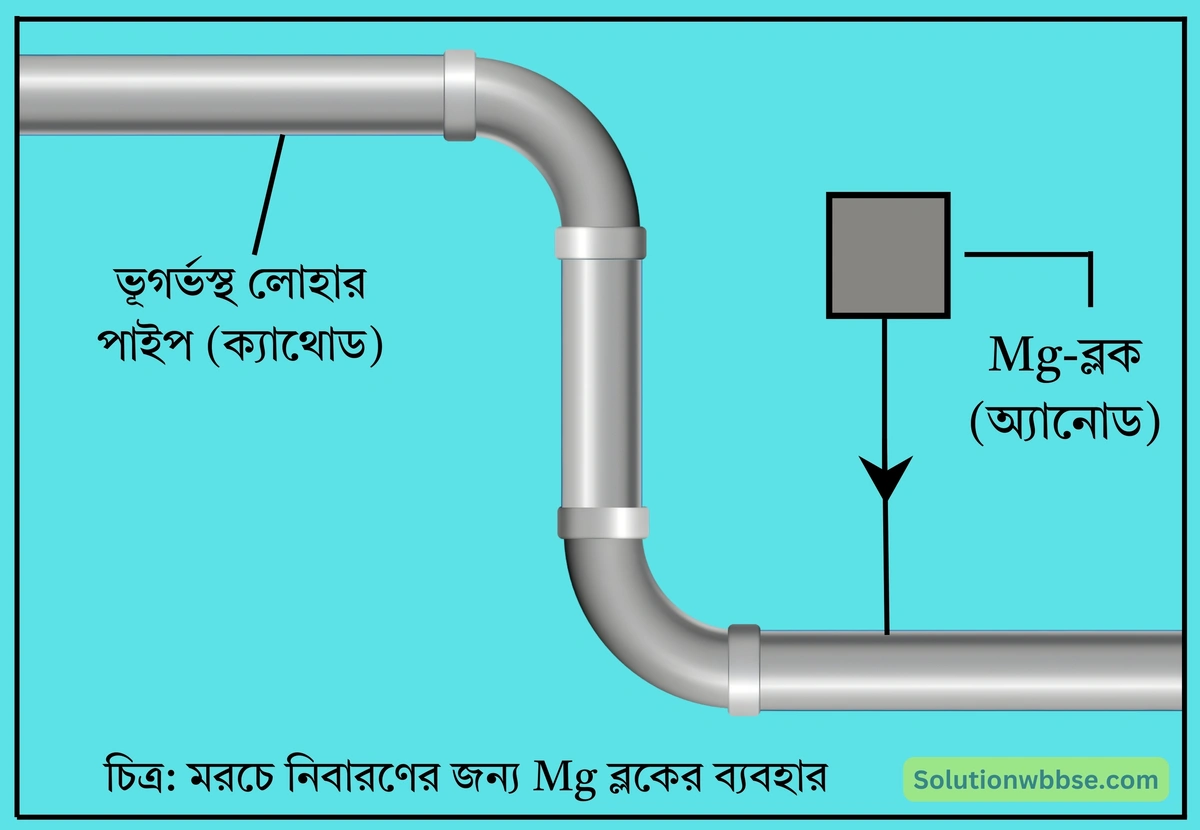
ক্যাথোডীয় সংরক্ষণ কাকে বলে?
তেলবাহী লোহার পাইপের মরচে পড়া নিবারণের জন্য ব্যবহৃত ম্যাগনেশিয়াম ব্লক (অ্যানোড) ক্ষয়প্রাপ্ত হয় ও লোহার পাইপটি (ক্যাথোড) সংরক্ষিত হয়। তাই অ্যানোডকে এক্ষেত্রে ‘উৎসগীকৃত অ্যানোড’ (sacrificial anode) ও প্রক্রিয়াটিকে ক্যাথোডীয় সংরক্ষণ (cathodic protection) বলে।
অম্ল স্বাদযুক্ত খাদ্য বা টকজাতীয় ফল, অ্যালুমিনিয়াম, জিংক বা কপারের তৈরি পাত্রে রাখা বা প্রসেসিং করা উচিত নয় কেন?
অথবা, দাগ বা কলঙ্ক ধরা (tarnished) অ্যালুমিনিয়াম, জিংক বা কপারের তৈরি পাত্র ভালোভাবে পরিষ্কার না করে ব্যবহার করা উচিত নয় কেন?
অম্ল স্বাদযুক্ত খাদ্য বা টকজাতীয় ফলে বিভিন্ন জৈব অ্যাসিড বর্তমান। জৈব অ্যাসিডগুলির সংস্পর্শে অ্যালুমিনিয়াম ও জিংক ধীরে ধীরে বিক্রিয়া করে জলে দ্রাব্য ধাতব লবণজাতীয় যৌগ উৎপন্ন করে। আবার কপার, O2 -এর উপস্থিতিতে জৈব অ্যাসিডের সাথে বিক্রিয়া করেও জলে দ্রাব্য যৌগ উৎপন্ন করতে পারে। এই যৌগগুলি বিষাক্ত, খাদ্যের সাথে দেহে প্রবেশ করলে শরীরে বিষক্রিয়া সৃষ্টি হয়। তাই অম্ল স্বাদযুক্ত খাদ্য বা টকজাতীয় ফল অ্যালুমিনিয়াম, জিংক বা কপারের তৈরি পাত্রে রাখা বা প্রসেসিং করা উচিত নয়। তাছাড়া, অ্যালুমিনিয়াম, জিংক বা কপারের তৈরি পাত্রে সবুজ দাগ বা কলঙ্ক থাকার অর্থ সেখানে এইসব ক্ষতিকর বিষাক্ত পদার্থ সঞ্চিত রয়েছে। তাই এগুলিকে ভালোভাবে পরিষ্কার না করে ব্যবহার করা উচিত নয়।
Class 10 Physical Science – Notes for All Chapters
আমরা আমাদের আর্টিকেলে দশম শ্রেণীর ভৌতবিজ্ঞানের অষ্টম অধ্যায় ‘পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ’ থেকে ‘ধাতুবিদ্যা’ এর দীর্ঘ প্রশ্নোত্তর নিয়ে আলোচনা করেছি। এই প্রশ্নগুলো দশম শ্রেণীর ভৌতবিজ্ঞান পরীক্ষার জন্য বা চাকরির পরীক্ষার জন্য অনেক গুরুত্বপূর্ণ। কারণ এই প্রশ্নগুলি দশম শ্রেণীর পরীক্ষা বা চাকরির পরীক্ষায় প্রায় দেখা যায়। আশা করি এই আর্টিকেলটি আপনাদের জন্য উপকারী হয়েছে। আপনাদের কোনো প্রশ্ন বা অসুবিধা হলে, আপনারা আমাদের সাথে টেলিগ্রামে যোগাযোগ করতে পারেন, আমরা উত্তর দেওয়ার চেষ্টা করবো। তাছাড়া নিচে আমাদের এই পোস্টটি আপনার প্রিয়জনের সাথে শেয়ার করুন, যাদের এটি প্রয়োজন হতে পারে। ধন্যবাদ।






মন্তব্য করুন