এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞানের তৃতীয় অধ্যায় ‘রাসায়নিক গণনা’ – এর গুরুত্বপূর্ণ সংক্ষিপ্ত প্রশ্নোত্তর নিয়ে আলোচনা করবো। এই প্রশ্নগুলো দশম শ্রেণীর শিক্ষার্থীদের পরীক্ষার প্রস্তুতির জন্য অত্যন্ত সহায়ক হবে, বিশেষত যারা প্রতিযোগিতামূলক পরীক্ষার জন্য প্রস্তুতি নিচ্ছেন। কারণ, এই ধরনের প্রশ্ন মাধ্যমিক এবং বিভিন্ন চাকরির পরীক্ষায় প্রায়শই আসে।

রাসায়নিক বিক্রিয়ায় ভরের সংরক্ষণ হয় – ব্যাখ্যা করো।
রাসায়নিক বিক্রিয়ায় বিক্রিয়ক পদার্থ, বিক্রিয়াজাত পদার্থে রূপান্তরিত হয়। বিক্রিয়ার পূর্বে বিক্রিয়ক পদার্থের ভর যা ছিল, বিক্রিয়ার পরে বিক্রিয়াজাত পদার্থের ভর তার সমান হয়।
যদি A এবং B বিক্রিয়া করে C এবং D উৎপন্ন করে, তবে রাসায়নিক বিক্রিয়াটির ক্ষেত্রে –
A -এর ভর + B -এর ভর = C -এর ভর + D -এর ভর।
অথবা বলা যায়, বিক্রিয়ার আগে (A + B) -এর মোট ভর = বিক্রিয়ার পরে (C + D) -এর মোট ভর।
রাসায়নিক বিক্রিয়ায় ভরের পরিমাপযোগ্য কোনো পরিবর্তন ঘটে না – ব্যাখ্যা করো।
রাসায়নিক বিক্রিয়াতে তাপের উদ্ভব হয় কিংবা তাপের শোষণ ঘটে। ভর ও শক্তির সমতুল্যতা অনুসারে যদি কোনো বিক্রিয়ার ফলে তাপের উদ্ভব হয়, তবে সেই বিক্রিয়ায় বিক্রিয়াজাত পদার্থের ভর তুল্যাঙ্ক পরিমাণে হ্রাস পাবে। অপরদিকে, যদি কোনো বিক্রিয়ায় তাপের শোষণ ঘটে, তবে সেই বিক্রিয়ায় বিক্রিয়াজাত পদার্থের ভর তুল্যাঙ্ক পরিমাণ বৃদ্ধি পাবে। কিন্তু সাধারণ রাসায়নিক বিক্রিয়াতে তাপের উদ্ভব বা শোষণের ফলে যে পরিমাণ ভরের হ্রাস বা বৃদ্ধি ঘটে, তা এতই নগণ্য যে অতি সুবেদী তুলাযন্ত্রেও সেটি ধরা পড়ে না। তাই বলা যায়, রাসায়নিক বিক্রিয়ায় ভরের পরিমাপযোগ্য কোনো পরিবর্তন ঘটে না।
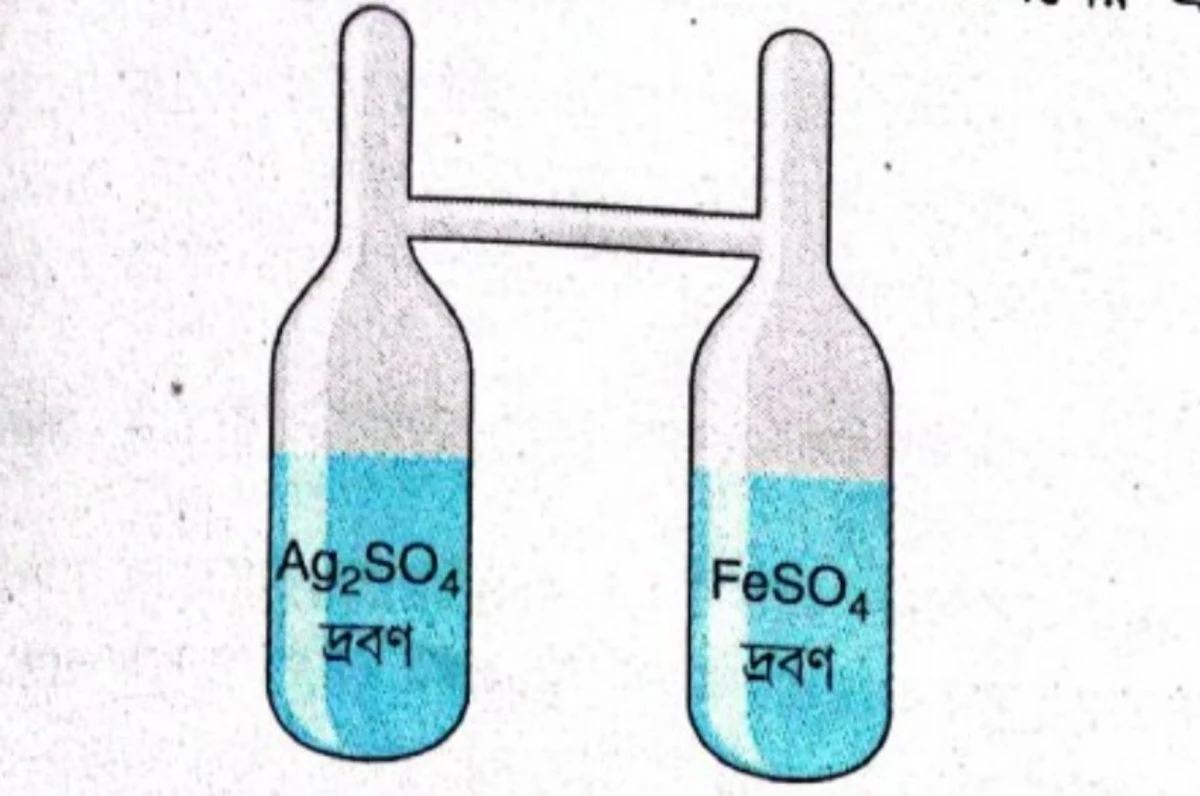
ল্যানডল্টের পরীক্ষা – ব্যাখ্যা করো।
ল্যানডল্টের পরীক্ষা – রাসায়নিক বিক্রিয়ায় ভরের সংরক্ষণ ঘটে – এটি প্রমাণ করার জন্য ল্যানডল্টের পরীক্ষাটি বিখ্যাত। ল্যানডল্ট ‘H’-আকৃতির একটি কাচনলের এক পাশের নলে স্বচ্ছ ফেরাস সালফেট দ্রবণ এবং অপর নলে স্বচ্ছ সিলভার সালফেট দ্রবণ ভরতি করেন। নল দুটির ওপরের খোলামুখ দুটি তাপ প্রয়োগ করে গলিয়ে বন্ধ করে ফেরাস সালফেট ও সিলভার সালফেট ভরা ‘H’ নলটির ভর মাপেন। তারপর নলটিকে এপাশে-ওপাশে কত করে মাঝের অনুভূমিক নলটির সাহায্যে দ্রবণ দুটিকে মিশিয়ে দেন। দ্রবণ দুটি মেশানোর ফলে রাসায়নিক বিক্রিয়া ঘটে নতুন পদার্থ ধাতব সিলভার উৎপন্ন হয়ে দ্রবণের তলায় জমা হয়। এই বিক্রিয়া হয়ে যাওয়ার পর আবার ‘H’ নলটির ভর মাপা হয়। দেখা যায় যে, রাসায়নিক বিক্রিয়ার আগে দ্রবণসমেত নলটির যে ভর ছিল, বিক্রিয়ার পরে উৎপন্ন নতুন পদার্থসমেত ‘H’ নলটির ভর একই আছে।
Ag2SO4 + 2FeSO4 → 2Ag↓ + Fe2(SO4)3
ডালটনের পরমাণুবাদের সাহায্যে রাসায়নিক বিক্রিয়ায় ভরের সংরক্ষণ কীভাবে ব্যাখ্যা করা যায়?
ডালটনের পরমাণুবাদ অনুসারে পরমাণু অবিভাজ্য এবং পরমাণুকে সৃষ্টি করা যায় না বা ধ্বংস করা যায় না। তাই রাসায়নিক বিক্রিয়ার আগে এবং পরে পরমাণুগুলি অপরিবর্তিত থাকে ও মোট পরমাণুর সংখ্যাও অপরিবর্তিত থাকে। এর ফলে বিক্রিয়ক পদার্থের মোট ভর, বিক্রিয়াজাত পদার্থের মোট ভরের সমান হয়। অর্থাৎ, রাসায়নিক বিক্রিয়ায় ভরের সংরক্ষণ হয়।
একটি লোহার খণ্ডকে আর্দ্র বায়ুতে রাখলে তার ভর বেড়ে যায় – এক্ষেত্রে ভরের সংরক্ষণ ঘটছে কি?
লোহার খণ্ডের ভর মেপে আর্দ্র আবহাওয়ার মধ্যে কয়েকদিন ফেলে রাখলে দেখা যাবে লোহার গায়ে মরচের আস্তরণ পড়েছে। এই মরচেযুক্ত লোহার খণ্ডের ভর প্রাথমিক ভরের চেয়ে বেশি হয়। লোহার সঙ্গে বাতাসের O2 এবং জলীয় বাষ্প যুক্ত হয়ে মরচে, অর্থাৎ সোদক ফেরিক অক্সাইড (Fe2O3⋅xH2O) উৎপন্ন করে। এক্ষেত্রে, লোহার ভর + সংযুক্ত অক্সিজেনের ভর + জলীয় বাষ্প (আর্দ্র বায়ুতে উপস্থিত) -এর ভর = মরচেযুক্ত লোহার ভর। অর্থাৎ, এই বিক্রিয়াতে ভরের সংরক্ষণ হয়।
মোমবাতির দহনের ফলে তার ভর হ্রাস পায় – এক্ষেত্রে ভরের সংরক্ষণ ঘটছে কি?
এক্ষেত্রে মোমবাতি জ্বলার সময় বাতাসের অক্সিজেনের সঙ্গে যুক্ত হয়ে কার্বন ডাইঅক্সাইড (CO2) গ্যাস ও জলীয় বাষ্প (H2O) উৎপন্ন করে, যেগুলি উৎপন্ন হওয়ার সঙ্গে সঙ্গে বাতাসে মিশে যায়। উৎপন্ন CO2 ও H2O -এর ভর মাপা সম্ভব হলে দেখা যেত, মোমবাতি এবং তার সাথে যুক্ত O2 -এর মোট ভর, উৎপন্ন CO2 ও H2O -এর মোট ভরের সমান। সুতরাং, দহনের পূর্বে (মোমবাতি + সংযুক্ত O2) -এর ভর = দহনের পরে (মোমবাতি + উৎপন্ন CO2 + উৎপন্ন H2O) -এর ভর। অতএব, এক্ষেত্রে ভরের সংরক্ষণ ঘটছে।
একটি ম্যাগনেশিয়াম ফিতাকে অক্সিজেন গ্যাসের মধ্যে পোড়ালে যে ছাই উৎপন্ন হয় তার ভর ম্যাগনেশিয়াম ফিতার ভরের থেকে বেশি হয়। এক্ষেত্রে ভরের সংরক্ষণ সূত্রটি লঙ্ঘিত হয় কিনা ব্যাখ্যা করো।
প্রকৃতপক্ষে দহনের সময় ম্যাগনেশিয়াম বায়ুর অক্সিজেনের সঙ্গে যুক্ত হয়ে ম্যাগনেশিয়াম অক্সাইড (MgO) উৎপন্ন করে। অক্সিজেনের ভর যুক্ত হওয়ায় ছাইয়ের ভর বৃদ্ধি পায়।
ম্যাগনেশিয়াম ফিতার ভর + ম্যাগনেশিয়ামের সাথে যুক্ত অক্সিজেনের ভর = উৎপন্ন ছাইয়ের ভর। সুতরাং, বিক্রিয়ার আগে ও পরে মোট ভর সমান থাকে অর্থাৎ ভরের সংরক্ষণ সূত্র লঙ্ঘিত হয় না।
অ্যাসিড মিশ্রিত জলের তড়িদ্বিশ্লেষণের ফলে ভরের সংরক্ষণ সূত্র লঙ্ঘিত হয় কিনা ব্যাখ্যা করো।
অ্যাসিডমিশ্রিত জলের তড়িদ্বিশ্লেষণের ফলে জল বিশ্লিষ্ট হয়ে হাইড্রোজেন ও অক্সিজেন গ্যাস উৎপন্ন করে। তড়িদ্বিশ্লেষণ প্রক্রিয়াটি যদি একটি বদ্ধ ফ্লাস্কে করা হয় তবে দেখা যাবে তড়িদ্বিশ্লেষণের আগে এবং পরে ভরের কোনো পরিবর্তন হয় না। অর্থাৎ, অ্যাসিডমিশ্রিত জলের ভর = অবশিষ্ট জলের ভর + উৎপন্ন H2 ও O2 -এর মোট ভর। সুতরাং, অ্যাসিডমিশ্রিত জলের তড়িদ্বিশ্লেষণের সময় ভরের সংরক্ষণ সূত্র লঙ্ঘিত হয় না।
বীজ থেকে উৎপন্ন চারাগাছ কালক্রমে বিরাট বৃক্ষে পরিণত হয় – এক্ষেত্রে কীভাবে ভরের সংরক্ষণ হয়?
বীজ থেকে বিরাট বৃক্ষে পরিণত হওয়ার প্রক্রিয়া চলাকালীন গাছটি মাটি থেকে শিকড়ের সাহায্যে জল ও বিভিন্ন খাদ্য উপাদান গ্রহণ করে এবং পাতার সাহায্যে বায়ু থেকে CO2 নিয়ে বায়ুতে O2 ত্যাগ করে। এই প্রক্রিয়ায় গাছটির দ্বারা গৃহীত পদার্থের নিট ভর (গৃহীত পদার্থের মোট ভর থেকে বর্জিত পদার্থের মোট ভরের বিয়োগফল) গণনা করা সম্ভব হলে দেখা যাবে যে, এই ভরের সঙ্গে বীজের ভর যোগ করলে বৃক্ষটির মোট ভর পাওয়া যাবে। অতএব, এক্ষেত্রে ভরের সংরক্ষণ হয়।
উচ্চশক্তির বিক্রিয়ায় ভরের সংরক্ষণ হয় না ব্যাখ্যা করো।
উচ্চশক্তির বিক্রিয়ায় (যেমন – নিউক্লিয় বিক্রিয়ায়) ভর শক্তিতে রূপান্তরিত হওয়ার ফলে বিপুল পরিমাণ শক্তির উদ্ভব হয়। ভর থেকে উৎপন্ন শক্তির পরিমাণ, আইনস্টাইনের E = mc2 সমীকরণ থেকে নির্ণয় করা যায়। তাই বলা যায় যে, উচ্চশক্তির বিক্রিয়ায় ভরের সংরক্ষণ হয় না। ভর ও শক্তির মোট মিলিত পরিমাণ যে-কোনো উচ্চশক্তির বিক্রিয়ার আগে ও পরে সর্বদা সমান থাকে।
আইনস্টাইনের ভর ও শক্তির তুল্যতা সূত্রটি বিবৃত করো।
বিজ্ঞানী আইনস্টাইনের আপেক্ষিকতাবাদ তত্ত্বানুসারে পদার্থের ভর এবং শক্তি হল একই সত্তার ভিন্নরূপ এবং উপযুক্ত শর্তে এরা পরস্পর রূপান্তরযোগ্য। যদি পদার্থের m ভর, তুল্য পরিমাণ শক্তি E -তে রূপান্তরিত হয় তাহলে ভর ও শক্তির পারস্পরিক রূপান্তর সম্পর্কিত সমীকরণ হবে, E = mc2, যেখানে c হল শূন্য মাধ্যমে আলোর গতিবেগ।
1 গ্রাম ভরকে সম্পূর্ণরূপে শক্তিতে রূপান্তরিত করলে E = mc2 সূত্রানুসারে কী পরিমাণ শক্তি পাওয়া যাবে?
ভর ও শক্তির তুল্যতা প্রকাশক সমীকরণটি হল E = mc2 যেখানে, E = শক্তি, m = ভর = 1 g এবং c = শূন্যমাধ্যমে আলোর বেগ = 3 × 1010 cm s-1
∴ E = 1 × (3 × 1010)2 আর্গ
= 9 × 1020 আর্গ
= 2.14 × 1013 ক্যালোরি। [∵ 4.2 × 107 আর্গ = 1 ক্যালোরি।]
গ্যাসের বাষ্পঘনত্ব এককবিহীন রাশি কেন?
কোনো গ্যাসের বাষ্পঘনত্ব =যেহেতু বাষ্পঘনত্ব দুটি ভরের অনুপাত তাই বাষ্পঘনত্বের কোনো একক নেই।
একটি গ্যাসের সাপেক্ষে অপর একটি গ্যাসের বাষ্পঘনত্ব কীভাবে নির্ণয় করা যায়?
যদি A ও B দুটি গ্যাসের আণবিক গুরুত্ব যথাক্রমে MA এবং MB হয়, তবে B গ্যাসের সাপেক্ষে A গ্যাসের বাষ্পঘনত্ব ()অতএব দুটি গ্যাসের আণবিক গুরুত্বের অনুপাতই হল একটি গ্যাসের সাপেক্ষে অপর একটি গ্যাসের বাষ্পঘনত্ব।
বায়ুর সাপেক্ষে CO2 গ্যাসের বাষ্পঘনত্ব নির্ণয় করো [দেওয়া আছে, বায়ুর গড় আণবিক গুরুত্ব 29]।
বায়ুর সাপেক্ষে গ্যাসের বাষ্পঘনত্ব =
= \(\frac{44}{29}\)
= 1.517
উষ্ণতাভেদে কোনো গ্যাসীয় পদার্থের বাষ্পঘনত্বের মান পরিবর্তিত হয় না কেন?
সমচাপ ও উষ্ণতায় নির্দিষ্ট আয়তনের কোনো গ্যাস, সম-আয়তনের হাইড্রোজেনের তুলনায় যতগুণ ভারী, সেই সংখ্যাই গ্যাসটির বাষ্পঘনত্ব। উষ্ণতা বৃদ্ধি বা হ্রাসের ফলে হাইড্রোজেন বা যে-কোনো গ্যাসের আয়তন সমানুপাতে বৃদ্ধি বা হ্রাস পায়। তাই উষ্ণতা পরিবর্তনে গ্যাসের বাষ্পঘনত্বের মান পরিবর্তিত হয় না।
আর্দ্র বাতাস অপেক্ষা শুষ্ক বাতাস ভারী হয় কেন?
বায়ুর বাষ্পঘনত্ব প্রায় 14.4 এবং জলীয় বাষ্পের বাষ্পঘনত্ব 9। সুতরাং, সম-আয়তনের জলীয় বাষ্প অপেক্ষা শুষ্ক বায়ু বেশি ভারী। আর্দ্র বাতাসে, শুষ্ক বাতাস অপেক্ষা বেশি জলীয় বাষ্প উপস্থিত থাকে। তাই সম-আয়তনের আর্দ্র বাতাস অপেক্ষা শুষ্ক বাতাস ভারী হয়।
মৌলিক বা যৌগিক পদার্থের ভর থেকে মোল-সংখ্যা কীভাবে নির্ণয় করবে উদাহরণের সাহায্যে দেখাও।
মৌলিক বা যৌগিক পদার্থের মোল-সংখ্যা =উদাহরণ – H2SO4 -এর গ্রাম-আণবিক ভর 98 g
সুতরাং, 49 g H₂SO₄ এর মোল-সংখ্যা =
STP -তে গ্যাসীয় পদার্থের আয়তন থেকে কীভাবে গ্যাসীয় অণুর মোল-সংখ্যা নির্ণয় করা হয় সেটি উদাহরণসহ দেখাও।
গ্যাসীয় অণুর মোল-সংখ্যা =উদাহরণ – STP -তে কোনো \(CO_2\) গ্যাসের নমুনার আয়তন যদি 44.8 লিটার হয় তবে উক্ত নমুনায় \(CO_2\) -এর মোল-সংখ্যা = \(\frac{44.8L}{22.4L}=2\)
মোল-সংখ্যা থেকে কীভাবে STP -তে গ্যাসের আয়তন ও তার অণুর সংখ্যা নির্ণয় করা যায়?
STP -তে কোনো গ্যাসের আয়তন (লিটার এককে) = গ্যাসীয় অণুর মোল-সংখ্যা × STP -তে গ্যাসের মোলার আয়তন
= গ্যাসীয় অণুর মোল-সংখ্যা × 22.4 লিটার গ্যাসের অণুর সংখ্যা
= গ্যাসের মোল-সংখ্যা × অ্যাভোগাড্রো সংখ্যা
= গ্যাসের মোল-সংখ্যা × 6.022 × 1023
Class 10 Physical Science – Notes for All Chapters
এই আর্টিকেলে আমরা মাধ্যমিক ভৌতবিজ্ঞান বইয়ের তৃতীয় অধ্যায়, “রাসায়নিক গণনা,” নিয়ে সংক্ষিপ্ত প্রশ্নোত্তর বিশ্লেষণ করেছি। এই প্রশ্নোত্তরগুলো দশম শ্রেণীর পরীক্ষার প্রস্তুতি ও বিভিন্ন প্রতিযোগিতামূলক পরীক্ষার জন্য বিশেষভাবে সহায়ক হবে, কারণ এ ধরনের প্রশ্ন প্রায়ই পরীক্ষায় আসে। আশা করি, এই আর্টিকেলটি আপনার প্রস্তুতির জন্য সহায়ক হয়েছে। যদি কোনো প্রশ্ন বা মতামত থাকে, তাহলে টেলিগ্রামে আমার সাথে যোগাযোগ করুন। আপনাদের প্রশ্নের উত্তর দিতে আমি সর্বদা প্রস্তুত। ধন্যবাদ!






মন্তব্য করুন